不同品种小麦穗部蜡质成分分析
王嘉欢,陈晓杰,张福彦,范家霖,杨保安,程仲杰,张建伟
(河南省科学院同位素研究所有限责任公司/河南省核农重点实验室,郑州 450015)
表皮蜡质是陆生植物地上部分的第一道物理屏障,在植物与环境的相互作用过程中,应对各种多变的环境胁迫时扮演着重要的角色[1].表皮蜡质可以保护植物免受强紫外线辐射和高温的危害[2],增加植物对高盐和低温的耐受性,还可以抵御外界病虫害和食草动物的侵害[3-5],限制植物的非气孔水分流失[6-7],另外,表皮蜡质还与植物抗旱性及产量密切正相关[2,8-10].不同植物表皮中的蜡质成分是不同,例如在番茄的叶片和果实中,蜡质主要成分为直连烷烃、支链烷烃、脂肪醇和三萜类等化合物[11],而荷叶表皮中蜡质成分重要为长链直链二醇、长链次级醇、伯醇以及脂肪酸等化合物[12].禾本科植物表皮蜡质化学组成主要有烷烃类、醛类、醇类、酸类、酯类、酮类、萜类及其他一些未知成分[13].
小麦(Triticum aestivumL.)是在全球温带地区种植的最重要的粮食作物之一.小麦蜡质是指覆盖在小麦表皮细胞外的一层由亲脂性化合物构成的疏水层,小麦的叶、茎、穗和芒等部位表面均被蜡质层覆盖,其表皮有大量的蜡质.小麦蜡质主要成分是超长链脂肪酸及其衍生物,包括初级醇、烷烃、醛、脂肪酸、β-和OH-β-二酮[14-16].蜡质组分在小麦不同器官是不同的,小麦叶片表皮蜡质主要组分是初级醇,叶鞘和茎表皮蜡质主要组分是β-二酮[17-18].β-二酮主要为正三十一烷-14、16-二酮,由于β-二酮的存在,许多现代小麦品种表现出白霜状蜡质外观.
虽然有关小麦表皮蜡质组成的研究已经较多,但大多数研究关注于小麦的叶片,对穗部的研究较少.小麦穗部作为重要的光合器官,对产量有直接贡献,目前尚不清楚不同品种小麦穗部表皮蜡质组成的差异.因此,为了了解小麦穗部表皮蜡质的组成特点,并获得小麦穗部表皮蜡质的含量及成分数据,本研究利用气相色谱-质谱联用仪对四种不同现代品种小麦材料的穗部表皮蜡质进行测定和分析,获得小麦蜡质组成成分特征和品种间差异,为后续研究小麦蜡质分子机理提供基础.
1 材料与方法
1.1 试剂与仪器
氯仿(英丰,中国)、正二十四烷烃、吡啶和双三甲基硅基三氟乙酰胺(BSTFA)均购自美国的西格玛奥德里奇公司.主要仪器有气相色谱-质谱联用仪(7890B,安捷伦,美国)、气相色谱样品瓶(安捷伦,美国)、容量瓶(天玻,中国),千分之一分析天平(BSA224S,赛多利斯,德国)、恒温水浴锅(DZKW-C,树立,中国)、氮吹仪(LC-DCY-12G,力辰,中国)、烘干箱(DHG-9246A,精宏,中国).
1.2 试验材料
洛旱17、郑品麦22号、中育1331、齐民7号四个小麦品种,于2020年10月15日种植于郑州市新郑市新村镇小麦试验基地(34°39′N 113°74′E).每个品种的小麦以10 cm的间距人工点播种植在行长为1.5 m、行距25 cm的试验田中.2021年4月20日选取样品,用干净的剪刀选取扬花期的小麦穗部,然后保存于4℃冰箱中用于后续实验.
1.3 标准品配制
用千分之一分析天平准确称取0.05 g正二十四烷烃(C24)标准品于50 mL容量瓶中,加入50 mL氯仿溶液配制成质量浓度为1 μg/μL的标准品液,密封后置于4℃冰箱保存.
1.4 氯仿浸提法提取小麦穗部表皮蜡质
将新鲜干净的小麦穗子放于提前用氯仿润洗过的小烧杯中,加入25~35 mL氯仿,使组织完全浸没在氯仿中,然后加入20 μL正二十四烷烃(C24,1 μg/μL)作为内标,轻轻晃动烧杯,浸提60 s.浸提完后,用干净的镊子捞出组织,将提取后的组织放入烘箱中烘干24 h后测定其干重,将浸提液放置于通风橱中使其挥发变少.将挥发后的提取液(10 mL)通过滤纸过滤到小玻璃瓶中,然后置于通风橱中完全挥发.加入1 mL的氯仿于小玻璃瓶中,然后转入气相色谱样品瓶中,置于通风橱中使其完全挥发.
1.5 蜡质提取物的衍生化反应
为了使提取到的蜡质能被气相色谱(Gas chromatography,GC)充分检测到,需先进行衍生反应.衍生反应的目的是将含有羟基(OH-)的化合物转化为其相应的三甲基甲硅烷基衍生物[19].具体步骤是:将样品在氮气下干燥,然后加入40 μL的BSTFA和40 μL吡啶,将GC小瓶盖好盖子,并将混合物置于70℃金属浴中60 min,然后迅速在氮气下吹干反应物,最后加入800 μL的氯仿用于下一步GC的测定.
1.6 气相-质谱联用仪(GC-MS)分析蜡质成分
配备有质谱检测器(Mass spectrometer,MS)和火焰离子化检测器(Flame ionization detector,FID)的GC分别用于组合物定性和定量分析.小麦蜡质提取物的成分在毛细管柱HP-1(长度30 m,内径0.32 mm,膜厚度0.25 μm;安捷伦,美国)上进行分析,并连接至FID,载气位氮气,进样体积1 μL,SPL1气化室温度为305℃、检测器温度为310℃、色谱柱流量为2 mL/min.温度程序如下:在50℃下保持2 min;然后以20℃/min的速度升温至220℃,保持2 min;接着以4℃/min的速度升温至310℃,然后在310℃保持5 min.
在与上述相同的GC条件下使用GC-MS对样品进行定量分析,但调节载气为氦气,氦气的流速为2.00 mL/min.扫描模式为全扫描模式,扫描的范围为35~700 m/z.
1.7 数据分析
基于每种化合物的峰面积和C24的峰面积计算每种蜡质组分的含量.所有小麦样品一式三份进行分析,每三个样品的方差系数(C.V.)小于15%.采用SIGMA PLOT 14.0作图后进行数据分析.
2 结果与分析
2.1 小麦蜡质表型分析
通过观察四个品种小麦扬花期的穗部蜡质表型(图1),发现洛旱17表型为淡绿色,郑品麦22、中育1331和齐民7号的表型都有不同程度的白霜状蜡质覆盖,其中郑品麦22白霜状较少,中育1331次之,齐民7号的白霜状蜡质层最厚.这些表型说明,不同品种的小麦穗部表皮蜡质存在差异,需进一步进行成分鉴定.

图1 四个小麦品种蜡质表型Fig.1 Cuticular wax phenotypes of four wheat varieties
2.2 小麦蜡质成分鉴定
洛旱17、郑品麦22、中育1331、齐民7号气相色谱图见图2,通过GC-MS得到其离子峰,并借助质谱数据库和文献数据检索来鉴定各个蜡质的组分[15].四个小麦品种中均检测出了不同的蜡质成分,每一个品种小麦(除洛旱17外)表皮蜡质提取物中均鉴定出了16种成分(图2).洛旱17表皮蜡质提取物中鉴定到了15种化学成分,比其他三个品种的蜡质少一种,即31-OH-β-二酮.鉴定到的这些成分包括四大类:烷烃、初级醇、脂肪醛和二酮.这四大类化学成分各由不同长度碳链组成,其中烷烃均由奇数碳链组成,碳链长度为25~33;初级醇均由偶数碳链组成,碳链长度22~30;脂肪醛均由偶数碳链组成,碳链长度24~28;而二酮则由单一碳链组成,碳链长度为31,由31-β-二酮和31-OH-β-二酮组成.通过气相色谱图可以发现,不同的品种间的蜡质组分存在差异.
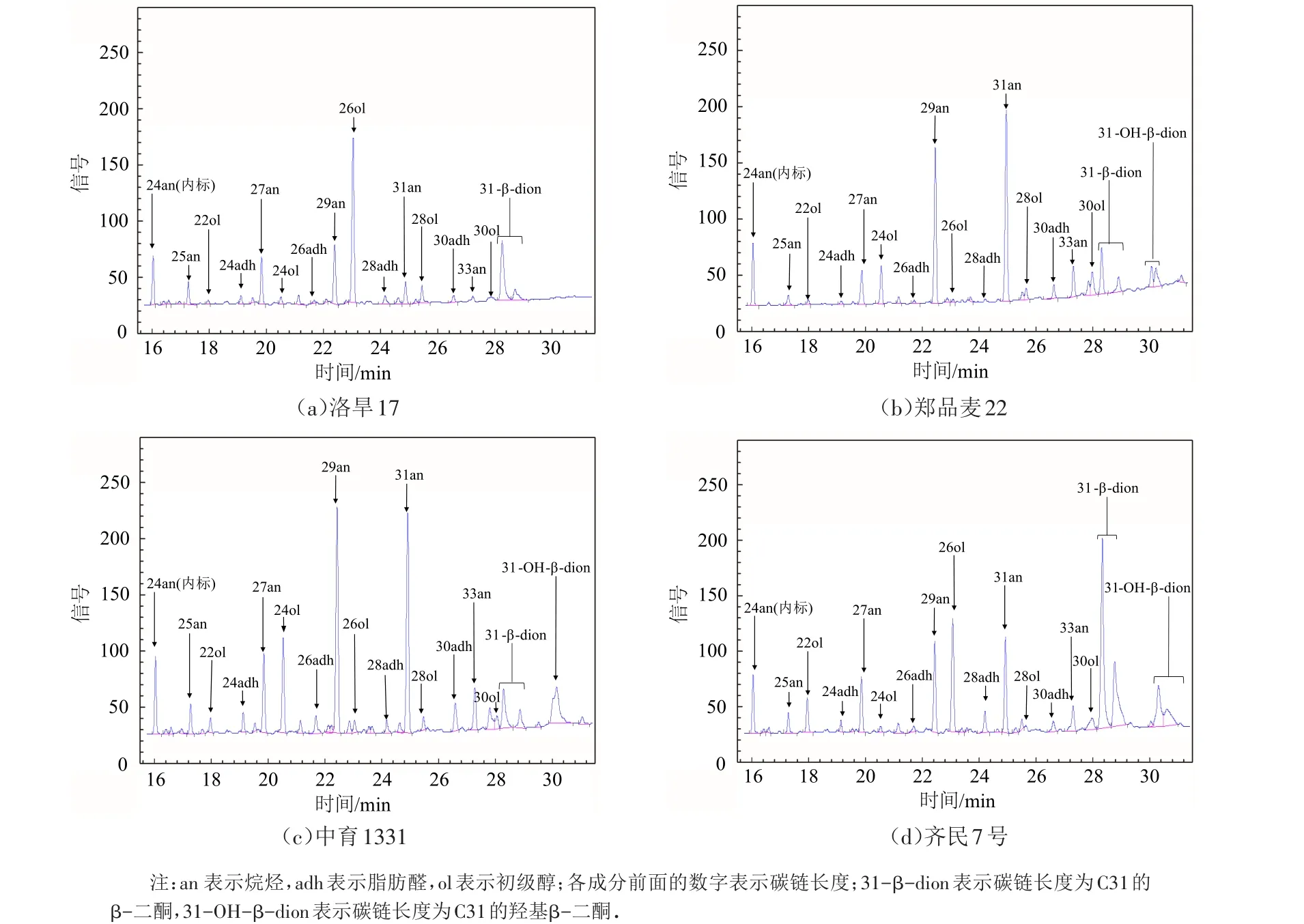
图2 四个小麦品种蜡质气相色谱图Fig.2 GC chromatograms of cuticular wax of four wheat varieties
2.3 小麦蜡质各组分同系物含量分析
通过进一步定量分析,发现四个小麦品种的蜡质各组分同系物绝对含量w之间存在较大差异.在洛旱17的穗部各蜡质组分中,烷烃由5种不同链长组成,其中二十九烷烃占主导地位,w=(70.7±0.9)μg/g,二十七烷烃次之,三十一烷烃和二十五烷烃含量相当,三十三烷烃最低.初级醇的各组分也存在差异,其中二十六醇含量最高,w=(177.0±14.8)μg/g,二十八醇、二十四醇和三十醇含量较低,而二十二醇最低.脂肪醛的各组分差异较小,与其他组分相比含量较低,其中二十八醛含量最高,w仅为(14.0±0.7)μg/g,二十四醛、二十八醛以及三十醛的含量较低.另外,比较特殊的是在洛旱17的表皮蜡质中,仅检测到了31-β-二酮,w=(135.9±14.0)μg/g,而未检测到OH-β-二酮,其他的三个小麦材料中则同时检测到了β-二酮和OH-β-二酮(图3).从总体组分上来看,洛旱17表皮蜡质中二十六醇含量占绝对优势,β-二酮含量次之,随后是二十九烷烃,而脂肪醛的各组分含量均较少.
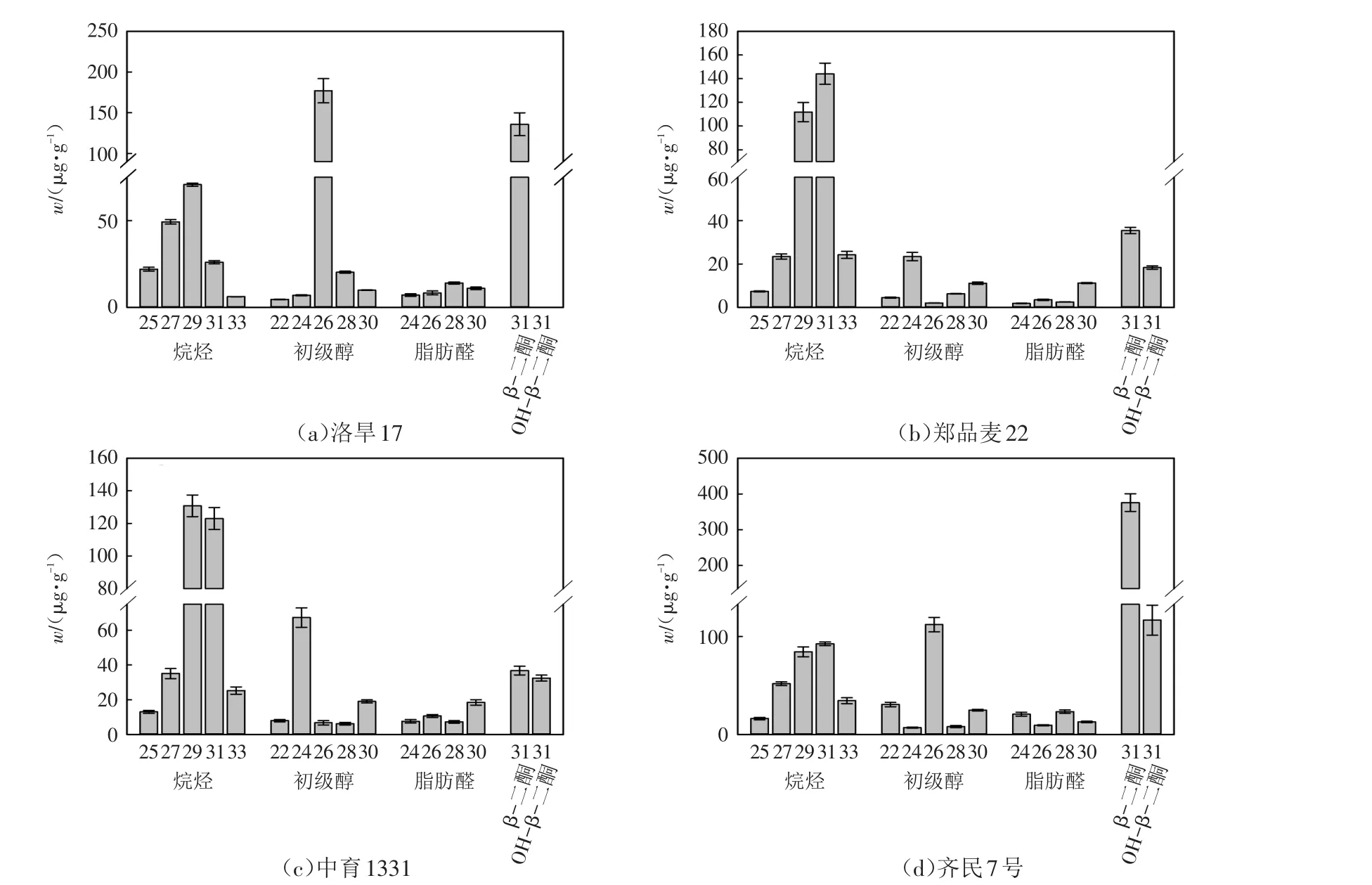
图3 四个小麦品种蜡质各组分含量Fig.3 Content of individual wax constituent of four wheat varieties
郑品麦22和中育1331穗部的各蜡质组分的分布规律接近且不同于洛旱17,在这两个品种的初级醇组分中,二十四醇的含量均占主导地位,w分别达到了(23.4±1.9)μg/g和(67.3±5.6)μg/g,三十醇的含量次之,其他链长的初级醇含量都较低.在脂肪醛的各组分中,三十醛的含量最高,w分别为(11.2±0.2)μg/g和(18.5±1.6)μg/g,二十六醛次之,其他醛的含量都很低.在二酮的各组分中,这两个品种的β-二酮的含量较高且较为接近,w分别为(35.4±1.5)μg/g和(36.8±2.5)μg/g,而OH-β-二酮的含量较低,w分别为(18.4±0.8)μg/g和(32.5±1.7)μg/g.值得注意的是,中育1331表皮蜡质中的OH-β-二酮的含量是郑品麦22的1.8倍.另外,稍有不同的是,郑品麦22和中育1331表皮蜡质中的烷烃分布不一样,在郑品麦22的穗部表皮蜡质中,三十一烷烃含量最高,w=(144.1±9.0)μg/g,二十九烷烃次之,其他链长的烷烃含量较低,其中二十五烷烃含量最低;而在中育1331中,二十九烷烃含量最高,w=(130.8±6.6)μg/g,三十一烷烃次之,其他链长的烷烃含量较低,二十五烷烃含量最低.从总体组分上来看,郑品麦22和中育1331表皮蜡质中二十九烷烃或三十一烷烃含量占绝对优势,31-β-二酮或二十四醇的含量次之,而脂肪醛的各组分含量均较少.
齐民7号的穗部表皮蜡质中的烷烃各组分分布与郑品麦22类似,都是三十一烷烃含量最高,二十九烷烃次之,二十五烷烃含量最低.齐民7号表皮蜡质中的初级醇的各组分则与其他三个材料的分布都不同,其中二十六醇含量最高,二十二醇和三十醇含量次之,而二十四醇含量最低;同样的,在脂肪醛的各组分含量均比较低,其中二十八醛含量最高,二十六醛含量最低.齐民7号与其他材料明显不一样的地方是蜡质组分中有大量的二酮,其中w(31-β-二酮)高达(375.7±24.7)μg/g,是其他三个材料的2.8~10.6倍;w(31-OH-β-二酮)也很高,达到了(116.7±15.3)μg/g,分别是郑品麦22号和中育1331的6.4倍和3.6倍.从总体组分上来看,齐民7号的表皮蜡质中β-二酮和OH-β-二酮含量占绝对优势,二十六醇的含量次之,而脂肪醛的各组分含量均较少.
2.4 小麦蜡质各组分总量分析
通过分析四个品种小麦穗部蜡质各组分同系物含量得到了各组分总量及相对含量,结果见表1.
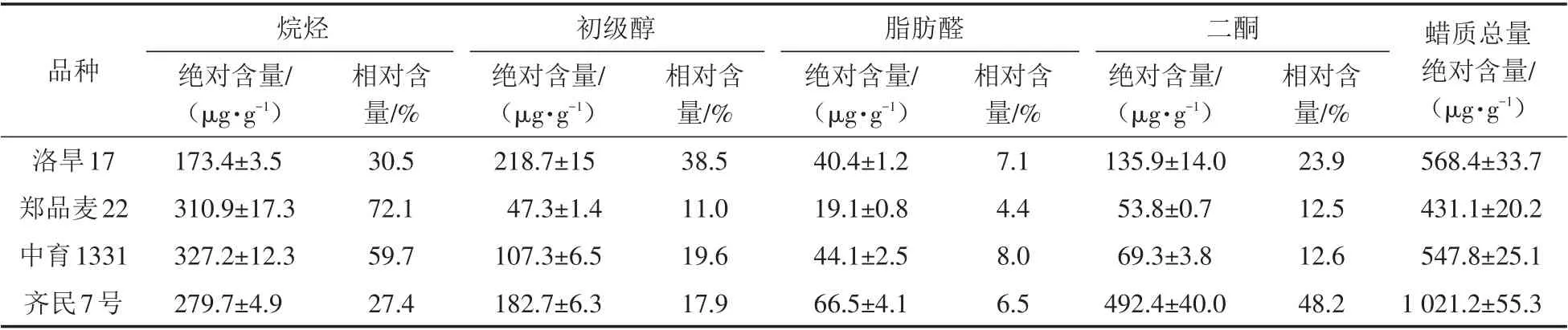
表1 四个小麦品种表皮蜡质各组分的绝对含量和相对含量Tab.1 Absolute and relative contents of individual wax constituent of four wheat varieties
结果显示,齐民7号的蜡质总量最高,为(1 021.2±55.3)μg/g,洛旱17和中育1331的蜡质总量较为接近,而郑品麦22的蜡质总量最低,为(431.1±20.2)μg/g.在这四个品种穗部表皮蜡质中,脂肪醛的总量均比较低,相对含量范围为4.4%~8.0%,而其他组分含量则差异较大.虽然洛旱17和中育1331的蜡质总量接近,但是两个品种各组分总量差异很大,洛旱17的初级醇绝对含量最高,达到了(218.7±15)μg/g(相对含量为38.5%),且比其他三个材料初级醇的含量都高;而中育1331则是烷烃总量最高,相对含量达到59.7%,初级醇绝对含量较低,为(107.3±6.5)μg/g.郑品麦22中烷烃占主导地位,相对含量达到了72.1%.而在齐民7号中,二酮绝对含量最高,为(492.4±40)μg/g,相对含量达到了48.2%.
3 讨论
本研究发现不同品种的小麦穗部表皮蜡质组分及含量是不同的,即便表皮蜡质总量接近,各组分也存在差异.另外,先前的研究往往认为有白霜状表型的材料为高蜡质材料,有淡绿色表型的材料为低蜡质材料.而本研究发现,淡绿色表型的洛旱17蜡质总量并不是最低的,它的表皮蜡质中没有OH-β-二酮.白霜状表型的郑品麦22、中育1331、齐民7号的OH-β-二酮含量则依次增高,这与小麦的蜡质表型也有一定的对应关系.因此,可以根据小麦是否有白霜状表型来确定小麦是否含有OH-β-二酮,而不能根据表型简单的定义低蜡和高蜡材料.由此也可以推断OH-β-二酮是导致小麦呈现白霜状表型的主要化合物.
虽然在越来越多的禾本科植物中发现了β-二酮和OH-β-二酮[19-21],关于二酮基因的定位及分子机制的研究也越来越多[22-24],但是仍旧缺乏对其生物活性及其潜在机制的更广泛理解.因此,基于上述讨论,本文章的4个不同品种的小麦材料可以作为用于进一步研究β-二酮和OH-β-二酮生物合成的合适材料,未来的研究需要更多的生理和基因功能实验来进一步阐明二酮合成的机理.

