奥美沙坦对高尿酸诱导的HK-2细胞上皮间质转化和细胞外基质合成的影响及机制
向启蒙,耿燕秋,余燕燕,邹 鑫,于 冰,刘秀娟
(1.江西中医药大学研究生院,南昌330004; 2.中国人民解放军联勤保障部队第九〇八医院肾内科,南昌330002; 3.中国人民解放军总医院第三医学中心肾内科,北京100039)
肾纤维化是多种慢性肾脏疾病进展到终末期的共同病理过程,与肾脏功能损害程度密切相关[1-2]。血管紧张素是影响肾间质纤维化发生发展的重要因素之一[3],多种血管紧张素受体拮抗剂例如缬沙坦、非马沙坦等被报道具有抗肾纤维化作用[4-5]。有研究[6-7]发现,血管紧张素受体拮抗剂奥美沙坦(OLM)具有肾脏保护作用,且能减少Alport综合征模型小鼠的肾脏纤维化,但其具体的抗纤维化机制尚未完全明确。Toll样受体4(TLR4)及其介导的氧化应激、炎症反应等可调控肾小管上皮细胞的上皮间质转化,促进纤连蛋白(Fibronectin)、Ⅰ型胶原(collagen Ⅰ)等细胞外基质的合成与积聚,促进肾纤维化的发生发展[8-9]。有研究[10]表明,OLM可抑制载脂蛋白E基因缺失模型小鼠主动脉中TLR4的表达,但其是否影响肾纤维化过程中TLR4表达、上皮间质转化和细胞外基质沉积仍不清楚。本研究以肾小管上皮HK-2细胞为研究对象,采用高尿酸诱导HK-2细胞纤维化,体外探究OLM对高尿酸诱导的肾小管上皮细胞上皮间质转化和细胞外基质沉积的影响及机制,以期为以肾纤维化为病理特征的慢性肾脏疾病提供新的治疗策略和实验依据。
1 材料与方法
1.1 细胞与主要试剂
人近肾端小管上皮HK-2细胞购自中国科学院细胞库。DMEM/F12培养基、胎牛血清购自美国Gibco公司。OLM购自美国Selleck公司。尿酸购自美国sigma公司。CCK-8细胞活性检测试剂盒、RIPA裂解液、BCA蛋白检测试剂盒均购自上海碧云天公司。TRIzol试剂、LipofectamineTM3000购自美国Invitrogen公司。PrimeScript TM RT reagent Kit试剂盒、SYBR Premix Ex Taq试剂盒购自日本TaKaRa公司。PCR引物、pcDNA3.1及TLR4过表达质粒pcDNA3.1-TLR4均由上海吉玛公司提供。E-cadherin、vimentin、α-SMA、TLR4、β-actin等的一抗及辣根过氧化物酶标记的二抗均购自美国Abcam公司。CA1410活性氧检测试剂盒购自北京索莱宝公司。collagen Ⅰ、Fibronectin、白细胞介素(IL-6)和肿瘤坏死因子(TNF-α)的ELISA试剂盒购自美国Abcam公司。
1.2 方法
1.2.1 细胞培养及活力检测
采用600 μmol·L-1的尿酸处理HK-2细胞体外诱导肾纤维化细胞模型。采用含10%胎牛血清的DMEM/F12培养基培养HK-2细胞,在37 ℃、5% CO2条件下培养传代,取4~8代生长良好的细胞用于实验。采用不同浓度的OLM(0、5、10、20 μmol·L-1)处理HK-2细胞,以2×105cells·mL-1的浓度,将各组细胞分别接种于96孔板,培养48 h后,按照CCK-8细胞活力检测试剂盒操作,每孔加入20 μL CCK-8溶液,37 ℃孵育2 h,酶标仪检测450 nm处吸光度值。
1.2.2 实验分组
将体外培养的HK-2细胞分为5组。1)对照组:正常培养的HK-2细胞;2)高尿酸组:培养基中加入600 μmol·L-1的尿酸以诱导体外肾纤维化细胞模型;3)高尿酸+OLM组:培养基中加入600 μmol·L-1的尿酸和10 μmol·L-1的OLM;4)高尿酸+OLM+TLR4组:转染pcDNA3.1-TLR4的HK-2细胞采用含有600 μmol·L-1的尿酸和10 μmol·L-1的OLM的培养基培养;5)高尿酸+OLM+空载组:仅转染pcDNA3.1空载质粒的HK-2细胞采用含有600 μmol·L-1的尿酸和10 μmol·L-1的OLM的培养基培养。
1.2.3 细胞转染
以1×105cells·mL-1的浓度将各组HK-2细胞接种于96孔板,过夜培养以使转染前细胞生长至汇合度80%左右。采用LipofectamineTM3000将pcDNA3.1-TLR4或pcDNA3.1分别转染HK-2细胞,48 h后实时定量PCR和western blot检测转染效率。
1.2.4 实时定量PCR检测
按照Trizol试剂盒的说明操作,提取各组细胞的总RNA。经过PrimeScript TM RT reagent Kit试剂盒反转录后,采用SYBR Premix Ex Taq试剂盒进行实时定量PCR检测。TLR4的引物序列为:上游5′-GATGTCAGGGAGGGGACTCT-3′,下游5′-TGCCAGAGCGGCTACTCAGA-3′。β-actin的引物序列为:上游5′-AGTGTGACGTTGACATCCGTA-3′,下游5′-GCCAGAGCAGTAATCTCCTTCT-3′。以β-actin为内参,按照2-△△CT法计算TLR4的mRNA相对表达。
1.2.5 western blot检测
采用RIPA裂解并提取各组细胞总蛋白,BCA试剂盒测定蛋白浓度。每组取20 μg用10% SDS-PAGE电泳分离后电转移到PVDF膜上。采用含5%脱脂奶粉的封闭液室温封闭1 h后,再将膜分别与抗E-cadherin、vimentin、α-SMA、TLR4、β-actin等一抗在4 ℃孵育过夜。漂洗后,室温下将膜与二抗孵育1 h,最后采用ECL化学发光试剂盒显影。用Image J软件分析蛋白条带的灰度值,以β-actin为内参,计算目的蛋白的相对表达水平。
1.2.6 细胞活性氧ROS检测
收集各组细胞,按照CA1410活性氧检测试剂盒的说明操作,利用DCFH-DA荧光探针检测各组细胞ROS水平。
1.2.7 ELISA检测细胞外基质和炎症因子
收集各组细胞上清液,按照ELISA试剂盒说明操作,检测细胞外基质(collagen Ⅰ和Fibronectin)、促炎因子(IL-6、TNF-α)的水平。
1.2.8 统计学方法
采用SPSS22.0软件和GraphPad Prism7.0对数据进行处理。所有实验至少独立重复3次,计量数据以均数±标准差表示。采用单因素方差分析进行多组间的比较,组间两两比较采用LSD-t检验,2组间比较采用student’st检验。以P<0.05为差异有统计学意义。
2 结果
2.1 OLM对HK-2细胞活力的影响
CCK-8结果显示,浓度为5、10、20 μmol·L-1的OLM对HK-2细胞活力无明显差异(P>0.05)。见图1。后续选择10 μmol·L-1的OLM处理细胞。
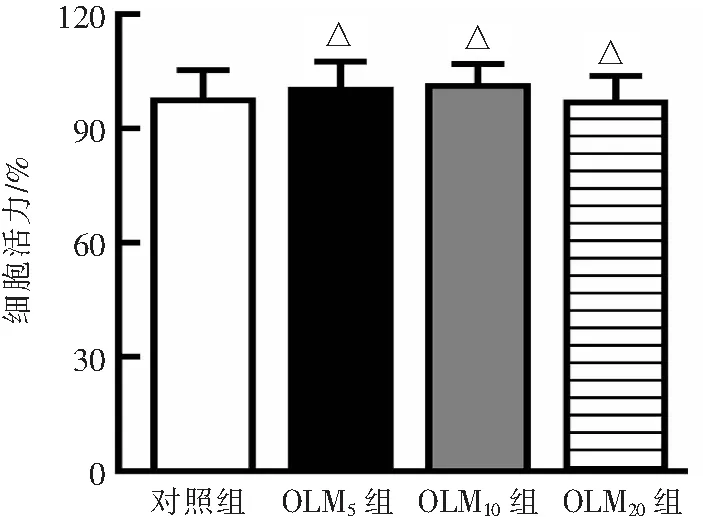
△P>0.05与对照组比较。图1 不同浓度OLM对HK-2细胞活力的影响
2.2 OLM对HK-2细胞上皮间质转化和细胞外基质合成的影响
与对照组相比,高尿酸组E-cadherin蛋白表达水平降低(P<0.05),而vimentin、α-SMA蛋白表达水平增加(P<0.05),细胞上清中collagen Ⅰ和Fibronectin的水平均增加(P<0.05);与高尿酸组相比,高尿酸+OLM组细胞E-cadherin蛋白表达水平增加(P<0.05),而vimentin和α-SMA蛋白表达水平减少(P<0.05),细胞上清中collagen Ⅰ和Fibronectin水平减少(P<0.05)。见图2。
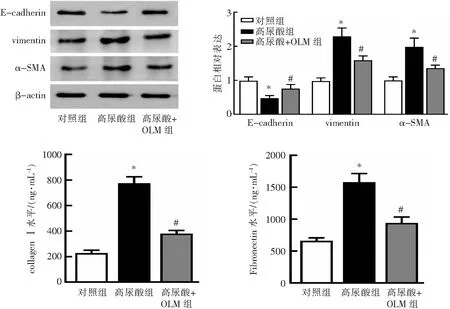
*P<0.05与对照组比较;#P<0.05与高尿酸组比较。图2 OLM对HK-2细胞上皮间质转化和细胞外基质标志物水平的影响
2.3 OLM对TLR4表达及氧化应激和炎症反应的影响
与对照组相比,高尿酸组细胞TLR4蛋白表达增加(P<0.05),ROS、IL-6、TNF-α水平均增加(P<0.05);与高尿酸组相比,高尿酸+OLM组细胞TLR4蛋白表达减少(P<0.05),ROS、IL-6、TNF-α水平均减少(P<0.05)。见图3。
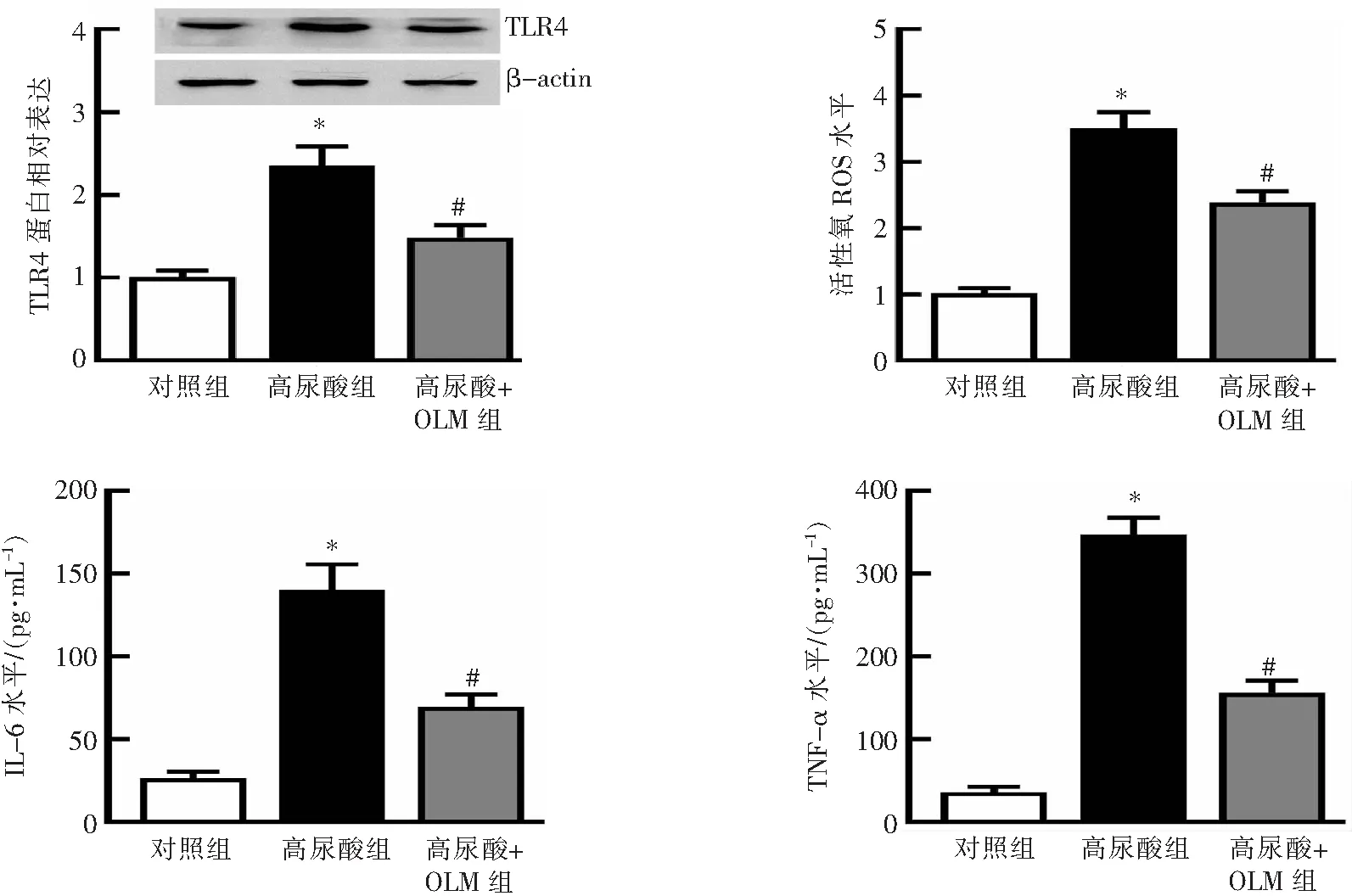
*P<0.05与对照组比较;#P<0.05与高尿酸组比较。图3 OLM对TLR4蛋白表达、氧化应激及炎症因子水平的影响
2.4 TLR4过表达的验证
与对照组相比,转染pcDNA3.1-TLR4后,HK-2细胞TLR4的mRNA表达水平上调(P<0.05),其蛋白表达水平也上调(P<0.05)。与对照组相比,转染空载体后,TLR4的mRNA和蛋白表达水平均无明显变化(均P>0.05)。见图4。
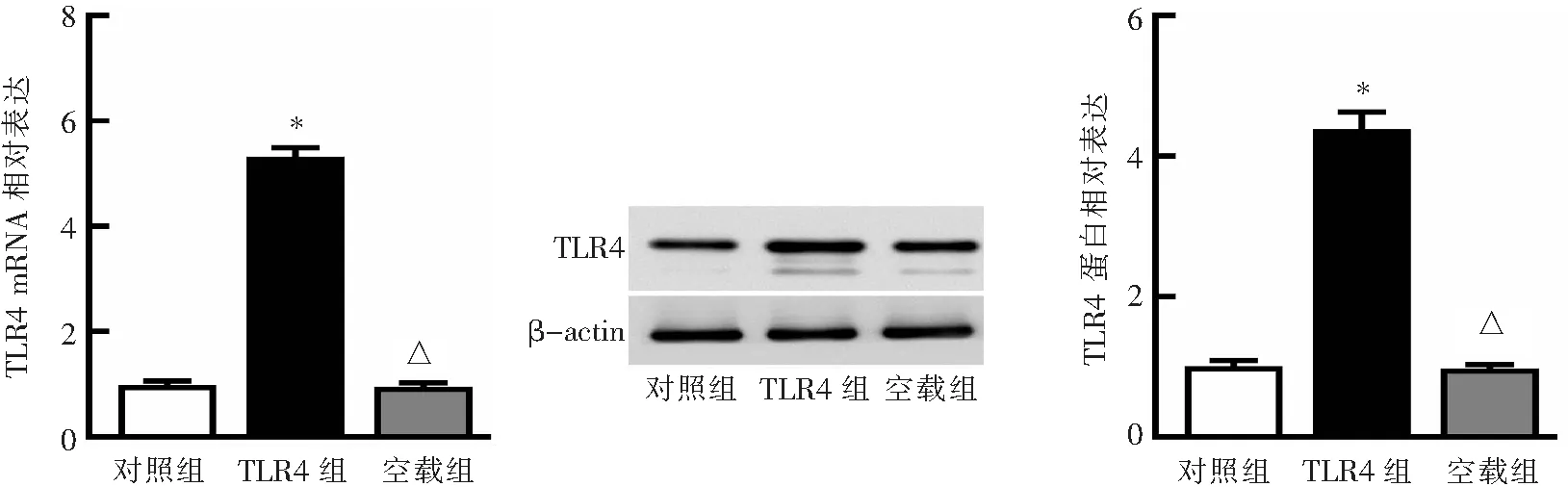
*P<0.05、△P>0.05与对照组比较。图4 TLR4在HK-2细胞中过表达的验证
2.5 TLR4过表达对HK-2细胞上皮间质转化和纤维化标志物的影响
与高尿酸+OLM组相比,高尿酸+OLM+TLR4组E-cadherin蛋白表达减少(P<0.05),而vimentin和α-SMA蛋白表达增加(P<0.05),细胞上清中collagen Ⅰ和Fibronectin水平也增加(P<0.05)。与高尿酸+OLM组相比,转染空载体后,E-cadherin、vimentin和α-SMA的蛋白表达水平均无明显变化,细胞上清中collagen Ⅰ和Fibronectin水平也无明显变化(P>0.05)。见图5。
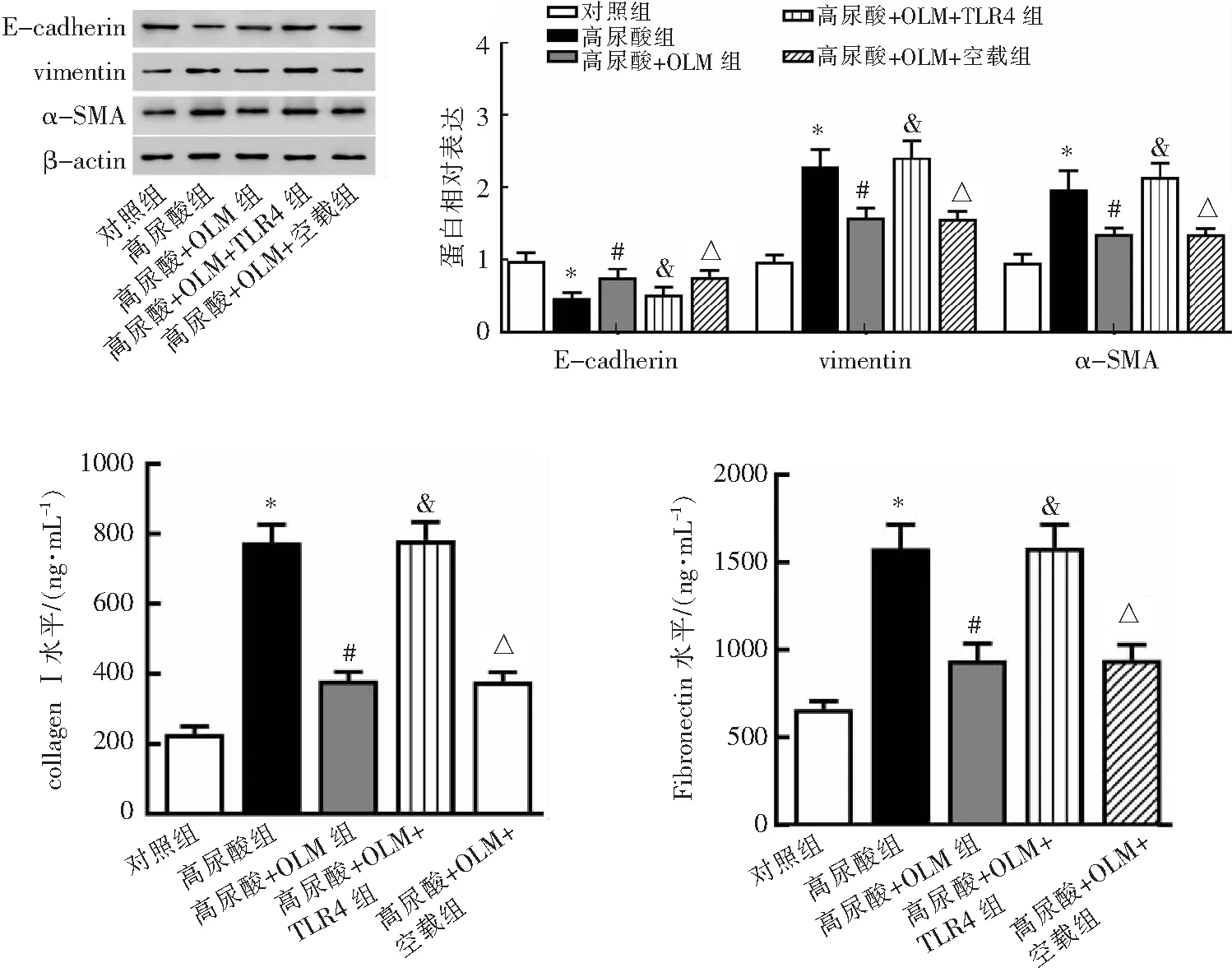
*P<0.05与对照组比较;#P<0.05与高尿酸组比较;&P<0.05、△P>0.05与高尿酸+OLM组比较。图5 TLR4过表达对HK-2细胞上皮间质转化和纤维化标志物的影响
3 讨论
细胞外基质的异常沉积是肾脏纤维化的始动因素和关键病变环节,抑制细胞外基质的过度合成或促进基质降解等可减少细胞外基质异常沉积,抑制肾纤维化进程[1]。肾间质肌成纤维细胞是合成细胞外基质的主要细胞,而肾小管上皮细胞可通过上皮间质转化获得肌成纤维细胞的特性[2,11]。因此,抑制肾小管上皮细胞的上皮间质转化是减少细胞外基质积聚重要方式。
血管紧张素受体拮抗剂OLM可以抑制人结膜下Tenon’s囊成纤维细胞的增殖活性[12],并减少Alport综合征模型小鼠的肾脏纤维化[7,13]。OLM的长期治疗可显著改善UUO模型小鼠的肾纤维化,并引起肾纤维化标志蛋白TGF-β1的表达降低[13]。本研究发现5、10、20 μmol·L-1浓度的OLM对肾小管上皮细胞的增殖活性的影响均无显著差异,本研究后续采用10 μmol·L-1的OLM研究其对肾小管上皮细胞上皮间质转化的影响。
高尿酸可诱导肾纤维化的发生和发展[14]。因此本研究采用高尿酸体外诱导肾小管上皮HK-2细胞的纤维化。与文献[14]报道类似,本研究中高尿酸处理显著减少上皮细胞标志蛋白E-cadherin的表达,增加间质细胞标志蛋白α-SMA、vimentin表达,同时细胞外基质collagen Ⅰ和Fibronectin水平也显著提高,表明高尿酸诱导肾小管上皮HK-2细胞的上皮间质转化,增加其细胞外基质积聚。然而,OLM明显增加E-cadherin表达,抑制α-SMA、vimentin表达,并降低collagen Ⅰ和Fibronectin水平,提示OLM可抑制高尿酸诱导的肾小管上皮细胞的上皮间质转化和细胞外基质积聚,进而发挥其抗肾纤维化作用。这一发现与奥美沙坦酯可以减少腹膜透析模型大鼠间皮细胞损伤标志分子α-SMA表达,而增加E-cadherin表达一致[15],也与OLM可减少糖尿病肾病模型小鼠肾组织collagen-Ⅲ和Fibronectin表达[16],抑制其肾纤维化类似。
TLR4及其介导氧化应激和促炎反应等可促进肾纤维化的发生和发展[8,17],高尿酸可通过激活TLR4信号通路诱导肾小管上皮细胞的上皮间质转化,而敲低TLR4则能抑制高尿酸的促纤维化作用[14]。在载脂蛋白E基因缺失模型小鼠中,OLM处理可抑制其主动脉中TLR4的表达[10]。既往研究[18]表明,口服OLM能减少溃疡性结肠炎模型小鼠血清IL-6和TNF-α水平,并提高抗氧化相关分子的表达。本研究发现,OLM可抑制高尿酸诱导的HK-2细胞TLR4表达,降低活性氧ROS水平,并减少促炎因子IL-6和TNF-α水平,表明OLM可抑制高尿酸诱导的HK-2细胞中TLR4表达及其介导的氧化应激和促炎反应。这与OLM可以减少腹膜透析模型大鼠血清IL-6和TNF-α炎症因子水平,抑制其微炎症状态一致[15]。此外,TLR4过表达可以部分逆转OLM介导的E-cadherin高表达、α-SMA和vimentin的低表达,增加细胞外基质collagen Ⅰ和Fibronectin水平,提示OLM抑制TLR4发挥抗肾纤维化作用。
综上所述,OLM可通过抑制TLR4及其介导的氧化应激和炎症反应抑制肾小管上皮HK-2细胞上皮间质转化和细胞外基质积聚,进而抑制肾纤维化。本研究为以肾纤维化为病理特征的慢性肾脏疾病的治疗策略提供了新方向,也为OLM在慢性肾脏相关疾病的防治应用提供了实验依据。

