基于能斯特方程探究可逆氧化还原反应模型
田一鸣 廖志刚

摘要:氧化还原与化学平衡均为高中化学的核心概念,将氧化还原与化学平衡的相关知识进行整合,会展示出丰富的化学信息。能斯特方程作为氧化还原反应的基本原理,构成了实现学生“微粒观”与“变化观”协同建构和多向整合的中介桥梁,使学生思维产生连锁化效应,可以深度激发化学认知,有效发展学生的化学核心素养。
关键词:氧化还原;化学平衡;能斯特方程;核心素养
文章编号:1008-0546( 2022)12x-0050-04
中图分类号:C632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2022. 12x.012
一、问题的提出
“氧化还原”是高中化学学习的基础核心概念,贯穿了整个高中化学学习过程,亦是化学“微粒观”建构的核心支点。“化学平衡”主要研究的对象为化学反应的限度以及影响化学平衡的因素,在化学基础理论中同样占据极其重要的地位,…是化学“变化观”建构的主要途径。两者均居于学生认知结构体系的中心位置,是知识、素养建构的主要基点。
将两个核心理论进行融合即对氧化还原反应可逆性的探讨是近年高考命题的热点。该类题目综合性强,在文献和历年真题中均有涉及,例如在2015年北京卷中,题目考查了离子在不同浓度下氧化性以及还原性的强弱,再如在2019年北交大附中期中测试中,相关题目考查了在NaClO2与HCl反应中酸度越大,生成物含量越大的原因。因此,正确理解影响物质氧化性、还原性的因素是突破该类问题的重点。而深刻剖析物质在不同外界条件下氧化性以及还原性的强弱问题则需引入能斯特方程作为理论支撑,该原理虽然在高中阶段并未涉及,但是却是支撑命题人实验设计和设问的理论依据。[2]
在能斯特方程中,通过浓度这一宏观变量构建出既满足平衡转化又体现微粒转移的可逆氧化还原反应的体系模型,实现对“微粒观”和“变化观”的整体表征,通过对模型的探究,进一步深化氧化还原反应在教学中的实际应用,体现了化学学科理解中本原性、结构化的认识价值。[3]
二、实验方案的设计与实施
1.实验原理
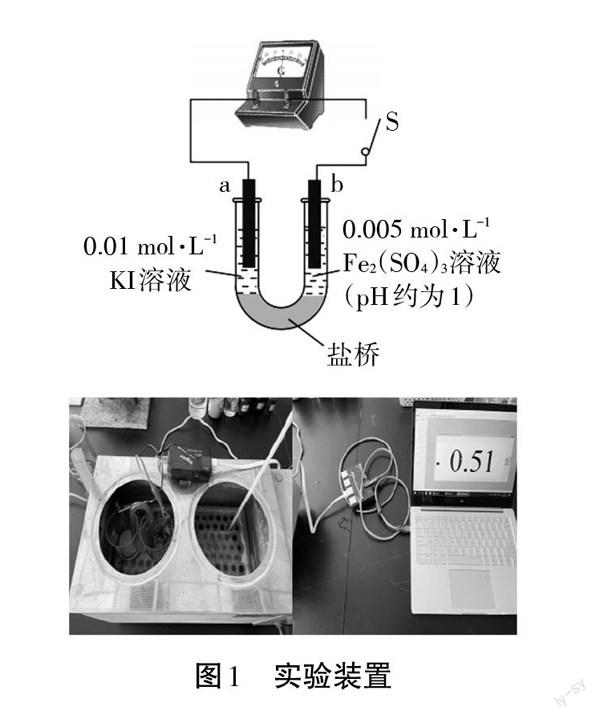
本文以2Fe3++21==2Fe2++I2作为探究对象,建构基于浓度改变量的可逆氧化还原反应的模型。实验使用石墨电极,正极电解液为Fe2(SO4)3,负极电解液为KI,连接盐桥以及导线构成闭合回路,形成原电池(实验装置如图1所示),用控制变量的方法使外界条件如温度、压强保持不变。由于矿(Fe3+/Fe2+)和φ(I2/I一)为标准状态下的电极电势,故本实验在恒温水浴的环境下进行,使温度控制在25℃左右。通过加入其他溶液,改变反应物或生成物离子浓度,进而改变化学平衡的移动方向,并使用电流传感器来表征反应的进行情况。
2.实验过程
(1)药品的配制
使用分析天平称取0.4150 G KI固体,使用250 mL容量瓶配制0.01 mol/L KI溶液,并將溶液转移至棕色试剂瓶中备用。再使用分析天平称取0.5000 G Fe2(SO4)3固体置于100 mL烧杯内,加入适量稀硫酸溶解,并将溶液pH调至约为1;再使用250 mL容量瓶将其配制成0.005 mol/L的Fe2(S04)3溶液,将溶液转移至棕色试剂瓶中备用。
使用分析天平称取8.4936 G AgNO,固体,使用50 mL容量瓶配制1 mol/L AgNO3溶液。并以此类推,分另0制得0.1 mol/L、0.5 mol/L、1.5 mol/L和2 mol/LAgNO,溶液。
再使用分析天平称取27.8020 9 FeSO4.7H2O固体置于100 mL烧杯中,加入足量稀硫酸与适量蒸馏水,二者体积之和需小于100 mL。将该烧杯置于磁力搅拌器上进行搅拌至固体溶解。待完全溶解后转移至100 mL容量瓶中,加入蒸馏水至刻度线定容、摇匀,制得1 mol/L FeS04溶液。以此类推,分别制得0.1 mol/L、0.5 mol/L、1.5 mol/L和2 mol/L的FeS04溶液。此时浓度变量溶液已经制备完毕。
用电子天平称取3.0 g琼脂固体于250 mL烧杯中加入97 mL的饱和KCl溶液后,置于电炉上加热,用玻璃棒不断搅拌至琼脂完全融化,趁热将琼脂一饱和KCl溶液转移至U型管中,待其冷却至室温浸泡于饱和KCl溶液中备用,此时盐桥制备完毕。
(2)原电池的组装
分别取20 mL 0.01 mol/L的KI溶液和0.005 mol/L的FeZ(S04)3溶液置于两个100 mL烧杯中,将烧杯放置于恒温水浴锅中,并在恒温水浴锅中加入足量的水及至水线没过两烧杯内溶液液面高度,再取一支量程为50℃的温度计置于烧杯中,打开恒温水浴锅的开关,将旋钮旋至加热,注意观察温度计示数,至22℃时立刻将按钮旋至恒温,利用余热将温度可控在25℃,按照实验装置将预备好的盐桥放置在两烧杯间,底端没人烧杯液面以下,将碳棒分别插入烧杯,连接电流传感器,形成闭合回路,构成原电池。
(3)改变原电池中反应物及生成物浓度对平衡影响的探究
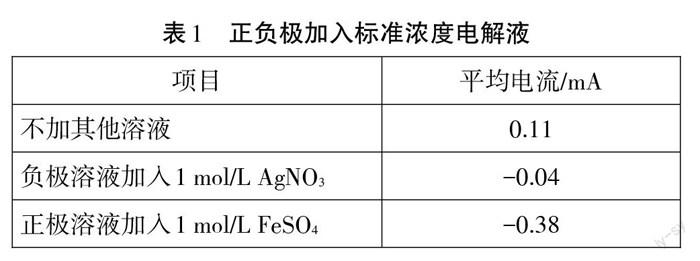
安装好装置后,打开DISLab7.2软件,点击仪表按钮,开始实验。用电流传感器采集数据并观察图像,待图像变动幅度趋于稳定时,向KI溶液中加入1mol/L AgNO3溶液,观察图像变化,待其再次趋于稳定后向Fe2(SO4)3溶液中加入1 mol/L FeS04溶液,继续观察图像变化,数据图像如图2所示,实验数据见表1。
控制右侧加入FeS04溶液浓度保持1 mol/L,采取浓度梯度方式,分四次向左侧溶液中加入0.1 mol/L、0.5 mol/L、1.5 mol/L和2 mol/L AgNO,溶液,观察图像趋势,待平稳后完成第二次实验,收集到的实验数据见表2。
控制左侧加入AgNO3溶液浓度保持1 mol/L,同理加入相同浓度梯度的FeSO4溶液,观察图像,待平稳后完成第三次实验。收集到的实验数据见表3,整理实验数据,实验仪器及药品。
将表2、表3数据以浓度为X轴,平均电流为Y轴,绘制成图像,如图3所示。
三、实验数据分析
1.利用能斯特方程对图像进行定量探究
选择-20 mA-20 mA量程的电流传感器,测量出300 s内2Fe3++21-==2Fe2++I2该反应在正常反应过程中加入1 mol/L AgNO,以及1 mol/L的FeSO4后的电流变化。
分析得知,在相同条件下,基于该氧化还原反应的原电池产生的平均电流值仅有0.11 mA,该反应过程中电流先增大后降低逐渐平稳,这是由于反应开始时只有部分溶液参与反应,为反应的起始点,到达最高点时全部溶液参与反应,电流达到峰值,随着反应的继续进行,逐渐达到平衡点電流下降最后趋于不变。该反应Fe3+为正极溶液,I一为负极溶液,根据氧化还原反应电位,矿(Fe3+/Fe2+)为0.77 V,矿(12/I)为0.54V,在非标准状态下电池电动势E=O.II V,电流为正向电流,在图像x轴上方。
又由于AGe=_nEeF=_RlrlnKe,nEe=0.059 lgKa,该反应的Ko-1 07'8。可知该反应在标准状态下反应很彻底,故要想使反应方向发生逆转,需要在非标准状态下进行反应,即控制外界因素不变,改变反应离子浓度,进而改变反应的电流方向及大小。在加入1 mol/L AgNO,后.电流值恰好发生了突跃,由正向平衡电流突跃至负向电流,电流大小由0.11 mA变至-0.04 mA,反应趋势与第一段趋势相似,逐渐平衡,电流趋近于0,但此段图像与理论不符。分析原因如下:由于Ag++l-=Agl l,反应生成沉淀,根据能斯特方程妒(I2/I一)=(9(I:/I一)-0.059 lgc(l-),在加入1 mol/L AgNO,后c(r)=Kspe( Agl) =9.3xl0。7 mol/L,带人能斯特方程可知妒(L/I-)=1.54 V,此时妒(I2/I一)>妒0(Fe3+/Fe2+),正负极对调,E=cp (12/I-) -矿(Fe3+/Fe2+) =1.54 V-0.77 V=0.77 V>O.11 V,产生的负向电流绝对值应大于O.llmA,故理论电流值应如图4中所示的黑色(稍粗)曲线。而实际图像中为对应时间内的红色(稍细)曲线,由于产生的Agl为稳定黄色沉淀,K。9很小,使得溶液中剩余的c(I-)仅有9.3xl0。17 mol/L,溶液的电导率需要以离子浓度作为支撑,对于几乎不存在I一的情况下,电池内阻较大,产生的电流非常小,在加入Imol/L的FeSO。后,由能斯特方程,妒(Fe3+/Fe2+)=旷(Fe3+/Fe“)+0.059 lg[c(Fe“)/c(Fe“)],此时非标准状态c(Fe3+/Fe2+)=0.63V,正极仍为I一,负极为Fe3+,该反应的非标准态电动势E=cp(12/I')-妒(Fe3+/Fe2+) =1.54 V-0.63 V=0.91 V,图像再次突跃且为三段电流中电动势最大的一段,而此反应中由于加入溶液FeS04,溶液中离子浓度大,故电阻较小,产生的电流值也较大,平均电流-0.38 mA,故形成了有两段突跃值的电流曲线,如图4所示。
2.利用化学平衡原理对图像进行定性解释
在2Fe3++2I==2Fe2++12反应中,由上述定量分析可知,该反应的Ke很大,故反应很彻底,几乎不存在可逆性,Fe3+为正极,I一为负极,产生的电流恒为正向电流。但在减少反应物浓度以及增加生成物浓度后,该反应存在可逆倾向,即在加入AgNO。后,使得Ag+与I一结合成Agl沉淀,溶液中的反应物c(I-)急剧减小,使得化学平衡向左移动,反应逆向进行,I一为正极,Fe3+为负极,则会产生负向电流,待该反应再次达到平衡,加入FeSO4后,溶液中的生成物c(Fe2+)增大,化学平衡再次向左移动,I一为正极,Fe3+为负极,继续产生负向电流,最终第三次达到化学平衡。
四、实验结论与应用
1.实验结论
根据能斯特方程,可通过改变氧化型或还原型的浓度,改变电极电势大小,进而实现氧化还原反应中反应物与生成物的转化。 2.实验应用 在实验设备方面,采取数字化实验的科学方法,利用微型传感器精确研究浓度微小变化带来的影响,引入电流传感器,通过物理中电流电阻的动态表征对实验结论进行全局性判断,[4]赋予化学实验新思维,新感知。数字化实验的应用也更为广泛,数字化实验在中学化学教学的价值将逐渐被体现出来。[5]
在中学教学方面,探究化学平衡载体下的氧化还原反应是利用能斯特方程作为衔接桥梁,以氧化型或还原型的浓度作为宏观变量,揭示了氧化还原反应在热力学判据中的实质,即电极电势的差值。该原理虽然在高中阶段并未涉及,但是却是支撑命题人实验设计和设问的理论依据。
同时,氧化还原与化学平衡的联系是很广泛的,如在制备氯气中选择浓盐酸作为强氧化剂与二氧化锰进行反应,在日常生活中手机锂离子电池充放电原理的应用问题等,解答此类综合性问题需要学生综合运用氧化还原和化学平衡知识。将氧化还原反应的热力学判据即电极电势与影响化学平衡移动的外界因素即离子浓度进行结合,有利于实现化学学科中“微粒观”与“变化观”的协同建构与多项整合,进而完成对学生的多维度考查,还可以丰富学生对于氧化还原反应的认知,对发展学生的化学学科核心素养大有裨益。
参考文献
[1]岳可芬,王小芳.外界条件对化学平衡的影响在物理化学中的内容[A].中国化学会化学热力学和热分析专业委员会.中国化学会第十五届全国化学热力学和热分析学术会议论文摘要[C].中国化学会化学热力学和热分析专业委员会:中国化学会,2010:2.
[2]杨晓琳,高修库,赵浏.运用能斯特方程定量分析影响物质氧化性与还原性的因素[J].高中数理化,2020(22):123-126.
[3] 郑长龙.化学学科理解与“素养为本”的化学课堂教学[J].课程·教材·教法,2019,39(09):120-125.
[4]周薇,王兆龙.特殊电化学现象的热力学分析[J].中学化学,2020(07):39-40.
[5]裴传友,马善恒,杨芹.中学化学数字化实验的发展与应用[J].化学教学,2020(02):56-60.

