分子靶向和免疫治疗在儿童恶性实体瘤中的应用进展
蒋莎义 吕志宝


蒋莎义,医学博士,上海市儿童医院血液肿瘤科主任医师。中国抗癌协会小儿肿瘤专业委员会委员,上海市抗癌协会儿童肿瘤专业委员会副主任委员,上海市健康科技协会基因健康专委会常务委员,国家肿瘤微创治疗产业技术创新战略联盟委员会委员。主持包括国家自然科学基金在内的多项科研课题,在国内外学术期刊发表论文70余篇。
通信作者:吕志宝,主任医师,教授,博士生导师,上海市儿童医院副院长,上海交通大学医学院儿科学院副院长,现任中华医学会小儿外科分会常务委员,中国医师协会小儿外科分会常务委员,中国抗癌协会小儿肿瘤分会常务委员,中华医学会小儿外科分会肝胆学组副组长,上海医学会小儿外科分会主任委员,上海市医学会外科分会委员,国际肝胆胰协会中国分会儿科专业委员会副主任委员,中国医师协会住院医师规范化培训儿外科专业委员会委员,《中华小儿外科杂志》、《临床小儿外科杂志》、《临床儿科杂志》、《上海交通大学学报(医学版)》等杂志编委,World Journalof Pediatric Surgery副主编。
摘要:目的:深入了解小分子靶向药物和免疫治疗在儿童恶性实体瘤中的应用进展。方法:对获批用于儿童恶性实体瘤的分子靶向和免疫治疗药物的儿科临床研究文献进行综述。结果:分别有近10种小分子靶向药物和免疫治療药物用于儿童恶性实体瘤临床,主要治疗复发难治或/和手术难以切除的病例。I期临床均显示出良好的耐受性。某些肿瘤完全或部分客观反应,如伴ALK异常的炎性肌成纤维细胞瘤和间变大淋巴瘤对克唑替尼,TRK融合肿瘤对拉罗替尼,都有可观反应。在免疫治疗药物中疗效显著的是GD2单克隆抗体,提高了高危神经母细胞瘤患儿生存率20%左右。结论:小分子靶向和免疫治疗药物是目前儿童复发难治恶性实体瘤的治疗策略,进一步提高了这类患儿的生存率,也是探索新疗法的研究方向。
关键词:分子靶向药物 免疫治疗 恶性实体肿瘤 儿童
中图分类号:R733.7文献标志码:A文章编号:1006—1533(2022)S2—0214—10
引用本文蒋莎义,吕志宝,分子靶向和免疫治疗在儿童恶性实体瘤中的应用进展.上海医药,2022,43(S2):214-223.
Advance of molecular targeted agents and immunotherapy applied to chil-dren with malignant solid tumors
JIANG Shayi,LYUZhibao
(Department of Hematology and Oncology,Children's Hospital of Shanghai,Shanghai 200062,China)
ABSTRACT Objeetive: To further understand the advance of small molecule targeted drugs and immunotherapy applying in children with malignant solid tumors.Methods: To review the research literature on the application of molecular targeted and immunotherapeutic drugs approved for children with malignant solid tumors.Results:There are nearly 10 small molecule targeted drugs and immunotherapeutic drugs used in the clinical treatment of children's mnalignant solid tumors.Atpresent,it is mainly used for patients with recurrence and refractory tumors and/or difficult to resect by surgery. Phase I clinical trials show good tolerance.Some tumors have complete or partial objective response. For example, inflammatory myofibroblastoma and anaplastic lymphoma with abnormal ALK have objective response to crizotinib and TRK fusion tumor to larotrectinib.Among immunotherapeutic drugs,GD2 monoclonal antibody is an outstanding one, improving the survival rate of children with high-risk neuroblastoma by about 20%.Conclusion:Small molecule targeted drugs and immunotherapies are currently the treatment strategies for children with relapsed and refractory malignant solid tumors,which further improve the survival rate of such children and are also the exploration direction of new therapies.
KEY WORDS molecular targeted agents;immunotherapy;malignant solid tumors;children
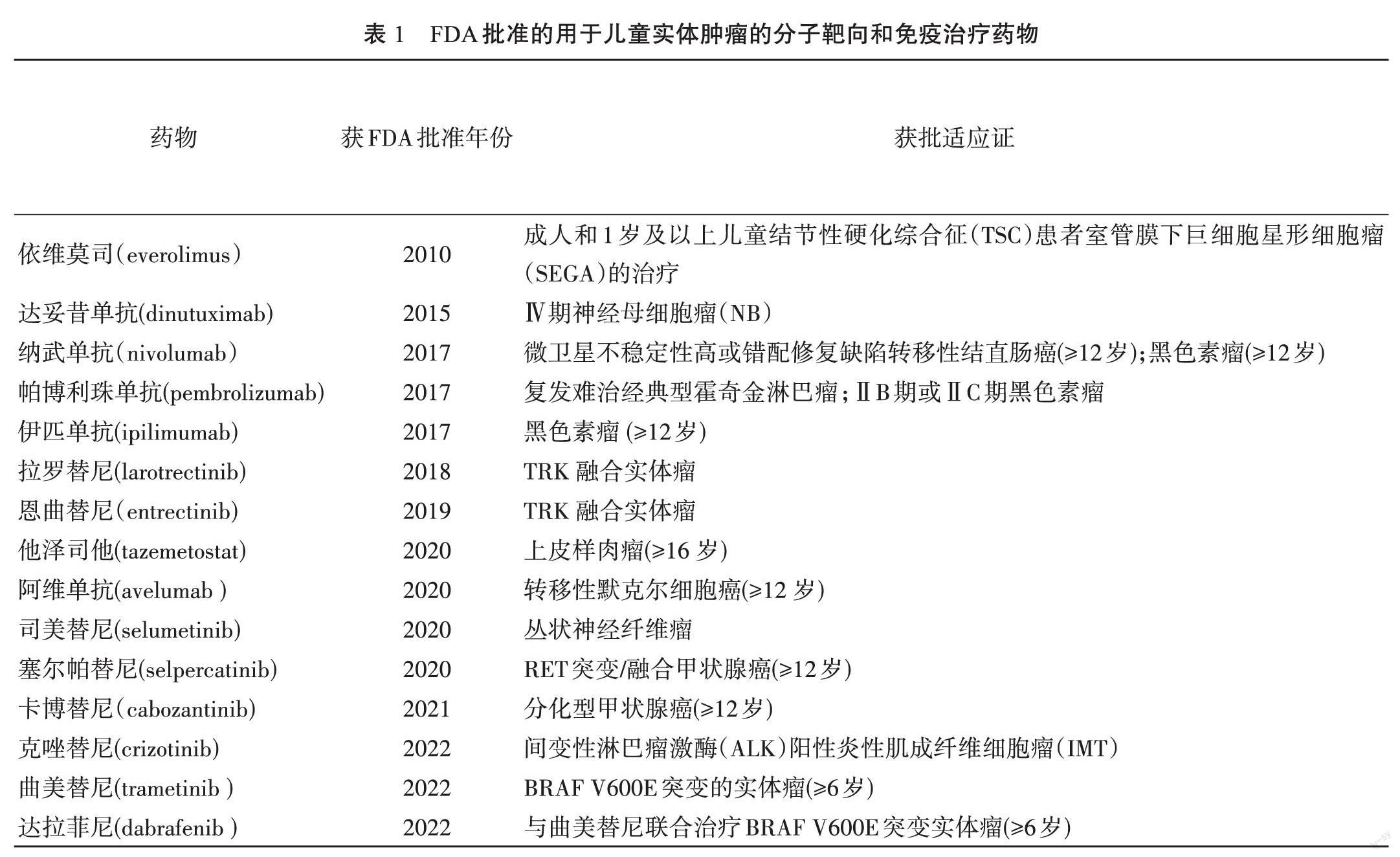
当今肿瘤治疗的药物多种多样,包括细胞毒化疗药物、激素、分子靶向和免疫治疗。分子靶向和免疫治疗是近10年兴起、发展迅速且具有广阔应用前景的肿瘤药物治疗方法,前者针对恶性肿瘤病理生理信号通路的靶点精准打击,阻扰肿瘤细胞生物活动;后者则是通过免疫调定点干预、抗体与肿瘤特有的抗原结合等,激活各类免疫细胞介导的细胞毒活性。靶向和免疫治疗药物在成人肿瘤治疗中如雨后春笋一样涌现,而针对儿童的获批的相关药物仅10余种,如拉罗替尼、司美替尼、克坐替尼和达妥昔单抗等(表1)。这里仅就美国FDA已批准的可用于儿童实体肿瘤的这两类药物作一简要综述。
1分子靶向药物
某些抑癌基因或癌基因异常,产生异常调节蛋白,改变正常下游多种酪氨酸激酶信号通路而促肿瘤发生、进展。与实体瘤的发生相关的有血管内皮生长因子(VEGF)、血小板衍生生长因子(PDGF)和成纤维细胞生长因子(FGF)等激活受体通路。分子靶向药物多为这些通路上受体酪氨酸激酶的抑制剂(TKI),靶向信号转导的关键酪氨酸激酶,阻止肿瘤细胞生长和存活。
1.1拉罗替尼(larotrectinib)和恩曲替尼(entrec- tinib)
神经营养性酪氨酸受体激酶(NTRK)基因(NTRK1、NTRK2和NTRK3)編码原肌球蛋白受体激酶(TRK)蛋白家族(TRKA、TRKB和TRKC),在各种生物过程和细胞功能的调节中起作用。NTRK基因可以与多种伴侣基因融合,所表达的嵌合蛋白通过组成型激酶激活,驱动肿瘤发生(2。所以,NTRK基因融合见于多种成人和儿童恶性肿瘤,是这些肿瘤的致癌驱动因素]。
拉罗替尼和恩曲替尼是第一代TRK抑制药物,可逆性与TRK结合,阻止TRK融合蛋白非配体依赖性组成型激活的实体瘤生长。
一项应用拉罗替尼单药于24名中位年龄为4.5岁的儿童局部晚期和转移性实体瘤的临床试验,包括婴儿型纤维肉瘤(n=8)、其他软组织肉瘤(n=7)和甲状腺乳头状癌(n=2)。肿瘤存在TRK融合者17例,无TRK融合者7例。不良事件主要为1级丙氨酸转氨酶和天冬氨酸转氨酶升高、白细胞减少和中性粒细胞降低。TRK融合阳性肿瘤患儿93%达到客观反应。1例婴儿型纤维肉瘤在12个周期后停药观察,1个月后进展,再次用药仍使肿瘤缩小。本研究中唯一的1例治疗中进展的NTRK融合的婴儿型纤维肉瘤治疗中进展病例,于复发肿瘤中检测到溶剂前沿(solvent front)抗性突变Gly623Arg TRKC。7例TRK融合阴性肿瘤患儿均对治疗无反应。推荐II期临床试验剂量(RP2D)为100mg/㎡2,2次/d,28d为1个周期5]。
上述临床试验(NCT02637687)中有5例NTRK融合的患儿(0.4~12岁)患有局部晚期婴儿纤维肉瘤(3例)或软组织肉瘤(2例),对拉罗替尼均有效,并在4~9个周期后进行了非致残性手术切除,3例为RO切除、2例分别为R1、R2切除。开始手术前至少停用拉罗替尼24h;如需要,手术48h后恢复用药。3名患者在术前获得完全(2例)或接近完全(治疗效果>98%,1例)病理反应,术后停用拉罗替尼7至15个月无复发;2名肿瘤切缘呈阳性患儿,继续接受拉罗替尼治疗[6]。
除了TRK,恩曲替尼还是原癌基因酪氨酸蛋白激酶ROS1和ALK的抑制剂,并可穿透血脑屏障。ROS1和ALK的基因融合导致致癌途径的组成部分激活7-8]NTRK及其融合蛋白在某些罕见儿童肿瘤中发生率高(>90%),包括婴儿纤维肉瘤、先天性中胚层肾瘤;在某些肿瘤中发生率较低(5%~25%),如儿童神经胶质瘤、胃肠道间质瘤、黑色素瘤和甲状腺乳头状癌;而在一些常见儿童肿瘤中罕见表达,包括急性白血病或软组织肉瘤[9-10]。
一项I/II期儿童和青少年临床试验,纳入<22岁的实体瘤患者,部分伴有NTRK1/2/3、ROS1或ALK融合,口服恩曲替尼的剂量递增。其最常见的治疗相关不良事件是体重增加(48.8%)和骨折(20.9%);RP2D是300mg/㎡;43名患儿(中位年龄7岁)可进行疗效评估,在融合阳性肿瘤患者中,客观反应率为57.7%。纳入293例NTRK、ROS1或ALK阳性局部晚期或转移性肿瘤患者的另一临床试验中,恩曲替尼剂量在成人为600~800mg/d,儿童为250~750mg·m-2·d-1(包含16名20岁以下的儿童和青少年复发或难治NTRK或ROS1阳性的脑或颅外实体瘤患儿);可评估疗效数据的患者中,73%达到完全或部分的反应[12]。
1.2司美替尼(selumetinib)和曲美替尼(trametinib)
RAS/RAF/MEK/ERK通路基因的改变可致经典丝裂原活化蛋白激酶(MAPK)调节失调。作为下游途径,MAPK信号(MEK/ERK)的异常激活通常是因为RAS 或BRAF基因功能获得性突变或神经纤维瘤病1型(neurofibromatosis type I,NF1)基因缺失或失活性突变所致。该通路是许多人类癌症发病机制中最常见的失调级联信号之一[13]。虽然在人类肿瘤中常见突变基因是BRAF、RAS和NF1而非编码MEK蛋白的基因,但由于MEK在MAPK级联信号中的核心作用,已被用作治疗靶点。
司美替尼即是选择性MEK抑制剂。而NF1是一种常染色体显性遗传性肿瘤易感综合征,位于染色体17q11.2.5的NF1抑癌基因在90%的病例中突变,导致NF1基因产物神经纤维蛋白功能丧失,增加了RAS活性而促进下游MAPK级联信号途径激活。司美替尼用于不能手术的NF1相关丛状神经纤维瘤(PNF)儿童,70%左右的患儿肿瘤缩小(1415],疼痛减轻、生活质量改善,阻止了疾病相关并发症的发生和进展[6]。一般剂量是25mg/㎡,口服2次/d,28d为1个周期,连续服用。试验中最长67个周期。副作用包括痤疮样皮疹、胃肠道反应和肌酸激酶升高[14-16]。
伴有RAF、NF1等涉及MAPK通路因子突变的24例复发难治实体瘤患儿(中位年龄14岁)接受司美替尼治療,7例高级别胶质瘤(high-grade glioma,HGG)和7例横纹肌肉瘤。没有观察到客观反应。3例最佳应答是疾病稳定,包括2例HGG患儿(NF1突变,6个周期;KRAS突变,12个周期)。6个月无进展生存率为15%。5例(25%)患者经历了3级及以上的不良事件。司美替尼在MAPK通路突变的上述肿瘤中作为单药治疗的疗效有限[1]。
曲美替尼是MEK1/MEK2可逆、高度选择性抑制剂,具有良好的口服生物利用度(72%)。食物可使曲美替尼AUC降低24%,Cmax降低70%,因此建议在禁食条件下,餐前1h或餐后2h服用。在一项多中心回顾性研究中,分析了18例使用曲美替尼治疗低级别胶质瘤(low-grade glioma,LGG)的患儿,6例部分反应、2例轻微反应和10例稳定疾病,疾病控制率为100%。对治疗反应的是BRAF和NF1驱动的肿瘤。中位治疗时间为12.5个月。3名患者在停药2~4个月出现疾病进展。89%发生治疗相关不良事件。44%出现严重不良事件,最常见的是皮疹和甲沟炎,其中6名(33%)患者需要减少剂量,2名(11%)患者需要停止治疗[18]。
NF1患儿除进展为PNF外,还可伴发LGG,可导致顽固性疼痛、神经功能缺损、因压迫导致的器官功能障碍等。PNF和LGG对化疗不敏感,主要采用手术治疗。6例伴广泛PNF或LGG的儿童NF1接受曲美替尼治疗,年龄为21个月至14岁。所有患儿均部分缓解或疾病稳定。2例危及生命的PNF患者在临床症状显著改善和发育追赶的同时,出现了部分影像学改善9]。
1.3达拉非尼(dabrafenib)
达拉非尼是一种有效和选择性的RAF激酶抑制剂,靶向BRAFV600E突变。
越来越多的儿童癌症中发现BRAFV600E突变,见于50%的儿童恶性黑色素瘤[20]、57%朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH)患儿[2、20.7%神经节胶质瘤、50.8%的多形性黄色星形细胞瘤以及各类儿童低级别胶质瘤(pediatric low-grade glioma,pLGG)[22-23]。这些数据表明,BRAFV600E可能是许多儿童癌症的治疗靶点。
在对有BRAFV600E突变的27例复发/难治性实体瘤(含LCH)患儿应用达拉非尼的I期临床试验中,最常见的3/4级不良事件是黄斑丘疹和关节痛(各2例),未观察到剂量限制毒性;第2阶段剂量为5.25mg·kg-·d-(年龄<12岁)和4.5mg·kg-1·d-1)(年龄≥12岁)分2次服用,每天不超过300mg[24]。在该临床试验(NCT01677741)的第1、2阶段共32例pLGG,包括毛细胞星形细胞瘤(n=13)、神经节胶质瘤(n=7)和多形性黄色星形细胞瘤(n=3)等,中位年龄8.9岁;客观反应率44%(14/32):1例完全反应和13例部分反应。5例疾病稳定[25]。
无法切除的脑干浸润性神经节胶质瘤患儿常规化疗+放疗后无进展生存率低。有研究报道:达拉非尼可使BRAFV600E突变的这种肿瘤迅速消退,临床和放射学有显著和持久的改善;尽管所有患者在停药后几天到几周内都出现了快速的临床和放射学复发,但当重新引入达拉非尼时,又会显示快速和持续的治疗反应;长期使用该靶向治疗耐受性良好[26]。
1.4克唑替尼(crizotinib)
克唑替尼是ALK、肝细胞生长因子受体c-Met和ROS1酪氨酸激酶受体及其致癌变体(例如,MET突变或ALK融合)的选择性小分子口服抑制剂[2]。ALK定位于细胞膜,由ALK基因编码合成。活性ALK调节涉及磷脂酰肌醇3-激酶(PI3K)-哺乳动物雷帕霉素靶蛋白(mTOR)等信号通路,在细胞生长、分化和凋亡中发挥作用。ALK基因在胚胎发育后失活,但可以通过染色体易位、拷贝数扩增或点突变而被激活[28]。ALK基因是发生易位的热点部位,已知有超过22种伴侣基因和60种融合蛋白。ALK异常见于间变性大细胞淋巴瘤(ALCL)、IMT和NB等多种肿瘤[29]。
美国儿童肿瘤协作组(Children's Oncology Group, COG)早期I期临床试验纳入79例1~22岁进展难治性肿瘤患儿,应用单药克唑替尼。耐受性良好,3、4级不良事件为中性粒细胞减少和肝酶升高。RP2D为每次280mg/㎡,2次/d。其中14例患儿的肿瘤对治疗完全或部分反应,主要集中在伴ALK异常的肿瘤病例,包括ALCL和IMT[30]。
COG的一项II期临床研究纳入26例复发/难治性ALK阳性ALCL和14例转移性或不能手术的ALK阳性IMT患儿,每日2次口服克唑替尼。以每次165(ALCL165)和280(ALCL280)mg/㎡治疗的ALCL患者的总有效率分别为83%和90%。IMT患儿(以每次100、165和280mg/㎡治疗)的总有效率为86%。ALCL165完全反应83%(5/6);ALCL280完全反应80%(16/20)、部分反应10%(2/20);IMT完全反应36%(5/14)、部分反应50%(7/14)。最常见的药物相关不良事件是中性粒细胞减少[31]。
对ALK阳性NB患儿而言,疗效还受ALK突变类型限制。20例复发/难治性NB患者接受克唑替尼治疗,每次280mg/㎡,每日2次,28d为1个周期,每3个周期评价疗效。客观应答率为15%:所有3名应答患儿都有体细胞ALK Arg1275Gln突变,是NB中最常见的ALK突变类型,其中2名患儿疾病长期稳定,分别为10和13个周期。另2种突变ALK Phe1174Leu和ALK Phel174Val 患儿,疾病都在治疗中进展。ALK扩增患儿对克唑替尼无反应。最常见的不良事件是中性粒细胞计数减少[32]。
1.5依维莫司(everolimus)
mTOR是普遍存在的丝氨酸-苏氨酸激酶,参与细胞周期、血管生成和細胞凋亡的调节。在许多人类癌症中,激活mTOR的细胞信号通路发生异常[33]。依维莫司是mTOR的小分子抑制剂,抑制mTOR,导致细胞G1期阻断和凋亡,并可抑制血管生成[34]
持续口服依维莫司在复发/难治性实体瘤的儿童中耐受性良好,剂量限制性毒性(DLT)包括腹泻和黏膜炎。3~5mg/㎡时显著抑制儿童外周血单个核细胞的mTOR信号通路。实体瘤儿童的RP2D为5mg/㎡(35]。8例复发难治软组织肉瘤和骨肉瘤及5例颅内肿瘤接受依维莫司与贝伐单抗联合治疗,同样耐受性良好,30%晚期病例疾病稳定。外周血单核细胞中的mTOR生物标志物磷酸-4EBP1 Thr/37/46从基线到第27天显著降低(P=0.045),提示依维莫司对mTOR的抑制作用。RP2D为依维莫司4mg/㎡,贝伐单抗8mg/kg,4周为1个周期[36]。依维莫司联合化疗治疗CIC-LEUTX融合并合并TSC2基因突变的中枢胚胎性肿瘤,可使疾病控制,可能与TSC2蛋白参与mTOR/AKT途径有关[37]。另有该药治疗中枢低级别胶质瘤的报道[38]。
1.6卡博替尼(cabozantinib)
卡博替尼抑制多种酪氨酸激酶,包括血管内皮生长因子受体2(VEGFR2)、MET、转染期间重排(RET)和内膜内皮细胞激酶(TEK)。在儿童实体瘤I期临床试验中安全性、耐受性良好,99.7%接受治疗的患儿的毒性为1~2级,包括高血压、腹泻、手足综合征和甲状腺功能减退,一般在护理或药物减量后即可缓解;RP2D是40mg·m-2·d-1[39]。包含儿童病例的一项I/II期临床试验,39例尤因肉瘤和42例骨肉瘤可评估疗效:骨肉瘤为16.7%部分缓解,33.3%病情稳定;尤因肉瘤为25.6%部分缓解,38.4%病情稳定[40]。另一针对年龄大于16岁NF1的I/II期临床试验,在NF1相关PNF中,使肿瘤体积减少和疼痛改善;有2名受试者因手足综合征而停用卡博替尼1]。还有报道卡博替尼治疗TFE3融合、表达MET的儿童肾癌[42)和NB43],疾病得到控制。
1.7塞尔帕替尼(selpercatinib)
该药是一种激酶抑制剂,其抑制野生型RET和多种突变的RET亚型以及VEGFR1和VEGFR3。RET编码的 RET蛋白由神经营养因子激活,诱导受体二聚化、激酶结构域磷酸化,对神经系统以及肾脏发育等起着至关重要作用。在RET融合的肿瘤中,伴侣基因融合到RET基因的远端部分,产生组成性活性嵌合蛋白。其融合和突变见于多种肿瘤:甲状腺癌、甲状腺髓样癌和非小细胞肺癌等。而在黑色素瘤、软组织肉瘤和卵巢癌等,RET融合的报道很少(<1%)[4445]。
多发性内分泌肿瘤2型(MEN2)中的甲状腺髓样癌(MTC)是由RET原癌基因突变引起的。塞尔帕替尼治疗儿童术后复发进展的MEN2的MTC,血清降钙素和癌胚抗原(CEA)下降,肿瘤体积缩小。不良反应包括短暂且可逆的丙氨酸转氨酶、血清胆红素1~2级升高和便秘。2
塞尔帕替尼对伴有RET基因融合的婴儿肌纤维瘤/血管外皮细胞瘤并肺转移、对化疗不敏感的转移性婴儿纤维肉瘤和足脂肪纤维瘤病都显示出疗效,90mg/㎡,2次/d,28d为1个周期4]。其中一例婴儿型纤维肉瘤患儿伴有颅内转移肿瘤,90mg/㎡时脑脊液塞尔帕替尼浓度4.5ng/mL,当增加剂量至180mg/㎡,2次/d时,脑脊液浓度16ng/mL。6个周期后颅内肿瘤反应率达66%,无治疗相关不良事件(47]。一项针对晚期RET改变的实体瘤或原发CNS肿瘤患儿的I/II期儿科临床试验(NCT03899792)正在进行中。
1.8他泽司他(tazemetostat)
是zeste同源物增强子2(EZH2)的选择性抑制剂。EZH2作为甲基转移酶,可催化组蛋白H3的赖氨酸27单甲基化、二甲基化和最终三甲基化,标志着组蛋白对转录的抑制[48]。高活性EZH2在干细胞和祖细胞中抑制与细胞周期阻滞和终末分化有关的基因。随着细胞开始分化,EZH2活性越来越受到SWI/SNF染色质重塑多蛋白复合物的对抗,这有助于促进细胞终末分化4。EZH2活性异常上调和SWI/SNF复合物因基因突变致功能丧失(例如,亚基INI1缺失)在人类肿瘤中广泛存在[50]。儿科肿瘤临床前试验,他泽司他在横纹肌样肿瘤模型中显示出显著的抗肿瘤活性(5。有研究纳入62例16岁以上转移性或晚期上皮样肉瘤,免疫组化分析失去INI1表达或/和双等位基因SMARCBI(编码INI1的基因)改变,使用他泽司他800mg,2次/d,持续服用。结果显示其具有良好的耐受性,3级或以上的治疗相关不良事件包括贫血(6%)和体重减轻(3%);26%在32周时疾病仍处于控制中;他泽司他提示有可能改善晚期上皮样肉瘤患者的预后[52]。
2免疫治疗
免疫逃逸使肿瘤细胞更加肆无忌惮地生长和侵袭,免疫系统的这种“隐形性”是由抑制性或调节性免疫细胞被募集到肿瘤微环境以及肿瘤细胞自身表达免疫抑制性抗原来介导的,前者抑制各种免疫细胞对肿瘤的免疫攻击;后者增强了免疫检查点的免疫抑制作用,如肿瘤细胞通过操纵细胞程序性死亡蛋白1(PD-1)及其配体(PD-L1)的相互作用而抑制T细胞的细胞毒性[53]。肿瘤的免疫治疗既是通过抗体与肿瘤特有抗原结合来激活免疫细胞介导的细胞毒性,或采用免疫检查点抑制剂对抗肿瘤细胞对PD-1/PD-L1的操控而恢复T细胞对肿瘤细胞的杀伤作用。还可通过体外工程化T细胞识别并杀伤肿瘤细胞。
2.1免疫检查点抑制剂(ICls)
ICIs已在成人肿瘤治疗中广泛应用。正常情况下,免疫检查点分子与其配体结合,抑制T细胞的免疫效应。检查点分子包括PD-1、细胞毒性T淋巴细胞抗原-4(CTLA-4)、T细胞淋巴细胞活化基因-3(lymphocyte activation gene-3,LAG-3)等。ICIs特异性与PD-1、 CTLA4、PD-L1和其他免疫检查点分子结合,可以有效地阻止肿瘤生长和促进肿瘤消退,在一些成人晚期癌症中显示出显著的疗效(54],并可在患有与种系错配修复缺陷相关的实体肿瘤的儿童中诱导肿瘤消退[55]。
2.1.1伊匹单抗(ipilimumab)
伊匹单抗是一种抗CTLA-4抗体。CTLA-4是免疫球蛋白超家族的成员,主要在活化淋巴细胞中表达,与抗原呈递细胞(antigen-presenting cells,APC)上存在的 B7-1诱导T细胞耐受,是T细胞激活和效应器功能的负调节器,导致免疫应答的下调。一项I期研究对33例小于21岁的晚期实体瘤患儿给予高达10mg/kg的伊匹单抗,免疫相关不良事件包括胰腺炎、肺炎、结肠炎、内分泌疾病和转氨酶升高。有6名受试者在4~10个周期内病情稳定(黑素瘤、骨肉瘤、透明细胞肉瘤和滑膜肉瘤)[56]。另一项研究针对年龄在12~18岁、无法切除的III期或IV期恶性黑色素瘤患者,每3周给予伊匹单抗3mg/kg或10mg/kg,结果显示伊匹单抗在这个年龄段黑色素瘤患者中表现出抗肿瘤活性,其安全性与成人相似[5]。
2.1.2帕博利珠单抗(pembrolizumab)
FDA于2020年6月16日批准了PD-1抗体帕博利珠单抗用于成人和儿童肿瘤突变负荷(tumor mutationalburden,TMB)高的、不能切除或转移性实体肿瘤患者。TMB被定义为一个肿瘤体细胞编码区突变的总数。高突变状态指每兆碱基至少10个突变(≥10mut/Mb)。TMB反映了特定肿瘤内整体体细胞基因组突变负荷。多项研究结果表明,较高的突变负荷似乎会增加新抗原形成和免疫系统识别的可能性。不同肿瘤类型的TMB不同,同一肿瘤类型不同个体之间也存在差异。
一项I/II期临床试验,纳入30家医院的8~15岁的PD-L1阳性、复发或难治性实体瘤或淋巴瘤155例。每周接受一次初始剂量为2mg/kg的帕博利珠单抗,静脉注射。56%患者发生了各类级别的治疗相关不良事件,最常见的是贫血(8%)、疲劳(8%)、淋巴细胞计数减少(7%)、发热(7%)、血清天冬氨酸转氨酶升高(6%)、腹泻、甲状腺功能减退、恶心和黄斑丘疹(各5%)。8%患者发生了3~5级治疗相关不良事件,最常见的是淋巴细胞计数下降(2%)和贫血(1%)。其中有复发或难治性霍奇金淋巴瘤患者15例,9名患者获得了客观缓解,与霍奇金淋巴瘤的其他临床试验一样[60],显示出较好疗效。在其余136例其他类型淋巴瘤和实体瘤患儿中,8例有部分反应(肾上腺皮质癌和间皮瘤各2例,恶性神经节胶质瘤、上皮样肉瘤、淋巴上皮癌和恶性横纹肌瘤各1例),客观反应患儿比率为5.9%[61]。
2.1.3纳武单抗(nivolumab)
一种人源化IgG4单克隆PD-1阻断抗体,每2周给药一次(240mg或3mg/kg)或每4周一次(480mg或6mg/kg),由FDA批准用于成人和儿童(年龄>12岁)的微卫星不稳定性高或错配修复缺陷的转移性结肠癌。
一项多中心、开放标签、单臂的I/II期试验,纳入85例、1~30岁复发难治非中枢神经系统肿瘤:横纹肌肉瘤、尤因肉瘤、骨肉瘤、NB、霍奇金淋巴瘤、非霍奇金恶性淋巴瘤和黑色素瘤。纳武单抗,3mg/kg,60min内静脉滴注,第1天和第15天,28d为1个周期。I期试验无剂量限制毒性,3mg/kg为儿科RP2D。II期试验中,47%出现贫血,非血液毒性为疲劳(37%)。无3级或4级不良事件。在淋巴瘤患者中观察到反应:30%霍奇金淋巴瘤和10%非霍奇金恶性淋巴瘤,所有反应者均有PD-L1表达。在其他肿瘤类型中未观察到客观反应[62]。
纳武单抗单药治疗10例中位年龄为15.1岁的晚期恶性实体瘤患者,包括恶性皮肤黑色素瘤(n=5)、脑肿瘤(n=2)、脑恶性黑色素瘤(n=1)、霍奇金淋巴瘤(n=1)和软组织肉瘤(n=1)。4例患者病情完全缓解:3例皮肤恶性黑色素瘤和1例结节型经典霍奇金淋巴瘤。整个组诊断后24个月的总生存率为36%。2名接受纳武单抗和伊普利单抗联合治疗的患者没有缓解。在4/10患者中观察到免疫治疗的不良事件,副作用可控[63]。
有纳武单抗联合达妥昔单抗治疗曾使用过达妥昔单抗并多次复发的NB,获得完全缓解[64]。
2.1.4阿维单抗(avelumab)
阿維单抗是抗PD-L1抗体,在成人已显示抗多种肿瘤活性,并且最初批准每2周给药10mg/kg,但随后基于药代动力学将其改为单剂量800mg。21例年龄<18岁的难治/复发实体瘤患者应用阿维单抗的I期临床试验,RP2D:年龄<12岁或体重<40kg的儿童,每2周15mg/kg;年龄≥12岁及体重≥40kg的患者,每2周800mg(65)]。后续的II期临床试验,患儿耐受性良好。未观察到客观反应,4例中枢神经系统肿瘤患者疾病稳定[66]。
2.2抗体依赖细胞毒性的免疫治疗
有较高免疫原性的肿瘤对上述免疫检验点抑制的免疫疗法反应较好。儿童肿瘤虽然也是由于发育过程中相关蛋白的异常表达和调节造成的,但这部分发育过程中表达的蛋白质在发育完成后的正常组织中沉默,自身的T细胞已经无法识别这些所谓的“癌胚抗原”,导致了大部分儿童肿瘤中缺少肿瘤反应性T细胞的浸润,因而对免疫检验点抑制剂响应率较低。所以,对儿童肿瘤的免疫治疗更专注于利用外来抗体与肿瘤特有抗原结合激发免疫反应的研究,靶向NB细胞的特异性单抗应运而生。这其中,以双唾液酸神经节苷脂(GD2)单克隆抗体为代表。
NB是儿童期最常见的颅外恶性实体肿瘤,60%的患儿归为高危神经母细胞瘤。高危神经母细胞瘤在传统治疗中的5年生存率低于40%,大多数患儿从骨、骨髓等残存微小病灶的转移灶部位复发。GD2特异性表达于NB细胞,抗GD2单克隆抗体(MoAb)的免疫治疗是目前治疗微小残留疾病的主要策略,其作用机制包括直接诱导细胞凋亡、NK细胞和中性粒细胞参与的抗体依赖性细胞毒性(ADCC)、补体介导的细胞毒性和抗体依赖性的细胞吞噬作用。现有两种抗GD2抗体研究最为广泛:ch14.18和3F8。ch14.18衍生嵌合抗体包括达妥昔单抗(dinutuximab)和达妥昔单抗β(dinutuximab-β),分别获得2015年FDA和2017年的欧洲药品管理局(EMA)批准;3F8的人源化形式,naxitamab于2020年接受加速FDA批准治疗复发和/或难治性NB[67]。
COG對226例高风险神经母细胞瘤进行随机临床试验,入组患者已完成诱导治疗、自体干细胞移植和放射治疗,并被随机分配至异维甲酸+达妥昔单抗、IL-2和粒细胞-巨噬细胞集落刺激因子(GM-CSF)的免疫治疗组与单用异维甲酸组。患者每个疗程接受达妥昔单抗的剂量为25mg*m-2·d-1),连续4d。每4周1个疗程,共5个疗程。达妥昔单抗显著改善无病生存率(EFS)和总生存率(OS)(2年EFS 66%vs 46%,P=0.01;2年OS 86%vs 75%,P=0.02)。52%的患者出现3、4或5级疼痛,23%和25%的患者分别出现毛细血管渗漏综合征和过敏反应,该研究结果是儿童HR-NB治疗里程碑性成果[68]。上述COG随机II期临床试验(ANBL0032)继续
随访,中位随访时间9.9年。达妥昔单抗组(n=114)和仅异维甲酸组(n=112),5年EFS分别为56.6%、46.1%(P=0.045);5年OS为73.2%、56.6%(P=0.042)[69]。在欧洲使用中国仓鼠卵巢细胞产生的达妥昔单抗β的II期临床试验证明添加IL-2增加毒性,与不添加相比疗效无显著差异:3年EFS60%对56%;4级非血液毒性28%对9%[70]。2006年,SIOPEN开展了一项随机试验,比较达妥昔单抗β+异维甲酸与单用异维甲酸治疗在维持治疗高危神经母细胞瘤的疗效,EFS分别是42%和57%,OS分别是50%和64%[7]。与COG达妥昔单抗疗效类似。COG达妥昔单抗治疗复发难治性NB临床试验,35名患者中,18名随机分为伊立替康-替莫唑胺-替西罗莫司(temsirolimus)组,17名分为伊立替康-替莫唑胺-达妥昔单抗组,中位随访时间为1.26年,客观反应率为6%对53%[72]。随后的扩大样本的研究也显示出较好的疗效[73]。人源化GD2抗体3F8(naxitamab)治疗IV期NB,同样效果显著[74-75]。抗GD2抗体的免疫疗法使IV期神经母细胞瘤的治疗效果明显提高。
肿瘤的化学治疗在儿科有着优于成人的疗效,但某些肿瘤仍然对化疗不敏感,如炎性肌成纤维细胞瘤、婴儿型纤维肉瘤;某些晚期进展性恶性实体肿瘤仍然是儿科肿瘤治疗的难题,如高危神经母细胞瘤。小分子靶向药物和特异性抗体的免疫治疗使这类患儿大大获益,是进一步突破治疗难点、探索高效治疗方法的研究方向。
参考文献
[1]XieL,Ji T, Guo W. Anti-angiogenesis target therapy for ad- vanced osteosarcoma (Review)[J].Oncol Rep,2017,38:625-636.
[2]Amatu A, Sartore-Bianchi A, BencardinoK,etal.Tropomy- osin receptor kinase (TRK) biology and the role of NTRK gene fusions in cancer[J]. Ann Oncol,2019, 30(Suppl 8): viii5-viii15.
[3]ShabbirA,Kojadinovic A, GidfarS,et al. Targeting TRK: a fast-tracked application of precision oncology and future di- rections[J].Crit Rev Oncol Hematol,2021,165:103451.
[4]ZhaoX,Kotch C, Fox E, et al. NTRK fusions identified in pediatric tumors: the frequency,fusion partners, and clinical outcome[J].JCO Precis Oncol,2021,5:PO.20.00250.
[5]LaetschTW,DuBoisSG,MascarenhasL,etal.Larotrectinib for paediatric solid tumoursharbouring NTRK gene fusions: phase I results from a multicentre,open-label,phase 1/2 study[J].Lancet Oncol,2018,19(5):705-714.
[6]DuBoisSG,LaetschTW,FedermanN,etal.The use of neo-adjuvant larotrectinib in the management of children with lo- cally advanced TRK fusion sarcomas[J].Cancer,2018,124(21):4241-4247.
[7]OuSH,AhnJS,DePetrisL,etal.Alectinib in crizotinib-re- fractory ALK-rearranged non-small-cell lung cancer: a phase II global study[J].J Clin Oncol,2016,34(7):661-668.
[8]ShawAT,RielyGJ,BangYJ,et al. Crizotinib in ROSI-rear- ranged advanced non-small-cell lung cancer (NSCLC): up- dated results,including overall survival,from PROFILE 1001[J].Ann Oncol,2019,30(7):1121-1126.
[9]OkamuraR,Boichard A, Kato S,et al. Analysis of NTRK al- terations in pan-cancer adult and pediatric malignancies: im- plications for NTRK-targeted therapeutics[J].JCO Precis On- col,2018,2018:PO.18.00183.
[10] Albert CM,DavisJL,FedermanN,etal.TRK fusion can- cers in children: a clinical review and recommendations for screening[J].J Clin Oncol,2019,37(6):513-524.
[11]Desai AV,Robinson GW, Gauvain K, et al. Entrectinib in children and young adults with solid or primary CNS tumors harboring NTRK, ROSI or ALK aberrations (STARTRK- NG)[J].Neuro Oncol,2022,24(10):1776-1789.
[12] Mercier F,Djebli N, González-Sales M, et al. Efficacy and safety exposure-response analyses of entrectinib in patients with advanced or metastatic solid tumors[J].Cancer Che- mother Pharmacol,2022,89(3):363-372.
[13]Pratilas CA, Xing F, Solit DB. Targeting oncogenic BRAF in human cancer[J].Curr Top Microbiol Immunol,2012,355:83-98.
[14]Dombi E,Baldwin A, Marcus LJ, et al. Activity of selu- metinib in neurofibromatosis type 1-related plexiform neuro- fibromas[J].NEngl J Med,2016,375(26):2550-2560.
[15] Gross AM,WoltersPL,Dombi E, et al. Selumetinib in chil- dren with inoperable plexiform neurofibromas[J].N Engl J Med,2020,382(15):1430-1442.
[16] Gross AM,GlassbergB,WoltersPL,etal.Selumetinib in children with neurofibromatosis type 1 and asymptomatic in- operable plexiform neurofibroma at risk for developing tu- mor-related morbidity[J]/OL].Neuro Oncol,2022:noac109. https://doi.org/10.1093/neuonc/noac109.
[17] Eckstein OS,Allen CE, Williams PM,et al. Phase II study of selumetinib in children and young adults with tumors har- boring activating mitogen-activated protein kinase pathway genetic alterations: arm E of the NCI-COG Pediatric MATCH trial[J].J Clin Oncol,2022,40(20):2235-2245.
[18]Selt F, van Tilburg CM, Bison B,etal.Response to tra-metinib treatment in progressive pediatric low-grade glioma patients[J].J Neurooncol,2020,149(3):499-510.
[19] Ronsley R,HounjetCD,ChengS,et al. Trametinib therapy for children with neurofibromatosis type 1 and life-threaten- ing plexiform neurofibroma or treatment-refractory low- grade glioma[J].Cancer MAed,2021,10(11):3556-3564.
[20]DaniottiM,FerrariA,Frigerio S, et al.Cutaneous melanoma in childhood and adolescence shows frequent lossof INK4A and gain of KIT[J].J Invest Dermatol,2009,129(7):1759-1768.
[21]BrownNA,FurtadoLV,BetzBL,etal.High prevalence of somatic MAP2K1 mutations in BRAF V600E-negative Langerhans cell histiocytosis[J].Blood,2014,124(10):1655-1658.
[22] Dougherty MJ,Santi M, Brose MS, et al. Activating muta- tions in BRAF characterize a spectrum of pediatric low- grade gliomas[J].Neuro Oncol,2010,12(7):621-630.
[23] Penman CL,Faulkner C, Lowis SP, et al. Current under-standing of BRAF alterations in diagnosis,prognosis,and therapeutic targeting in pediatric low-grade gliomas[J]. Front Oncol,2015,5(54):1-10.
[24]HargraveDR,BouffetE,TaboriU,etal.A phase 1 and phar- macokinetic study of oral dabrafenib in children and adoles- cent patients with recurrent orrefractory BRAF V600 muta- tion-positive solid tumors[J].Clin Cancer Res,2019,25(24):7303-7311.
[25] Hargrave DR,BouffetE,TaboriU,et al. Efficacy and safety of dabrafenib in pediatric patients with BRAF V600 muta- tion-positive relapsed or refractory low-grade glioma:re- suilts from a phase I/Il a study[J].Clin Cancer Res,2019, 25(24):7303-7311.
[26] Philippe L,Maria K,Tariq A,et al. Efficacy of Dabrafenib for three children with brainstem BRAF V600E positive gan- glioglioma[J].J Neurooncol,2019,145(1):135-141.
[27] Christensen JG,ZouHY,Arango ME, et al.Cytoreductive antitumor activity of PF-2341066, a novel inhibitor of ana- plastic lymphoma kinase and c-Met, in experimental models of anaplastic large-cell lymphoma[J].Mol Cancer Ther, 2007,6(12 Pt 1):3314-3322.
[28]Kruczynski A, Delsol G, Laurent C, et al. Anaplastic lym- phoma kinase as a therapeutic target[J].ExpertOpinTher Targets,2012,16:1127-1138.
[29]HallbergB,Palmer RH. Mechanistic insight into ALK recep- tor tyrosine kinase in human cancer biology[J].Nat Rev Cancer,2013,13:685-700.
[30]Mossé YP, Lim MS, Voss SD, et al. Safety and activity ofcrizotinib for paediatric patients with refractory solid tu- mours or anaplastic large-cell lymphoma:a Children's Oncol-ogy Group phase I consortium study[J]. Lancet Oncol, 2013,14(6):472-480.
[31]Mossé YP, Voss SD, Lim MS, et al. Targeting ALK withcrizotinibin pediatric anaplastic large cell lymphoma and in- flammatorymyofibroblastic tumor: a Children's Oncology Group study[J].J Clin Oncol,2017,35(28):3215-3221.
[32]Foster JH, Voss SD, Hall DC, et al. Activity of crizotinib in patients with 1 ALK-aberrant relapsed/refractory neuroblas- toma: a Children's Oncology Group Study (ADVL0912)[J]. Clin Cancer Res,2021,27(13):3543-3548.
[33]WullschlegerS,LoewithR,Hall MN.TOR signaling in growth and metabolism[J].Cell,2006,124(3):471-484.
[34]SarbassovDD,Ali SM, Sengupta S, et al. Prolonged rapamy-cin treatment inhibits mTORC2 assembly and Akt/PKB[J]. Mol Cell, 2006,22(2):159-168.
[35]FouladiM,LaninghamF,WuJ,etal.Phase I study of evero- limus in pediatric patients with refractory solid tumors[J]. Clin Oncol,2007,25(30):4806-4812.
[36] Santana VM,SahrN,Tatevossian RG, et al.A phase 1 trialofeverolimus and bevacizumab in children with recurrent solid tumors[J].Cancer,2020,126(8):1749-1757.
[37] Hu W,WangJ,YuanL,et al. A unique case of pediatric cen- tral nervous system embryonal tumor harboring the CIC- LEUTX fusion,germline NBN variant and somatic TSC2 mu- tation:expanding the spectrum of CIC-rearranged neoplasia [J].Front Oncol,2020,10:598970.
[38] Lodi M, Boccuto L, Carai A, et al. Low-grade gliomas in pa-tients with Noonan syndrome:case-based review of the liter- ature[J].Diagnostics (Basel),2020,10(8):582.
[39] Chuk M, Widemann B, Minard C,et al. A phase 1 study ofcabozantinib in children and adolescents with recurrent or refractory solid tumors, including CNS tumors:trial AD- VL1211,a report from the Children's Oncology Group[J]. Pediatr Blood Cancer,2018,65(8):e27077.
[40]ItalianoA,MirO,Mathoulin-PelissierS,etal.Cabozantinib in patients with advanced Ewing sarcoma or osteosarcoma (CABONE):a multicentre,single-arm,phase 2 trial[J].Lan- cet Oncol,2020,21(3):446-455.
[41]FisherMJ,Shih CS, Rhodes SD, et al.Cabozantinib for neu- rofibromatosis type 1-related plexiform neurofibromas:a phase 2 trial[J]. Nat Med,2021,27(1):165-173.
[42]Wedekind MF, Ranalli M, Shah N. Clinical efficacy of cabo- zantinib in two pediatric patients with recurrent renal cellcarcinoma[J].Pediatr Blood Cancer,2017,64(11):e26586.
[43]PerisaMP,StoreyM,StrebyKA,etal.Cabozantinib for re-lapsed neuroblastoma:single institution case series[J].Pedi- atr Blood Cancer,2020, 67(7):e28317.
[44]LeeYA,LeeH,ImSW,et al. NTRK and RET fusion-direct-ed therapy in pediatric thyroid cancer yields a tumor re- sponse and radioiodine uptake[J].J Clin Invest,2021,131(18):e144847.
[45] Li AY, MeCusker MG, Russo A,et al. RET fusions in solid tumors[J].Cancer Treat Rev,2019,81:101911.
[46] Shankar A, KurzawinskiT,Ross E, et al. Treatment outcome with a selective RET tyrosine kinase inhibitor selpercatinib in children with multiple endocrine neoplasia type 2 and ad- vanced medullary thyroid carcinoma[J].Eur J Cancer,2021, 158:38-46.
[47] Ortiz MV, Gerdemann U, Raju SG, et al. Activity of thehighly specific RET inhibitor selpercatinib (LOXO-292) in pediatric patients with tumors harboring RET gene altera- tions[J].JCO Precis Oncol,2020,4:PO.19.00401.
[48]CometI,RiisingEM,LeblancB,etal.Maintaining cell iden- tity:PRC2-mediated regulation of transcription and cancer [J].Nat Rev Cancer,2016,16(12):803-810.
[49]KadochC,CopelandRA,Keilhack H.PRC2 and SWI/SNFchromatin remodeling complexes in health and disease[J]. Biochemistry,2016,55(11):1600-1614.
[50] Duan R, Du W, Guo W.EZH2: a novel target for cancertreatment[J].J Hematol Oncol,2020,13(1):104.
[51]KurmashevaRT,Sammons M, Favours E, et al. Initial test- ing(stage 1) of tazemetostat (EPZ-6438), a novel EZH2 in- hibitor,by the Pediatric Preclinical Testing Program[J].Pedi- atr Blood Cancer,2017,64(3):10.1002/pbc.26218.
[52]GounderM,Sch?ffskiP,JonesRL,etal.Tazemetostat in ad- vanced epithelioid sarcoma with loss of INII/SMARCBI: an international,open-label,phase 2 basket study[J].Lancet Oncol,2020,21(11):1423-1432.
[53] Chen DS, Mellman I. Oncology meets immunology:the can- cer-immunity cycle[J]. Immunity,2013,39(1):1-10.
[54]Ribas A, Wolchok JD. Cancer immunotherapy using check- point blockade[J].Science, 2018,359:1350-1355.
[55]LaroucheV,AtkinsonJ,AlbrechtS,et al. Sustained com- plete response of recurrent glioblastoma to combined check- point inhibition in a young patient with constitutional mis- match repair deficiency[J].Pediatr Blood Cancer,2018,65: e27389.
[56]MerchantMS,Wright M, Baird K, et al.Phase I clinical tri- al of ipilimumab in pediatric patients with advanced solid tu- mors[J].Clin Cancer Res,2016,22(6):1364-1370.
[57]GeoergerB,Bergeron C, Gore L,et al. Phase II study of ipi- limumab in adolescents with unresectable stage Ill or IV ma- lignant melanoma[J].Eur J Cancer,2017,86:358-363.
[58] Fancello L, Gandini S, Pelicci PG,et al. Tumor mutationalburden quantification from targeted gene panels: major ad- vancements and challenges[J].J Immunother Cancer,2019, 7(1):183.
[59]StenzingerA,AllenJD,MaasJ,et al. Tumor mutational bur- den standardization initiatives:recommendations for consis- tent tumor mutational burden assessment in clinical samnples to guide immunotherapy treatment decisions[J].Genes Chro- mosomes Cancer,2019,58(8):578-588.
[60] Al HadidiSA,LeeHJ.Pembrolizumab for the treatment of Hodgkin lymphoma[J].Expert Opin Biol Ther, 2020,20(11):1275-1282.
[61]GeoergerB,KangHJ,Yalon-Oren M,et al. Pembrolizumab in paediatric patients with advanced melanoma or a PD-L1- positive,advanced,relapsed, or refractory solid tumour or lymphoma (KEYNOTE-051):interim analysis of an open-la- bel,single-arm,phase 1-2 trial[J].Lancet Oncol,2020,21(1):121-133.
[62]Davis KL, Fox E, Merchant MS, et al. Nivolumab in chil- dren and young adults with relapsed or refractory solid tu- mours or lymphoma (ADVL1412): a multicentre,open-la- bel,single-arm,phase 1-2 trial[J].Lancet Oncol,2020,21(4):541-550.
[63]MarjaNska A, Drogosiewicz M, Dembowska-Bagi?ska B. Nivolumab for the treatment of advanced pediatric malig- nancies[J].Anticancer Res,2020,40(12):7095-7100.
[64] Ehlert K, Hansjuergens I, Zinke A, et al.Nivolumab and dinutuximab beta in two patients with refractory roblastoma[J].J Immunother Cancer,2020,8(1):e000540.
[65]VugmeysterY,Grisic AM, Brockhaus B,etal.Avelumab dose selection for clinical studies in pediatric patients with solid tumors[J].Clin Pharmacokinet,2022,61(7):985-995.
[66] Loeb DM,LeeJW,Morgenstern DA, et al. Avelumab in pae- diatric patients with refractory or relapsed solid tumours: dose-escalation results from an open-label,single-arm, phase 1/2 trial[J].Cancer Immunol Immunother,2022,71(10):2485-2495.
[67] Park JA,Cheung NV. Targets and antibody formats for im-munotherapy of neuroblastoma[J].J Clin Oncol,2020,38(16):1836-1848.
[68]Yu AL,Gilman AL,Ozkaynak MF, et al. Anti-GD2 antibody with GM-CSF, interleukin-2,and isotretinoin for neuroblas- toma[J].N Engl J Med,2010,363(14):1324-1334.
[69] Yu AL, Gilman AL,OzkaynakMF,etal.Long-term follow-up of a phase IlI study of ch14.18(dinutuximab)+cytokine immunotherapy in children with high-risk neuroblastoma: COG study ANBL0032[J].Clin Cancer Res,2021,27(8):2179-2189.
[70]LadensteinR,P?tschgerU,Valteau-CouanetD,etal.Inter- leukin 2 with anti-GD2 antibody ch14.18/CHO (dinutux- imab beta) in patients with high-risk neuroblastoma (HR- NBL1/SIOPEN): a multicentre,randomised, phase 3 trial[J]. Lancet Oncol,2018,19(12):1617-1629.
[71]LadensteinR,P?tschgerU,Valteau-CouanetD,etal.Investi- gation of the role of dinutuximab beta-based immunothera- py in the SIOPEN high-risk neuroblastoma 1 trial (HR- NBL1)[J].Cancers(Basel),2020,12(2):309.
[72]Mody R, Naranjo A, Van Ryn C, et al. Irinotecan-temozolo- mide with temsirolimus or dinutuximab in children with re- fractory or relapsed neuroblastoma (COG ANBL1221):an open-label, randomised, phase 2 trial[J]. Lancet Oncol, 2017,18(7):946-957.
[73] Mody R,Yu AL,Naranjo A, et al. Irinotecan,temozolomide,anddinutuiximab with GM-CSF in children with refractory or relapsed neuroblastoma: a report from the Children's On- cology Group[J].Clin Oncol,2020,38(19):2160-2169.
[74] Cheung NK,CheungIY,KushnerBH,etal.Murine anti- GD2 monoclonal antibody 3F8 combined with granulocyte- macrophage colony-stimulating factor and 13-cis-retinoic ac- id in high-risk patients with stage 4 neuroblastoma in first re- mission[J].J Clin Oncol,2012,30(26):3264-3270.
[75] Cheung IY,KushnerBH,Modak S, et al. Phase I trial of anti-GD2 monoclonal antibody hu3F8 plus GM-CSF: im- pact of body weight,immunogenicity and anti-GD2 re- sponse on pharmacokinetics and survival[J]. Oncoimmunol- ogy,2017,6(11):e1358331.
(收稿日期:2022-09-19)

