生长调节剂GN-01对蛹虫草寄生性病原真菌的诱导抗病效果
崔芙蓉 王升厚 李梦雪 柳叶飞 徐方旭


摘 要 以不同地区表现白毛病特征的蛹虫草为材料,分离获得2种病原真菌,对其进行形态学鉴定和分子生物学鉴定,其中BYJ1鉴定为日耳曼曲霉(Aspergillus germanicus),BYJ2为焦曲霉(Aspergillus ustus)。通过侵染实验探讨不同添加方法下,植物生长调节剂GN-01对蛹虫草寄生性病原真菌的抗性诱导作用。结果表明,在培养基中加入或在蛹虫草生长过程中加入稀释3 000倍的GN-01可显著提高蛹虫草SOD和POD酶活性,降低蛹虫草白毛病发病率,说明GN-01可作为防控蛹虫草寄生性病原真菌的抗性诱导剂。
关键词 蛹虫草;寄生性病原真菌;植物生长调节剂;诱导抗病性
中图分类号:Q93 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2022.17.022
蛹虫草(Cordyceps militaris)是一种药食同源真菌,含有虫草素、虫草酸及虫草多糖等活性成分[1-2]。在蛹虫草栽培过程中,白毛病危害较为严重,极易造成蛹虫草子实体倒伏和矮小畸形。植物生长调节剂是人工合成或天然提取的具有激素生理活性的化合物,目前在农业生产中广泛应用,并取得了显著效果。本实验对蛹虫草栽培过程中感染的病原真菌进行分离纯化及鉴定,通过侵染实验探究植物生长调节剂GN-01对蛹虫草寄生性病原真菌的诱导抗病作用,旨在为白毛病的控制及预防提供理论依据[3]。
1 材料与方法
1.1 实验材料
不同区域发病的蛹虫草、蛹虫草菌株PT07(沈阳师范大学特种菌业研究所提供)、植物生长调节剂(GN-01)、真菌基因组DNA快速抽提试剂盒、马铃薯葡萄糖琼脂(Potato Dextrose Agar,PDA)培养基和马铃薯葡萄糖水(Potato Dextrose Broth,PDB)培养基[4]。
1.2 实验方法
1.2.1 病原真菌分离纯化
刮取发病蛹虫草上的病原真菌菌丝,采用划线法将其接种于PDA培养基上,25 ℃恒温培养3~7 d;待有菌落形成时,挑取单个菌落,用点接法将其接种至PDA培养基上继续培养。重复上述操作,直到纯化出单一菌落,于4 ℃冰箱中保存备用[5]。
1.2.2 病原真菌形态鉴定
将纯化后的病原真菌接种于PDA培养基上,25 ℃条件下培养至生长出完整的菌落,观察菌落形态特征。利用光学显微镜观察菌丝和孢子的形态特征,参照《真菌鉴定手册》进行形态学鉴定。
1.2.3 病原真菌分子生物学鉴定
将纯化后的病原真菌接种于PDA斜面上,样品送至上海派诺森生物科技有限公司進行真菌基因组DNA提取、真菌基因组PCR扩增、PCR产物的回收及DNA序列的对比分析。将所得序列文件与NCBI数据库中的数据进行比对,构建系统发育树。
1.2.4 病原真菌侵染蛹虫草子实体
GN-01稀释浓度(均为体积浓度)分别为1∶50(2号)、1∶100(3号)、1∶200(4号)、1∶500(5号)、1∶1 000(6号)、1∶3 000(7号)、1∶3 500(8号)和1∶4 000(9号),对照组(1号)为清水。分别在蛹虫草栽培培养基中和生长过程中加入不同稀释浓度的GN-01,并按照蛹虫草常规方法进行培养。
将分离所得病原真菌接种于PDB培养基中摇瓶培养7 d,将菌体打碎,用无菌水稀释100倍备用。选择生长到第35 d的、2种不同培养方式的蛹虫草子实体进行病原菌侵染实验,对照组补等量清水,在20 ℃培养55 d后测定防御酶活性及发病率。
1.3 指标检测
1.3.1 SOD和POD酶活性测定
SOD和POD酶活性测定的药品配制及实验步骤参照文献[6]的方法进行。
1.3.2 发病率测定
按照公式(1)计算不同实验组别蛹虫草总发病率。
发病率=(发病数/总数)×100% (1)
1.4 数据分析
采用SPSS 22.0软件对数据进行统计分析。
2 结果与分析
2.1 病原真菌形态鉴定
分离所得病原真菌分别命名为BYJ1和BYJ2。如图1所示,2种病原真菌在PDA培养基中生长3~7 d 后,菌丝部分为白色,不透明,菌丝致密,边缘规则;菌落颜色正反一致,生长速度较慢;菌丝分枝,有隔;有明显成熟脱落的孢子且孢子较小,孢子直径为3.8~4.5 μm。BYJ1菌株菌丝宽度为2.0~5.0 μm,BYJ2菌株菌丝宽度为5.0~6.3 μm。
2.2 病原真菌的分子鉴定
将病原菌BYJ1和BYJ2所得序列进行拼接后与NCBI数据库中的序列数据进行比对。由图2可知,BYJ1为日耳曼曲霉(Aspergillus germanicus),BYJ2为焦曲霉(Aspergillus ustus)。
2.3 GN-01对蛹虫草抗病能力的影响
2.3.1 GN-01对蛹虫草防御氧化酶活性的影响
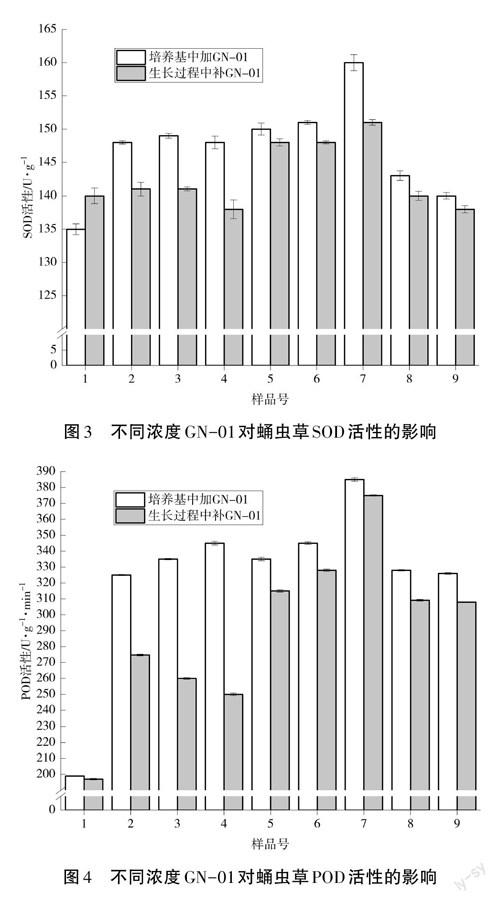
随着在栽培培养基中添加或在生长过程中补加GN-01稀释倍数的增大,蛹虫草子实体的SOD和POD酶活性呈先增强后降低的趋势,在稀释倍数为3 000时(7号样品)防御氧化酶活性最高,说明蛹虫草子实体在受到病原真菌侵害时,适当浓度的GN-01可诱导SOD和POD酶活性明显上升,以抵抗病原真菌侵害(见图3、图4)。
2.3.2 GN-01对蛹虫草发病率的影响
由表1可知,在培养基中添加或在生长过程中补加稀释50~4 000倍的GN-01,蛹虫草白毛病发病率呈逐渐降低趋势。这说明蛹虫草受到病原真菌侵害时,在栽培培养基中添加或在生长过程中补加稀释50~4 000倍的GN-01可显著减轻病原真菌的侵害,提高蛹虫草的抗病性。
2.4 侵染实验
根据前述预实验结果,选择稀释3 000倍的
GN-01进行病原真菌侵染抗性实验。如图5所示,与对照组相比,在栽培培养基中添加和在生长过程中补加稀释3 000倍的GN-01,蛹虫草子实体的发病程度均呈著减轻,与前述的预实验结果相吻合。
3 讨论与结论
植物诱导抗病性被认为是植物保护技术的新途径。蛹虫草自身具有一套完整的防御体系,生物或非生物胁迫都可刺激这种防御反应,因此通常将防御酶活性变化作为衡量植株防御能力的重要指标。SOD可清除自由基,延缓植物衰老;POD可减少活性氧积累,保护膜结构完整。本实验以在蛹虫草培养基添加GN-01和在生长过程中补加GN-012种实验所得的蛹虫草子实体为原材料,对蛹虫草的防御酶活性进行测定,以探究GN-01对蛹虫草的诱导抗病性作用。结果表明,当蛹虫草受到病原真菌侵害时,在栽培培养基中添加或在生长过程中补加稀释50~3 000倍的GN-01时,SOD和POD酶活性呈上升趋势,且在GN-01稀释倍数为3 000时,SOD和POD酶活性达到峰值,能有效减轻病原真菌的侵害,提升蛹虫草的抗病性,侵染实验结果与酶活性实验结果吻合。
将植物生长调节剂作为病原菌抑制剂进行开发有较好的应用前景,在栽培培养基中添加或在生长过程中补加稀释3 000倍的GN-01,都可提高蛹虫草相关防御酶活性,有效防治蛹虫草寄生性病原真菌病害的發生。目前,蛹虫草寄生性病原真菌研究体系还不完整,大部分的致病机制有待深入研究,未来应着重研究病原菌致病机制和筛选蛹虫草优良抗病菌株。
参考文献:
[1] Sung G H, Hywel-Jones N L, Sung J M, et al. Phylogenetic classification of Cordyceps and the clavicipitaceous fungi[J]. Studies in Mycology, 2007, 57(1): 55-59.
[2] 王尊生,王升厚,袁勤生.冬虫夏草(Cordyceps sinensis)菌丝体固体发酵粉中麦角甾醇的定量分析[J].沈阳师范大学学报(自然科学版),2005(3):293-296.
[3] 张卉,郝国良,徐俊斌.生物表面活性剂产生菌的筛选及培养条件优化[J].沈阳师范大学学报(自然科学版),2011,29(2):293-296.
[4] 赵颖,于飞,郭明敏,等.碱蓬内生真菌JP3的分离、鉴定及促生作用研究[J].沈阳师范大学学报(自然科学版),2015,33(1):116-120.
[5] 马莲菊,朱淼,汪雅楠,等.根瘤菌多样性研究技术进展[J].沈阳师范大学学报(自然科学版),2021,39(6):538-543.
[6] 高华晨.不同高粱品种抗氧化指标及内源激素分析[D].沈阳:沈阳师范大学,2019.
(责任编辑:张春雨 丁志祥)
收稿日期:2022-07-12
基金项目:辽宁省科技厅重大科技攻关项目“辽宁虫草产业群生产性种源繁育体系风险防范技术研究”(2019JH2/10200003)。
作者简介:崔芙蓉(1997—),女,辽宁抚顺人,在读硕士,研究方向为微生物资源与利用。

