短尾铁线莲不同部位水浸提液对刺槐幼苗根系生长及生理特性的化感作用
于东立, 郭韶鑫, 冯志培, 范贝贝, 杨喜田
(河南农业大学林学院,河南 郑州 450002)
刺槐(RobiniapseudoacaciaL.)抗逆性强,具有重要的经济和生态价值,是中国华北太行山区主要的造林树种[1-3]。为更利于森林可持续经营,目前该地区常通过对刺槐人工林进行抚育间伐来增加森林蓄积量和改变林分结构[4]。然而,间伐处理使刺槐人工林林冠层结构及林下生境条件发生改变[5-7],林下形成的较好的光照环境,这导致木质藤本植物短尾铁线莲(Clematisbrevicaudata)大量繁殖[8-10],并通过缠绕刺槐向上攀长,造成太行山区大面积的刺槐林生长衰弱甚至死亡[11-14],严重阻碍了刺槐人工林的可持续经营。
植物化感作用是植物通过向周围环境中释放化感物质,从而影响邻近植物萌发和生长的效应[15]。例如,半夏[16]、劲陟黄芪[17]、猪毛蒿[18]、油菜[19]等通过释放代谢物质(黄酮类和香豆素等)到环境中,对周围其他植物的生长和存活产生直接或间接的作用。近年来,化感作用在人工林培育工作中越来越受到重视[20-21]。国内外大量研究也已表明皂苷类、黄酮类和香豆素为主要的化感物质[22-26]。根据上述现象,短尾铁线莲对刺槐的影响,除物理攀援等因素外,是否存在化感作用还未见报道。因此,从化感角度入手,开展短尾铁线莲对刺槐生长和生理影响的研究变得较为重要。
植物化感物质分布在植物的根、茎和叶等组织部位。目前,利用不同组织水浸提液是研究植物间化感作用最常用且直接有效的手段[27-28]。然而,植物不同部位接受化感信号反应不同[29-30],也已有研究表明根系受化感作用的影响较为强烈[31-32]。因此,本研究以刺槐幼苗为研究对象,通过对比分析短尾铁线莲不同部位(根、茎和叶)水浸提液对刺槐幼苗根系生长和生理特性的影响,以期为从化感作用角度研究刺槐与短尾铁线莲的生长关系提供科学依据,对刺槐人工林如何采取合理的经营措施具有重要的参考意义。
1 材料与方法
1.1 试验区概况
试验地点位于河南省郑州市河南农业大学林业生态试验站(34°43′N,112°42′E)遮雨、四周通风且透光的网室,光照为自然光。该地区年平均温度为14.2 ℃,极端最高温度为43 ℃,极端最低温度为-17.9 ℃,全年日常时数约为2 400 h,年平均降水量为640.9 mm,无霜期约为220 d。
试验中所用的短尾铁线莲来自于河南省济源市南山林场(35°01′N,112°28′E),林场位于太行山南段,属于温带大陆性气候,年平均气温为13.4 ℃,年平均降水量为650 mm,全年无霜期为235 d。刺槐种子也来源于此,发芽率约为86%。
1.2 试验方法
1.2.1 浸提液的制备 对太行山南段野生短尾铁线莲进行破坏性采样,整株挖掘。迅速带回实验室,将其分为根、茎和叶3部分,然后放在阴暗通风处一起阴干,将其粉碎,分别过0.25 mm筛,获得短尾铁线莲根、茎和叶干粉。参考高玉莲等[19]的方法制备浸提液,具体步骤为:取3种干粉各100 g,加入1 L蒸馏水充分震荡,浸24 h后过滤,分别得到质量浓度为100 g·L-1的根、茎和叶浸提液。向3种浸提母液加蒸馏水,分别稀释至5、10、20、30和50 g·L-1,蒸馏水(0 g·L-1)作为对照组(CK)。
1.2.2 试验设计 运用盆栽方法,于2018-04-02号将预处理的露白刺槐种子播种在塑料营养钵中(上口径20 cm,下口径13 cm,高25 cm),每盆3粒,长叶后定苗1株。栽培基质为沙子、蛭石和珍珠岩的混合物(V∶V∶V=3∶1∶1)。为避免其他因素的影响,均不喷洒农药和施肥。
育苗3个月后,分别量取300 mL上述5个质量浓度梯度的短尾铁线莲的根、茎和叶水浸提液对长势基本一致(株高:(12.25±0.58) cm;地径:(3.25±0.16) mm)的90株刺槐幼苗进行浇灌。同时,用等量的蒸馏水浇灌对照组的6株刺槐苗。每隔1周施加1次,每次添加的浸提液均重新配置,连续施加13周。整个试验期间,所有处理每隔3 d浇1次水。于2018-10-15对各处理进行破坏取样。另外,施加浸提液和浇水时,为避免浸提液溢出营养钵底部且分布均匀,将营养钵4等分,每等分处放置有1个进水管(高25 cm×内径5 cm),进水管与营养钵基质接触处设有大小均匀的小孔。
1.3 指标测定
采用WILLIAMSON[33]的方法计算化感效应指数(response index,RI),即:
RI=1-C/T(T≥C)或RI=T/C-1(T 式中:C代表对照组CK;T代表处理组;当RI>0为促进作用;RI<0为抑制作用;RI绝对值大小表示化感作用强度的大小。 于2018-10-15对各处理刺槐幼苗采用破坏性取样,整株挖掘,将根系分离。每种浸提液质量浓度下每个组织部位水浸提液浇灌的3刺槐幼苗根系用于测定生物量;另外的3株用于测定生理活性。 (1)根系生物量:放入75 ℃烘箱72 h烘干,称质量(精确至0.000 1 g),得到根系生物量。 (2)生理指标测定:采集的根系迅速用编号的锡箔纸包好,放入液氮速冻,带回实验室放入-80 ℃冰箱保存。可溶性蛋白含量采用考马斯亮蓝G-250显色法[34]测定。超氧化物歧化酶活性(SOD活性)采用氮蓝四唑(NBT)法测定,过氧化物酶(POD)活性采用愈创木酚法测定,过氧化氢酶活性(CAT)采用紫外吸收法检测[35],丙二醛(MDA)含量测定方法参照赵世杰等[36]的方法。 利用Microsoft Excel 2010对数据进行整理和计算,用SPSS 25分别对不同组织部位水浸提液和不同质量浓度间刺槐幼苗根系生物量的化感效应指数(RI)、渗透调节物质(可溶性蛋白和MDA)和抗氧化酶(SOD、POD和CAT)活性数据进行单因素方差分析(One-ANOVA),用Turkey法进行差异性检验(α=0.05)。利用Origin 2018进行图表绘制。图中数据均采用均值±标准误差表示。 与CK(RI=0)相比,短尾铁线莲根、茎和叶3种水浸提液浇灌刺槐幼苗后,刺槐根生物量的生长随质量浓度变化呈倒“V”趋势,即先增长后减小(图1)。3种水浸提液质量浓度在5 、10 和20 g·L-1时对刺槐根系生长均有促进作用,其中叶水浸提液在5 g·L-1时对刺槐幼苗根系的促进作用强于另外2种水浸提液;在20 g·L-1时,茎水浸提液的促进作用却强于另外2种;在30 g·L-1时,根和茎水浸提液对刺槐幼苗的根系起促进作用,而叶水浸提液则抑制了刺槐根系的生长;3种水浸提液均在50 g·L-1时均对刺槐幼苗根系的生长起抑制作用,茎浸提液的抑制作用强于另外2种。 注:不同小写字母表示相同浸提液不同质量浓度之间差异性显著(P<0.05);不同大写字母表示相同质量浓度不同浸提液之间差异性显著(P<0.05)。 刺槐幼苗根系的可溶性蛋白含量随短尾铁线莲根、茎和叶水浸提液质量浓度(5、10、20、30和50 g·L-1)的升高而降低(表1),其中叶浸提液对刺槐根系的可溶性蛋白含量的影响最高,与对照(CK)相比,30和50 g·L-1的水浸提液使刺槐根系的可溶性蛋白含量显著降低1.99 和2.90 mg·g-1(P<0.05)。茎浸提液质量浓度在10 g·L-1时,相较于CK显著增加了刺槐幼苗根系的可溶性蛋白含量,增幅为13.96%(P<0.05);但在20 g·L-1时却使其根系可溶性蛋白含量增加了3.94% (P>0.05)。刺槐根系的可溶性蛋白含量随叶水浸提液质量浓度的升高而降低,与CK相比,在5、10和20 g·L-1时无显著差异 (P>0.05);而在30和50 g·L-1时显著减少了35.29%和51.49% (P<0.05)。在20、30和50 g·L-1时,刺槐根系可溶性蛋白的含量受到短尾铁线莲叶浸提液的抑制作用显著大于根浸提液和茎浸提液 (P<0.05)。 与刺槐幼苗根系的可溶性蛋白含量变化规律相反,根系中的MDA含量均随短尾铁线莲3种浸提液浓度的升高而增加(表1)。50 g·L-1时3种浸提液处理下刺槐幼苗根系的MDA含量比CK显著增加38.09、25.25和18.99 nmol·g-1(P<0.05)。其中,根浸提液处理下的MDA含量增加最明显,在浸提液质量浓度为50 g·L-1时,比CK显著增加38.09 nmol·g-1(P<0.05)。10 g·L-1的茎浸提液使刺槐幼苗根系的MDA含量显著增加11.13 nmol·g-1(P<0.05)。30和50 g·L-1的茎和叶浸提液处理的刺槐幼苗的根系MDA含量均比CK显著增加15.56和25.25 nmol·g-1,18.52和18.99 nmol·g-1(P<0.05)。在20和50 g·L-1时,根浸提液对刺槐根系MDA含量的促进作用显著大于茎浸提液和叶浸提液(P<0.05)。 表1 短尾铁线莲不同部位水浸提液对刺槐根系可溶性蛋白和丙二醛(MDA)含量的影响 2.3.1 短尾铁线莲水浸提液对刺槐幼苗根系POD活性的影响 与CK(RI=0)相比,短尾铁线莲根、茎和叶3种水浸提液浇灌刺槐幼苗后,根系POD活性随质量浓度的升高呈现先增大后减少的变化趋势(表2)。其中,根浸提液对刺槐幼苗根系POD活性的影响最大,与对照(CK)相比,20 g·L-1的水浸提液使刺槐根系的POD活性显著增加了51.81%(P<0.05);在50 g·L-1时却使其根系POD活性显著减少了39.86% (P<0.05);且在此质量浓度下根浸提液对刺槐根系POD活性的抑制作用显著强于茎、叶浸提液(P<0.05)。与CK相比,茎浸提液在5、10和20 g·L-1时无显著性增加(P>0.05);50 g·L-1时显著减少了24.67%(P<0.05)。叶浸提液在质量浓度10、20和30 g·L-1时,对刺槐根系POD活性均有显著增加,增幅为25.19%、36.09%和5.66%(P<0.05);在50 g·L-1时,POD活性显著减少30.0% (P<0.05)。 2.3.2 短尾铁线莲水浸提液对刺槐幼苗根系SOD活性的影响 与根系POD活性变化规律相似,刺槐SOD活性随短尾铁线莲根、茎和叶3种水浸提液浓度的升高,整体呈现先增大后减少的变化趋势(表2)。根浸提液在质量浓度10 、20 、30 g·L-1时,使刺槐幼苗根系SOD活性显著增加,增幅为14.41%、52.09%和39.85% (P<0.05);且在20、30 g·L-1时,对刺槐根系SOD活性的促进作用显著大于茎、叶浸提液 (P<0.05)。叶浸提液在5和10 g·L-1时,与CK相比,刺槐幼苗SOD活性不显著下降1.18%和2.02% (P>0.05);在20 g·L-1时SOD活性增至最大,增加18.19% (P<0.05)。在50 g·L-1时,3种浸提液浇灌下刺槐幼苗根系SOD活性均显著小于CK (P<0.05);茎浸提液对刺槐幼苗SOD活性的抑制最大 (P<0.05),且与CK相比减少49.11%。 2.3.3 短尾铁线莲水浸提液对刺槐幼苗根系CAT活性的影响 刺槐幼苗根系CAT活性随浸提液质量浓度的变化如表2所示。根浸提液在5、10和20 g·L-1时,与CK相比,刺槐幼苗根系CAT活性没有显著增大;当质量浓度30和50 g·L-1时,根系CAT活性受到抑制,其中50 g·L-1时受到显著抑制,减少37.67% (P<0.05)。茎浸提液浇灌下刺槐幼苗根系CAT活性出现“减少-增大-减少”的变化规律;在20 g·L-1时,CAT活性不显著增大,与CK相比增大21.62%;在较高质量浓度(30和50 g·L-1)时CAT活性受到抑制,50 g·L-1时,根系CAT活性显著减少63.05%(P<0.05)。叶浸提液浇灌下CAT活性变化与茎浸提液浇灌下相似,在20 g·L-1时,CAT活性显著增大40.00%;在30和50 g·L-1时CAT活性显著受到抑制,减少34.70%和50.70% (P<0.05)。 表2 短尾铁线莲不同部位水浸提液对刺槐幼苗根系抗氧化酶活性的影响 植物之间的相互作用是化感作用的一种常见现象,绝大多数情况下是抑制作用[15]。但师小平等[37]也指出,化感作用的产生是化感物质积累到一定的浓度后形成的,在低于这个浓度时,植物的生长不会受到影响,甚至还会对植物的生长起到促进作用。 本研究中,不同部位短尾铁线莲水浸提液在低质量浓度时对刺槐幼苗根系的生长起促进作用,而较高质量浓度时却抑制其生长。同时,茎浸提液对刺槐幼苗根系生长的化感作用大于另外2种浸提液。这与前人的相关研究较为相似[27,38]。茎浸提液对刺槐幼苗根系的影响相对较大,这可能与木质藤本植物的生物特性有关。茎的生物量越大,释放的化感物质也会更多,对支撑木的影响也会更大,通过雨水淋溶等进入植物根系从而影响刺槐根系的生长,与李凤兰等[27]研究结果一致。 植物体内可溶性蛋白含量是反映植物整体代谢的重要指标之一,在细胞免疫方面也发挥了重要作用。当植物受到胁迫时,体内的可溶性蛋白会受到抑制[39]。浸提液质量浓度较高时,不同浸提液处理下的刺槐幼苗根系可溶性蛋白含量均有显著减少,与程巍等[40]研究一致。随着浸提液质量浓度的增大,刺槐幼苗受到的化感胁迫也增大,导致刺槐幼苗蛋白质与酶的合成受到抑制或者是化感物质进到刺槐幼苗细胞内,导致蛋白质结构变性,从而表现为含量降低[41]。丙二醛(MDA)是膜脂过氧化的主要产物,是膜系统受害的重要标志之一[42]。当浸提液质量浓度较高时,刺槐幼苗根系的MDA含量与CK相比显著增大,且根浸提液处理下MDA含量大于另外2种。与李洁等[43]研究结果相似。植物遭受胁迫后,体内活性氧(ROS)的产生和消除失去平衡,ROS产生的含量显著升高,造成氧化胁迫[41]。浸提液较高质量浓度时,刺槐幼苗的抗氧化能力不足以抵抗化感胁迫,致使膜质过氧化作用增强,MDA含量升高。 植物体内ROS含量较高时,体内抗氧化酶(SOD、POD和CAT)相互作用,避免膜脂过氧化对细胞造成伤害[44]。本研究发现,浸提液质量浓度较低时,3种浸提液处理下刺槐幼苗根系抗氧化酶SOD、POD和CAT活性均有不同程度的增大。表明刺槐幼苗受到短尾铁线莲化感胁迫后,其自身的抗氧化酶积极响应,自身活性增强以此来抵抗细胞内活性氧造成的伤害。浸提液质量浓度为50 g·L-1时,3种抗氧化酶活性显著小于CK,说明这种通过提高抗氧化酶活性来抵抗化感胁迫的应激反应只在一定受害程度内有效[45-46],不能有效清除刺槐幼苗根系积累的ROS,致使ROS在体内逐渐积累,对植株造成不可逆的伤害。SOD、POD和CAT活性在浸提液较低质量浓度下,变化规律略有不同,这可能是短尾铁线莲水浸提液中的化感物质对刺槐幼苗不同抗氧化酶活性的影响程度不同[19,42]。 综上所述,短尾铁线莲对刺槐幼苗存在一定的化感作用,且短尾铁线莲茎浸提液对刺槐幼苗根系生长以及抗氧化酶整体影响较大,可能与短尾铁线莲这种藤本植物特性有关[11-13],一方面生物量更大的茎中含有的某种化感物质更多,在体内运输到地下根系部分来影响刺槐根系的正常生长发育,另一方面释放到环境中的化感物质能够通过雨雾淋溶的方式进入到土壤环境中,进而影响刺槐根系的正常生长发育[36]。1.4 数据统计与分析
2 结果与分析
2.1 短尾铁线莲水浸提液对刺槐幼苗根系生物量的影响
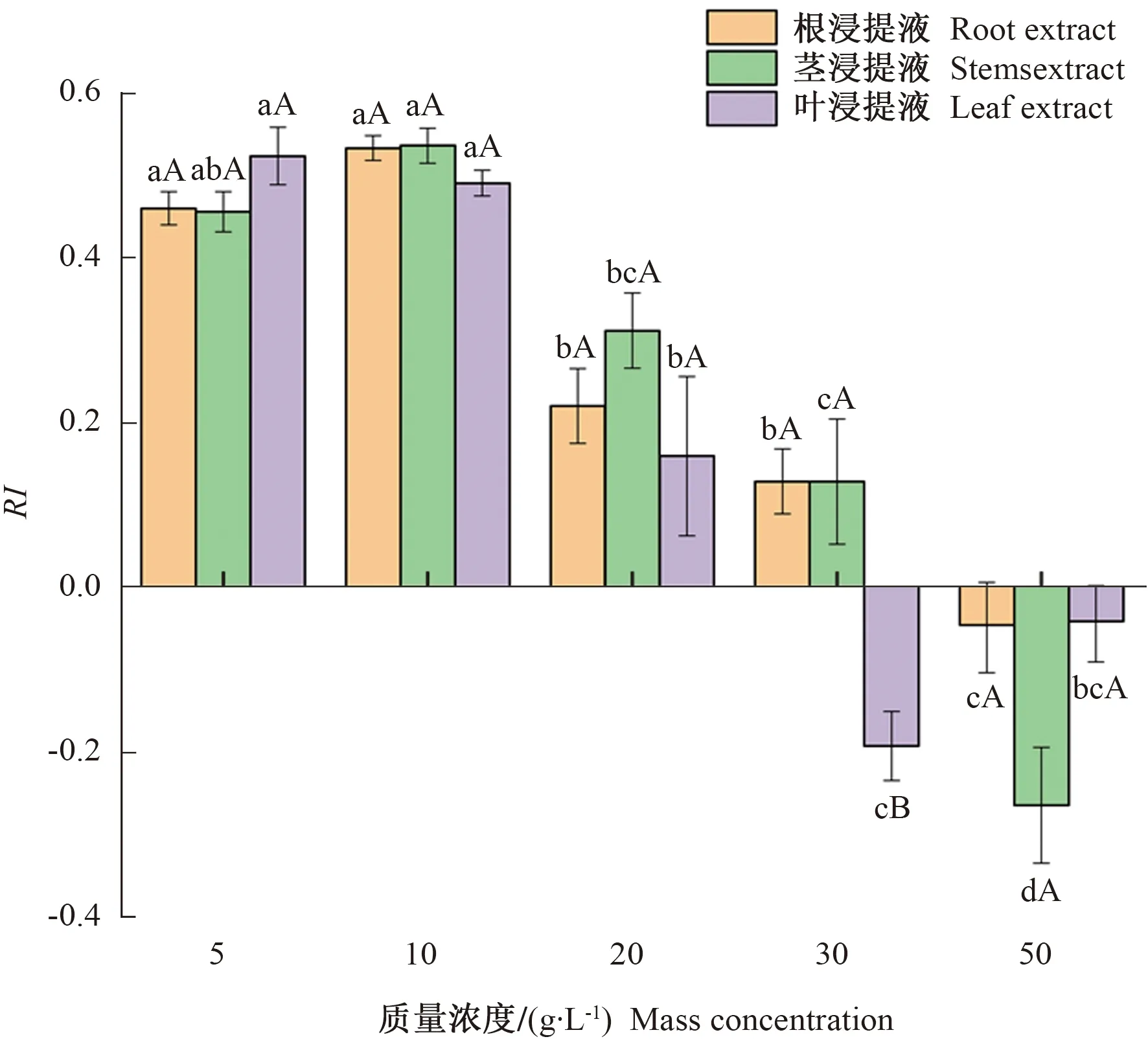
2.2 短尾铁线莲水浸提液对刺槐幼苗根系可溶性蛋白和丙二醛(MDA)含量的影响
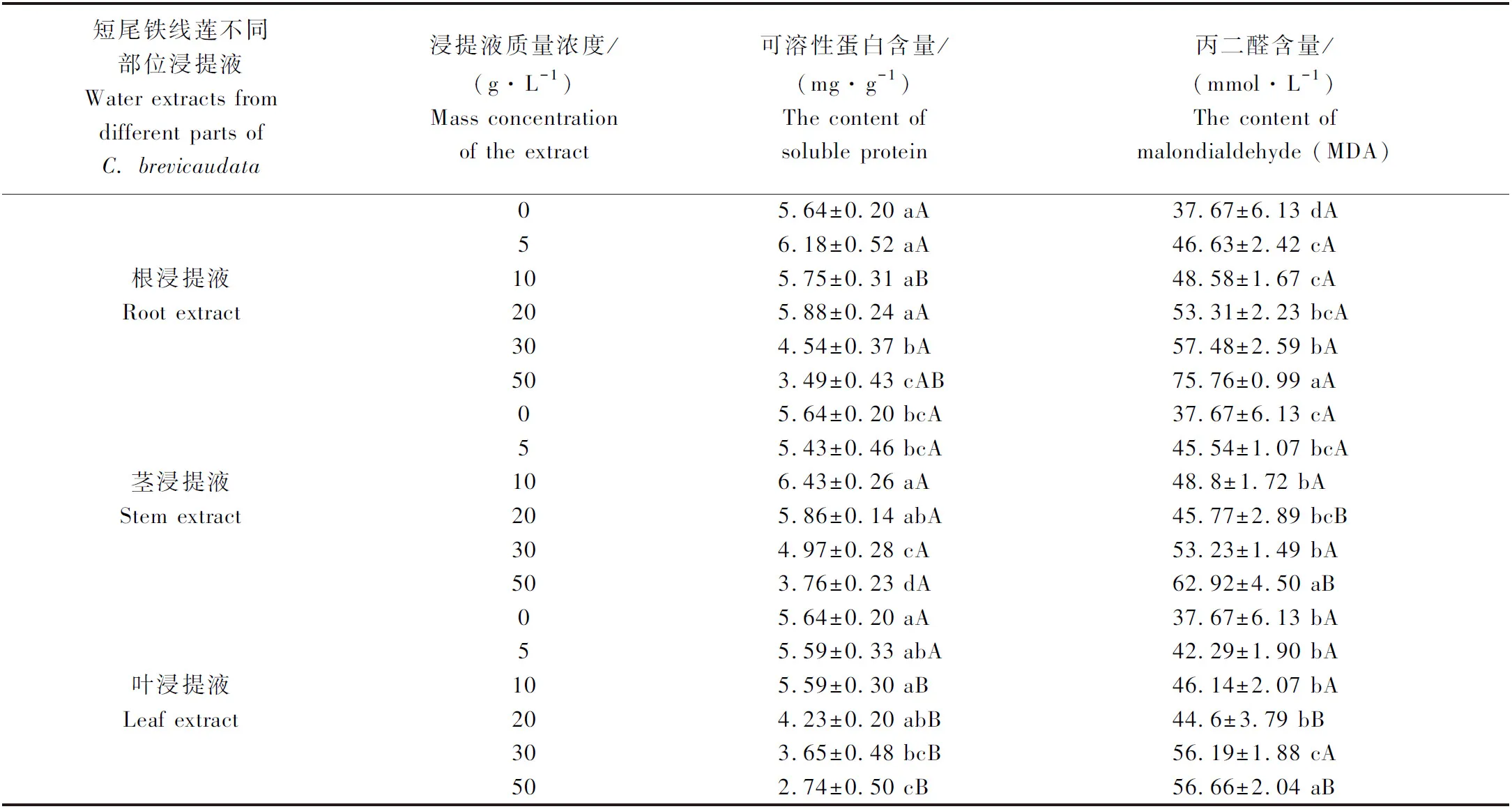
2.3 短尾铁线莲水浸提液对刺槐幼苗根系抗氧化酶活性的影响
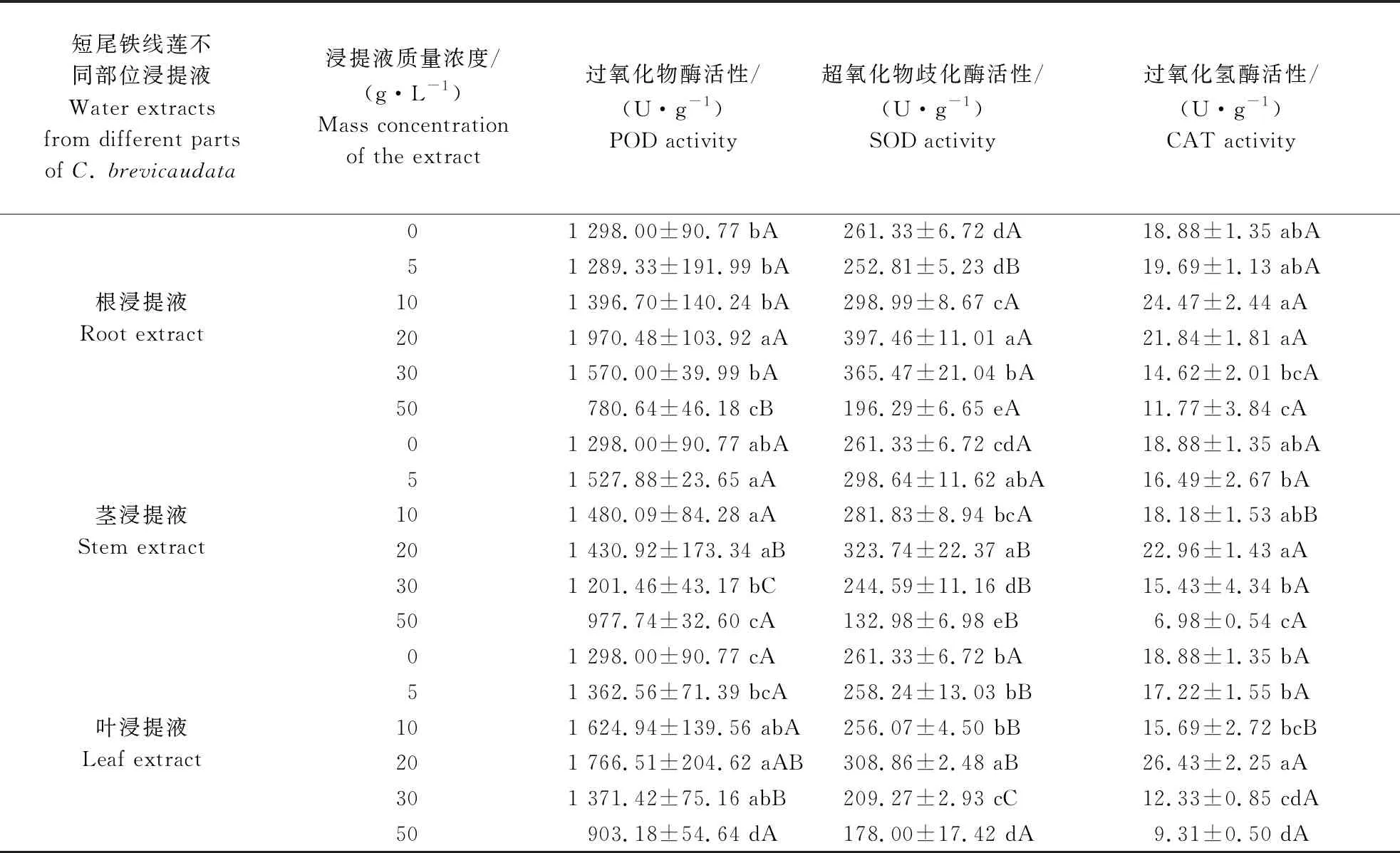
3 结论与讨论

