Aβ抗真菌活性与聚集形态和细胞壁多糖的关系探究
文 榕,周君琳,王 倬,张 琛,王一丁
(1.四川师范大学 生命科学学院,成都 610101;2.中国科学院过程工程研究所生化工程国家重点实验室,北京 100190)
阿尔茨海默症(alzheimer’s disease,AD)是发生于老年或老年前期,以记忆认知功能障碍为特征的中枢神经系统退行性疾病。据世界卫生组织最新统计,目前全世界AD 的发病人数高达2500万,平均每7s就会增加1个AD患者。我国有AD患者600多万,绝对数量居世界首位。迄今为止AD的发病机制仍未完全阐明,当前的主流学说认为,β 淀粉样蛋白(β−amyloid,Aβ)的错误折叠和聚集是AD 主要的致病机制。Aβ 是通过β−分泌酶(β−secretase)和γ−分泌酶(γ−secretase)连续裂解淀粉样前体蛋白(APP)产生的含有39~43 个氨基酸残基的多肽,其在脑内的聚集沉积可作用于神经元产生毒性,并进一步激活脑内小胶质细胞等产生慢性炎症反应,最终导致认知功能紊乱。γ−分泌酶裂解位点不同会产生不同长度的Aβ肽链,其中两个最常见的残基亚型是拥有40个氨基酸的Aβ40和拥有42个氨基酸的Aβ42,虽然Aβ40占神经元分泌Aβ的90%~95%,但Aβ42更容易发生淀粉样变性。
Aβ曾被认为是APP分解代谢产生的无任何正常生理功能的“代谢垃圾”,但近年来研究发现,Aβ与先天免疫系统中的抗感染关键因子“抗菌肽”(antimicrobial peptides,AMPs)十分相似。前期研究发现,Aβ可以抑制8种临床常见病原菌的生长,AD 患者脑组织样品较正常组织样品的抗菌活性显著升高,而在该组织样品中加入Aβ 抗体后,其抗菌活性被显著抑制。其他研究也发现,脑内Aβ 水平的降低则会增加人们受感染的风险。前期动物研究发现,病原真菌白色念珠菌可以穿过血脑屏障并引发炎症反应,形成与阿尔茨海默病近似斑块并造成轻度记忆障碍。病原细菌牙龈卟啉单胞菌也可以进入脑内,并促进Aβ的产生。这些研究结果表明,微生物的感染与AD的发生发展可能存在密切关系,相关研究者也基于此提出了AD发病机制的微生物感染假说。
近年研究发现,AD 患者的血清中存在较多真菌源生物大分子(多糖、蛋白质和DNA),在患者脑组织切片中也发现了真菌细胞和真菌源物质,而正常人脑组织切片中并没有发现相关物质的存在。流行病学研究显示,真菌感染和多种精神疾病有密切关联。基于动物模型的研究表明,白色念珠菌可以穿过血脑屏障引发神经细胞炎症反应,并在脑中形成与阿尔茨海默病中Aβ 斑块类似的肉芽肿型结构,造成小鼠轻度记忆障碍。体外研究也发现,Aβ可以快速缠绕在真菌菌体上发挥抗菌活性。真菌感染可能与AD存在密切关系,但真菌与AD发生发展的具体关系仍有待发现证明,其作用机制及AD病理相关的关键因子等仍有待明确。
研究发现,Aβ 可以快速识别并结合于真菌细胞壁中的多糖结构。针对AD 诊断标志物的研究也提供了AD 与真菌细胞壁间关系的更多线索。临床研究表明,AD 患者的脑脊液几丁质酶样蛋白YKL−40 和几丁质酶Chitinase1 的浓度明显高于正常人群,YKL−40 和Chitinase1 可能是AD 诊断和预后的重要生物标志物。几丁质是常见于真菌细胞壁、甲壳类动物及昆虫外壳的一种多糖,在人体内并未发现。几丁质酶及相关蛋白可能通过结合、降解真菌细胞壁几丁质参与宿主抵抗真菌感染的过程。尽管AD 患者几丁质酶表达水平的升高在AD发病机制中的所扮演的角色尚不清楚,但这些研究进一步预示着真菌尤其是几丁质等真菌细胞壁多糖组分在AD发生中可能扮演重要角色。
白色念珠菌是一种寄生于人体皮肤、黏膜、肠道中的条件致病真菌,当人体免疫功能下降或者体内菌群失调,可能引起表皮、黏膜或全身性念珠菌病。白色念珠菌还会导致类风湿关节炎和阿尔茨海默症等多种疾病。由于植入性医学材料增多以及抗生素滥用等因素,导致白色念珠菌的耐药菌大量增加以及白色念珠菌病的发病率不断上升,每年约造成2400 万感染病症。本研究主要以白色念珠菌为研究对象,研究了Aβ 的抗真菌活性,比较了不同聚集形态对Aβ 抗真菌活性的影响,并初步探索了其作用位点及抗菌机制,这将为Aβ生理活性探究提供新的理论依据。
1 材料与方法
1.1 材料
白色念珠菌(Candida albicans
,SC5314)由中国科学院微生物所菌种保藏中心提供。Aβ42 由吉尔生化上海有限公司合成(纯度>95%)。葡萄糖、细菌学蛋白胨、酵母膏和琼脂均购买自OXOID 公司。DMSO 购买自西陇科学股份有限公司。BCA蛋白浓度测定试剂盒、3−(4,5−二甲基噻唑−2)−2,5−二苯基四氮唑溴盐(MTT)、三氮吗啡啉丙磺酸(MOPS)、锇酸均购买自北京索莱宝科技公司。RPMI−1640 培养基粉末购买自Thermofisher 公司。六氟异丙醇、细胞壁钙荧光白(Calcofluor White,CFW)、硫黄素T(ThT)、氟康唑、来源于酿酒酵母的葡聚糖和甘露聚糖以及来源于虾蟹壳的几丁质、壳聚糖和壳寡糖均从Sigma 公司购买。卡泊芬净购买自APExBIO 公司。其他未提及的试剂均为国产最高纯度试剂。1.2 方法
1.2.1 白色念珠菌培养 使用YPD 固体培养基(2%葡萄糖,2%细菌学蛋白胨,1%酵母膏,2%琼脂)活化白色念珠菌冻存菌株并置于30℃恒温培养箱静置培养48h。挑取白色念珠菌单菌落至YPD 液体培养基,30℃恒温摇床200r·min过夜培养。如需培养生物被膜,则使用RPMI 1640 培养基(34.53g·L三氮吗啡啉丙磺酸,10.4g·LRPMI−1640 粉)调整过夜培养的菌液浓度至1×10cells·mL。按照每孔100μL 菌液加入96 孔板,96孔板最外侧两排和两列加入200μL无菌水以保持湿度,将96孔板置于37℃恒温培养箱静置培养24h,在孔板底部即可形成成熟生物膜。
1.2.2 Aβ42单体化处理 1mg Aβ42溶于1mL六氟异丙醇,冰浴超声20min,4℃静置2h。待Aβ42完全溶解后,冰浴超声20min 打散Aβ42聚集体,然后4℃、14000r·min离心20min,收集上清至1.5mL EP 管中并冻干。向冻干Aβ42 中加入400μL NaOH(20mM)吹打混匀,冰浴10min 使其完全溶解。再次4℃、14000r·min离心10min,取上清并通过BCA蛋白浓度测定试剂盒测定Aβ42浓度,−80℃保存。
1.2.3 Aβ42浓度测定 将BCA试剂与Cu试剂按照50∶1的比例配制BCA工作液。取90μL PBS加入10μL BSA标准品(5mg·mL),将标准品稀释至0.5mg·mL,96孔板中分别加入0,2,4,6,8,12,16,20μL稀释后的标准品,加PBS 补足至20μL。将Aβ42 分别按照5 倍和10 倍稀释,取20μL 稀释后的Aβ42 加到96 孔板。各孔加入200μL BCA 工作液,充分混匀,96孔板边缘孔加无菌水防止边缘效应影响检测结果,37℃恒温培养箱静置孵育30min。孵育结束后通过酶标仪测定562nm 处吸光值。根据标准曲线计算Aβ42浓度,保证样品点落在标准线1/2后。
1.2.4 MTT法测定Aβ42对白色念珠菌细胞活力的影响 如上述培养白色念珠菌浮游菌及生物被膜,在浮游菌试验中,用含有特定浓度Aβ42的YPD 液体培养基调整菌液浓度为1×10cells·mL,37℃作用24h,将96孔板以1000r·min离心10min,弃上清,每孔加入100μL MTT 溶液(0.2mg·mL),37℃避光孵育3h。弃上清,每孔加入50μL DMSO 溶液,置于水平摇床100r·min混匀10min,待甲臜完全溶解后,使用酶标仪测定490nm 处吸光值。在生物被膜试验中,待形成成熟生物被膜后加入用RPMI−1640 培养基配制的不同浓度的Aβ42,37℃静置培养24h,培养结束后弃上清并用无菌磷酸盐缓冲液(PBS)洗去浮游的白色念珠菌,加入MTT 溶液进行生物膜细胞的活力测定。
1.2.5 荧光显微镜观察Aβ42对白色念珠菌的作用 分别用含有0,3.33,16.67μg·mLAβ42 的YPD 液体培养基调整菌液浓度为1×10cells·mL,并按照每孔600μL 菌液加入24 孔板,37℃静置培养24h。Aβ42 处理结束后,用PBS 洗去浮游白色念珠菌,每孔再加入终浓度为10μg·mL的细胞壁钙荧光白(calcofluor white,CFW)进行荧光染色,37℃恒温培养箱避光孵育1h,PBS洗净多余染料并置于荧光显微镜下观察。
1.2.6 不同聚集状态Aβ42对白色念珠菌的抑制作用 使用Tris−HCl(pH值7.4,10mM)将Aβ42分别稀释为10,50,100μg·mL,并将其置于37℃恒温培养箱静置孵育4h形成寡聚态Aβ42,或96h形成纤维态Aβ42。将不同形态Aβ42分别作用于白色念珠菌生物被膜和浮游菌24h,处理结束后通过MTT试验检测各组白色念珠菌细胞活力。
1.2.7 透射电子显微镜(TEM)观察Aβ42聚集状态 参考文献中的方法进行透射电子显微镜样品的制备。Tris−HCl 缓冲液(10mM,pH 值7.4)稀释Aβ42 至10μM,取20μL 稀释好的Aβ42 溶液于37℃分别静置孵育0,4,60,96h。将孵育好的Aβ42 超声10s,在不打散Aβ42 聚集体的前提下将Aβ42 分散均匀。将10μL 样品垂直滴在300目碳膜铜网上,静置5min后用吸水滤纸从一侧吸去液体。加入2.5%戊二醛固定5min后,用吸水纸吸去液体。使用乙酸双氧铀负染5min 后,用吸水纸吸去液体,37℃烘箱烘干1h,样品通过透射电子显微镜(Ht−7700)观察。
1.2.8 扫描电子显微镜(SEM)观察Aβ42抗白色念珠菌黏附作用 按照文献中的方法进行扫描电镜样品的制备。将酸浸以及高压灭菌处理的细胞爬片放入24 孔板中,每孔加入500μL 含有1×10cells·mL白色念珠菌的培养基,37℃恒温培养箱静置培养24h。待生物被膜成熟后弃去旧培养基,每孔加入400μL 浓度为200μg·mL的Aβ42,37℃恒温箱静置孵育24h,处理结束后弃去上清并用PBS洗掉浮游白色念珠菌。加入500μL 2.5%戊二醛−4%多聚甲醛固定液,4℃固定1h。加入预冷的PBS 缓冲液洗去多余固定液后使用400μL 1%锇酸继续固定45min。吸去锇酸固定液并用PBS清洗。使用50%、70%、80%、90%、95%、100%乙醇进行梯度脱水。处理结束后将细胞爬片保存于4℃无水乙醇中,经过临界点干燥和喷金处理后即可通过扫描电子显微镜(SU8010)在5kV下进行样品的观察。
1.2.9 硫黄素T(ThT)荧光测定 ThT 是一种苯并噻唑盐,可与Aβ 纤维丝特异性结合而不与单体或低聚中间体结合,并且ThT的结合不会影响Aβ参与淀粉样纤维原的组装。因此,ThT常用于定量分析体系中淀粉样纤维的含量。在黑色非结合性聚苯乙烯96 孔板中进行ThT 荧光测定试验,每孔添加200μL 体系。使用Tris−HCl缓冲液(10mM,pH 值7.4)稀释Aβ42、多糖和ThT 母液至终浓度为50μM、200μg·mL和20μM,37℃孵育1,4,8,12,24,48h。孵育结束后使用酶标仪在445nm 激发波长和485nm 发射波长下检测荧光强度。每次试验均设置3个平行并且减去不含Aβ42的荧光背景值。
1.2.10 壳寡糖、低聚壳聚糖与Aβ42复配后对白色念珠菌的抑制作用 培养成熟的白色念珠菌生物被膜,分别用浓度为50μg·mL的Aβ42、200μg·mL的壳寡糖(COS)、200μg·mL的低聚壳聚糖(LCS)、1mg·mL的氟康唑(FLC)、1μg·mL的卡泊芬净(CAS)以及与Aβ42复配的混合物处理生物被膜,37℃培养箱静置孵育24h。处理结束后吸走上清并用PBS洗去游离白色念珠菌,并通过MTT 试验检测不同处理条件下白色念珠菌的细胞活力。各处理组设置6个平行并重复试验3次。
2 结果与分析
2.1 Aβ42对白色念珠菌代谢活力的抑制
Aβ42 作用于白色念珠菌生物膜后,能显著抑制白色念珠菌生物膜细胞活性,且随Aβ42 浓度升高,抑菌作用增强。Aβ42 在10μg·mL浓度下并不会对生物膜态白色念珠菌产生抑菌活性,当浓度分别为50,100,200μg·mL时,Aβ42 对生物膜态白色念珠菌的抑菌率分别达到35.43%、48.10%、57.42%(图1A)。Aβ42 也能显著抑制浮游态白色念珠菌的活性,低浓度Aβ42 对浮游菌的抑菌效果比对生物膜的抑菌效果更显著,0.1μg·mLAβ42 便能显著抑制白色念珠菌浮游菌活性,且随着Aβ42 浓度的增加,其对浮游态白色念珠菌的抑菌效果越来越强(图1B)。CFW染料能够标记白色念珠菌细胞壁几丁质,在荧光显微镜下能够观察到白色念珠菌菌丝和孢子发出明亮的蓝色荧光。荧光显微镜结果显示,与对照组相比,经过Aβ42 处理的白色念珠菌荧光强度减弱。说明Aβ42能显著抑制白色念珠菌菌丝的生成,减少白色念珠菌的毒性和耐药性,并且抑菌效果与Aβ 42浓度呈现正相关(图1C)。
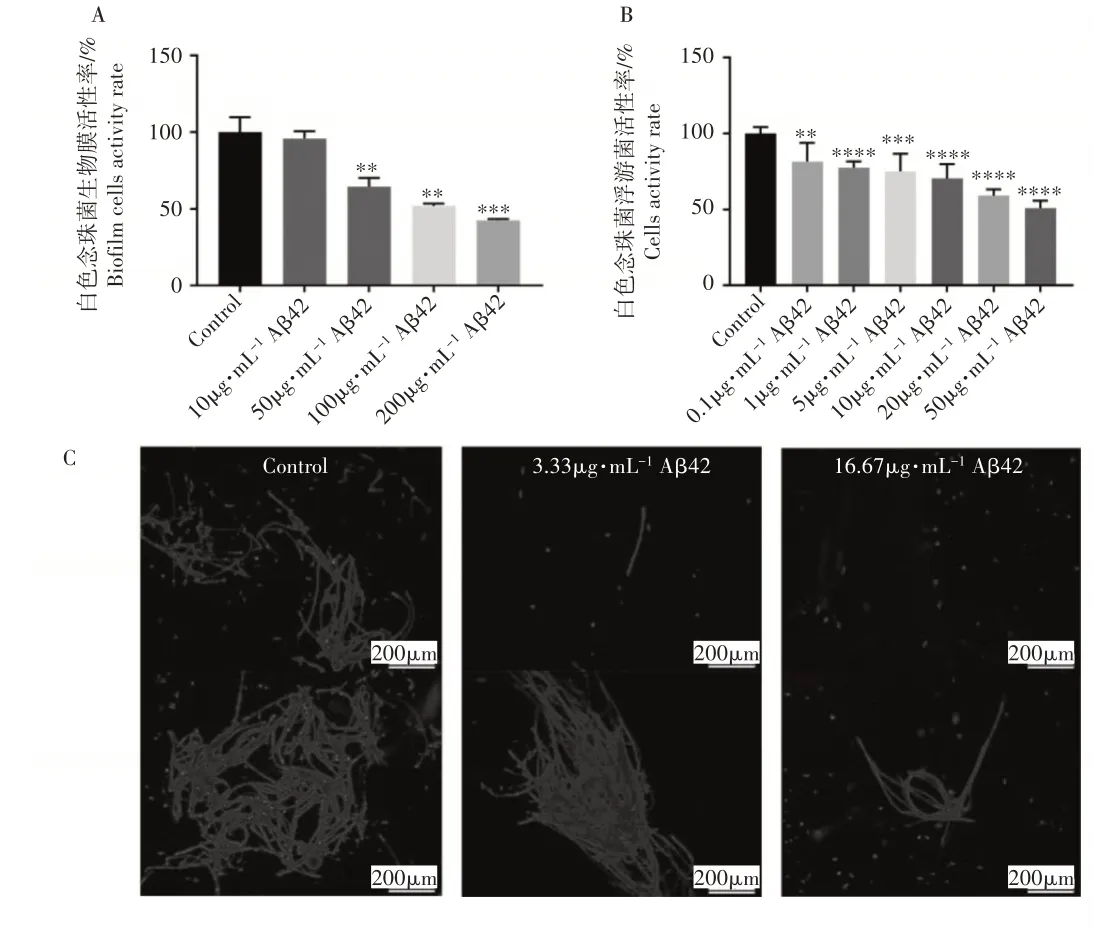
图1 不同浓度Aβ42对白色念珠菌的抑制作用Figure1 The inhibitory effect of Aβ42 on Candida albicans
2.2 不同聚集状态Aβ42对白色念珠菌的抑制作用
由图2A 和图2B 可知,无论白色念珠菌生物膜还是浮游菌,寡聚态和纤维态Aβ42 均表现出了明显的抑菌作用。在低浓度时,寡聚态和纤维态Aβ42在抑菌效果方面没有明显差异,但在高浓度时,寡聚态Aβ42抗菌活性显著强于纤维态(p
<0.05)。Aβ42 的寡聚态及纤维态通过透射电镜观察确定。如图2C 所示,未孵育的Aβ42单体呈现点状,均匀分布在碳膜铜网上。孵育4h 后Aβ42 发生聚集,形成团块状的寡聚态Aβ42。孵育60h 后,开始形成纤维态Aβ42。孵育96h 后的Aβ42 基本全部呈现纤维态。研究结果表明不同聚集状态的Aβ 其抗真菌活性存在差异,当Aβ转变为纤维态时其抗菌活性降低。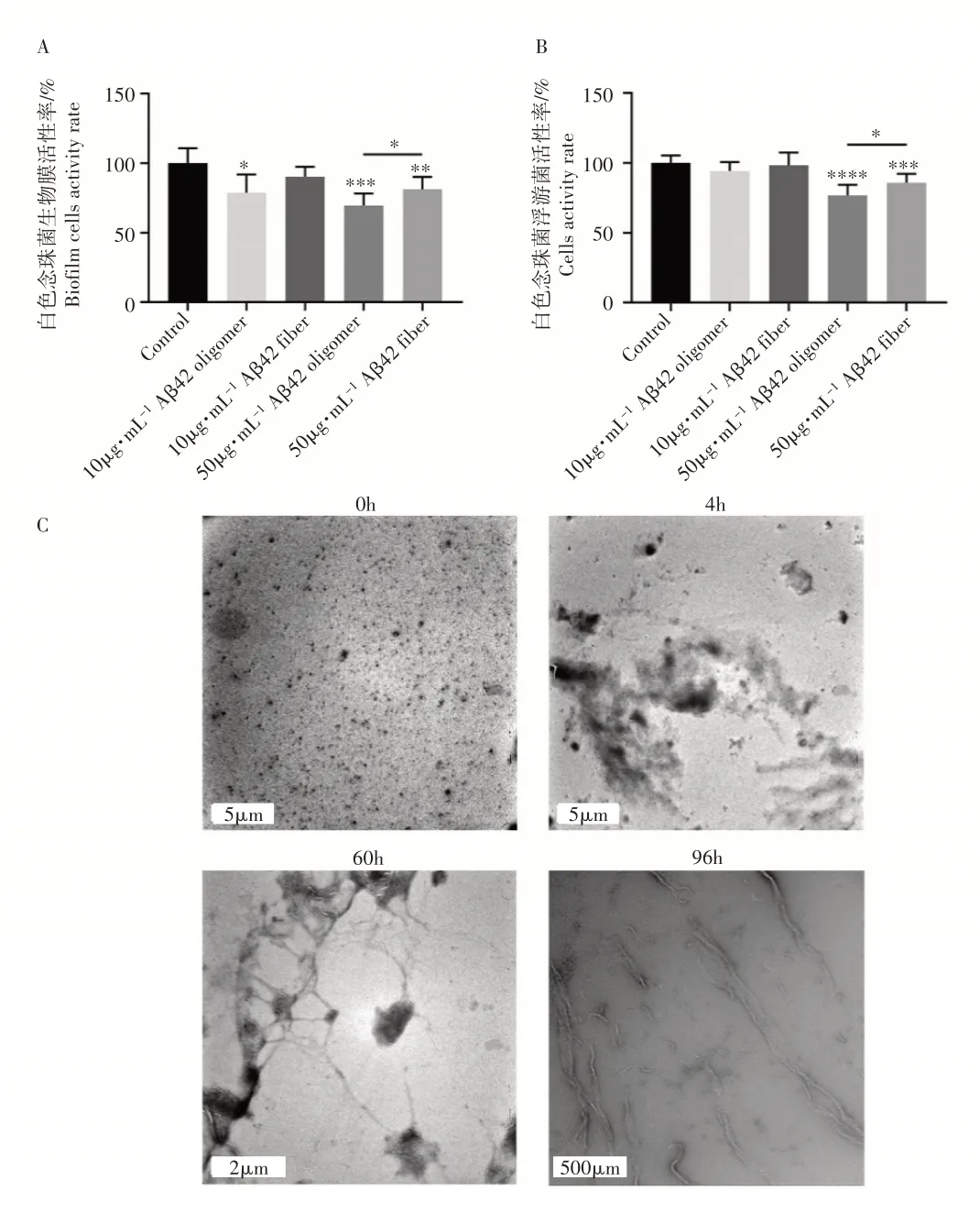
图2 不同聚集状态Aβ42对白色念珠菌的抑制作用Figure2 Antifungal activity of Aβ42 indifferent oligomerization statuses
2.3 扫描电镜观察Aβ42对白色念珠菌生物被膜的抑制作用
通过扫描电镜对Aβ42 处理后的白色念珠菌表面结构进行观察。图3A、图3B 和图3C 分别为正常生长的白色念珠菌生物膜及菌丝放大1k、10k、30k后的表面结构图像。由图3A 可知,白色念珠菌生物被膜是由大量菌丝交连形成的致密三维网络结构,再由菌丝细胞分泌的胞外基质包裹形成菌细胞团。图3B中的絮状物质就是生物膜的胞外基质结构,在图3C 的高倍放大条件下可以看到白色念珠菌菌丝饱满且表面光滑。图3D、图3E、图3F 分别为经过200μg•mLAβ42 处理后白色念珠菌生物膜及菌丝放大1k、10k、30k后的表面结构图像。由图3D 可知,Aβ42处理后生物膜中的菌丝显著减少,胞外基质丢失(图3D),且Aβ42 处理使得原本光滑饱满的菌丝变得干瘪粗糙(图3E)。由于喷金变为圆球形的寡聚体Aβ42附着在白色念珠菌菌丝壁上,菌丝壁表面变得疏松多孔(图3F)。这与抗菌肽破坏菌体的细胞壁膜,致使壁膜凹凸不平,从而改变通透性的作用效果相似。说明Aβ42 显著抑制了白色念珠菌生物被膜的形成,其作用机制可能通过附着于白色念珠菌细胞壁,破坏细胞壁结构从而导致细胞死亡。

图3 Aβ42影响白色念珠菌生物被膜的SEM图片Figure3 SEM images of Aβ42-treated Candida albicans biofilm
2.4 白色念珠菌细胞壁多糖对Aβ42活性的影响
ThT 可以嵌入到Aβ42 的β 片层中并在荧光显微镜下呈现绿色荧光,随着Aβ42 的聚合程度越高荧光值越大。为了探究白色念珠菌细胞壁多糖对Aβ42聚集的影响,将白色念珠菌细胞壁的主要组分葡聚糖、甘露聚糖和几丁质分别与Aβ42 单体一起孵育24h。结果表明,在孵育48h 后几丁质促Aβ42 的聚集作用最为明显,葡聚糖也会显著促进Aβ42的聚集,但甘露聚糖对Aβ42的聚集没有影响(图4a),说明白色念珠菌细胞壁多糖与Aβ 42 存在相互作用关系。真菌细胞壁中的几丁质可以在菌体分泌的水解酶和脱乙酰酶的作用下降解产生壳寡糖和低聚壳聚糖,壳寡糖和低聚壳聚糖对白色念珠菌生物被膜均有抑菌效果(p
<0.01),但分别将壳寡糖和低聚壳聚糖与Aβ42 复配后,对白色念珠菌生物膜的抑菌作用减弱(图4b)。分别将氟康唑和卡泊芬净这两种药物与Aβ42复配均表现出抗菌效果增强趋势,说明抗真菌药物与Aβ42通过不同的作用靶点,协同发挥抗真菌活性。Aβ42 与细胞壁多糖片段的复配以及与抗真菌药物的复配后抗真菌活性趋势的差异,说明Aβ42通过与白色念珠菌细胞壁多糖相互作用从而发挥抗菌活性。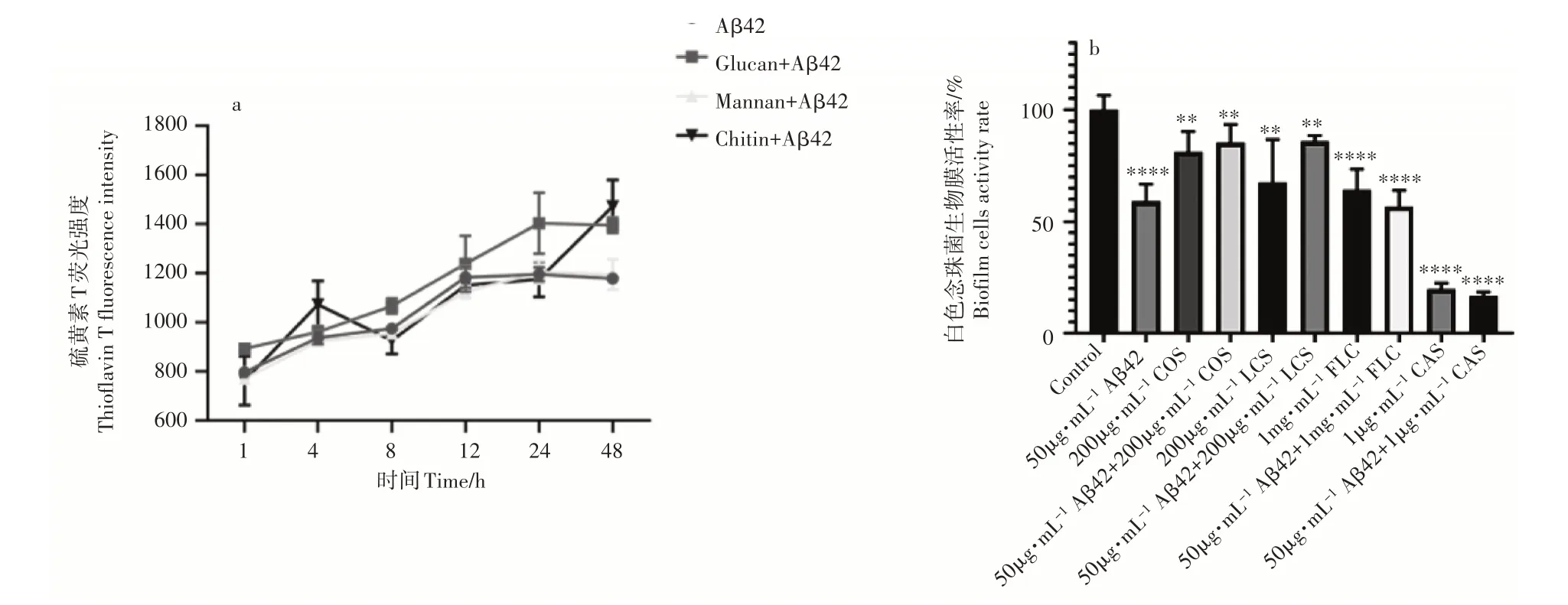
图4 Aβ42与白色念珠菌细胞壁多糖相互作用Figure4 Interaction between Aβ42 and Candida albicans cell wall polysaccharides
3 讨论与结论
随着AD 致病机制中“微生物感染假说”的提出和发展,越来越多的研究证明AD 的发生与微生物息息相关。白色念珠菌可以穿过血脑屏障并引发炎症反应,是AD 患者大脑中发现较多的一种真菌。目前主流学说认为Aβ 的错误折叠和聚集沉积是造成AD 的主要原因。近年来研究也发现Aβ 沉积可能与抗菌有关。AD 患者较正常脑组织样品的抗菌活性显著升高,而在该组织样品中加入Aβ 抗体后,其抗菌活性被显著抑制。相关研究者认为,大脑通过产生Aβ 包裹消灭入侵的微生物,并将有害的病原体聚集成斑块以防止感染,但过量产生的Aβ 因为形成纤维体而导致抗菌能力减弱并且Aβ 与病原菌形成的斑块由于遗传、环境、机体机能衰退等因素未能及时清除,引起大脑中免疫细胞持续的炎症反应,最终诱发AD。Aβ42 是一条由42 个氨基酸构成的短肽,分子量约为4514.1Da。其结构主要由强疏水性的β 片层构成,因而容易沉积。Aβ 单体不会长期存在,会不断自聚集形成Aβ 寡聚体,包括聚合度为10 以下的低分子量寡聚体以及聚合度为20~40 的高分子量寡聚体。两种类型寡聚体再进一步形成原纤维与纤维。而Aβ 的神经毒性主要来源于可溶性的寡聚体,并且AD 患者的认知状态与大脑内Aβ 寡聚体浓度有着密切的关系。前期研究已经发现了Aβ 的抗真菌活性,但不同聚集状态的Aβ 和抗菌活性之间的关系仍不清楚以及Aβ抗菌的机制依旧不明。
本试验首先验证了Aβ42作用于白色念珠菌后能显著抑制生物膜和浮游菌活性,并且抑菌活性与Aβ42浓度呈现正相关。CFW 染色后发现Aβ42 能显著抑制白色念珠菌菌丝的生成。为探究不同聚集状态的Aβ 对抗菌活性有何影响,将孵育不同时间的Aβ 处理白色念珠菌,结果显示,纤维态Aβ42对白色念珠菌的抗菌活性没有寡聚态强,这与孔繁军的不同聚集状态Aβ 对神经元的损伤结果一致。为了证明Aβ 是如何发挥抗菌活性的,通过扫描电子显微镜观察到Aβ42附着在白色念珠菌菌丝上,并使得原本光滑饱满的正常菌丝变得干瘪粗糙、胞外基质缺失以及菌丝壁出现多处小孔。说明Aβ42 破坏了白色念珠菌细胞壁结构并且降低了白色念珠菌的黏附作用。其次分别将高纯度的葡聚糖、甘露聚糖和几丁质与Aβ42一起孵育,发现一些多糖能够与Aβ42结合促进其聚集。已有研究也发现,Aβ可以快速识别并结合于真菌细胞壁中的多糖结构。将真菌细胞壁几丁质降解产物壳寡糖和低聚壳聚糖分别与Aβ42复配,发现Aβ42的抗菌活性被削弱。说明外源加入的细胞壁多糖片段与Aβ42结合后,抑制了Aβ42与白色念珠菌细胞壁中几丁质或者葡聚糖的结合,导致Aβ42无法发挥抗真菌活性。抗真菌药物氟康唑靶向于真菌细胞膜中麦角固醇,卡泊芬净作为β−1,3 葡聚糖合成酶的非竞争性抑制剂,抑制真菌细胞壁中β−1,3 葡聚糖的合成,分别将这两种药物与Aβ42 复配均表现出抗菌效果增强趋势。Aβ42 与细胞壁多糖片段的复配以及与抗真菌药物的复配后抗真菌活性趋势的差异,进一步证明Aβ通过结合真菌细胞壁多糖发挥抗菌活性。
Aβ42 对浮游态和生物膜态白色念珠菌都具有显著的抗菌活性,并且抗菌活性与Aβ42 浓度呈现正相关。不同聚集状态的Aβ其抗真菌活性存在差异,当Aβ转变为纤维态时其抗菌活性降低。Aβ42通过与真菌细胞壁多糖结合并破坏细胞壁完整性从而发挥抗菌活性。本研究为进一步探究Aβ生理活性提供了新的理论依据。

