酮酰胺化合物抗病毒活性及其天然产物来源
苏雨婷 李兆星 李娟 段彦 欧阳文 赵丽娟 张云坤 肖易倍 李顺祥

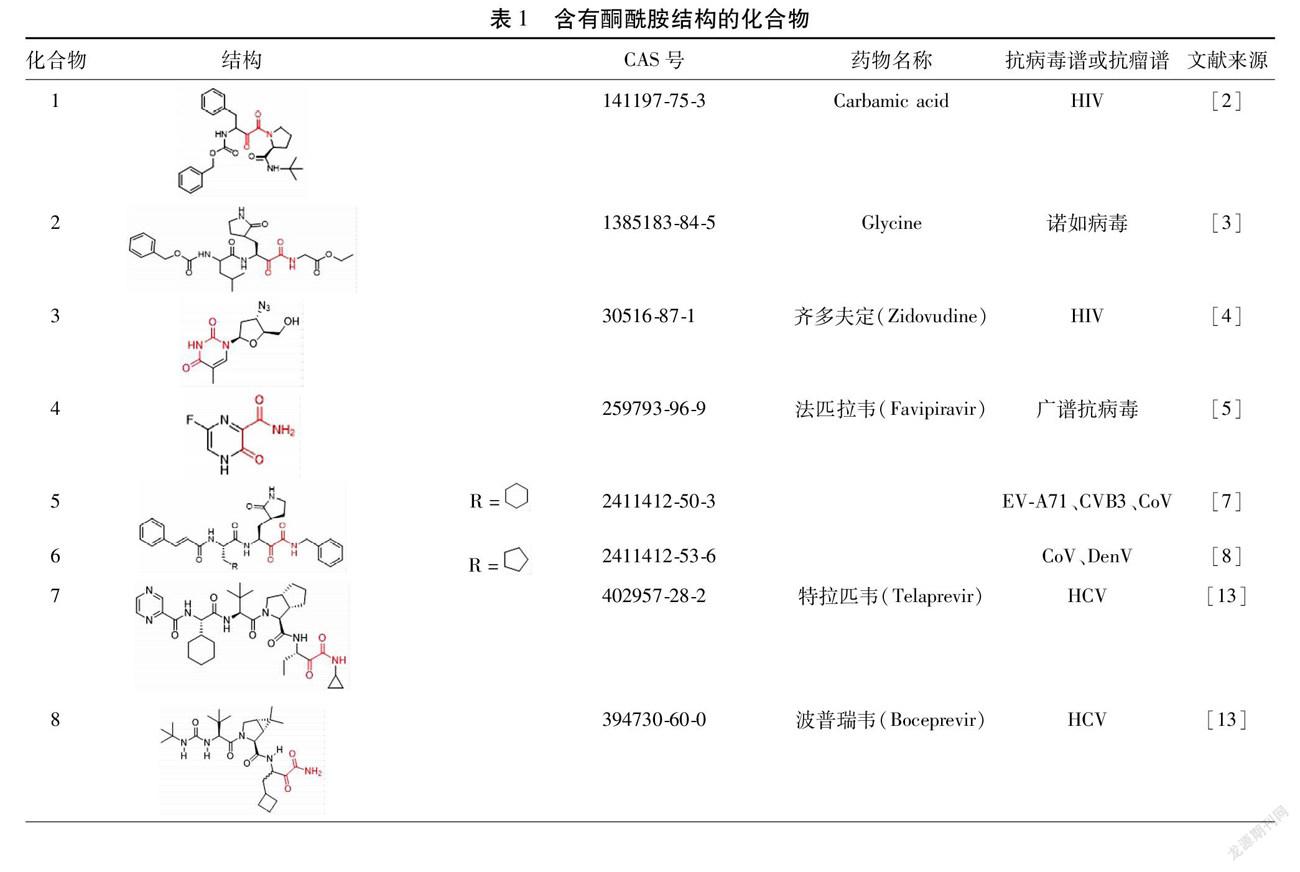
摘要 酮酰胺化合物对冠状病毒(CoV)、丙型肝炎病毒(HCV)、人类免疫缺陷病毒(HIV)、朊病毒(Pr)等病毒均表现出良好的抑制活性。本研究对酮酰胺化合物抗病毒活性及其天然产物来源进行综述,发现不少具有清热解毒功效的中药中含有此类成分,为酮酰胺化合物在防治CoV等病毒性疾病方面的开发应用提供参考。
关键词 酮酰胺化合物;冠状病毒;丙型肝炎病毒;人类免疫缺陷病毒;朊病毒;抗病毒活性;天然产物;中药
Antiviral Activities of Ketoamide Compounds and the Natural Sources
SU Yuting1,LI Zhaoxing2,LI Juan1,DUAN Yan1,OUYANG Wen1,ZHAO Lijuan1,ZHANG Yunkun1,XIAO Yibei2,LI Shunxiang1
(1 Hunan Province Engineering Research Center of Bioactive Substance Discovery of Chinese Medicine,School of Pharmacy,Hunan University of Chinese Medicine,Changsha 410208,China; 2 School of Pharmacy,China Pharmaceutical University,Nanjing 211198,China)
Abstract Ketoamide compounds show inhibitory activity against coronavirus(CoV),hepatitis C virus(HCV),human immunodeficiency virus(HIV),prion(Pr),and other viruses.This article reviews the antiviral activity of ketoamide compounds and the natural sources of them.It was found that many Chinese medicinals for clearing heat and detoxification contain such ingredients.The result can serve as a reference for the development and application of ketoamide compounds in the prevention and treatment of diseases caused by viruses such as CoV.
Keywords Ketoamide compound; CoV; HCV; HIV; Pr; Antiviral activity; Natural product; Chinese medicinal
中图分类号:R285文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.08.024
酮酰胺是一类具有良好活性的物质,其基本结构母核为α-酮酰胺和β-酮酰胺。酮酰胺化合物广泛存在于天然产物中,经结构修饰后还可作为各类药物的核心骨架结构,同时也是5-羟色胺6(5-HT6)、α-二酮和β-内酰胺等多种重要化合物的合成前体物质[1]。酮酰胺化合物具有明显的实用价值,α-酮酰胺可用于开发人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)蛋白酶(1)[2],诺如病毒3CL蛋白酶(2)[3]等多种抑制剂。具有抗HIV活性的药物齐多夫定(Zidovudine,3)[4]以及广谱抗病毒药物法匹拉韦(Favipiravir,4)[5]均属于β-酮酰胺。目前常用各种途径合成酮酰胺化合物,主要包括炔胺氧化、芳基酮及其衍生物氧化酰胺化、卤代烃双羰化反应、不饱和芳香烃氧化、α-氨基酸及其衍生物空气氧化和芳基酮酸无催化一锅法等方法[6]。近期研究发现具有酮酰胺结构的化合物对最近爆发的严重急性呼吸系统综合征冠状病毒2型(Severe Acute Respiratory Syndrome Coronavirus 2,SARS-CoV-2)有良好的抑制作用[7-8]。鉴于酮酰胺类化合物的抗病毒活性,本研究系统综述了酮酰胺类化合物在抗病毒方面的作用和机制研究及其天然产物来源,为研发酮酰胺类抗病毒抑制剂提供理论基础,也为中医药治疗病毒性疾病的有效性提供科学依据。
1 酮酰胺化合物的药理学作用
1.1 抗CoV CoV在自然界中广泛存在,是一类对人及家畜均具有潜在威胁的病原体,共分为α、β、γ和δ 4个属,其中SARS-CoV、中东呼吸综合征冠状病毒(Middle East Respiratory Syndrome Coronavirus,MERS-CoV)以及SARS-CoV-2均属于β属冠状病毒。截止至2021年1月27日8时35分,由SARS-CoV-2引发的COVID-19全球累計确诊100 702 433例,死亡2 156 499例,已构成全球大流行。Zhang等[7]设计合成的酮酰胺类化合物对冠状病毒有较强的抑制作用,对分离的蛋白酶、病毒复制子和病毒感染的Huh7细胞均表现出良好的抑制作用,其中经过结构修饰得到的酮酰胺化合物11r(5)对SARS-CoV Mpro的IC50为0.7 μmol/L,对HCoV-NL63 Mpro、肠道病毒71型(Enterovirus 71,EV-A71)3Cpro和柯萨奇病毒B3型(CVB3)3Cpro的IC50分别为12.3 μmol/L、1.7 μmol/L和0.9 μmol/L。由于SARS-CoV的主要蛋白酶与SARS-CoV-2之间有高度相似性,因此作者预测11r对SARS-CoV-2可能也表现出同样良好的抗病毒活性。在此基础上,德国吕贝克大学生物化学研究所Rolf Hilgenfeld团队为了减少11r与血浆蛋白的结合阻力增加其在血浆中的溶解度并延长11r在血浆中的半衰期,将11r经过修饰得到酮酰胺化合物13a(6),用已解析的SARS-CoV-2主要蛋白酶晶体结构与13a对接发现,与11r比较13a在小鼠中的血浆半衰期增加了约3倍,体外动力学血浆溶解度提高约19倍,同时热动力学溶解度提高了约13倍,进而对小鼠皮下途径的药代动力学研究发现该酮酰胺抑制剂有明显的肺向性和适用于通过吸入途径给药的适应性[8]。Islam等[9]继续将11r等40种具有抗病毒活性的植物化学物质与SARS-CoV-2 3CL水解酶结合,根据它们的亲和力选择了5个最佳候选化合物,其中11r与3CL水解酶的亲和力为-7.8 kcal/mol(1 cal=4.184 J),分子动力学结构也显示11r均方根偏差低于其他化合物与3CL水解酶的配合物,表明其稳定性良好。18C49ABA-9782-4F88-822B-A2BF43177231
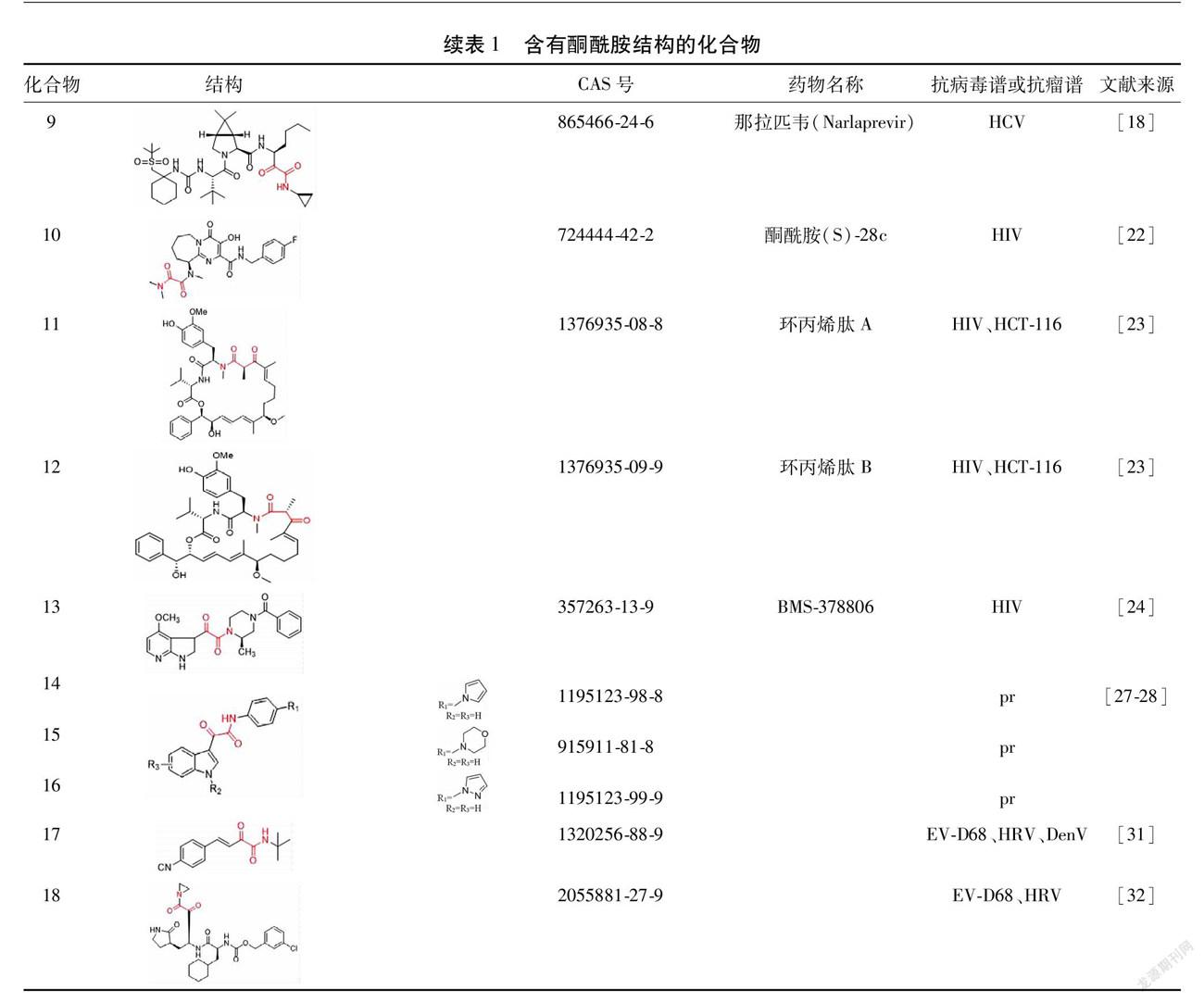
1.2 抗丙型肝炎病毒(Hepatitis C Virus, HCV) HCV流行范围广泛,各个年龄阶段、不同性别、人种均易感染HCV。据世界卫生组织统计,目前全球HCV感染者约1.85亿,其全球感染率高达2.8%,且每年约35万人因感染HCV而致死[10-12]。HCV入侵人体后一般会选择性感染肝脏细胞,在肝脏中通过翻译复制等过程进行繁殖。特拉匹韦(Telaprevir,7)[13]和波普瑞韦(Boceprevir,8)[13]于2011年获美国食品药品监督管理局批准上市标志着丙型肝炎直接抗病毒药物的问世,结束了干扰素时代,这2种药物均为口服HCV非结构蛋白NS3/4A蛋白酶的第一代线性酮酰胺类抑制剂[14],其中Telaprevir主要通过抑制NS3/4A丝氨酸蛋白酶发挥抑制作用[15]。Lin等[16]研究发现Telaprevir在体内以时间和剂量依赖的方式降低HCV复制子细胞中的RNA和蛋白水平;在HCV药敏试验中,IC50随培养时间的增加而降低。另外,Boceprevir中的酮酰胺单元结构能与HCV丝氨酸蛋白酶结合,在宿主细胞中HCV的复制会相应受到抑制,进而来控制病情。龚含情[17]为研究一系列类似Boceprevir的酮酰胺类化合物与受体蛋白丝氨酸酶活性之间的关系,选取了39种类似Boceprevir的酮酰胺类化合物建模,研究发现比较分子力场分析法(Comparative Molecular Field Analysis,CoMFA)和比较分子相似性指数分析法(Comparative Molecular Similarity Indices Analysis,CoMSIA)模型都具有较高的活性。随后研究发现那拉匹韦(9)[18]具有更加良好的药效动力学效应(比Boceprevir高约10倍)药代动力学特征和物理化学特征。为了进一步认识以NS3/4A蛋白酶为靶标的酮酰胺抑制剂与HCV之间的相互作用以及活性趋势,Wadood等[19]对16个酮酰胺抑制剂进行分子对接研究,对接分析检测出重要配体与目标蛋白结合位点的相互作用,并在对接评分与生物活性之间产生良好的相关系数(r2=0.690),这些分子对接结果将有助于酮酰胺类化合物作为HCV NS3/4A蛋白酶抑制剂的进一步优化。
1.3 抗HIV HIV导致人类获得性免疫缺陷综合征(Acquired Immunodeficiency Syndrome,AIDS),这是世界上最严重的健康威胁之一。目前国际上共有6大类30多种药物用于治疗HIV,分别为核苷类反转录酶抑制剂、非核苷类反转录酶抑制剂、蛋白酶抑制剂、整合酶抑制剂、膜融合抑制剂以及5型C-C趋化因子受体(C-C Chemokine Receptor Type 5,CCR5)抑制劑[20]。在HIV-1蛋白酶抑制剂设计中,α-酮酰胺化合物可作为良好的过渡态模拟物。Sheha等[21]将含有羟甲基羰基的二肽或三肽化合物通过氧化羟甲基得到对HIV蛋白酶有明显抑制作用的新型α-酮酰胺核心结构,磁共振成像结果显示出氧化得到的α-酮酰胺活性比相应含羟甲基羰基的抑制剂活性有所提高,主要是由于α-酮酰胺的酮羰基在蛋白酶活性位点的水平上水合形成。在研究HIV-1整合酶时,Muraglia等[22]发现酮酰胺结构单元的引入对酶的活性以及药理学作用有着积极意义,进一步通过体内体外研究发现带有酮酰胺基团的化合物是一种非常有效的选择性HIV整合酶抑制剂,在临床前物种(大鼠,狗,恒河猴)中具有口服生物利用度,并具有良好的药理学特性,其中酮酰胺(S)-28c(10)抑制HIV活性的效果最佳,IC50为12 nmol/L。Qi等[23]合成得到的环丙烯肽A(11)和环丙烯肽B(12)均属于酮酰胺类化合物,对抑制HIV感染的IC50分别为15 nmol/L和18 nmol/L,对人结肠癌细胞(HCT-116)也表现出显著的抑制活性,IC50值为110 nmol/L。BMS-378806(13)为4-甲氧基-7-氮杂吲哚衍生物,Lin等[24]发现在体外对X4型、R5型、X4/R5型HIV-1病毒毒株、HIV-1实验室病毒毒株以及B亚型HIV-1临床病毒毒株均表现出纳摩尔级抑制作用,其有效中浓度(Median Effective Concentration,EC50)均为40 nmol/L。
1.4 抗pr 朊病毒病(Prion Diseases,pr)也称传染性海绵状脑病(Transmissible Spongiform Encephalopathy,TSE),是由朊病毒引起的可感染人和动物的致死性神经退行性疾病。TSE与正常细胞病毒蛋白(PrPC)向不溶性聚集构象异构体PrPSC的转化有关。这些聚集体被认为会导致TSE中神经元细胞死亡,形成液泡并导致脑组织的特征性海绵状变性[25-26]。有研究设计合成了一系列吲哚-3-乙醛酰胺类化合物,并测试这类化合物抑制PrPS形成的能力,结果表明在C-6处进行取代可有效提高抗pr病毒活性),研究发现化合物14-16的EC50分别为0.006 μmol/L、0.009 μmol/L和0.001 μmol/L,在亚微摩尔级显示出对朊病毒的选择性抑制活性[27-28]。Thompson等[29]研发了另一系列抗朊病毒剂,首先扩大一组对位取代的吲哚-3-乙氧基乙酰胺,然后修饰乙醛酰胺部分。这项研究证实,吲哚-3-乙二醛酰胺衍生物的最佳R1基团是具有至少2个杂原子的5元芳族环。进一步研究16的构效关系发现,16单独用药对传代多次后的朊病毒感染细胞也表现出良好的治愈效果。Thompson等[30]将吲哚环取代的吲哚-3-乙二醛酰胺(R3=6-Me,6-CN或6-NO2)作为抗朊病毒剂,分析发现其具有增强微粒稳定性,提高细胞活力和毒性小等优点。
1.5 其他 登革病毒(Dengue Virus,DenV)属黄病毒科,是一种单链RNA病毒。为了生成具有增加药物相似性的化合物,Steuer等[31]用酮酰胺结构单元取代醛基,在酶法测定中酮酰胺类化合物表现出对DenV蛋白酶的中等亲和力,化合物35(17)在细胞培养法中以剂量依赖性方式抑制DenV复制,在非细胞毒性浓度下病毒滴度降低了1 000倍以上。另外,酮酰胺类化合物还可作为肠病毒D68(Enterovirus D68,EV-D68)、人鼻病毒(Human Rhinovirus,HRV)等一系列病毒的有效抑制剂。Zhang等[7]设计合成的酮酰胺类化合物不仅对冠状病毒起作用,这类酮酰胺化合物对EV-D68也有着相同的抑制活性。Kim等[32]证明了α-酮酰胺化合物对EV-D68和HRV的EC50值均在低纳摩尔范围内,并且这类α-酮酰胺化合物均具有良好的体外安全性指标,其中化合物10(18)对EV-D68和HRV具有最强的抗病毒活性,对其在大鼠体内的药代动力学和口服生物利用度进行评价均表现出良好的结果,因此作者认为该化合物可作为一种可行的潜在候选药物用于进一步开发EV-D68或HRV感染的单一药物或与其他抑制剂联合治疗。18C49ABA-9782-4F88-822B-A2BF43177231
2 酮酰胺化合物的天然产物来源
药用植物中的部分化合物已成功用于治疗多种病毒性疾病,Tahir等[33]利用药用植物数据库从32 297种潜在的抗病毒植物化学成分中筛选出可能SARS-CoV-2 3CLpro为靶标进而发挥抗病毒活性的9种化学成分。由此可见,从天然产物中挖掘具有抗病毒活性的化合物已经成为开发抗病毒药物的重要途径。
部分具有抗病毒作用的清热解毒类中药中存在酮酰胺类化合物。板蓝根是清热解毒、凉血利咽的代表性中药,临床上常用于防治呼吸道病毒性疾病,Liao等[34]发现板蓝根中存在喹咪唑类生物碱2,4-喹唑啉二酮(19),具有抗肿瘤、抗菌、抗病毒、抗癌、消炎、降血糖、降血压等药理作用[35]。喻瑛瑛等[36]和Zhang等[37]从清热解毒、消肿止痛的北豆根中分离出6,7-dimethoxy-N-Methyl-3,4-dioxo-1(2H)-IsoquinOlin-One(20),属异喹啉类生物碱。板蓝根所含核苷类成分是抗病毒的有效成分之一,其中尿苷(21)中存在酮酰胺单元结构,且能干扰病毒核酸的合成,是中药抗病毒的活性成分[38-39],另外曹新伟[40]从具有润肺化痰、散结消痈功效的川贝母鳞茎中分离得到的一系列核苷类成分尿嘧啶(22)、胸嘧啶(23)、尿苷(21)、胸苷(24)均属于酮酰胺类化合物,银杏、地黄和马齿苋中也含有尿嘧啶[41-43]。吕锦锦等[44]采用多种色谱技术从具有滋阴补血之功的熟地黄中分离出baimantuoluoamide B(25),属于酰胺类生物碱,Yang等[45]发现洋金花中也含有该化合物。李凤琴等[46]从行气止痛、活血散瘀的延胡索根茎以及Blanco等[47]从宣肺利咽、祛痰止咳的桔梗中均分离得到pontevedrine(26)。Ma等[48]从鱼腥草中分离得到22种生物碱并对其进行活性分析,其中3-methoxy-6H-benzod ioxolo-benzoquinoline-4,5-dione(27)、3-methoxy-6-methyl-6H-benzodioxoloben-zoquinoline-4,5-dione(28)、ouregidione(29)、cephalinone A(30)、cephalinone B(31)均属于吲哚类生物碱,同时也属于酮酰胺类化合物。另外Wu等[49]研究人员从兰科黄兰属黄兰中发现了3种酮酰胺类化合物,2,4-喹唑啉二酮(19)、吲哚醌(32)、cephalinone B(31),2,4-喹唑啉二酮和吲哚醌属于吲哚类生物碱,且这2种化合物也存在于鹤顶兰属紫花鹤顶兰中[50-51],其中吲哚醌具有抗肿瘤活性[52]。Pan等[53]从石松中分离出的Obscurumine C(33)和刘丽等[54]从有散热止痛、降逆止呕之功的吴茱萸中分离得到的吴茱萸酰胺乙(34)均属于吲哚类生物碱。茶是世界三大饮料之一,各研究者从普洱熟茶及其基原植物中共分离得到170个化合物,其中分离出的咖啡因(35)、茶碱(36)、可可碱(37)、7-甲基黄嘌呤(38)、8-氧化咖啡因(39)、苦茶碱(40)均属于酮酰胺类化合物[55],且这些化合物都具有良好的活性[56-58]。
另外,从菌类和海绵等天然产物中发现的部分酮酰胺化合物已证明有较良好的药理活性。从链霉菌(Streptomyces Tsukubaensis)中分离得到FK506(41)具有23-元大环内酯结构[59],已被开发为免疫抑制剂类药物。从吸水链霉菌(Streptomyces Hyspicus)中分离的雷帕霉素(42)[60]是T细胞增殖的阻断剂。从薰衣草链霉菌(SANK 60477)的菌丝体中提取分离的补偿肽(Chloropeptin Ⅱ)(43)[61]及链霉菌(WK-34194)中含有的其异构体(Chloropeptin I)(44)[62],可有效阻止HIV复制。Eurystatin A(45)和Eurystatin B(46)均来源于绿脓链霉菌(R353-21),五肽抑制素(H-Val Val-Pos-D-Leu-Val-OH)(47)由绿色产色链霉菌中分离得到[63],以上3种化合物对脯氨酰内肽酶均表现出显著的抑制作用,环胞酰胺(Ct)(48)对凝血酶和胰蛋白酶等丝氨酸蛋白酶均表现出有效抑制活性,该物质是由日本海洋海绵属(Theonella Swinhoei)分离得到一类大环五肽[64]。Gong等[65]从海绵Pericharax Heteroraphis中得到Pyronaamidine(49),并发现其对K562细胞系显示出细胞毒性,半抑制浓度(Inhibitory Concentration 50,IC50)值为9.4 mmol/L。从埃及红海海绵Leucetta Cf Chagosensis中分离得到的咪唑类生物碱Naamidines A(50)、Naamidines B(51)和Naamidines G(52)对新型隐球菌具有较强的抑制作用,最低抑制浓度(Minimum Inhibitory Concentration,MIC)值均在6.25~12.5 mg/mL[66]。
3 討论
目前,人类致病性病毒达1 200多种,病毒致病具有传播速度快,影响范围广,死亡率高、对世界经济造成重大损失等危害,因而成为防控疾病的重点[67-68]。早期出现的病毒性疾病有乙型脑炎、麻疹、脊髓灰质炎等,这一系列病毒性疾病还未完全消除,新的病毒性疾病又不断被发现,如2019年爆发的SARS-CoV-2具有非常强的传染性,影响到210个国家和地区,给人类带来了前所未有的灾难。因此,如何应对新发、突发病毒性疾病的流行及未来可能爆发的大流行疫情,成为人类所面临的重大挑战。
酮酰胺化合物具有2个潜在的亲核反应位点,分别位于2个亲电中心旁边。由于酮酰胺的特殊结构,其常作为亲电子弹头与其他骨架结合后形成特定的抑制剂。酮酰胺作为病毒抑制剂与其他二羰基衍生物比较,酮酰胺化合物具有更良好的药代动力学特性。如α-酮酰胺与α-酮酸比较,酮酰胺化合物显示出更高的膜渗透性,对血浆酯酶的稳定性更高[69-70]。Stein等[71]将α-酮酰胺等亲电子弹头与Z-Leu-Leu-Leu骨架偶联,对所构成的蛋白酶抑制剂对蛋白酶体Ch TL测定抑制作用,结果表明α-酮酰胺为最有效的可逆抑制剂,并强调以其弹头作为最有效的可逆抑制剂的多肽,可能用于治疗实体瘤以及自身免疫性疾病。18C49ABA-9782-4F88-822B-A2BF43177231
中藥和天然产物所含化学成分复杂、数量庞大、作用机制复杂,是获取抗病毒活性成分和先导化合物的重要来源。相较于西药,中药以及天然产物多成分、多靶点的特点使其在疾病的治疗中富有极大优势。中药和天然产物在最近爆发的COVID-19中发挥着重要作用,研究表明连花清瘟方对SARS-COV-2的复制表现出显著的抑制效果,并在体外发挥抗炎作用[72]。王林等[73]利用网络药理学从连花清瘟中筛选出378个活性成分,282个潜在靶点,其中与COVID-19共同靶点55个,且连花清瘟方中所含中药板蓝根、鱼腥草均存在酮酰胺化合物。因此可以从天然产物入手,特别是利用中医药的临床经验,对清热解毒、消肿止痛、宣肺利咽、化痰止咳等中药进行深入的化学与生理学活性研究,以发现临床上有用的原型药物,或利用高通量、高内涵等筛选技术初步从天然产物中挖掘出能与病毒特定蛋白和酶有良好结合性的酮酰胺化合物,再进一步从分子、细胞、动物活性探讨其具体作用机制,经结构修饰和改造后,寻找特异性高、毒性小、便于大生产的候选化合物,为快速研发出SARS-CoV-2抑制剂及其他病毒抑制剂提供关键的科学突破。
参考文献
[1]张晓斌.基于α-酮酰胺合成的新方法学研究[D].淮北:淮北师范大学,2013.
[2]Slee DH,Laslo KL,Elder JH,et al.Selectivity in the Inhibition of HIV and FIV Protease:Inhibitory and Mechanistic Studies of Pyrrolidine-Containing α-Keto Amide and Hydroxyethylamine Core Structures[J].J Am Chem Soc,1995,117(48):11867-11878.
[3]Mandadapu SR,Weerawarna PM,Gunnam MR,et al.Potent inhibition of norovirus 3CL protease by peptidyl α-ketoamides and α-ketoheterocycles[J].Bioorg Med Chem Lett,2012,22(14):4820-4826.
[4]Gopalakrishnan R,Kozany C,Gaali S,et al.Evaluation of synthetic FK506 analogues as ligands for the FK506-binding proteins 51 and 52[J].J Med Chem,2012,55(9):4114-4122.
[5]Delang L,Abdelnabi R,Neyts J.Favipiravir as a potential countermeasure against neglected and emerging RNA viruses[J].Antiviral Res,2018,153:85-94.
[6]许航线.α-酮酰胺化合物合成研究进展[J].合成材料老化与应用,2019,48(2):148-151.
[7]Zhang L,Lin D,Kusov Y,et al.α-Ketoamides as Broad-Spectrum Inhibitors of Coronavirus and Enterovirus Replication:Structure-Based Design,Synthesis,and Activity Assessment[J].J Med Chem,2020,63(9):4562-4578.
[8]Zhang L,Lin D,Sun X,et al.Crystal structure of SARS-CoV-2 main protease provides a basis for design of improved α-ketoamide inhibitors[J].Science,2020,368(6489):409-412.
[9]Islam R,Parves MR,Paul AS,et al.A molecular modeling approach to identify effective antiviral phytochemicals against the main protease of SARS-CoV-2[J].J Biomol Struct Dyn,2021,39(9):3213-3224.
[10]Mohd Hanafiah K,Groeger J,Flaxman AD,et al.Global epidemiology of hepatitis C virus infection:new estimates of age-specific antibody to HCV seroprevalence[J].Hepatology,2013,57(4):1333-1342.
[11]Lavanchy D.The global burden of hepatitis C[J].Liver Int,2009,29(1):74-81.
[12]World Health Organization.Guidelines for the Screening,Care and Treatment of Persons with Hepatitis C Infection[S].Geneva:World Health Organization,2014.
[13]Wedler HB,Palazzo TA,Pemberton RP,et al.Predicting hydration propensities of biologically relevant α-ketoamides[J].Bioorg Med Chem Lett,2015,25(19):4153-4157.18C49ABA-9782-4F88-822B-A2BF43177231
[14]Garnock-Jones KP.Boceprevir:a review of its use in the management of chronic hepatitis C genotype 1 infection[J].Drugs,2012,72(18):2431-2456.
[15]Jesudian AB,Jacobson IM.Optimal treatment with telaprevir for chronic HCV infection[J].Liver Int,2013,33(1):3-13.
[16]Lin K,Perni RB,Kwong AD,et al.VX-950,a novel hepatitis C virus(HCV) NS3-4A protease inhibitor,exhibits potent antiviral activities in HCv replicon cells[J].Antimicrob Agents Chemother,2006,50(5):1813-1822.
[17]龔含情.抗病毒药物与蛋白的相互作用及分子模拟[D].上海:上海师范大学,2019.
[18]Perni RB,Almquist SJ,Byrn RA,et al.Preclinical profile of VX-950,a potent,selective,and orally bioavailable inhibitor of hepatitis C virus NS3-4A serine protease[J].Antimicrob Agents Chemother,2006,50(3):899-909.
[19]Wadood A,Riaz M,Jamal SB,et al.Interactions of ketoamide inhibitors on HCV NS3/4A protease target:molecular docking studies[J].Mol Biol Rep,2014,41(1):337-345.
[20]中华医学会感染病学分会艾滋病丙型肝炎学组,中国疾病预防控制中心.中国艾滋病诊疗指南(2018年版)[J].中华内科杂志,2018,57(12):867-884.
[21]Sheha MM,Mahfouz NM,Hassan HY,et al.Synthesis of di-and tripeptide analogues containing alpha-ketoamide as a new core structure for inhibition of HIV-1 protease[J].Eur J Med Chem,2000,35(10):887-894.
[22]Muraglia E,Kinzel O,Gardelli C,et al.Design and synthesis of bicyclic pyrimidinones as potent and orally bioavailable HIV-1 integrase inhibitors[J].J Med Chem,2008,51(4):861-874.
[23]Qi N,Wang Z,Allu SR,et al.Total Syntheses of Anti-HIV Cyclodepsipeptides Aetheramides A and B[J].J Org Chem,2016,81(24):12466-12471.
[24]Lin PF,Blair W,Wang T,et al.A small molecule HIV-1 inhibitor that targets the HIV-1 envelope and inhibits CD4 receptor binding[J].Proc Natl Acad Sci U S A,2003,100(19):11013-11018.
[25]Hu W,Kieseier B,Frohman E,et al.Prion proteins:physiological functions and role in neurological disorders[J].J Neurol Sci,2008,264(1-2):1-8.
[26]Singh A,Mohan ML,Isaac AO,et al.Prion protein modulates cellular iron uptake:a novel function with implications for prion disease pathogenesis[J].PLoS One,2009,4(2):e4468.
[27]Thompson MJ,Borsenberger V,Louth JC,et al.Design,synthesis,and structure-activity relationship of indole-3-glyoxylamide libraries possessing highly potent activity in a cell line model of prion disease[J].J Med Chem,2009,52(23):7503-7511.
[28]de Sá Alves FR,Barreiro EJ,Fraga CA.From nature to drug discovery:the indole scaffold as a ‘privileged structure[J].Mini Rev Med Chem,2009,9(7):782-793.18C49ABA-9782-4F88-822B-A2BF43177231
[29]Thompson MJ,Louth JC,Ferrara S,et al.Structure-activity relationship refinement and further assessment of indole-3-glyoxylamides as a lead series against prion disease[J].ChemMedChem,2011,6(1):115-130.
[30]Thompson MJ,Louth JC,Ferrara S,et al.Discovery of 6-substituted indole-3-glyoxylamides as lead antiprion agents with enhanced cell line activity,improved microsomal stability and low toxicity[J].Eur J Med Chem,2011,46(9):4125-4132.
[31]Steuer C,Gege C,Fischl W,et al.Synthesis and biological evaluation of α-ketoamides as inhibitors of the Dengue virus protease with antiviral activity in cell-culture[J].Bioorg Med Chem,2011,19(13):4067-4074.
[32]Kim Y,Kankanamalage AC,Damalanka VC,et al.Potent inhibition of enterovirus D68 and human rhinoviruses by dipeptidyl aldehydes and α-ketoamides[J].Antiviral Res,2016,125:84-91.
[33]Tahir Ul Qamar M,Alqahtani SM,Alamri MA,et al.Structural basis of SARS-CoV-2 3CL(pro) and anti-COVID-19 drug discovery from medicinal plants[J].J Pharm Anal,2020,10(4):313-319.
[34]Liao BL,Pan YJ,Zhang W,et al.Four Natural Compounds Separated from Folium Isatidis:Crystal Structures and Antibacterial Activity[J].Chem Biodivers,2018,15(7):e1800152.
[35]刘晓飞.几丁质合成酶抑制剂喹唑啉-2,4-二酮类新化合物的设计合成与生物活性研究[D].重庆:西南大学,2016.
[36]喻瑛瑛,邵佳,魏金霞,等.北豆根中生物碱类成分及其药理作用研究进展[J].中药材,2019,42(10):2453-2461.
[37]Zhang X,Ye W,Zhao S,et al.Isoquinoline and isoindole alkaloids from Menispermum dauricum[J].Phytochemistry,2004,65(7):929-932.
[38]林丽君,聂黎行,戴忠,等.板蓝根的研究概况[J].中国药业,2015,24(21):1-4.
[39]杨建昕,李峰,李娜,等.板蓝根抗病毒活性成分研究进展[J].辽宁中医药大学学报,2016,18(7):141-143.
[40]曹新伟.川贝母的化学成分研究与贝母属药用植物质量评价[D].北京:中国协和医科大学,2008.
[41]Pan Y,Zheng W,Yang S.Chemical and activity investigation on metabolites produced by an endophytic fungi Psathyrella candolleana from the seed of Ginkgo biloba[J].Nat Prod Res,2020,34(21):3130-3133.
[42]Zhou J,Shi GR,Liu YF,et al.Nine new compounds from the whole plants of Rehmannia henryi[J].J Asian Nat Prod Res,2019,21(5):399-408.
[43]刘净,于志斌,叶蕴华,等.马齿苋活性部位化学成分研究[J].天然产物研究与开发,2007,19(B11):398-399.
[44]呂锦锦,张靖柯,张贝贝,等.九蒸九晒熟地黄中的一个新生物碱[J].药学学报,2020,55(2):289-293.
[45]Yang BY,Xia YG,Wang QH,et al.Two new amide alkaloids from the flower of Datura metel L[J].Fitoterapia,2010,81(8):1003-1005.
[46]李凤琴,周琼,马林,等.延胡索化学成分的分离和结构鉴定[J].中国实验方剂学杂志,2019,25(1):211-216.
[47]Blanco OM,Castedo L,Villaverde MC.Alkaloids from Platycapnos spicata[J].Phytochemistry,1993,32(4):1055-1057.18C49ABA-9782-4F88-822B-A2BF43177231
[48]Ma Q,Wei R,Wang Z,et al.Bioactive alkaloids from the aerial parts of Houttuynia cordata[J].J Ethnopharmacol,2017,195:166-172.
[49]Wu PL,Hsu YL,Jao CW.Indole alkaloids from Cephalanceropsis gracilis[J].J Nat Prod,2006,69(10):1467-1470.
[50]Jao CW,Hung TH,Chang CF,et al.Chemical constituents of Phaius mishmensis[J].Molecules,2016,21(11):1605-1615.
[51]Toshiyuki M,Akinobu K,Tetsuo S,et al.Chemical constituents of two oriental orchids,Calanthe discolor and C.liukiuensis:Precursor indole glycoside of tryptanthrin and indirubin[J].Heterocycles,2001,54(2):957-966.
[52]徐志.靛紅杂合体在抗肿瘤领域的应用[J].国外医药:抗生素分册,2020,41(3):163-169.
[53]Pan K,Luo JG,Kong LY.Three new Lycopodium alkaloids from Lycopodium obscurum[J].J Asian Nat Prod Res,2013,15(5):441-445.
[54]刘丽,张笑敏,许浚,等.吴茱萸化学成分和药理作用及质量标志物(Q-marker)的预测分析[J].中草药,2020,51(10):2689-2702.
[55]李娜,张颖君,朱宏涛,等.普洱茶及其基原植物的化学以及优势微生物研究[J].世界科学技术-中医药现代化,2019,21(6):1173-1188.
[56]杨丹,祝颖,谷天瀑,等.7-甲基黄嘌呤为近视防控新发现[J].中国实用眼科杂志,2017,35(5):453-455.
[57]折改梅,陈可可,张颖君,等.8-氧化咖啡因和嘧啶类生物碱在普洱熟茶中的存在[J].云南植物研究,2007,29(6):713-716.
[58]翟金晓,高中勇,赛雅雯,等.液相色谱-串联质谱法同时测定饮料中的咖啡因、茶碱和可可碱[J].中国卫生检验杂志,2020,30(2):144-147.
[59]Tanaka H,Kuroda A,Marusawa H,et al.Structure of FK506,a novel immunosuppressant isolated from Streptomyces[J].J Am Chem Soc,1987,109(16):5031-5033.
[60]Vézina C,Kudelski A,Sehgal SN.Rapamycin(AY-22,989),a new antifungal antibiotic.I.Taxonomy of the producing streptomycete and isolation of the active principle[J].J Antibiot(Tokyo),1975,28(10):721-726.
[61]Kaneko I,Kamoshida K,Takahashi S.com
plestatin,a potent anti-complement substance produced by Streptomyces lavendulae.I.Fermentation,isolation and biological characterization[J].J Antibiot,1989,42(2):236-241.
[62]Matsuzaki K,Ikeda H,Ogino T,et al.Chloropeptins I and Ⅱ,novel inhibitors against gp120-CD4 binding from Streptomyces sp[J].J Antibiot(Tokyo),1994,47(10):1173-1174.
[63]Toda S,Kotake C,Tsuno T,et al.Eurystatins A and B,new prolyl endopeptidase inhibitors.Ⅱ.Physico-chemical properties and structure determination[J].J Antibiot,1992,45(10):1580-1586.
[64]Fusetani N,Matsunaga S,Matsumoto H,et al.Bioactive marine metabolites.33.Cyclotheonamides,potent thrombin inhibitors,from a marine sponge Theonella sp[J].J Am Chem Soc,1990,112(19):7053-7054.
[65]Gong KK,Tang XL,Liu YS,et al.Imidazole Alkaloids from the South China Sea Sponge Pericharax heteroraphis and Their Cytotoxic and Antiviral Activities[J].Molecules,2016,21(2):150.18C49ABA-9782-4F88-822B-A2BF43177231
[66]D.Chuck Dunbar,John M.Rimoldi,Alice M.Clark,et al.Anti-Cryptococcal and Nitric Oxide Synthase Inhibitory Imidazole Alkaloids from the Calcareous Sponge Leucetta cf chagosensis[J].Tetrahedron,2000,56(45):8795-8798.
[67]郑楠,赵明,田晓鑫,等.全球新型冠状病毒疫苗及治疗药物研发现状与趋势[J].中国新药杂志,2022,31(1):69-76.
[68]Kim KH,Tandi TE,Choi JW,et al.Middle East respiratory syndrome coronavirus(MERS-CoV) outbreak in South Korea,2015:epidemiology,characteristics and public health implications[J].J Hosp Infect,2017,95(2):207-213.
[69]Harbeson SL,Abelleira SM,Akiyama A,et al.Stereospecific synthesis of peptidyl alpha-keto amides as inhibitors of calpain[J].J Med Chem,1994,37(18):2918-2929.
[70]Cuerrier D,Moldoveanu T,Inoue J,et al.Calpain inhibition by alpha-ketoamide and cyclic hemiacetal inhibitors revealed by X-ray crystallography[J].Biochemistry,2006,45(24):7446-7452.
[71]Stein ML,Cui H,Beck P,et al.Systematic comparison of peptidic proteasome inhibitors highlights the α-ketoamide electrophile as an auspicious reversible lead motif[J].Angew Chem Int Ed Engl,2014,53(6):1679-1683.
[72]Runfeng L,Yunlong H,Jicheng H,et al.Lianhuaqingwen exerts anti-viral and anti-inflammatory activity against novel coronavirus(SARS-CoV-2)[J].Pharmacol Res,2020,156:104761.
[73]王林,杨志华,张浩然,等.连花清瘟治疗新型冠状病毒(2019-nCoV)肺炎网络药理学研究与初证[J].中藥材,2020,43(3):772-778.
(2021-07-09收稿 本文编辑:魏庆双)
基金项目:湖南省科学技术厅社会发展领域重点研发项目(2020SK3035)——2020年度创新型省份建设专项抗击新冠肺炎疫情专题项目;湖南中医药大学中药学一流学科项目(校行科字[2018]3号);长沙市科技计划项目(kh1902260)——蟾酥抗人乳头状瘤病毒的活性物质筛选及其医用产品的开发作者简介:苏雨婷(1998.04—),女,硕士研究生在读,研究方向:中药活性物质研究,E-mail:1026884926@qq.com
通信作者:李顺祥(1964.01—),男,博士研究生,教授,研究员,博士研究生导师,研究方向:中药药效物质基础与机制研究,E-mail:lishunxiang@hotmail.com;肖易倍(1984.06—),男,博士研究生,教授,博士研究生导师,研究方向:分子药理学与结构生物学研究,E-mail:xiao5273349@gmail.com18C49ABA-9782-4F88-822B-A2BF43177231

