嗅觉相关脑区神经突方向离散度与密度成像早期诊断帕金森病的价值
热米拉·玉山 肖 宁 刘存存 陆 鹏 王 红
新疆医科大学第二附属医院,新疆 乌鲁木齐 830011
嗅觉障碍是帕金森病(Parkinson’s disease,PD)最典型的非运动特征之一,也是帕金森病伴痴呆的预测特征[1]。它被作为PD 诊断的支持标准之一,早已纳入《MDS 帕金森病临床诊断标准》[2]中。多项研究表明,嗅觉障碍可能先于临床上明显的帕金森运动症状至少4 a出现,并且可存在于高达90%的早期PD 患者[3]。也有研究指出,嗅觉障碍在疾病典型运动症状出现之前即可发生并与患者疾病严重程度无关[4]。嗅觉检测方法大体分为主观和客观两种,其中磁共振成像作为一种客观定量检测方法,在PD的诊断及鉴别诊断中有重要价值。神经突方向离散度与密度成像(neurite orientation dispersion and density imaging,NODDI)作为一种新兴的磁共振成像技术,为神经突定向、弥散和密度的体内标测提供了可能。因此,利用NODDI 可以更深入了解帕金森病患者发生的特异性神经退行性改变。本研究拟应用NODDI 技术分析早期PD 组与健康对照组嗅皮质各脑区的微结构变化,探讨NODDI 技术对早期帕金森病患者的辅助诊断价值。
1 资料与方法
1.1 一般资料收集2020-05—2021-05 在新疆医科大学第二附属医院神经内科临床确诊的早期帕金森病患者30 例为PD 组,其中男16 例,女14 例,年龄49~72(62.30±7.01)岁。正常对照组均来自于同期体检健康者40 例,其中男22 例,女18 例,年龄50~70(60.15±6.29)岁。PD 组与正常对照组年龄(P=0.81,两独立样本t 检验)和性别(P=0.89,卡方检验)差异无统计学意义,具有可比性。
PD组纳入标准:经专科确诊为原发性帕金森病且Hoehn & Yahr(H-Y)分级Ⅰ~Ⅱ级患者(诊断采用英国帕金森病协会脑库制定的帕金森病临床诊断标准);无鼻腔或鼻窦疾病史,鼻科常规检查正常;患者能够配合完成研究内容。病例组和健康组的排除标准:有严重头部损伤、颅内手术、鼻腔手术、季节性过敏、鼻窦炎或其他当前呼吸道感染史、有影响嗅觉功能的其他疾病受试者。本研究受试者均已签署知情同意书,本次研究获得伦理委员会审查批准。
1.2 嗅觉测试采用简易嗅觉监察法:选用乙醇、酱油、香水、樟脑油、醋为测试物,水为对照物,装于颜色、样式完全相同的小瓶中。检查开始时受检者闭目,先堵住左侧鼻孔用右侧鼻孔嗅小瓶中的气味,小瓶置于距鼻孔下方1 cm处,接着让受检者说明名称并做好记录。然后用同样方法测左侧鼻孔嗅觉功能。每位受检者检查过程中有时间间隔,以避免出现嗅觉疲劳影响结果。受检者全部辨识正确为嗅觉正常,其余为有嗅觉障碍。本研究选择30例患者均有嗅觉障碍。
1.3 H-Y分级由于本研究重点探讨嗅觉相关脑区NODDI 参数值对帕金森病早期诊断的价值,因此采用Hoehn & Yahr 分级量表选择H-YⅠ~Ⅱ患者作为研究对象,其中H-YⅠ级14例,H-YⅡ级16例。
1.4 检查方法使用飞利浦3.0T MRI扫描仪,利用32 通道头部线圈对参与者进行扫描,用合适的衬垫以尽量减少头部活动。NODDI序列采用自旋回波平面成像扩散加权方案获得,该序列由2个b值沿前后相位编码方向的32个均匀分布方向组成。扫描参数为:b 值:1 000 s/mm2、2 000 s/mm2;TR:3 000;TE:80 ms;矩阵:128 mm×128 mm;FOV:230 mm×200 mm×119 mm;层厚:5 mm;总扫描时间:9 min。扫描范围:颅顶至小脑。
1.5 数据分析首先将MR 扫描得到的原始Dicom数据转化成FEL-NIFTI 格式,然后用Matlab R2013a软件利用NODDI编码执行图像处理得到神经突体积分数(intracellular volume fraction,VIC)图、神经突方向分散度(orientation dispersionindex,ODI)图。
1.6 感兴趣区分析感兴趣区的选取由2名具有丰富诊断经验的放射科主治医师采用双盲方法进行,3次测量取平均值。使用常规T1WI、T2WI 序列当作参考图,选取感兴趣区(所选感兴趣区为双侧海马、双侧杏仁核),然后在同一层面ODI 及VIC 图中经测量获得双侧海马、双侧杏仁核的ODI及VIC值(图1)。
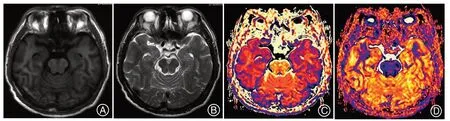
图1 Matlab R2013a软件利用NODDI编码执行得到的PD伴嗅觉障碍患者VIC、ODI。A:杏仁核及海马层面T1WI图;B:杏仁核及海马层面T2WI图;C:杏仁核及海马层面VIC图;D:杏仁核及海马层面ODI图。PD患者双侧海马、左侧杏仁核VIC值与对照组对比显著减低Figure 1 VIC and ODI maps of PD patients with dysosmia obtained by using NODDI coding with Matlab R2013a software.A:T1WI images of amygdala and hippocampus;B:T2WI images of amygdala and hippocampus;C:VIC map of amygdala and hippocampus; D: ODI map of amygdala and hippocampus. The VIC values of bilateral hippocampus and left amygdala in PD patients were significantly lower than those in the control group
1.7 统计学分析采用SPSS 22.0 统计学软件对数据进行统计学分析。计量资料比较使用t检验,计数资料比较使用卡方检验。在进行统计分析前,首先对2组资料进行正态性检验,本研究中获取的临床资料均呈正态分布,以均数±标准差(±s)表示。采用两独立样本t 检验比较PD 组与对照组相同脑区VIC和ODI 值;采用配对样本t 检验比较PD 组相同脑区左右侧VIC 和ODI 值、PD 组H-Y 分级Ⅰ与Ⅱ级VIC值及ODI值,以P<0.05为差异有统计学意义。用受试者工作特征(receiver operator characteristic,ROC)曲线评估参数的诊断价值,曲线下面积(area under the curve,AUC)越接近1.0准确性越高。
2 结果
2.1 PD组嗅皮质左右侧NODDI参数值比较帕金森病患者海马及杏仁核左右侧VIC、ODI值对比差异无统计学意义(P>0.05,表1)。
表1 PD组海马及杏仁核左右侧VIC、ODI值比较 (±s)Table 1 Comparison of VIC and ODI values in left and right sides of hippocampus and amygdala in PD group (±s)

表1 PD组海马及杏仁核左右侧VIC、ODI值比较 (±s)Table 1 Comparison of VIC and ODI values in left and right sides of hippocampus and amygdala in PD group (±s)
参数VIC ODI部位海马杏仁核海马杏仁核左侧0.418±0.035 0.431±0.030 0.468±0.028 0.426±0.033右侧0.415±0.031 0.428±0.022 0.459±0.027 0.425±0.044 t值0.352 0.396 1.220 0.053 P值0.726 0.693 0.227 0.958
2.2 PD组与对照组NODDI参数值比较帕金森病患者双侧海马、左侧杏仁核VIC值较对照组降低(P<0.05,表2),帕金森病患者双侧海马与杏仁核ODI 值与对照组相比差异无统计学意义(P>0.05,表3)。
表2 PD组与对照组VIC值比较 (±s)Table 2 Comparison of VIC values between PD group and control group (±s)

表2 PD组与对照组VIC值比较 (±s)Table 2 Comparison of VIC values between PD group and control group (±s)
部位左侧杏仁核右侧杏仁核左侧海马右侧海马病例组0.431±0.030 0.428±0.022 0.418±0.035 0.415±0.031对照组0.452±0.024 0.440±0.035 0.459±0.043 0.451±0.033 t值—3.846—1.613—4.265—4.590 P值<0.001 0.111<0.001<0.001
表3 PD组与对照组ODI值比较 (±s)Table 3 Comparison of ODI between PD group and control group (±s)

表3 PD组与对照组ODI值比较 (±s)Table 3 Comparison of ODI between PD group and control group (±s)
部位左侧杏仁核右侧杏仁核左侧海马右侧海马病例组0.426±0.033 0.425±0.044 0.468±0.028 0.459±0.027对照组0.437±0.043 0.444±0.047 0.483±0.040 0.474±0.033 t值—1.115—1.662—1.827—1.874 P值0.269 0.101 0.072 0.065
2.3 PD组H-Y Ⅰ级与H-Y Ⅱ级海马及杏仁核NODDI 参数值比较PD 组H-YⅠ级与H-YⅡ级海马及杏仁核VIC 值、ODI 值比较差异无统计学意义(P>0.05,表4)。
表4 PD组海马及杏仁核NODDI参数值 (±s)Table 4 NODDI parameter values of hippocampus and amygdala in PD group (±s)
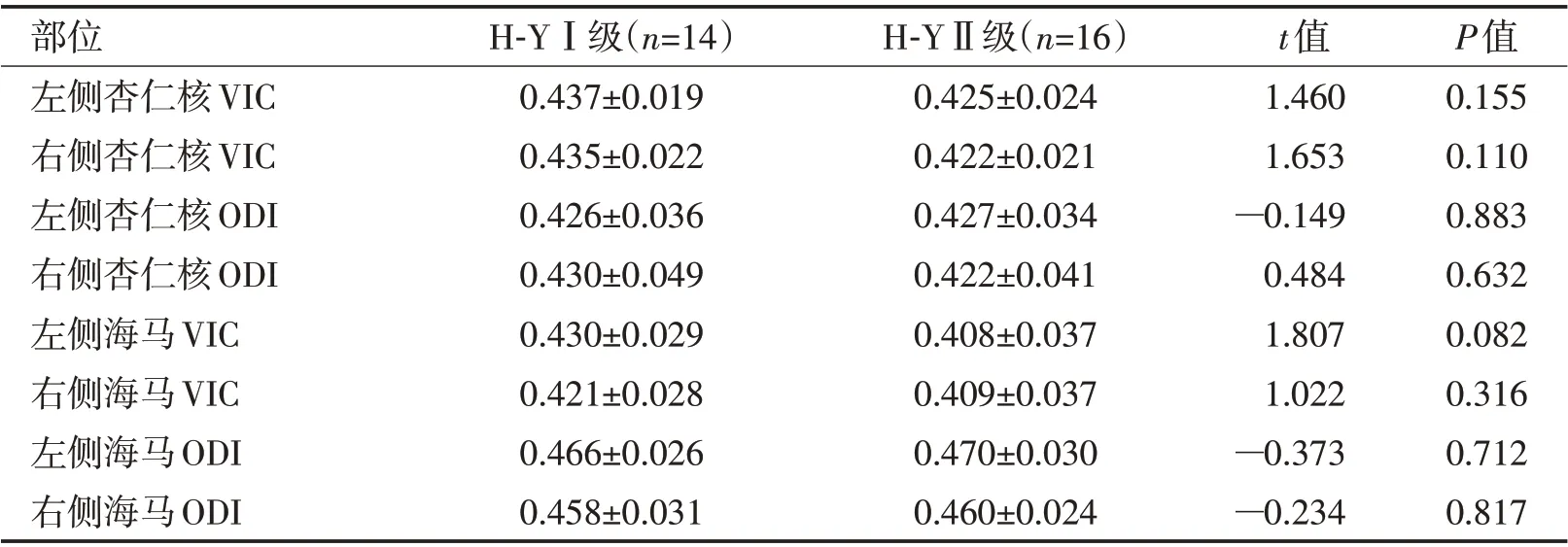
表4 PD组海马及杏仁核NODDI参数值 (±s)Table 4 NODDI parameter values of hippocampus and amygdala in PD group (±s)
部位左侧杏仁核VIC右侧杏仁核VIC左侧杏仁核ODI右侧杏仁核ODI左侧海马VIC右侧海马VIC左侧海马ODI右侧海马ODI H-YⅠ级(n=14)0.437±0.019 0.435±0.022 0.426±0.036 0.430±0.049 0.430±0.029 0.421±0.028 0.466±0.026 0.458±0.031 H-YⅡ级(n=16)0.425±0.024 0.422±0.021 0.427±0.034 0.422±0.041 0.408±0.037 0.409±0.037 0.470±0.030 0.460±0.024 t值1.460 1.653—0.149 0.484 1.807 1.022—0.373—0.234 P值0.155 0.110 0.883 0.632 0.082 0.316 0.712 0.817
2.4 ROC曲线 据上述研究结果绘制嗅皮质VIC值ROC曲线(图2),左侧海马、右侧海马、左侧杏仁核VIC值AUC分别为0.761、0.778、0.748,均>0.7,提示嗅皮质VIC值对帕金森病的诊断具有一定的价值。
3 讨论
人的嗅觉信息是从嗅觉上皮传递到嗅球,嗅球又通过嗅觉神经投射到初级嗅觉皮质,然后次级嗅皮质接受初级嗅皮质投射的嗅觉信息并进一步处理,投射到杏仁核复合体[5]、海马及海马旁回进行信息整合而产生[6-7]。目前,PD 嗅觉功能障碍的机制尚不明确。BRAAK等[8]提出帕金森病病理过程最初由延髓和嗅球开始并在这些区域出现路易小体沉积,嗅觉功能的障碍与路易体沉积有关。神经影像学研究报道,这种嗅觉缺陷可能与嗅觉相关脑区的萎缩相关[9]。也有学者提出PD患者嗅觉障碍与壳核多巴胺周转有相关性[10]。近期一项研究[11]显示,早期PD患者脑脊液中总Tau蛋白和磷酸化Tau蛋白与α-突触核蛋白比值、C反应蛋白水平增高,或许这些变化也会对患者嗅觉功能产生一定影响。但通过大量研究可以确定的是,通过使用嗅觉测试定量评估嗅觉减退的水平预测帕金森病的发作是可以实现的[12]。
扩散张量成像技术(diffusion tensor imaging,DTI)作为目前普遍应用的扩散磁功能成像技术,可用来测量白质纤维束的完整性。既往研究运用DTI 技术观察PD 伴嗅觉障碍患者嗅觉相关脑区破坏情况,发现PD 患者嗅觉中枢白质纤维束的完整性是有破坏的[13],但研究发现FA 的 变 化 是 非 特 异 性 的[14]。NODDI 作为一种新兴的技术,它的开发为神经突定向、弥散和密度的体内标测提供了可能。NODDI是一种多室扩散成像模型,区分了3种显微结构环境,包括细胞内、细胞外和脑脊液室,使得它对神经突密度及方向离散度具有高灵敏度及特异度,因此可提供比标准DTI指数提供的数据更具体的神经元数据[15]。NODDI有3个常用的标量参数[16]:VIC、ODI 及脑脊液体积分数(isotropic volume fraction,Viso)。NODDI的测量能够更好地描述白质和灰质的微观变化:白质中的ODI增加反映了轴突缺失或破坏,而灰质结构中的ODI和VIC减少反映了树突变薄。
本研究利用NODDI 技术对PD 患者与正常对照组双侧海马、双侧杏仁核VIC 及ODI 值进行对比,双侧海马、左侧杏仁核VIC值与对照组对应脑区VIC值之间差异有统计学意义(P<0.05)。
VIC 和ODI 可以描述体素中细胞外游离水去除后轴突和树突的生物学微结构。KAMAGATA等[17]的研究显示,与对照组相比,PD 患者额叶、颞叶、边缘系统的皮质显示出VIC显著降低。本研究也出现了类似的结果,提示帕金森病患者嗅皮质中神经元出现损伤。PD患者嗅皮质VIC值降低可能是由于患者神经系统发生的多巴胺能神经元进行性缺失、α-突触核蛋白胞质内聚集、多种因素导致小胶质细胞的异常激活等复杂变化,引起这些区域神经元变性即树突、轴突变薄,密度减低。嗅皮质中神经细胞体积的缩小或数量减少最终影响患者的嗅觉功能。本研究还发现,PD 组H-YⅠ级与H-YⅡ级患者海马及杏仁核VIC 值、ODI 值差异均无统计学意义(P>0.05),提示嗅觉相关脑区神经元的结构变化与病情的严重程度之间无相关性。同时,对PD患者双侧海马、左侧杏仁核VIC 值进行ROC 曲线分析,结果显示,左侧海马、右侧海马、左侧杏仁核VIC 值AUC 分别为0.761、0.778、0.748,均>0.7 且<0.9,提示其可作为帕金森病早期的生物标志物,对PD的早期诊断提供一定的辅助依据。
本研究也存在以下不足之处:(1)受多种客观因素限制,样本容量偏小;(2)未评估帕金森病不伴嗅觉障碍组嗅皮质微结构变化。因此,在往后的研究中需要加以改进,优化设计,提高数据可信性。
本研究说明NODDI参数有助于加深对帕金森病嗅觉障碍发生机制的理解,可以对帕金森病早期诊断提供客观的辅助依据。

