产胡萝卜素酵母菌的筛选
刘 悦, 王立达, 兰 英, 李青超, 刘 洋, 赵秀梅, 杨 莹
(黑龙江省农业科学院 齐齐哈尔分院,黑龙江齐齐哈尔161006)
类胡萝卜素作为一类天然色素, 其种类包括α-胡萝卜素、隐黄质、番茄红素、叶黄素、玉米黄素、β-胡萝卜素等(沈雯等,2021)。 经过长期研究表明,类胡萝卜素具有很多生物活性,比如抗氧化作用、预防癌症、抗辐射、延缓衰老等,同时其可作为维生素A 的前体(包怡红等,2020)。 植物中分布的类胡萝卜素最为广泛, 因此人们常常通过摄食蔬菜和水果来满足自身对类胡萝卜素的需求。
目前仅仅依靠天然类胡萝卜素远远不能满足人们的需求。 我国研究了利用化学合成法来生产胡萝卜素, 但是这种方法不仅成本高而且技术复杂, 合成出来的胡萝卜素不能满足人们对其成分的要求。 而利用微生物发酵生产胡萝卜素有很大的应用前景, 并且酵母菌发酵产胡萝卜素有许多优势,例如:营养要求低、发酵期短、菌体营养丰富、发酵条件易于控制等(吴园园等,2020;马田等,2019;孙玉敬等,2012)。 近年来, 在研究利用微生物生产类胡萝卜素方面越来越多样化,除了经常用的三孢布拉霉菌、红酵母之外,还有环黑星霉、环孢霉也可以用于生产类胡萝卜素, 目前对其他菌种的合成研究还是比较少, 对其生物合成的遗传学研究也鲜见报 道 (Saini 等,2017;Hernández-Almanza 等,2016)。 因此需要进一步探索和开发合成胡萝卜素的方法。 本研究从土壤中筛选胡萝卜素高产的酵母菌株, 用定量分析的方法确定胡萝卜素的产量,并对摇床发酵条件进行初步优化,为今后胡萝卜素的生产提供科学依据。
1 材料与方法
1.1 供试材料 土样采集于黑龙江省农业科学院齐齐哈尔分院科研试验基地园区中的土壤。
1.2 试验试剂及培养基 以下培养基配方中所用试剂均购于国药集团化学试剂有限公司。
沙氏培养基:称取7.5 g 的沙氏培养基溶解到含有150 mL 蒸馏水的搪瓷缸内,加热煮沸,待冷却后,分装入250 mL 锥形瓶内,各装30 mL,115 ℃,灭菌15 min。
PDA 培养基:称取34.5 g 的PDA 培养基溶解到含有750 mL 蒸馏水的搪瓷缸内,加热煮沸,待冷却后,分装入500 mL 的锥形瓶中,115 ℃,灭菌15 min。
SDAY 培养基: 称取60 g 的SDAY 培养基溶解到含有750 mL 蒸馏水的搪瓷缸内,加热煮沸,待冷却后,分装入500 mL 的锥形瓶中,121 ℃,灭菌20 min。
斜面培养基: 称取4.6 g 的PDA 培养基溶解到含有100 mL 蒸馏水的搪瓷缸内,加热煮沸,待冷却后,分装入10 支试管内,每个试管中加入5 mL,121 ℃,灭菌20 min。
YPD 培养基: 称取2 g 葡萄糖,2 g 蛋白胨,1 g酵母浸粉溶解到含有100 mL 蒸馏水的搪瓷缸内,加热煮沸,待冷却后,分装入250 mL 的锥形瓶中, 每个锥形瓶中放入30 mL 培养基,121 ℃,灭菌20 min。
1.3 试验方法
1.3.1 采集样品 本试验样品来源于营养丰富、微生物较多的土壤。根据土壤营养的丰富程度,采集地表下10 ~ 15 cm 处的样品。
1.3.2 富集培养 在无菌操作台中, 取5 g 的土壤样品置于含有50 mL 无菌水和十几个玻璃珠的250 mL 锥形三角瓶中, 振荡10 min 后静置片刻,取悬浮液5 mL 接种于沙氏液体培养基,将培养基放入到28 ℃,150 r/min 的摇床中,进行富集培养24 h。
1.3.3 稀释涂布与划线分离 将富集培养过的原始菌液梯度稀释,并均匀涂布在PDA 和SDAY 培养基表面,在生化培养箱中生长3 ~ 5 d 后,将平板中的红色或橙红色、 橙黄色的菌落进行划线分离。
1.3.4 种子培养与摇瓶发酵培养 在无菌操作台中, 挑取划线分离的单菌落接种到含有30 mL YPD 液体培养基的250 mL 锥形瓶中, 培养的温度为28 ℃, 摇床速度为150 r/min, 培养至对数期。 达到对数期的菌株以10%的接种量接种到含有30 mL YPD 液体培养基的250 mL 锥形瓶中,在28 ℃,150 r/min 的条件下,发酵培养72 h。
1.3.5 酵母菌生物量的测定 将发酵培养后的菌液分装到10 mL 的离心管(m)中。4000 r/min 离心15 min,弃去上液清,然后用无菌水洗涤菌体沉淀两次, 并在50 ~ 60 ℃下干燥至恒重, 称量重量M。 求得酵母菌生物量W,公式如下:
W/(g/L)=(M-m)×100。
1.3.6 胡萝卜素的抽提 参考Kim (2010) 的方法。 将二甲基亚砜在55 ℃水浴中预热5 min,向离心洗涤后的菌体中加入10 mL 预热后的二甲基亚砜, 在65 ℃的水浴锅中进行20 min 破壁处理,期间每3 min 用漩涡振荡器一次,以增强破壁效果。 然后加入二甲基亚砜3 倍量的丙酮(30 mL),黑暗中提取30 min,并每隔5 min 用漩涡振荡器振荡。然后4000 r/min 离心15 min。收集色素上清液,重复提取过程直至菌体变为白色。
1.3.7 胡萝卜素的定性、 定量分析 采用分光光度法将色素浸提液在380 ~ 700 nm 波长下进行全波长扫描,确定最大吸收波长,并对该菌种特征吸收峰进行光谱分析。 开始波长700 nm,结束波长380 nm,扫描速度中速。 总胡萝卜素含量的测定参考马家丽(2015)方法进行计算。
总胡萝卜素含量/(μg/g)=(A×D×V)/0.16m;
式中:A 为总胡萝卜素最大吸收波长下的吸光度;D 为测定试样时的稀释倍数;V为提取所用溶液的体积,mL;0.16 为胡萝卜素的摩尔消光系数,L/mg;m为酵母菌的菌体质量,g。
胡萝卜素产量/(mg/L)=生物量(g/L)×胡萝卜素含量(mg/g)。
采用高效液相色谱技术, 根据不同组分及标准品的保留时间与光谱吸收值相结合的方法对色素提取液进行定性与定量分析。色素提取液进样前需用0.45 μm 的微孔滤膜去除杂质; 流动相:A:90%乙腈;B:100%乙酸乙酯;梯度洗脱:0 ~ 5 min,B 从0 升至50%;5.01 min,B 升至53%;5.01 ~l0 min,B 保 持 在53%;10 ~ 15.01 min,B 升 至54%;15.01 ~ 20 min,B 升至55%;20.01 min,B 升至56%;20.01 ~ 30 min,B 从56%升至57%;30 ~35 min,B 降为0;流速l mL/min;进样量20 μL;检测波长450 nm(周鲜娇等,2009)。 标准品测定方法同上。
1.3.8 培养基无机盐组分单因素试验设计 取一环活化过的单菌落接种到含有30 mL YPD 液体培养基中,培养温度为28 ℃,摇床转速为150 r/min,振荡培养至对数期,将达到对数生长期的菌种以10%的接种量接种到含有30 mL YPD 液体培养基中,分别添加不同浓度的KH2PO4(0.3、0.4、0.5、0.6、0.7 g/L), MgSO4(0.2、0.3、0.4、0.5、0.6 g/L),NaCl (0.1、0.15、0.2、0.25、0.3g/L)(唐 棠 等,2011),振荡培养72 h。
1.3.9 正交试验优化设计 根据无机盐的单因素试验,KH2PO4、MgSO4、NaCl 对酵母菌发酵胡萝卜素有影响,且影响均为正效应。以基础的培养液为对照,采用三因素三水平的正交试验设计方案(表1),进一步优化培养基组成(马歌丽等,2015)。
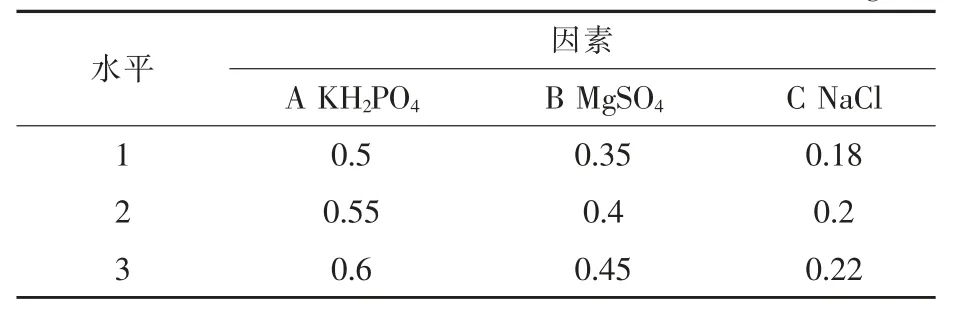
表1 正交试验g/L
1.4 数据统计与分析 利用SPSS 20 对数据进行处理分析。
2 结果与分析
2.1 菌种筛选的结果
2.1.1 菌种在PDA 培养基上的菌落形态 总共采集35 个土样,经过筛选、观察、分离纯化,在培养基上划线分离培养后的菌落形态, 总共得到7种酵母菌,菌落颜色及形态如表2。

表2 酵母菌在PDA 培养基上的菌落形态
2.1.2 酵母菌显微结构图 图1 为酵母菌制片在100×倍显微镜下观察的结果,可以看出酵母菌的细胞较大,并且均处于出芽状态,这是典型的酵母菌的细胞结构。

图1 酵母菌显微结构图
2.2 采用分光光度法对类胡萝卜素进行光谱测定 由图2 可知, 在490 nm 处有一个最高的吸收峰,其两侧还有两个吸收峰,出现胡萝卜素典型的三指吸收峰。 因此得出所筛选的7 种酵母菌株所产色素为胡萝卜素,并且其中有一种为β-胡萝卜素。 从表3 中可以看出所筛选菌株编号为21-1、33-2、22-1、27-1、25-1、17-1、25-2,产量分别为7.42、7.28、7.26、7.08、6.30、5.53、3.28 mg/L。 其中产量最高的菌株,编号为21-1,产量为7.42 mg/L。
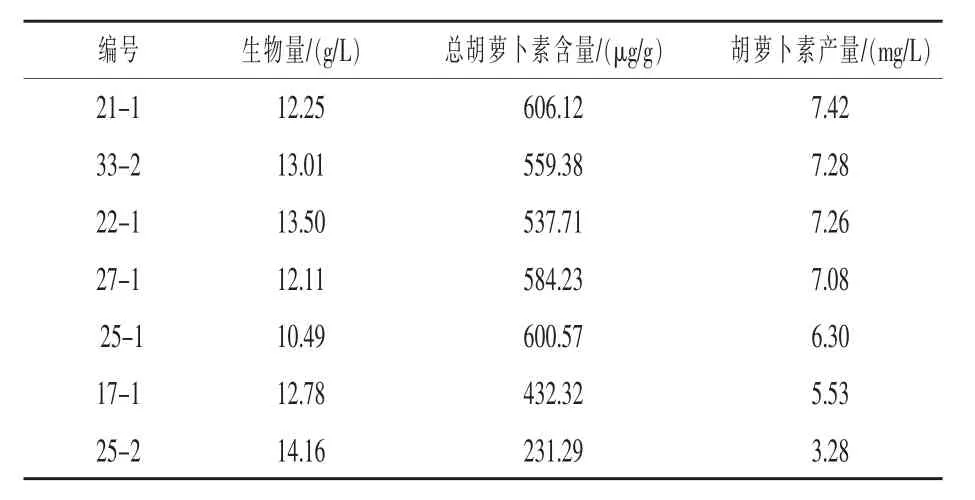
表3 胡萝卜素产量
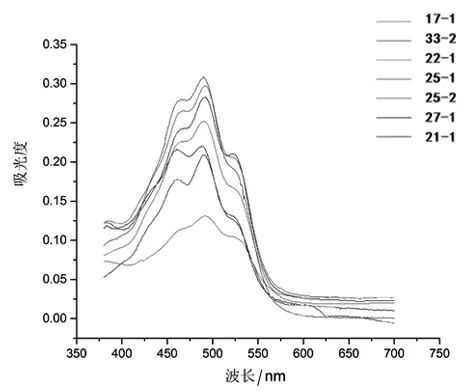
图2 提取色素的扫描光谱
2.3 无机盐对酵母菌产胡萝卜素的影响
2.3.1 无机盐组分单因素对酵母菌产胡萝卜素的影响 为提高胡萝卜素的产量, 对筛选出的编号21-1 的酵母菌培养条件进行优化。 以YPD 为基础培养基并作空白对照, 分别添加不同浓度的无机盐,结果表明,随着KH2PO4质量浓度的增加,胡萝卜素的产量呈先上升后下降的趋势,在KH2PO4质量浓度为0.6 g/L 时, 胡萝卜素的产量达到最大,产量值为8.23 mg/L。 对于无机盐Mg-SO4的添加结果发现, 随着MgSO4质量浓度的增加, 胡萝卜素的产量呈先上升后下降的趋势,在MgSO4质量浓度为0.4 g/L 时,胡萝卜素的产量达到最大,产量值为7.72 mg/L。而对于添加NaCl 的结果表明,随着NaCl 质量浓度的增加,胡萝卜素的产量呈先上升后下降的趋势,在NaCl 质量浓度为0.2 g/L 时,胡萝卜素的产量达到最大,产量值为7.61 mg/L(图3)。
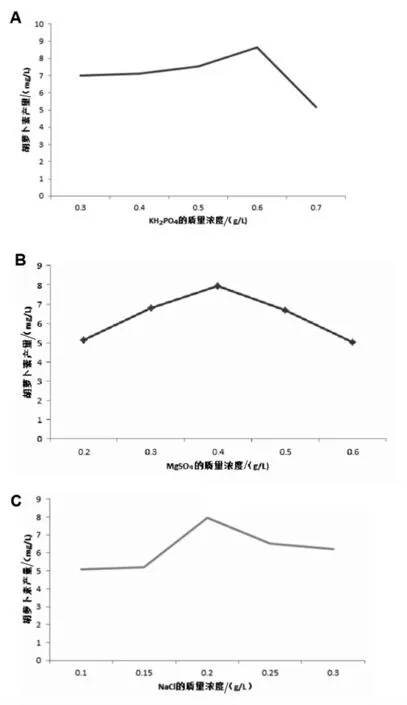
图3 无机盐对酵母菌产胡萝卜素的影响
2.3.2 正交试验对酵母菌产胡萝卜素的影响 在单因素试验的基础上,选取最大产量质量浓度的无机盐0.6 g/L 的KH2PO4;0.4 g/L 的MgSO4;0.2 g/L的NaCl,以这三个浓度的无机盐为中心点,各无机盐取三个浓度进行正交试验。
正交试验结果表明, 三种无机盐对胡萝卜素的产量影响顺序为A>C>B, 即KH2PO4是影响酵母菌生产胡萝卜素的主要因素, 其次为NaCl,最后是MgSO4。从表4 中可以看出,胡萝卜素的最高产量为8.55 mg/L, 其相应的各因素组合为A1B2C2, 即0.5 g/L KH2PO4、0.4 g/L MgSO4、0.2 g/L NaCl。 这时与最初的酵母菌产量相比较, 提高了15.3%。
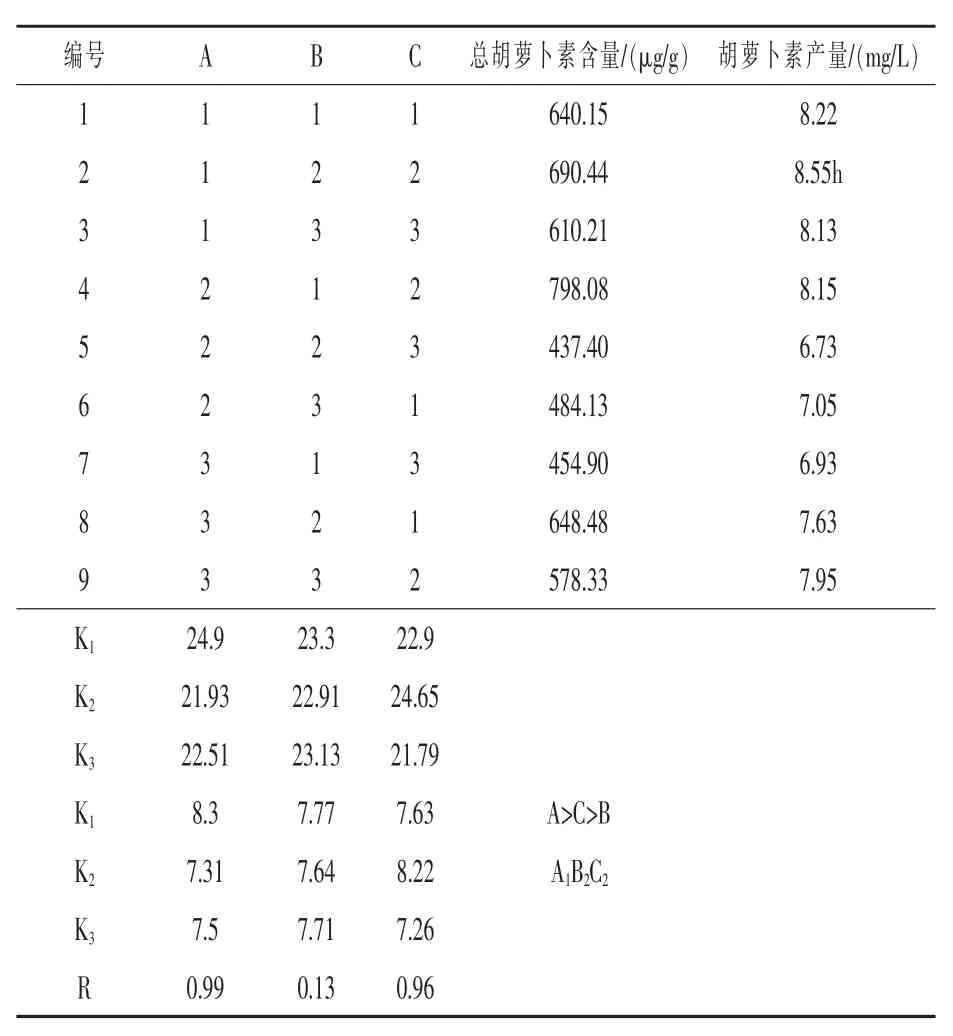
表4 正交试验结果与分析
2.4 高效液相色谱法测定类胡萝卜素组分与含量 由图4 可知,β-胡萝卜素标准品的出峰时间为13.335,所筛选菌种的产物中有一种组分在此附近都有出峰, 因此确定产物中有一种是β-胡萝卜素。根据出峰面积可以看出β-胡萝卜素产量,按从高到低依次是25-1、21-1、27-1、25-2、17-1、22-1。
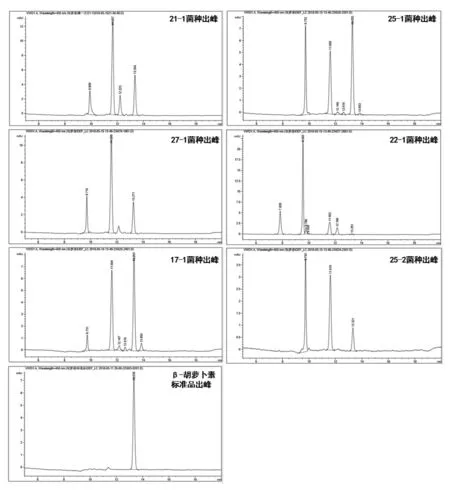
图4 各菌株的类胡萝卜素组分与含量
3 讨论
胡萝卜素作为一种天然色素, 已经广泛应用于多个领域。经过长期研究它的生物活性,了解到其功能对人体会产生大量的益处。 但是天然胡萝卜素远远不能满足我国人口的需求, 所以需要通过其他方法进行批量生产胡萝卜素。 本试验探讨的是,通过酵母菌生产胡萝卜素。酵母菌细胞形态一般呈现圆形、球形及圆柱形等,多数呈出芽繁殖(马伟东等,2020)。本研究经分离纯化筛选出7 株酵母菌,菌株颜色较多偏红色,菌株形态以圆形为主,结合显微镜观察结果发现,酵母菌细胞处于出芽状态,这是典型的酵母菌的细胞结构。
采用分光光度法对类胡萝卜素进行光谱测定发现,在490 nm 处有一个最高的吸收峰,其两侧还有两个吸收峰,出现胡萝卜素典型的三指吸收峰,得出所筛选的7 种酵母菌株所产色素为胡萝卜素。 这与刘月英(2000)研究结果类似,利用分光光度法对胡萝卜素吸收峰测定,并与标准品进行对照,同时也发现酵母菌株吸收光谱的测定与菌株的培养条件以及色素提取、测定条件密切相关。 另外,在研究无机盐组分单因素对酵母菌产胡萝卜素的影响中发现,随着KH2PO4质量浓度的增加,胡萝卜素的产量逐步提高,在0.6 g/L 时到达最大,然后产量会发生骤减。 产生这种现象的原因可能是KH2PO4质量浓度太高,破坏了细胞的渗透压,有部分酵母菌可能发生死亡(吴雪君等,2020)。 此外研究结果发现,无机盐KH2PO4对酵母菌产胡萝卜素的影响最为明显,MgSO4、NaCl 其次。徐军(2003)在研究无机盐对青霉PT95 菌株产类胡萝卜素影响时发现, 无机盐KH2PO4的添加对类胡萝卜素产量的影响效果最好。同时,三种无机盐正交试验结果发现,对发酵条件进行优化后, 与最初的酵母菌产量相比较, 提高了15.3%。 有研究表明无机盐KH2PO4、MgSO4、NaCl 的添加使酵母菌产胡萝卜素的产率提高,并且本研究影响因素的整体趋势与前人基本保持一致(叶双明等,2020;丁长河等,2019;张磊,2017;张颖鑫等,2010)。 另从所筛选出的菌株高效液相色谱图发现,与β-胡萝卜素标准品的液相色谱特征吸收峰比较,β-胡萝卜素标准品的出峰时间为13.335 min, 所筛选菌种的产物中有一种组分在此附近都有出峰,可以初步判定色素粗提液中含有β-胡萝卜素,后续试验将会继续验证,同时也会利用基因工程方法对筛选出的酵母菌进行基因敲除等研究,为今后胡萝卜素的开发与生产提供理论基础。
4 结论
本试验通过紫外扫描结果看出色素提取物具有胡萝卜素典型的三指吸收峰, 共筛选出7 株符合试验要求,筛选菌株所产生的色素为胡萝卜素。所筛选菌株编号为21-1、33-2、22-1、27-1、25-1、17-1、25-2, 产 量 分 别 为7.42、7.28、7.26、7.08、6.30、5.53、3.28 mg/L。 其中产量最高的菌株,编号为21-1,产量为7.42 mg/L。 对此菌株进行无机盐组分单因素试验和正交试验的初步优化, 优化后21-1 菌株胡萝卜素产量为8.55 mg/L, 相比初筛的菌种提高了15.3%。 将这7 株菌株产胡萝卜素的特征吸收峰与β-胡萝卜素标准品进行对比,发现所筛选菌种的产物中有一种组分色素粗提液中含有β-胡萝卜素,为获得具有开发应用价值的产胡萝卜素的酵母菌株奠定理论基础。

