碳青霉烯类耐药肺炎克雷伯菌染色体介导黏菌素耐药机制研究
张一琦,陈 欣,聂志妍,郑永贵,苏佳纯
肺炎克雷伯菌是医院感染最常见的病原菌之一,随着碳青霉烯类抗生素在临床上的广泛应用,我国碳青霉烯类耐药肺炎克雷伯菌(CRKP)的检出率逐年增加[1],且其感染已经对临床构成严重威胁。多黏菌素类抗生素(包括黏菌素、多黏菌素B)是一类从多黏芽孢杆菌培养液中提取得到的多肽类抗生素,对多数革兰阴性菌有抗菌作用,其耐药菌检出率较低,但目前有研究表明对多黏菌素的耐药率有增加趋势[2-3]。作为抗击多重耐药革兰阴性菌的“最后一道防线”,如何减少其耐药的发生就显得尤为重要。有文献报道,黏菌素在临床使用中可使CRKP出现染色体突变,从而介导对黏菌素耐药[4]。本研究通过体外黏菌素的选择性压力作用,获取对黏菌素的耐药突变株,并通过全基因组二代测序分析,研究其耐药的形成机制,为临床科学合理使用黏菌素、减少黏菌素耐药CRKP的传播和蔓延提供客观依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 药敏质控菌株为大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853,以及CRKP临床分离株(CRKP 12-130),均为复旦大学附属华山医院抗生素研究所冻存菌株。
1.1.2 仪器与试剂 细菌比浊仪(法国生物梅里埃公司)、ChemiDoc XRS+化学发光成像系统(美国Bio-Rad公司);Mueller Hinton(MH)琼脂和营养琼脂为英国OXIOD公司商品、阳离子调节MH肉汤(CAMHB)为美国BD公司商品,黏菌素标准品购自中国食品药品鉴定研究院。
1.2 方法
1.2.1 黏菌素自发耐药突变菌株的选择 将临床分离菌CRKP 12-130复苏后,取单个菌落接种到新平板上分区划线,从中挑取单个菌落接种至 5 mL MH肉汤培养37℃过夜,次日对菌液采用平板菌落计数法计算100 μL菌液所含菌落的数量作为初始菌落数。同时取100 μL CRKP 12-130菌液涂布于分别含2、4、8、16、32倍MIC黏菌素的MH琼脂平板,连续5 d观察不同黏菌素浓度的MH琼脂平板上CRKP 12-130菌株的生长情况。对不同黏菌素浓度平板上长出的菌落进行计数、编号,随机取50个菌落,并将其接种至不含黏菌素的新鲜MH琼脂平板,连续传代10次。
按美国临床和实验室标准化协会(CLSI)推荐的微量肉汤稀释法进行药敏测定及结果判读(MIC≥4 mg/L判定为对黏菌素耐药)[5]。通过计数细菌的初始总菌落数,以及黏菌素不同抗生素浓度下选择获得的耐药菌落数计算突变频率,计算公式为:突变频率=筛选平板上总菌落数×耐药率/初始菌落数。
1.2.2 突变株细菌基因组DNA提取和测序 随机取不同黏菌素MIC的CRKP 12-130耐药突变株40株,以及CRKP 12-130原始株,采用由天根生化科技(北京)有限公司生产的细菌基因组DNA提取试剂盒(DP302),按照说明书操作步骤,提取细菌基因组DNA;将基因组DNA采用Illumina二代测序平台进行测序,测序数据拼接后与黏菌素敏感肺炎克雷伯菌HS11286参考序列(GenBank序列号:NC_016845.1)进行比对,分析其耐药相关突变情况。
1.2.3mgrB基因PCR检测 根据二代测序分析结果,利用mgrB基因两翼序列(KPHS-33450和KPHS-33620)进行聚合酶链反应(PCR)引物设计(见图1),引物序列为mgrB-yz1-Fs:ata agc cac gct taa cca atc g与mgrB-yz1-Rs:cgc ctg aca tta acg cct tcg,PCR产物151 bp,以TaKaRa DL2000为DNA marker时mgrB基因缺失菌株的PCR产物会在100 bp与250 bp间出现条带;而无mgrB基因缺失的菌株由于两引物间超过15 kb,72℃延伸30 s扩增条件下将不会获得PCR产物。采用煮沸法制备细菌DNA模板。PCR反应体系总体积50 μL,包括DNA模板3 μL,相应上、下游引物各2 μL(10 μmol/L),PCR反应试剂Mix 25 μL,ddH2O 18 μL。PCR扩增条件94℃预变性5 min;94℃变性30 s;56℃退火30 s;72℃延伸30 s;共循环35次;72℃延伸5 min。
采用1%琼脂糖凝胶进行电泳,电泳后经SYBR GreenⅠ染色30 min后在ChemiDoc XRS+化学发光成像系统采集图像,分析菌株中mgrB基因发生变异的情况,如在100 bp与250 bp间出现PCR产物条带,表明受试菌株存在mgrB基因完全缺失。
2 结果
2.1 CRKP 12-130对黏菌素的耐药突变频率
通过平板菌落计数法计算出100 μL CRKP 12-130过夜培养菌液的初始菌落数为5.3×107CFU/mL。 涂布于含2倍MIC(0.5 mg/L)、4倍MIC(1 mg/L)、8倍MIC(2 mg/L)、16倍MIC(4 mg/L)、32倍MIC(8 mg/L)黏菌素药物浓度的MH琼脂平板,5 d后菌落计数结果显示2倍MIC平板上生长400个、4倍MIC平板上生长193个、8倍MIC平板上生长300个、16倍MIC平板上生长270个、32倍MIC平板上生长206个。
采用CLSI推荐的微量肉汤稀释法测定黏菌素对细菌的MIC,黏菌素对质控菌株大肠埃希菌ATCC 25922和铜绿假单胞菌ATCC 27853的MIC分别为 0.25 mg/L和0.5 mg/L,均在质控范围内;250株待测菌中,230株(92.0%)显示对黏菌素耐药。从含2倍、4倍、8倍、16倍、32倍MIC黏菌素的选择平板上获得细菌耐药的占比分别是66%、94%、100%、100%、100%;根据耐药突变菌落数和初始菌落数计算CKRP对黏菌素的耐药突变频率。见表1。
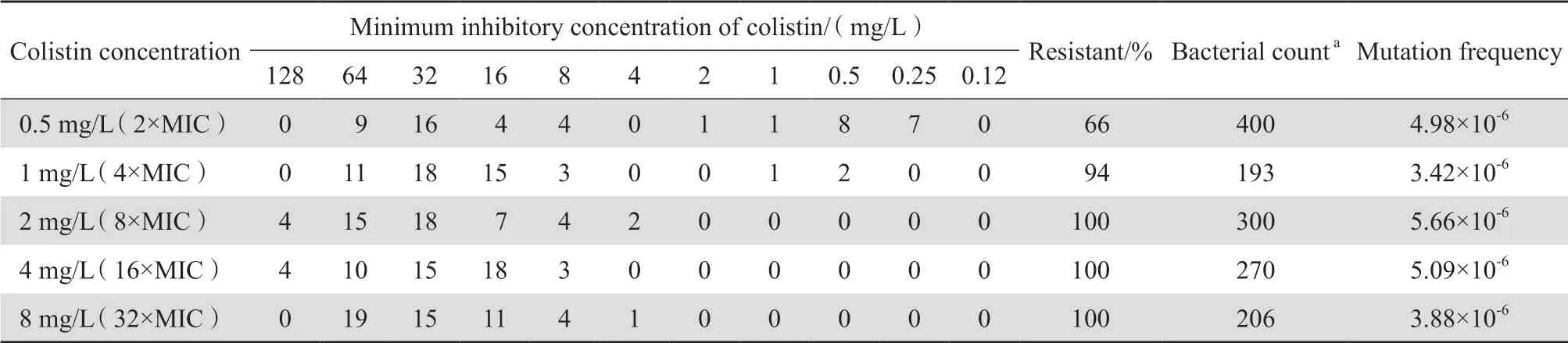
表1 不同黏菌素浓度平板上获得250株肺炎克雷伯菌菌株的药敏结果及耐药突变频率Table 1 Mutation frequency of colistin resistance and susceptibility of 250 strains of Klebsiella pneumoniae obtained on selective plate containing different concentrations of colistin
2.2 黏菌素耐药相关基因检测
本研究挑选了40株不同黏菌素耐药水平的CRKP进行全基因组二代测序,结果显示,15株菌株存在mgrB基因缺失,同时伴随mgrB基因两侧KPHS-33560和KPHS-33580序 列(GenBank序列号:NC_016845.1)的缺失。2株菌株存在mgrB基因位置相同的部分缺失突变。2株菌株的mgrB基因中出现了碱基的替换突变(G82C),并导致变异(Gly28Cys)。这些菌株的MIC值在16~128 mg/L,表现出高水平耐药。测序菌株的phoP、pmrA、pmrB基因均为野生型,未发生突变,见表2。
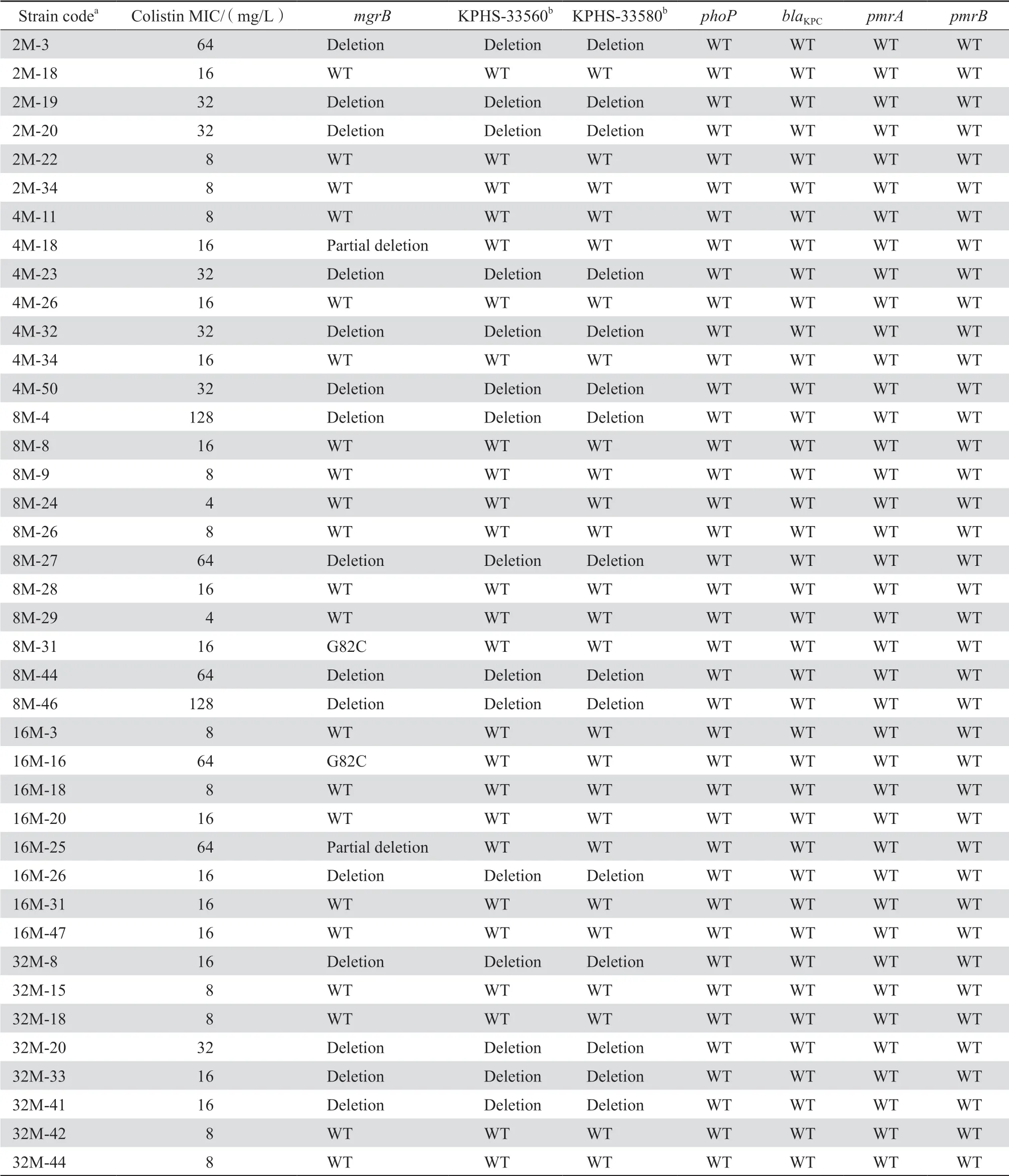
表2 黏菌素耐药突变菌株的全基因组二代测序分析结果Table 2 Genomic variation of colistin-resistant mutants by whole-genome second-generation sequencing analysis
通过PCR扩增及琼脂糖凝胶电泳,在230株从2倍、4倍、8倍、16倍和32倍MIC黏菌素选择平板上获得的黏菌素耐药CRKP菌株中分别有18株、21株、22株、15株、23株,在100 bp与250 bp间存在PCR产物条带,共计99株mgrB基因完全缺失菌株。
3 讨论
本研究将临床分离的CRKP通过微量肉汤稀释法测定其MIC,并通过含不同黏菌素浓度选择、计算CRKP菌株的突变株和突变频率,发现含8倍MIC(2 mg/L)黏菌素选择浓度中突变频率最高,为5.66×10-6,含16倍MIC(4 mg/L)和2倍MIC (0.5 mg/L)黏菌素选择浓度中突变频率次之,分别为5.09×10-6和4.98×10-6,含32倍MIC(5 mg/L)和4倍MIC(1 mg/L)黏菌素选择浓度中突变频率略低,分别为3.88×10-6和3.42×10-6。综上,表明肺炎克雷伯菌临床分离株在黏菌素暴露后易发生耐药相关突变,临床使用黏菌素进行肺炎克雷伯菌感染的治疗中有很大概率选择出耐药突变菌株,不同浓度黏菌素的选择压力下均可选择出耐药突变株,提示在黏菌素单药治疗期间需谨防耐药突变株出现。
我们在获得的黏菌素耐药株中挑选了40株,其MIC范围为4~128 mg/L,借助全基因组二代测序并结合生物学信息分析,发现此次耐黏菌素突变株中mgrB基因的缺失是最常见的突变。之前的研究显示,mgrB基因对PhoPQ双组分系统起着负反馈调节的作用[6]。当mgrB基因发生插入失活而无法正确表达时,PhoPQ双组分系统将过度表达,进而激活pmrHFIJKLM操纵子[7]。pmrHFIJKLM操纵子的产物能够合成4-氨基阿拉伯糖(L-Ara4N),通过在脂质A上添加正电荷,降低其与黏菌素的亲和力,而导致耐药[8]。同时,我们根据mgrB基因缺失耐药株两端存留序列设计引物,进行PCR扩增并电泳分析,结果显示有99株菌株在100 bp与250 bp间出现PCR产物条带,为mgrB基因缺失的菌株。上述结果可推测,本组资料显示的mgrB基因突变可能在多黏菌素耐药性产生中发挥了重要作用。
PhoP是PhoPQ双组分系统的组成部分,与pmrA和pmrB编码的pmrAB双组分系统共同调控L-Ara4N的合成和pmrHFIJKLM操纵子表达[9]。 有研究人员观察到肺炎克雷伯菌中phoP基因上单个氨基酸Asp191Tyr的改变将致使phoP基因非正常表达,进而导致耐药[7]。pmrA和pmrB基因的突变可能会引起pmrAB系统的激活,使pmrC和pmrHFIJKLM操纵子上移,促使阳离子基团添加到细菌脂多糖的脂质A上,进而形成对多黏菌素的耐药性[10]。本研究挑选不同黏菌素耐药水平的突变株进行耐药相关基因序列分析,结果显示phoP、pmrA、pmrB基因均为野生型,未发生突变,相较mgrB基因,phoPQ、pmrAB双组分系统在黏菌素选择压力下有更好的稳定性。
综上,CRKP菌株暴露于不同浓度黏菌素时,可快速选择出突变耐药株,推测临床使用黏菌素治疗CRKP感染时,细菌染色体可能发生变异,进而导致耐药及治疗失败;mgrB基因突变是导致CRKP对黏菌素耐药的主要机制,在使用黏菌素过程中应关注此类现象的发生,加强防范。此外,由于本研究测试菌株少,实验未进行多次重复等不足,后续将纳入更多临床分离株,开展进一步研究,明确此类耐药形成现象是否具有普遍性,为防控提供参考依据。

