历年《新型抗肿瘤药物临床应用指导原则》概况与变迁
藕顺龙 罗静 王松 宋饶 蒋倩
关键词新型抗肿瘤药物;指导原则;作用靶点;更新;变迁
肿瘤发病原因尚未完全阐明,治疗手段仍较局限,是世界人口死亡的主要原因之一[1]。全球癌症统计数据显示:2020 年全球恶性肿瘤新发病例1 929 万例、死亡病例996 万例[2]。肿瘤疾病负担的持续加重加速了肿瘤学科发展,以蛋白酶抑制剂、单克隆抗体和免疫检查点抑制剂类药物为主的新型抗肿瘤药物相继研发上市[3]。相比传统化疗药物,新型抗肿瘤药物普遍具有疗效更好、不良反应发生率更低、患者依从性更好等特征[4],但使用时需综合考虑药物可及性、患者治疗意愿和疾病预后三大要素。不合理的临床应用在造成药物疗效降低、副作用增加的同时,还会给患者造成严重的经济负担。
为规范新型抗肿瘤药物的合理应用、提高肿瘤临床治疗的用药水平、保障医疗质量和卫生资源的合理利用、维护肿瘤患者健康权益,国家卫生健康委员会牵头制定了《新型抗肿瘤药物临床应用指导原则》(后文简称《指导原则》),以指导新型抗肿瘤药物的临床合理应用[5]。本研究拟全面分析历年《指导原则》的变迁情况,重点剖析我国新型抗肿瘤药物的品种数量、适应证分类、医保纳入信息及我国原研新型抗肿瘤药品的发展状况,总结《指导原则》的变迁趋势及可能存在的问题,为后续《指导原则》的更新提供建议或参考。
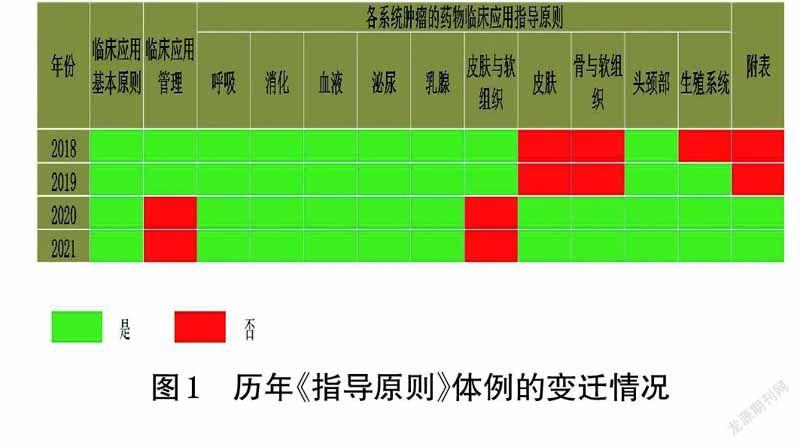
1 历年《指导原则》体例的变迁情况
2018 年9 月21 日,国家卫生健康委员会发布了关于印发《指导原则》的通知,并明确指示需定期修订、更新该原则。此后,于2019 年12 月16 日、2020 年12 月29日、2021 年12 月27 日,国家卫生健康委员会分别对该《指导原则》进行了更新[6-8]。
2018 年版《指导原则》从临床应用基本原则、临床应用管理、各系统肿瘤的药物临床应用指导原则3 个方面指导新型抗肿瘤药物的临床应用与管理。2019 年版《指导原则》延续了2018 年版的体例,仅在“各系统肿瘤的药物临床应用指导原则”项中增加了“生殖系统”。2020 年版《指导原则》的体例较前2 版则发生了较大变化:删除了“临床应用管理”项,增添了“附表”项,“皮肤与软组织”系统被拆分为“皮肤”和“骨与软组织”2 个系统。2021 年版《指导原则》延续了2020 年版的体例。历年《指导原则》体例变迁情况见图1。
2 历年《指导原则》中药品变迁情况
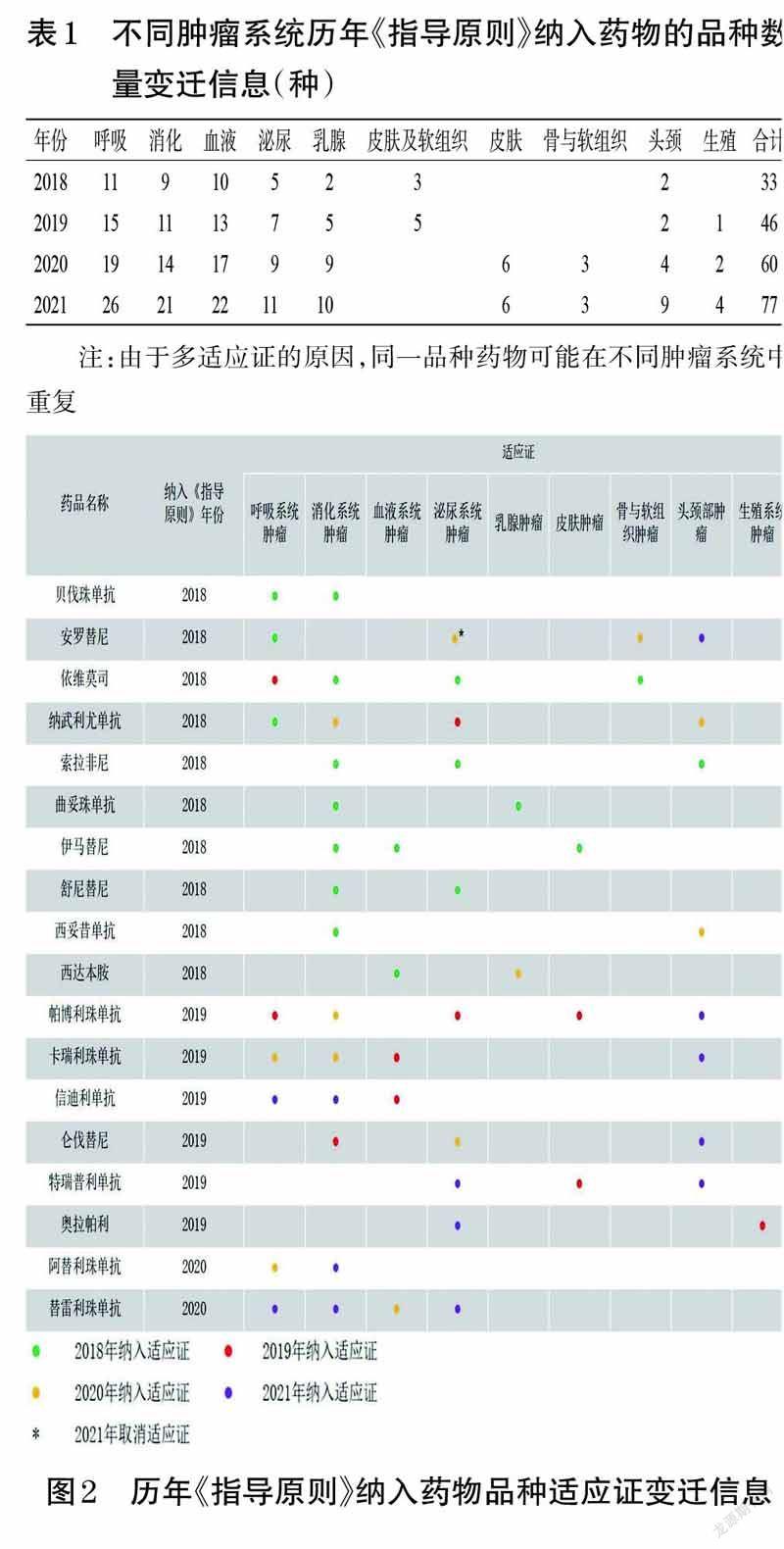
2.1 历年《指导原则》中新型抗肿瘤药物的品种数量及适应证变迁情况
2018 年版《指导原则》中纳入新型抗肿瘤药物的品种数为33 个,2019、2020、2021 年分别增加至46、60、77个。历年《指导原则》纳入的新型抗肿瘤药物的适应证均以相应年度的药品说明书为准,部分新型抗肿瘤药物的适应证覆盖了多个肿瘤系统,且同一品种药物的各适应证纳入《指导原则》的时间也不尽相同。其中,安罗替尼在2020 年版《指导原则》中新增了“晚期肾细胞癌高危患者一线治疗”的适应证,但又在2021 年版《指导原则》中取消。历年《指导原则》的药物品种数量及适应证的变迁情况充分体现了《指导原则》制定的动态性。历年《指导原则》纳入药物的品种数量变迁信息见表1,适应证变迁信息见图2。
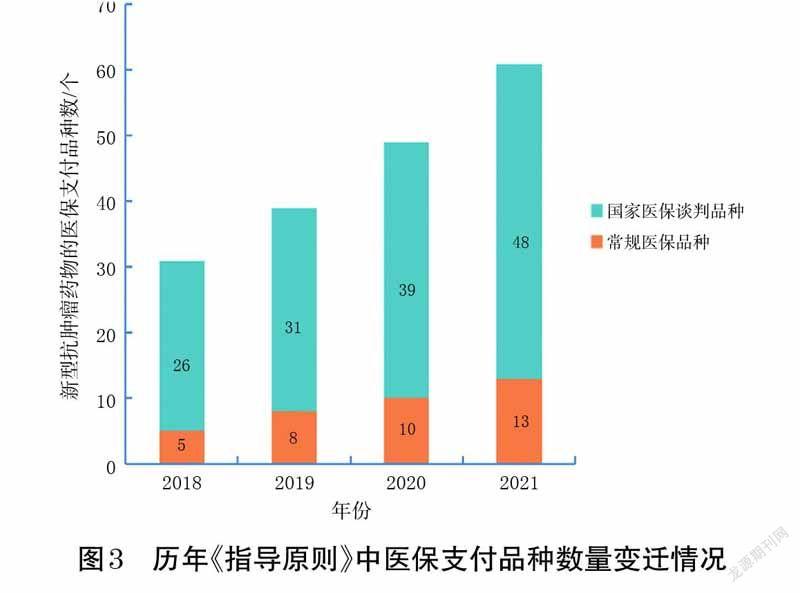
2.2 历年《指导原则》中新型抗肿瘤药物的医保支付品种数量变迁情况
分别以相应年度《国家基本医疗保险、工伤保险和生育保险药品目录》(后文简称《医保目录》)为基准,2018 年版《指导原则》纳入的新型抗肿瘤药物品种中常规医保品种有5 个,国家医保谈判品种有26 个;2019 年版《指导原则》中新增了8 个国家医保谈判品种,并有3个品种被调入常规医保目录;2020 年版《指导原则》中新增了10 个国家医保谈判品种,并有2 个品种被调入常规医保目录;2021 年版《指导原则》中新增了12 个国家医保谈判品种,并有3 个品种被调入常规医保目录。医保支付品种数逐年稳步增加,这受益于当前国家医保谈判工作趋于常态化的机制,同时也体现了国家医保基金对新型抗肿瘤药物的支持[9]。历年《指导原则》中医保支付品种数量变迁情况见图3。
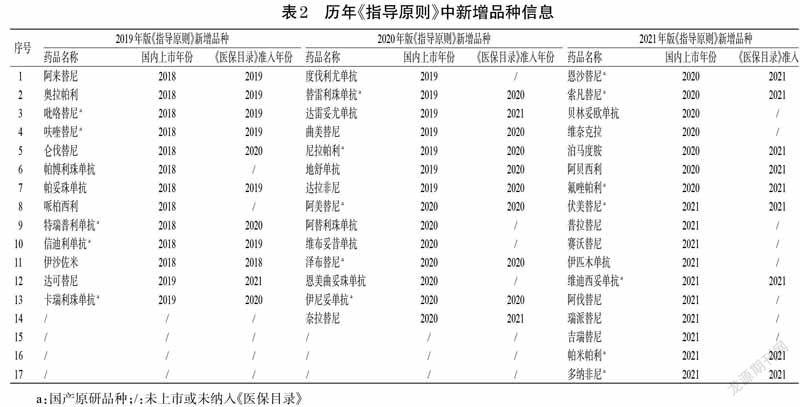
2.3 历年《指导原则》中新型抗肿瘤药物新增品种信息
2019 年版《指导原则》较2018 年版新增了13 个品种,其中包括国产原研品种5 个;2020 年版《指导原则》较2019 年版新增了14 个品种,其中包括国产原研品种5个;2021 年版《指导原则》较2020 年版新增了17 个品种,其中包括国产原研品种7 個。所有新增品种纳入《指导原则》的时间均为该品种在国内上市当年或上市后1 年,且国产原研药品种均在上市后就被及时纳入了《医保目录》。历年《指导原则》中新增品种信息见表2。
2.4 历年《指导原则》中新型抗肿瘤药物的作用靶点变迁情况
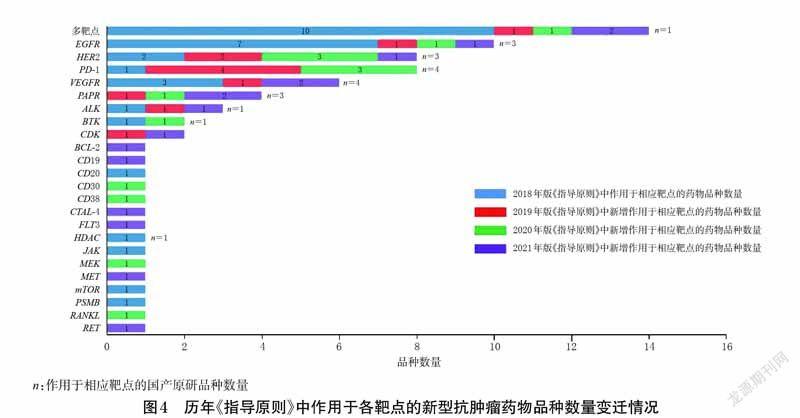
2018 年版《指导原则》中新型抗肿瘤药物主要作用于EGFR、HRE2、VEGFR 等传统靶点。自2019 年版《指导原则》起,作用于PD-1、PARP、ALK、CDK等新兴靶点的药物品种数不断增加,且国产原研品种占比较大。历年《指导原则》中作用于各靶点的新型抗肿瘤药物数量变迁情况见图4。
3 《指导原则》的变迁趋势及可能存在的问题
3.1 规范新型抗肿瘤药物的合理使用
2018、2019 年版《指导原则》主要包含“临床应用指导原则”和“临床应用管理”两大版块。其中,“临床应用管理”版块仅仅概述了新型抗肿瘤药物的临床管理,缺乏指导内容细则,对临床药学团队抗肿瘤药物临床管理的指导作用有限;且“临床应用管理”版块模糊了《指导原则》的定位,故此体例下的《指导原则》缺乏一定科学性。2020 年12 月22 日,国家卫生健康委发布了《抗肿瘤药物临床应用管理办法(试行)》,正式从行政决策层面瘤药物的临床管理,解决了既往抗肿瘤药物管理缺乏行政决策制度管理的漏洞[10-11]。同年,2020 年版《指导原则》删除了“临床应用管理”项,新增了“附表”项,旨在从卫生技术层面指导新型抗肿瘤药物的临床合理应用和特异性不良反应的预防和治疗。至此,行政决策服务于卫生技术,进一步规范了新型抗肿瘤药物的合理使用。
3.2 新型抗肿瘤药物的临床应用范围不断扩增
伴随着肿瘤学科和循证医学的快速发展,新型抗肿瘤药物及其新的适应证被不断批准上市,《指导原则》中新型抗肿瘤药物的临床应用范围不断扩大。其主要体现在:(1)《指导原则》纳入的药物品种数量稳步增加。2018 年版《指导原则》纳入品种33 个,随后骤增至2021年版的77 个,并且所有新增品种纳入《指導原则》的时间均为该品种在国内上市当年或之后1 年,做到了上市即纳入,可及时指导新上市新型抗肿瘤药物的临床合理使用。(2)新型抗肿瘤药物治疗覆盖癌种范围不断扩大。随着基因组学的不断进步,以及抗肿瘤药物作用靶点的发现和新型抗肿瘤药物的上市均呈现出“井喷式”现象,部分小癌种既往无特效治疗药品的情况逐渐改善。在历年《指导原则》的变迁中,作用于生殖、乳腺、软组织、头颈等肿瘤系统的新型抗肿瘤药物从无到有、从少到多,增加了临床在治疗方案上的选择性,并提高了小癌种患者对药物的可及性。(3)循证更新新型抗肿瘤药品适应证。由于部分新型抗肿瘤药物作用机制是恢复免疫系统活性、作用靶点分布于不同组织细胞中等原因,其可能拥有较广的抗瘤谱,且药品上市后部分适应证仍在临床研究中。如免疫检查点抑制剂卡瑞利珠单抗于2019 年5 月被国家药品监督管理局(National MedicalProducts Administration,NMPA)批准用于霍奇金淋巴瘤,而后续的研究又分别证实了其在食管癌、非小细胞肺癌和鼻咽癌患者的治疗中存在益处[12],且研究结果批准用于临床的时间与卡瑞利珠单抗在历年《指导原则》中适应证的更新时间一致,这充分体现了《指导原则》制定的科学性。
3.3 国产新型抗肿瘤药物的发展激励国产药品创新
长期以来,我国都是传统的仿制药大国,而非制药强国。但经过国家新药创制重大专项的支持,拥有完全自主知识产权的靶向抗肿瘤药物埃克替尼和阿帕替尼已经上市,这标志着我国靶向药物的研发进入了“中国创造”阶段[13]。截至2020 年1 月,我国共有821 种临床试验研究阶段的抗癌候选药物,其中“me-too 药物”404 种,一类新药359 种[14]。在历年《指导原则》新增品种中,国产原研品种数量越来越多,且主要作用于PD-1、PAPR等新型靶点。以2021 年版《医保目录》为准,所有纳入《指导原则》的国产原研新型抗肿瘤药物均被纳入了该版《医保目录》支付范围,这不仅降低了我国药品市场对进口药品的依赖,还极大地减轻了肿瘤患者的经济负担。国产原研新型抗肿瘤药物的不断上市和准入《医保目录》,激励了我国药品创新。
3.4 关注治疗药物缺乏的肿瘤类型及新型抗肿瘤药物的临床价值
2021 年版《指导原则》纳入的77 个新型抗肿瘤药物的适应证已覆盖了呼吸、消化、生殖等10 个肿瘤系统,但对于我国发病率较高的宫颈癌、膀胱癌等癌种,《指导原则》目前尚未纳入新型抗肿瘤药物进行用药指导,这提示《指导原则》制定专家组在后续《指导原则》的更新中应关注当前治疗药物缺乏的肿瘤类型;此外,卫生行政部门应积极推动治疗药物缺乏的肿瘤的药物研发工作,以未满足的肿瘤治疗需求推动药品研发创新[14]。肿瘤药物治疗证据更新迭代快,但当前《指导原则》纳入新型抗肿瘤药物的适应证仅参考了药品说明书,存在一定的滞后性。当现有药物不能满足肿瘤治疗的需求时,应参考国内外权威指南及高质量的循证证据[15],甄别纳入新型抗肿瘤药物超说明书用药适应证[16-17],及时提高肿瘤患者的药物可及性和用药合理性。
新型抗肿瘤药物显著延长了肿瘤患者的生存时间,但其特异性不良反应发生率高,且价格昂贵,这在一定程度上影响了其合理使用。2020 年版《指导原则》增添了“附表”项来指导特异性不良反应发生时的用药,这进一步规范了新型抗肿瘤药物的安全应用。但有研究发现,部分新型抗肿瘤药物的临床价值低,其高昂的价格并未创造相应的临床价值,甚至未创造临床价值[18]。而历年《指导原则》均未提及新型抗肿瘤药物治疗各类型肿瘤的价值大小,缺失了从安全性、有效性、经济性用药原则上综合指导临床合理用药的作用。这提示《指导原则》的后续更新可关注新型抗肿瘤药物治疗不同类型肿瘤的价值评分,降低治疗中的经济毒性,促进新型抗肿瘤药物安全、有效、经济的应用。
4 结语
历年《指导原则》体例的更新旨在进一步从卫生专业技术层面指导新型抗肿瘤药物的临床应用,新增品种、适应证符合科学性、动态性原则,国产原研品种发展迅速,作用于新兴靶点的创新品种涌现;但同时,宫颈癌、膀胱癌等癌种治疗药物缺乏,适应证的纳入存在一定的滞后性,且未提及药物治疗的价值。期待未来《指导原则》的更新参考国内外权威指南、高质量循证证据,综合性关注新型抗肿瘤药物的临床价值。

