灯盏花不同部位水浸提液对小麦和萝卜的化感效应
王田涛 关德军 周文忠 钟汝艳 李河 施娴



摘要:从化感作用角度筛选适宜与灯盏花进行间作、套作、轮作的农作物,从而为解决灯盏花连作障碍、建立合理的灯盏花间作、套作、轮作体系提供参考依据。采用水提法制备灯盏花根、茎、叶浸提液,每种浸提液设4个浓度梯度[0(CK)、0.05、0.10、0.15 g/mL],研究灯盏花不同部位水浸液对小麦(Triticum aestivum)和萝卜(Raphanus sativus)的化感效应。结果表明,灯盏花根、茎、叶水浸提液对小麦和萝卜种子萌发、幼苗生长、幼苗生理均有较强的化感作用,且化感作用强度随水浸提液浓度的增加而增强;灯盏花根、叶水浸提液对萝卜种子发芽势、发芽指数和苗长的影响均表现出低促高抑的双重效应;灯盏花各部位水浸提液对小麦、萝卜化感作用的排序分别为叶=茎>根、根>茎>叶;灯盏花根、茎、叶水浸提液对小麦、萝卜的综合化感指数均为负值,综合化感效应强度随着浓度的升高而逐渐增强。综合来看,小麦比萝卜更适宜与灯盏花进行间作、套作、轮作。
关键词:灯盏花;水浸提液;化感效应;种子萌发;幼苗生长
中图分类号: S567.23+9.04文献标志码: A
文章编号:1002-1302(2022)12-0252-08
收稿日期:2021-07-19
基金项目:国家自然科学基金(编号:81960684);云南省地方本科高校基础研究联合专项资金面上项目(编号:202101BA070001-056);2021年度云南省“三区”科技人才支持计划;红河学院大学生创新创业训练项目(编号:DCXL181061、DCXL200134)。
作者简介:王田涛(1986—),男,河南商丘人,博士,副教授,主要从事药用植物连作障碍研究。E-mail:wangtian19862003@163.com。
通信作者:施 娴,硕士,副教授,主要从事植物营养与环境研究。E-mail:shixiang841123@163.com。
灯盏花[Erigeron breviscapu (Vant.) Hand-Mazz)]是菊科多年生草本植物,别称灯盏细辛、东菊等,具有活血通络止痛、祛风散寒等功效[1],灯盏花乙素作为其主要活性成分,是治疗闭塞性脑血管疾病和脑溢血后遗症的天然特效药物[2]。灯盏花主要分布于云南省,其人工栽培面积和产量均占全国的95%以上[3]。灯盏花野生资源匮乏,目前主要通过人工栽培来满足市场的需求。灯盏花适生区域狭窄,且人工栽培连作障碍现象严重,栽培1年后,常采用换地栽培,严重影响了产业化发展。通过与其他作物间作、套作、轮作是目前缓解药用植物连作障碍的有效方法之一。植物化感效应是植物化感物质通过雨雾淋溶、自然挥发、根分泌、植株分解、种子萌发和花粉扩散等途径释放到环境中进而影响周围植物生长的现象,其中雨雾淋溶和自然挥发是植物化感物质释放的重要途径[4],其对利用作物间作、套作、轮作缓解药用植物连作障碍具有指示作用。因此,研究灯盏花对农作物的化感效应,可为建立合理的灯盏花间作、套作、轮作体系提供依据。近年来,许多研究者从化感作用角度探讨了不同作物加入药用植物间作、套作、轮作体系缓解其连作障碍的可行性。马瑞君等研究发现,小麦和燕麦对当归的化感作用具有一定的耐受能力,根部的化感作用强于茎叶,并有高浓度抑制、低浓度促进的效应,小麦和燕麦可以用于當归轮作体系[5]。张子龙等研究发现,玉米对三七化感作用的敏感性弱于小麦,玉米更适宜与三七进行轮作[6]。常晖等研究发现,黄精植株不同部位对萝卜、小麦、白菜的化感综合效应强度排序为果实>根茎>叶片>茎秆;黄精根茎和果实的提取液对3种受体作物种子萌发、幼苗生长均有极显著的抑制作用[7]。周武先等发现,半夏不同部位的浸提液对玉米、萝卜、白菜的化感效应表现为低浓度轻微促进、高浓度较强抑制的现象,且半夏的化感物质主要集中于地下部块茎中,玉米最适合与半夏进行轮作或间作[8]。周武先等还发现,高浓度白术块茎研磨液和须根研磨液对白菜种子萌发及幼苗生长表现出显著的化感抑制作用,其他处理的化感作用较弱,白术地下部化感物质主要存在于块茎中,以研磨提取的方式效率最高[9]。总体看出,白术对白菜的化感抑制作用较弱,表明白术可以与白菜进行轮作、间作。目前,已有研究者对当归[5,10]、黄精[7]、半夏[8,11]、白术[9]等药用植物的化感作用进行了报道,关于灯盏花的研究多集中于药理、肥料施用、成分提取等方面,但是关于灯盏花化感效应的报道较少。本研究采用化感作用的研究方法,系统研究灯盏花植株根、茎、叶水浸提液对禾本科代表作物小麦和十字花科代表作物萝卜种子萌发、幼苗生长的影响,以期为建立合理的间作、套作、轮作体系,缓解灯盏花连作障碍提供支撑。
1 材料与方法
1.1 试验材料
供试材料为灯盏花植株,于2018年11月采自云南泽生生物科技有限公司灯盏花种植基地(103°65′E,24°49′N)。受体材料为萝卜和小麦种子,购自云南省蒙自市观音桥农贸批发市场。
1.2 试验方法
1.2.1 灯盏花水浸提液的制备 将灯盏花植株洗净并吹干表面水分,分离成根、茎和叶3个部分,室内自然风干后粉碎,过40目筛,各称取30.00 g灯盏花根、茎、叶粉末,分别置于250 mL三角瓶内,并分别加入150 mL超纯水,封口后放入摇床中,于 150 r/min 处理12 h后静置12 h,过滤,制得 0.20 g/mL 灯盏花各部位水浸提液。采用倍量稀释法将灯盏花各部位水浸提液分别稀释成0.15、0.10、0.05 g/mL浓度梯度备用。
1.2.2 种子萌发试验 选择籽粒完整、饱满的小麦和萝卜种子,分别用5%次氯酸钠溶液浸泡3 min,再用流动的清水清洗数遍,放滤纸上晾干,在直径为 9 cm 的培养皿内铺上2层滤纸后均匀放入50粒种子,加入3 mL各浓度灯盏花水浸提液,以蒸馏水为对照(CK),每个处理重复3次。将培养皿放入 (25±1) ℃恒温培养箱内培养,隔天加3 mL水浸提液,保持滤纸湿润。每24 h调查1次,种子萌发6 d后测量种子的胚根、胚芽长度。相关计算公式如下:
发芽率=发芽种子数/供试种子数×100%;
发芽势=发芽数达最大时的发芽种子总数/供试种子数×100%;
发芽指数(GI)=∑(Gt/Dt)。
式中:Gt、Dt分别是第t天发芽种子数(粒)、相应种子发芽所需的时间(d)。
幼苗活力指数=GI×S。
式中:GI、S分别为发芽指数、种子萌发6 d后的胚芽长度与胚根长度之和[12]。
采用化感效应指数(RI)[13]反映化感作用强度:
当T≥C时,RI=1-C/T;当T<C时,RI=T/C-1。
式中:C、T分别为对照组、处理组的值。RI>0、RI<0分别表示促进作用、抑制作用,其绝对值大小表示作用强度的大小。
综合化感指数(M)为各处理的化感效应指数求和后所得的平均值,M>0、M<0分别表示促进作用、抑制作用,其绝对值大小表征作用强弱[14]。
1.2.3 小麦和萝卜幼苗培养及生理指标的测定 把直径为0.5~1.0 mm的河沙清洗后晾干,在80 ℃烘8 h,每个培养皿称取50.00 g河沙,加入25 mL蒸馏水润湿沙子。将萌发露白的种子播到培养皿中,使每皿种子数保持一致,置于25 ℃恒温箱中进行光照培养。第2天开始每天加4 mL水浸提液。当苗高为5~6 cm时,参照李小方等的方法测量幼苗的丙二醛(MDA)含量、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、根系活力等生理指标[15]。
1.3 数据统计与分析
用Excel 007对数据进行处理和作图,用SPSS 19.0的最小显著性差异法(LSD)进行单因素显著性分析。
2 结果与分析
2.1 不同浓度灯盏花根、茎、叶浸提液对种子萌发的影响
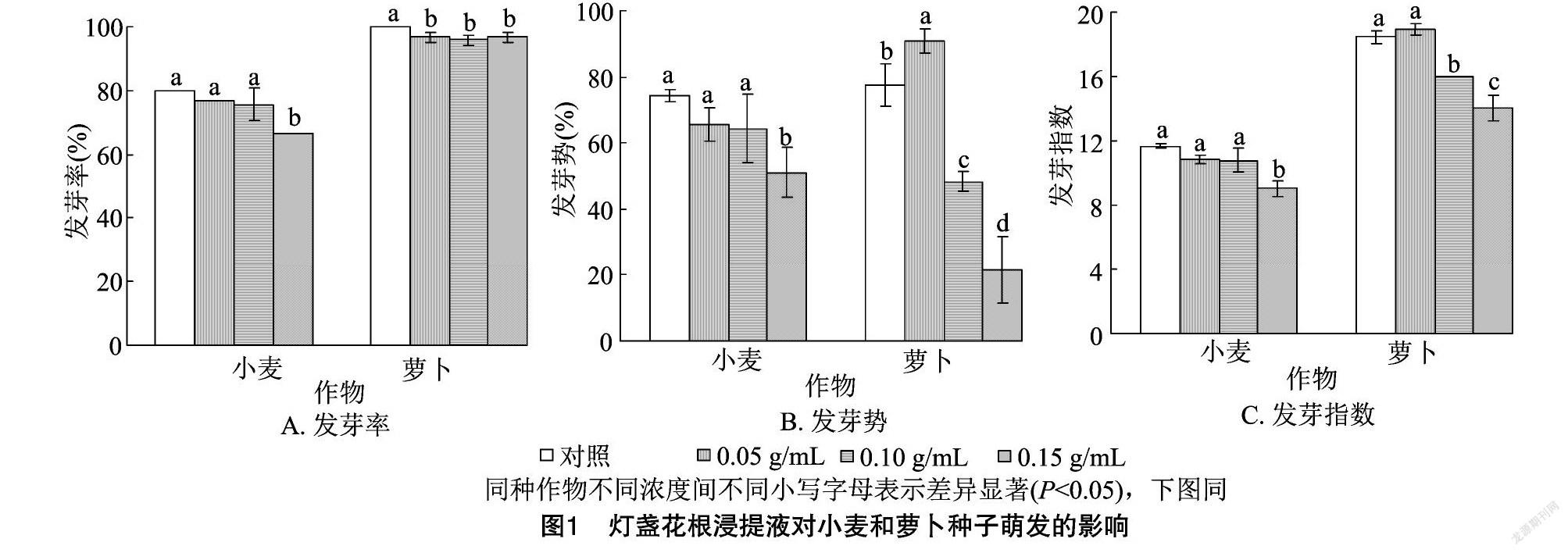
2.1.1 灯盏花根浸提液对种子萌发的影响 由图1-A可以看出,小麦、萝卜种子的发芽率呈现随着灯盏花根浸提液浓度的增高而降低的规律,在0.05、0.10 g/mL灯盏花根浸提液处理下,小麦种子发芽率与对照间的差异均不显著;在0.15 g/mL灯盏花根浸提液处理下,小麦种子发芽率显著低于对照;各浓度处理的萝卜种子发芽率差异不显著,但均显著低于对照处理。由图1-B可以看出,灯盏花根浸提液对小麦种子的发芽势均有抑制作用,且抑制效应大小呈现浓度效应,但对萝卜种子的发芽势呈现出低促高抑的双重效应。在0.05、0.10 g/mL灯盏花根浸提液处理下,小麦种子发芽势与对照间的差异均不显著;在0.15 g/mL灯盏花根浸提液处理下,小麦种子的发芽势显著低于对照;0.05 g/mL灯盏花根浸提液处理的萝卜种子发芽势显著高于对照(提高17.20%),0.10、0.15g/mL灯盏花根浸提液处理的萝卜种子发芽势之间差异显著,且均显著低于对照(分别降低了37.64%、72.04%)。由图1-C 可以看出,随着灯盏花根浸提液浓度的增加,小麦种子发芽指数呈现逐渐降低的规律,萝卜种子发芽指数呈现先增加后降低的趋势;在0.05 g/mL灯盏花根浸提液处理下,小麦、萝卜种子的发芽指数与对照间差异均不显著;在0.10 g/mL灯盏花根浸提液处理下,小麦种子的发芽指数與对照间的差异不显著,萝卜种子的发芽指数显著低于对照;在0.15 g/mL灯盏花根浸提液处理下,小麦、萝卜种子的发芽指数均显著低于对照。
2.1.2 灯盏花茎浸提液对种子萌发的影响 由图2-A可以看出,小麦、萝卜种子的发芽率均呈现随着灯盏花茎浸提液浓度的增加而降低的规律。在 0.05 g/mL 灯盏花茎浸提液处理下,小麦、萝卜种子发芽率与对照相比差异均不显著;在0.15 g/mL的较高浓度灯盏花茎浸提液处理下,小麦、萝卜种子的发芽率均显著低于对照。由图2-B可以看出,小麦、萝卜种子的发芽势均呈现随着灯盏花茎浸提液浓度的增加而降低的规律,其中小麦种子的发芽势随着浸提液浓度的增加而显著降低,在0.05 g/mL灯盏花茎浸提液处理下,萝卜种子的发芽势与对照相比差异不显著,其余处理均显著低于对照。由图2-C可以看出,小麦、萝卜种子的发芽指数均呈现出随着灯盏花茎浸提液浓度的增加而降低的规律。在0.05 g/mL灯盏花茎浸提液处理下,小麦、萝卜种子的发芽指数与对照相比差异均不显著;在0.10、0.15 g/mL灯盏花茎浸提液处理下,小麦、萝卜种子的发芽指数间差异均显著,且两者均显著低于对照。
2.1.3 灯盏花叶浸提液对种子萌发的影响 由图3-A可以看出,随着灯盏花叶浸提液浓度的增加,小麦、萝卜种子发芽率均呈现降低的规律。在各浓度处理下,小麦的发芽率均显著低于对照,0.05 g/mL与0.10 g/mL灯盏花叶浸提液处理间差异不显著;0.05、0.10 g/mL灯盏花叶浸提液处理的萝卜种子发芽率与对照相比差异均不显著,0.15 g/mL灯盏花叶浸提液处理的萝卜种子发芽率显著低于对照。由图3-B可以看出,随着灯盏花叶浸提液浓度的增加,小麦种子发芽势呈现逐渐降低的规律,萝卜种子发芽势呈现先增加后降低的规律。各浓度处理的小麦种子发芽势均显著低于对照,在0.10 g/mL与0.15 g/mL灯盏花叶浸提液处理间差异不显著;0.05 g/mL灯盏花叶浸提液处理的萝卜种子发芽势显著高于对照,0.10 g/mL 灯盏花叶浸提液处理与对照间差异不显著,0.15 g/mL灯盏花叶浸提液处理显著低于对照。由图3-C可以看出,小麦种子发芽指数呈现出随着灯盏花叶浸提液浓度的增加而降低的规律,萝卜种子发芽指数表现出随着灯盏花叶浸提液浓度的增加而先增加后降低的规律。各灯盏花浸提液浓度处理的小麦种子发芽指数均显著低于对照,0.05 g/mL与 0.10 g/mL 灯盏花叶浸提液处理间差异不显著;0.05 g/mL 灯盏花叶浸提液处理的萝卜种子发芽指数显著高于对照,0.10 g/mL 灯盏花叶浸提液处理与对照间的差异不显著,0.15 g/mL灯盏花叶浸提液处理显著低于对照。
2.2 不同浓度灯盏花根、茎、叶浸提液对幼苗生长的影响
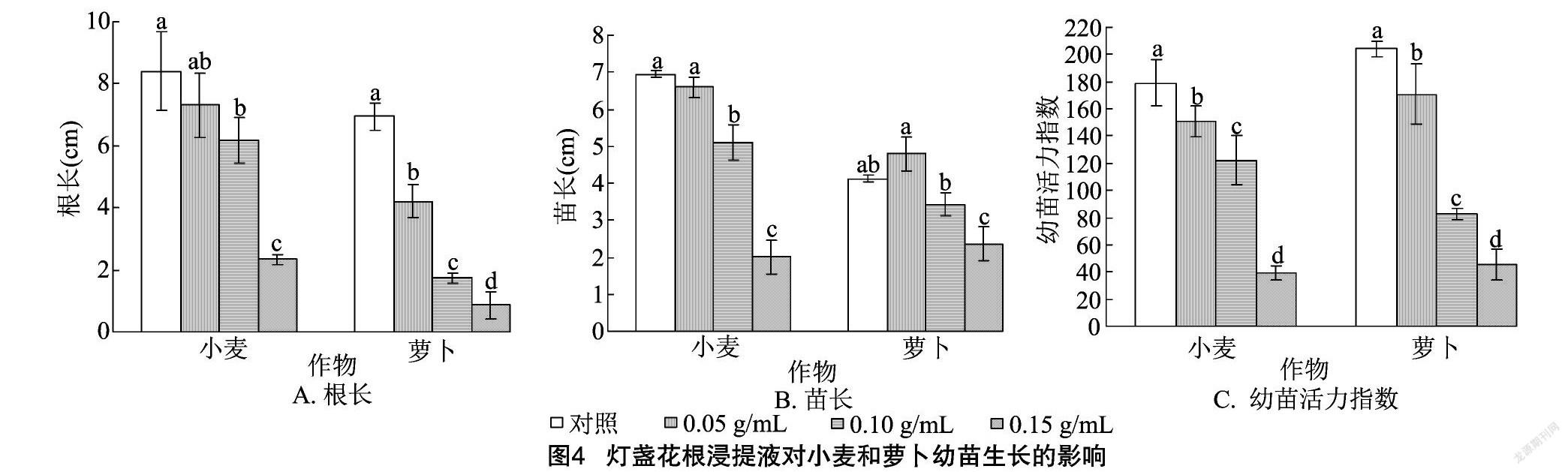
2.2.1 灯盏花根浸提液对幼苗生长的影响 由图4-A可以看出,小麦幼苗根长呈现随着灯盏花根浸提液浓度的增加而减小的规律。在0.05 g/mL灯盏花根浸提液处理下,小麦幼苗根长与对照间差异不显著,0.10、0.15 g/mL灯盏花根浸提液处理的小麦幼苗根长差异显著,且均显著低于对照。萝卜幼苗根长随着灯盏花根浸提液浓度的增加而显著减小。0.15 g/mL灯盏花根浸提液处理的小麦、萝卜幼苗根长与对照相比分别降低了72.23%、87.63%。由图4-B可以看出,小麦苗长随着灯盏花根浸提液浓度的增加而减小,萝卜苗长随着灯盏花根浸提液浓度的增加呈现先增加后降低的规律。在0.05 g/mL灯盏花根浸提液处理下,小麦、萝卜苗长与对照间的差异均不显著:小麦苗长减小了5.04%,萝卜苗长增加了16.26%。0.10 g/mL与0.15 g/mL灯盏花根浸提液处理间的小麦、萝卜苗长差异均显著,且均显著低于对照。由图4-C可以看出,小麦、萝卜幼苗活力指数均随着灯盏花根浸提液浓度的增加而显著减小。
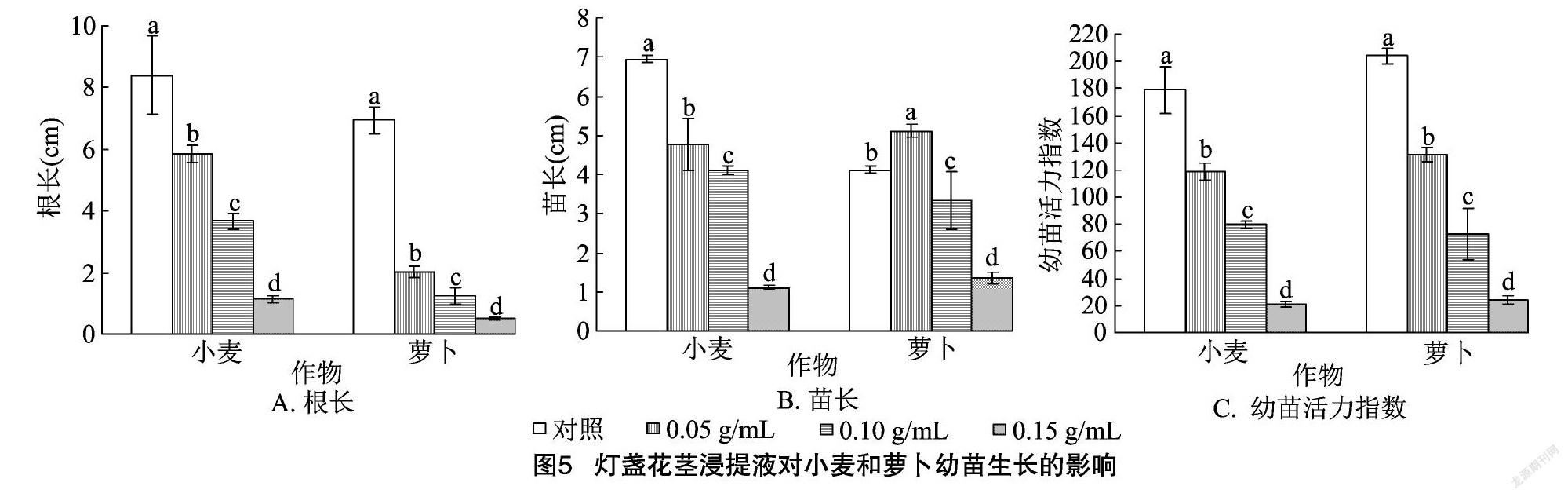
2.2.2 灯盏花茎浸提液对幼苗生长的影响 由图5-A可以看出,小麦、萝卜幼苗的根长均随着灯盏花茎浸提液浓度的增加而显著减小,说明灯盏花茎浸提液均能显著抑制小麦、萝卜幼苗根的生长。由图5-B可以看出,小麦苗长随着灯盏花茎浸提液浓度的增加而显著减小;萝卜苗长随着灯盏花茎浸提液浓度的增加而先增加后降低,且不同浓度间的差异均显著。0.05 g/mL灯盏花茎浸提液处理的萝卜苗长比对照显著提高24.27%;0.15 g/mL灯盏花茎浸提液处理的小麦、萝卜苗长分别比对照降低了83.86%、67.23%。由此可见,高浓度灯盏花茎浸提液均能显著抑制小麦、萝卜幼苗的生长。由图5-C可以看出,小麦、萝卜幼苗的活力指数均随着灯盏花茎浸提液浓度的增加而显著减小。
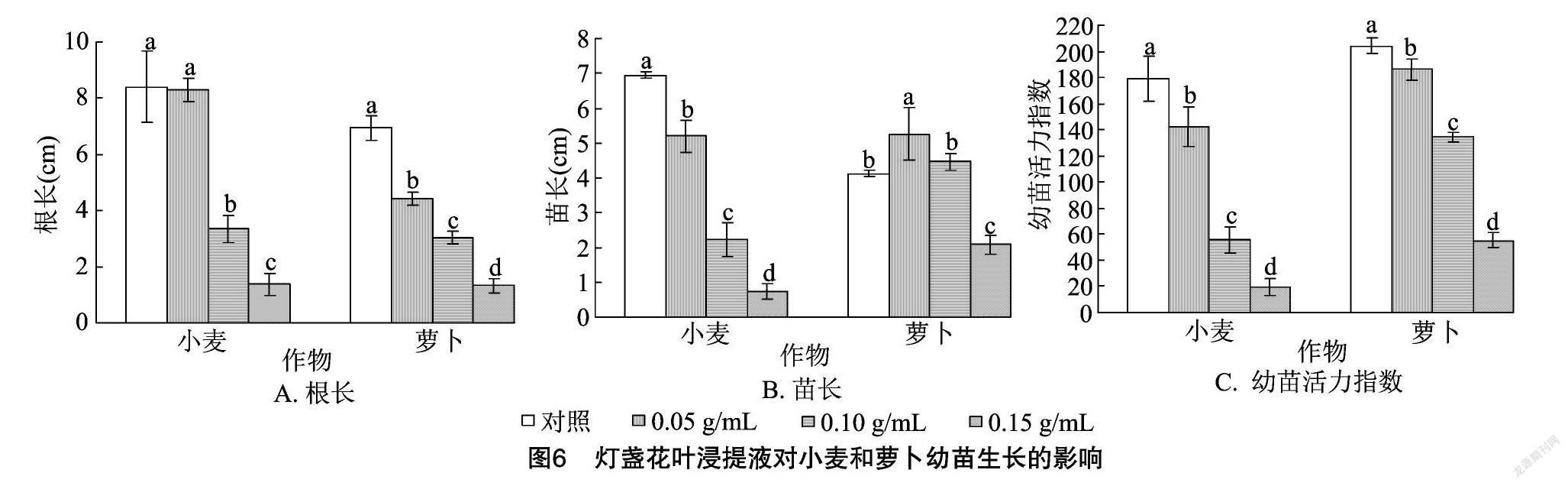
2.2.3 灯盏花叶浸提液对幼苗生长的影响 由图6-A可以看出,小麦、萝卜幼苗根长均呈现随着灯盏花叶浸提液浓度的增加而减小的规律,除0.05 g/mL灯盏花叶浸提液处理的小麦幼苗根长与对照间差异不显著外,其余各浓度处理的根长均显著低于对照,且不同浓度间的差异均显著。由图6-B可以看出,小麦苗长随着灯盏花叶浸提液浓度的增加而显著减小;而萝卜苗长随着灯盏花叶浸提液浓度的增加先增加后降低。0.05 g/mL灯盏花叶浸提液处理的萝卜苗长比对照显著提高27.91%;0.15 g/mL灯盏花叶浸提液处理的小麦、萝卜苗长分别比对照降低了89.48%、49.51%。由此可见,高浓度灯盏花叶浸提液均能显著抑制小麦、萝卜幼苗的生长。由图6-C可以看出,小麦、萝卜幼苗活力指数均随着灯盏花叶浸提液浓度的增加而显著减小。
2.3 不同浓度灯盏花根、茎、叶浸提液对幼苗生理指标的影响
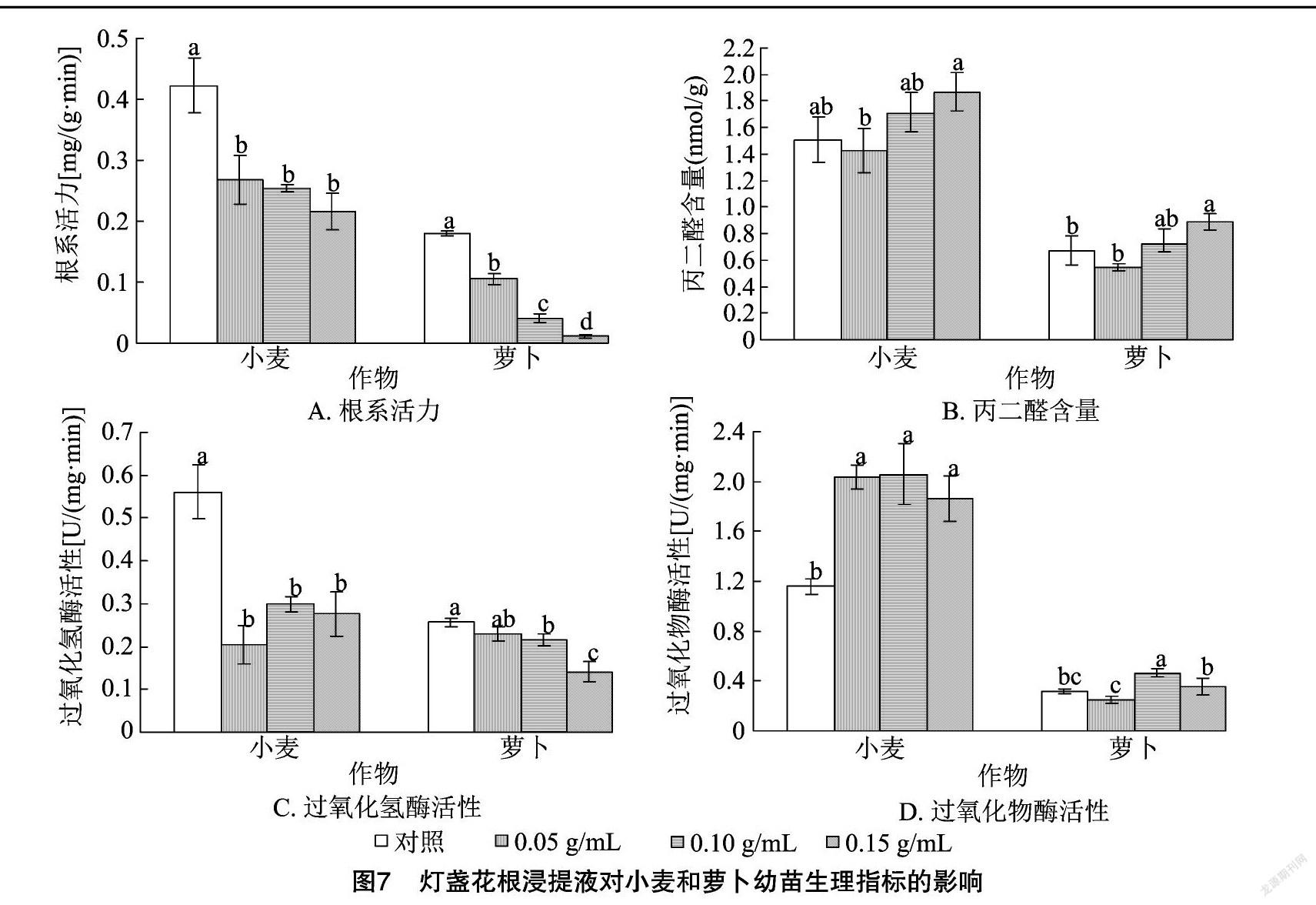
2.3.1 灯盏花根浸提液对幼苗生理指标的影响 由图7-A可以看出,小麦、萝卜幼苗根系活力均呈现随着灯盏花根浸提液浓度的增加而降低的规律。各浓度灯盏花根浸提液处理的小麦幼苗根系活力差异不显著,但均显著低于对照;各浓度灯盏花根浸提液处理的萝卜幼苗根系活力差异显著,且均显著低于对照。由图7-B可以看出,小麦、萝卜幼苗MDA含量随着灯盏花根浸提液浓度的增加均呈现低浓度抑制高浓度促进的双重效应。各浓度灯盏花根浸提液处理与对照间小麦幼苗的MDA含量差异均不显著;萝卜幼苗的MDA含量在低浓度灯盏花根浸提液处理下受抑制,在高浓度灯盏花根浸提液处理下促进效果显著。由图7-C可以看出,各浓度灯盏花根浸提液处理的小麦幼苗CAT活性差异不显著,均显著低于对照;与对照相比,低浓度灯盏花根浸提液的萝卜幼苗CAT活性与对照差异不显著,其他浓度与对照均差异显著,各浓度灯盏花根浸提液处理的萝卜幼苗CAT活性均低于对照。由图7-D可以看出,各浓度灯盏花根浸提液处理的小麦幼苗POD活性差异不显著,均显著高于对照;在低浓度灯盏花根浸提液处理下,萝卜幼苗POD活性受到抑制, 但抑制作用不显著; 在中高浓
度灯盏花根浸提液处理下,萝卜幼苗的POD活性受到促进,其中0.10 g/mL灯盏花根浸提液处理的促进效果显著。
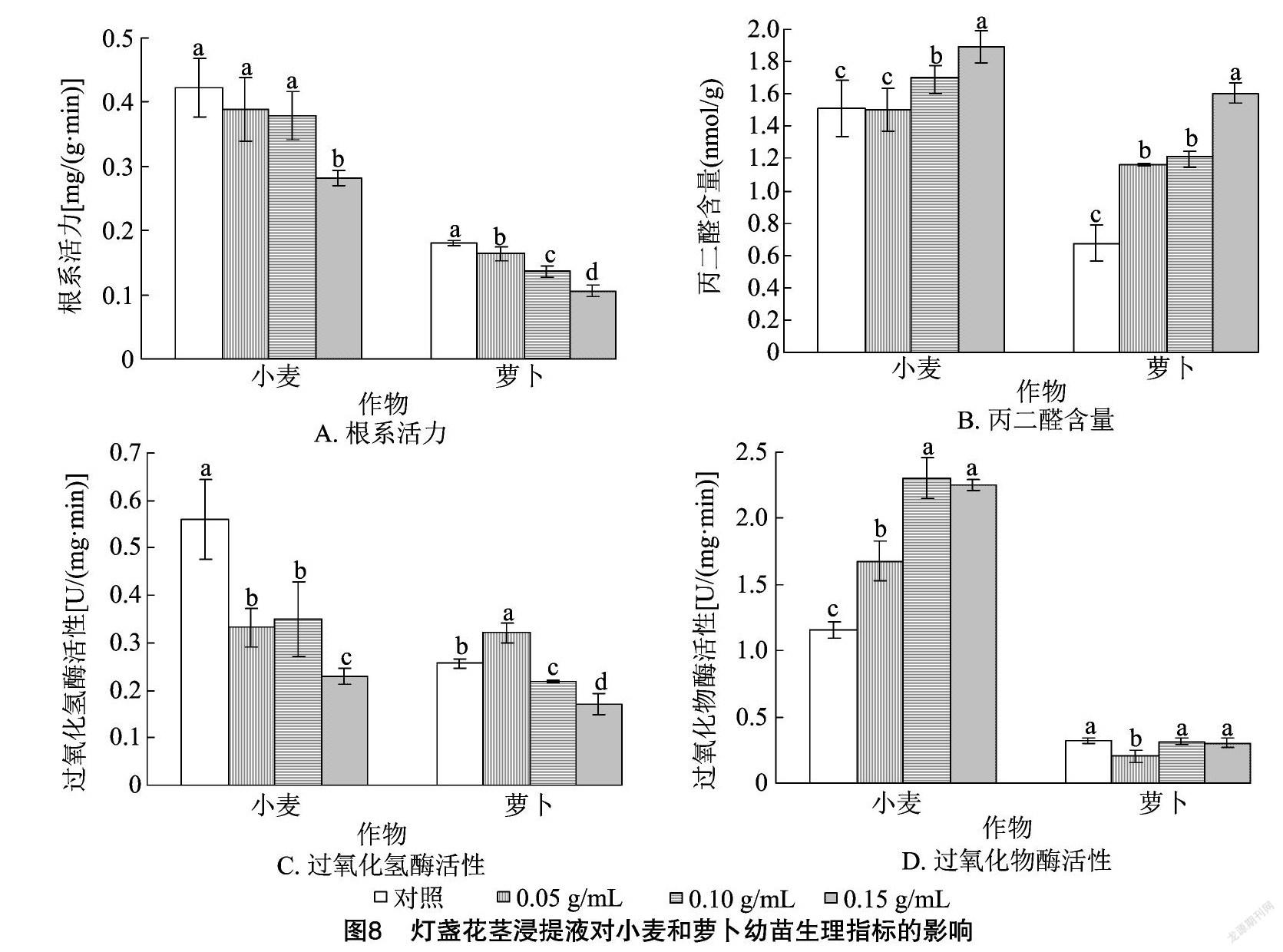
2.3.2 灯盏花茎浸提液对幼苗生理指标的影响 由图8-A可以看出,小麦、萝卜幼苗根系活力均呈现随着灯盏花茎浸提液浓度的增加而降低的规律。与对照相比,0.15 g/mL灯盏花茎浸提液处理的小麦幼苗根系活力差异显著,其余浓度处理差异均不显著;各浓度灯盏花茎浸提液处理的萝卜幼苗根系活力差异显著,且均显著低于对照。由图8-B可以看出,小麦幼苗MDA含量随着灯盏花茎浸提液浓度的增加呈现先降低后增加的规律,但降低效果不显著,在高浓度时增加效果显著。灯盏花各浓度处理均能显著提高萝卜幼苗MDA含量,0.10 g/mL与0.05 g/mL处理间的差异不显著。由图8-C可知,各浓度灯盏花茎浸提液处理的小麦幼苗CAT活性均显著低于对照;萝卜幼苗CAT活性随着灯盏花茎浸提液浓度的增加呈现先增加后降低的规律,且促进作用与抑制作用均显著。由图8-D可以看出,各浓度灯盏花茎浸提液处理的小麦幼苗POD活性均显著高于对照,0.10 g/mL与 0.15 g/mL 处理间的差异不显著;各浓度灯盏花茎浸提液处理的萝卜POD活性均低于对照,0.05 g/mL处理的抑制作用显著,其他浓度处理的抑制作用不显著。
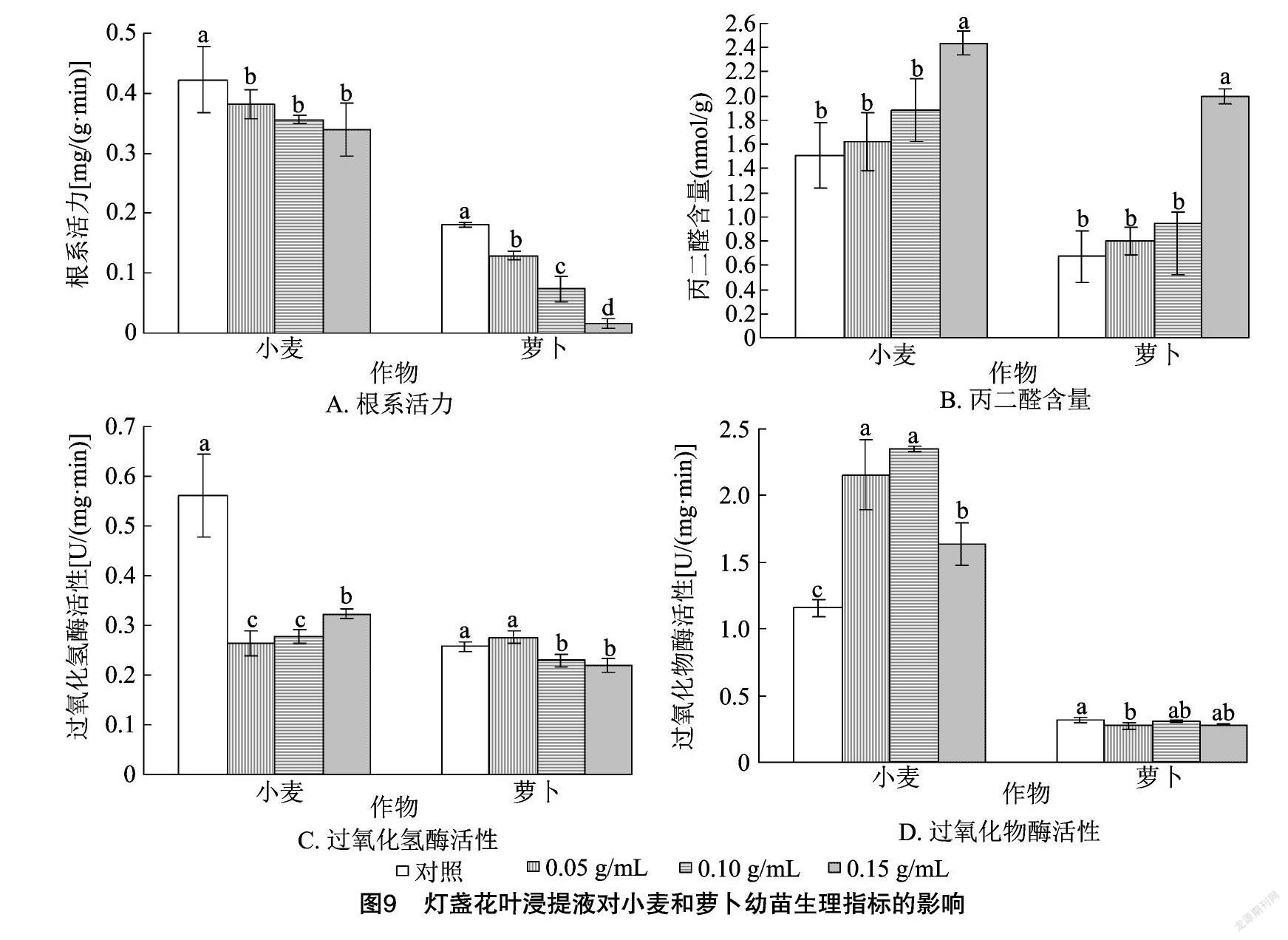
2.3.3 灯盏花叶浸提液对幼苗生理指标的影响 由图9-A可以看出,小麦、萝卜幼苗根系活力均呈现随着灯盏花叶浸提液浓度的增加而降低的规律。与对照相比,各浓度灯盏花叶浸提液处理的小麦幼苗根系活力均显著降低;各浓度灯盏花叶浸提液处理的萝卜幼苗根系活力差异显著,且均显著低于对照。由图9-B可以看出,小麦、萝卜幼苗MDA含量均随着灯盏花叶浸提液浓度的增加而增加,小麦、萝卜幼苗MDA含量在0.05 g/mL与0.10 g/mL处理间的差异均不显著,0.15 g/mL燈盏花叶浸提液处理的MDA含量均显著高于对照。由图 9-C 可以看出,各浓度灯盏花叶浸提液处理的小麦幼苗CAT活性均显著低于对照;萝卜幼苗的CAT活性随着灯盏花叶浸提液浓度的增加呈现先增加后降低的规律,且促进作用不显著,抑制作用显著。由图9-D 可以看出,各浓度灯盏花叶浸提液处理的小麦幼苗POD活性均显著高于对照,0.05 g/mL与 0.10 g/mL处理间的差异不显著;各浓度灯盏花茎浸提液处理的萝卜POD活性均低于对照,其中 0.05 g/mL 浓度处理抑制作用显著,其他浓度处理的抑制作用不显著。
2.4 不同浓度灯盏花根、茎、叶浸提液对小麦、萝卜综合化感效应指数的影响
为综合分析灯盏花根、茎、叶水浸液对2种作物的化感效应,通过计算2种作物的发芽率、发芽势、发芽指数、根长、苗长、 幼苗活力指数、根系活力、丙
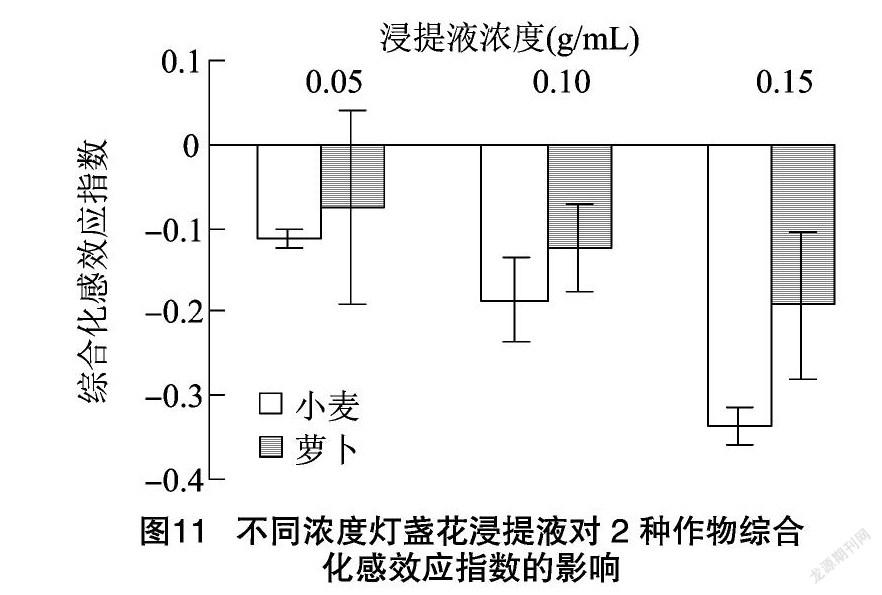
二醛含量、CAT活性、POD活性等9个指标的RI,得出综合化感效应。由图10可以看出,灯盏花根、茎、叶浸提液对2种作物的综合化感效应指数均为负值,均表现为抑制效应,2种作物受抑制程度均呈现随着灯盏花根、茎、叶浸提液浓度的增加而逐渐增强的规律,当根、茎、叶浸提液浓度为0.15 g/mL时,综合化感效应指数的绝对值均达到最大值。灯盏花根、茎、叶浸提液对小麦和萝卜的综合化感效应强度排序分别为叶=茎>根、根>茎>叶。灯盏花植株浸提液对小麦的平均综合化感效应指数为 -0.2 对萝卜的平均综合化感效应指数为-0.22,说明灯盏花对小麦、萝卜的化感效应基本一致。将不同浓度下灯盏花植株浸提液对同一受体作物的综合化感效应指数进行统计可知,在各浓度处理下,灯盏花植株浸提液对小麦、萝卜的化感效应强度均表现为小麦>萝卜(图11)。
3 讨论与结论
植物化感作用在自然界中普遍存在,当化感物质在土壤中积累到一定程度后,就会影响植物种子萌发和幼苗生长,延长种子发芽时间,降低发芽速率,使植物对地上、地下资源的竞争加剧[16]。植物不同部位对受体植物的化感作用存在差异[17],植物化感作用的强弱不仅与浸提液浓度、化感物质种类有关,还与受体植物的种类有关[18]。本研究以不同浓度灯盏花根、茎、叶水浸提液处理小麦和萝卜种子,观察其对种子萌发、幼苗生长、幼苗生理的影响,结果表明,灯盏花根、茎、叶水浸提液对小麦和萝卜种子萌发、幼苗生长和幼苗生理各指标均具有明显的抑制或促进作用,且抑制作用随着浓度的提高而增强。对小麦种子萌发、幼苗生长、根系活力、过氧化氢酶活性均表现为抑制作用;对小麦幼苗丙二醛含量、过氧化物酶活性均表现为促进作用。对萝卜种子发芽率、根长、幼苗活力指数、根系活力、丙二醛含量均表现为抑制作用;对萝卜种子发芽势、发芽指数、苗长、过氧化氢酶活性呈现为低浓度促进、高浓度抑制的作用。有研究表明,不同化感物质浓度对植物的化感作用也不同,在高浓度下具有显著的抑制作用,在低浓度下的作用不显著或者起到促进作用[19]。灯盏花根、叶水浸提液对萝卜种子发芽势、发芽指数和苗长的影响,呈现低促高抑的双重效应,这与姚树宽等关于假苍耳根、茎浸提液对萝卜、白菜、油菜影响的研究结果[20]一致。
本研究还发现,灯盏花根、茎、叶水浸提液对小麦、萝卜的综合化感指数均为负值,说明灯盏花各部位水浸提液对小麦、萝卜的生长均表现为综合抑制作用,综合化感效应强度随着浓度的升高而逐渐增强,这与常晖等关于黄精根茎、叶水提液对小麦和萝卜的研究结果[7]一致,与范丽花等关于猪毛蒿浸提液对多年生黑麦草、红豆草和谷子影响的研究结果[21]也一致。综合化感效应指数显示,灯盏花不同部位水浸提液对小麦化感效应表现为叶=茎>根,对萝卜表现为根>茎>叶,说明灯盏花根、茎、叶均会产生化感物质,起化感作用的主要化感物质可能与受体植物种类有关,后续需要继续研究其对其他作物的化感效应,进一步测定具体化感物质,验证是同一化感物质起作用还是因受体植物种类不同而化感物质有所不同。因灯盏花药用部位主要为茎、叶,大量根系被当成残茬留在土壤中,因此小麦比萝卜更适宜与灯盏花进行间作、套作、轮作。
参考文献:
[1]国家药典委员会. 中华人民共和国药典:一部[M]. 北京:中国医药科技出版社,2020:155.
[2]YangXF,HeW,LuWH,etal.Effectsofscutellarinonliver
function after brain schemia/reperfusion in rats[J]. Acta Pharmacologica Sinica,2003,24(11):1118-1124.
[3]林丽飞,洪 亮,杨文跃,等. 外源精胺对南方根结线虫胁迫下灯盏花生理生化的影响[J]. 江西农业大学学报,2019,41(2):267-272.
[4]孔垂华,胡 飞,王 朋. 植物化感(相生相克)作用[M]. 北京:高等教育出版社,2016:142-152.
[5]马瑞君,惠继瑞,朱 慧,等. 当归营养期的化感作用[J]. 中国生态农业学报,2008,16(6):1483-1488.
[6]张子龙,拱健婷,孙 萌,等. 三七对玉米和小麦的化感效应及其差异分析[J]. 南方农业学报,2015,46(6):985-990.
[7]常 晖,逯 莉,党艳妮,等. 黄精对三种作物种子萌发和幼苗生长的化感作用[J]. 北方园艺,2019(8):130-136.
[8]周武先,罗孝荣,段媛媛,等. 半夏对3种常见农作物的化感作用及其生理机制研究[J]. 南方农业学报,2019,50(7):1451-1459.
[9]周武先,段媛媛,罗孝荣,等. 白术化感物质存在的主要部位及其对小白菜的化感作用研究[J]. 中药材,2019,42(6):1222-1227.
[10]王田涛,王 琦,王惠珍,等. 连作条件下间作模式对当归生长特性和产量的影响[J]. 草业学报,2013,22(2):54-61.
[11]王一峰,王明霞,孟彦斌,等. 半夏不同部位浸提液对小麦种子萌发及幼苗生长的化感效应[J]. 西北农业学报,2016,25(8):1173-1179.
[12]张新慧,郎多勇,陈 靖,等. 蒙古黄芪植株水浸液的自毒作用研究[J]. 中药材,2014,37(2):187-191.
[13]Williamson G B,Richardson D. Bioassays for allelopathy:measuring treatment responses with independent controls[J]. Journal of Chemical Ecology,1988,14(1):181-187.
[14]沈慧敏,郭鸿儒,黄高宝,等. 不同植物对小麦、黄瓜和萝卜幼苗化感作用潜力的初步评价[J]. 应用生态学报,2005,16(4):740-743.
[15]李小方,张志良. 植物生理学实验指导[M]. 北京:高等教育出版社,2016.
[16]王玉芝,张汝民,高 岩. 冷蒿浸提液对几种饲用植物的化感作用[J]. 中国草地学报,2008,30(2):47-53.
[17]胡远彬,陈 俊,肖天昊,等. 劲直黄芪水浸提液化感作用研究[J]. 草业学报,2013,22(6):136-142.
[18]曹子林,王晓丽,涂 璟. 紫茎泽兰不同处理方法水提液对云南松种子萌发的化感作用[J]. 种子,201 30(8):46-49.
[19]Rudrappa T,Bonsall J,Gallagher J L,et al. Root-secreted allelochemical in the noxious weed Phragmites australis deploys a reactive oxygen species response and microtubule assembly disruption to execute rhizotoxicity[J]. Journal of Chemical Ecology,2007,33(10):1898-1918.
[20]姚樹宽,李凤兰,彭丽娜,等. 假苍耳不同部位水浸提液对五种十字花科植物化感作用的研究[J]. 草业学报,2018,27(9):56-66.
[21]范丽花,汪鹏斌,王玉霞,等. 猪毛蒿枯落物水浸提液对5种草地植物种子萌发的化感作用[J]. 中国草地学报,202 43(1):96-103.

