61例视神经脊髓炎谱系疾病临床特点、NLR、ELR对疾病严重程度的影响
李扬帆, 李 健
(1.锦州医科大学 研究生学院,辽宁 锦州 121000;2.锦州医科大学附属第一医院 神经内科,辽宁 锦州 121000)
视神经脊髓炎(neuromyelitis optica, NMO),又称Devic病,是一种自身抗体介导、以体液免疫为主的中枢神经系统(central nerous system, CNS)高致残性和高复发率的自身免疫炎性脱髓鞘疾病[1]。特异性标志物NMO-IgG的发现及其后来确认为抗水通道蛋白4(AQP4)抗体的研究,使得NMO在发病机制、诊断及治疗上取得重大进步[2-3]。2015年国际诊断小组根据血清AQP4抗体的存在与否分为血清AQP4抗体(+)与血清AQP4抗体(-)的标准,进一步将NMO扩充为视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders, NMOSD),并总结了NMOSD的多项核心症状[4]。
NMOSD的病程绝大多数呈复发缓解型,且随着发病次数的增加,视神经、神经功能损害会越来越重,尽管激素、丙种球蛋白、免疫抑制剂等治疗已应用于临床,但绝大多数NMOSD出院时仍不能完全恢复正常[5]。因此研究影响NMOSD疾病严重程度、预后的临床指标对于NMOSD病情判断至关重要。NMOSD伴随抗体的不同可能会导致不同的疾病严重程度[6]。另外,也有学者认为白蛋白指数(血清/脑脊液白蛋白)可以代表NMOSD发病过程中的血脑屏障破坏程度,并与NMOSD的疾病严重程度有关[7]。
本研究通过回顾性分析就诊于锦州医科大学附属第一医院的61例NMOSD患者,总结NMOSD的一般临床发病规律,并对NMOSD外周血中炎性细胞计数及疾病严重程度变化的预测价值加以完善,为其诊断和治疗提供新的思路。
1 资料与方法
1.1病例选择 选择2017年6月至2021年6月在锦州医科大学附属第一医院神经内科住院首次确诊的NMOSD患者61例。纳入标准:(1)所有入组患者均满足2015年国际NMO诊断小组(IPND)制定的NMOSD诊断标准[5];(2)所有NMOSD患者均处于NMOSD发病急性期内,急性期被定义为临床上出现新的神经异常症状持续超过24 h或原有症状恶化超过24 h,MRI表现为长T1长T2信号的与症状相关的异常病灶。排除标准:(1)既往有影响扩展残疾状态量表评分(expanded disability status scale,EDSS)、改良Rankin评分(MRS)、视力及神经功能缺损、炎性细胞计数的其他基础疾病患者;(2)住院前已使用激素、免疫抑制剂等药物治疗者。并选取同期与NMOSD组年龄、性别相匹配的61例健康体检者作为对照组,排除NMOSD及患有上述其他疾病患者。所有患者至少由两名主任医师做出诊断,本研究经锦州医科大学附属第一医院医学伦理委员会批准(批件号:202226)。
1.2研究方法
1.2.1临床资料采集 记录所有研究对象性别、年龄、首次发病年龄、现病史、既往史,血清及脑脊液AQP4抗体、其他自身免疫抗体状态,出院情况等;并由两位神经内科高年资主治医生独立完成对NMOSD患者进行入院时EDSS评分。
1.2.2标本采集及观察指标 采集所有研究对象入院时晨起空腹静脉血2 ml检测血液炎性指标,从化验中选取中性粒细胞计数、嗜酸性粒细胞计数、单核细胞计数、淋巴细胞计数、血小板计数、尿酸(UA)计数、胱抑素C(CysC)计数、C-反应蛋白(CRP)计数记录下来,并计算中性粒细胞淋巴细胞比率(NLR)、嗜酸性粒细胞淋巴细胞比率(ELR)、单核细胞淋巴细胞比率(MLR)、血小板淋巴细胞比率(PLR)。
1.2.3神经功能缺损评分及分组 入院时对患者进行EDSS评分,总分0~10分,根据入院时EDSS评分将NMOSD患者分为轻症组(EDSS≤3.5分)和中重症组(EDSS>3.5分)。
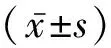
2 结 果
2.1基本资料 共纳入61例NMOSD患者,其中男10例,女51例,年龄25~84岁,平均(50.48±13.72)岁。EDSS评分为(5.37±2.48)分。AQP4抗体阳性组53例,AQP4抗体阴性组8例。合并其他自身免疫抗体的患者20例。
2.2NMOSD组与对照组各项指标比较 两组UA、CysC水平比较差异无统计学意义(P>0.05),两组CRP、NLR、ELR、MLR、PLR指标比较,差异有统计学意义(P<0.05),见表1。
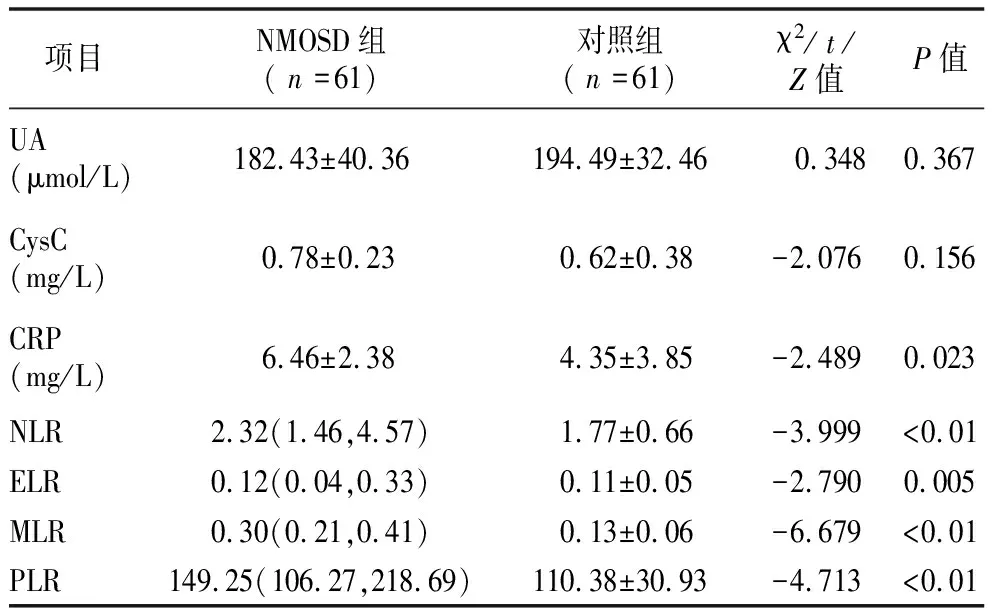
表1 两组临床特点比较
2.3性别、年龄、伴随抗体与疾病严重程度的关系 61例NMOSD患者中,轻症组25例,中重症组36例。两亚组在性别、首次发病年龄、AQP抗体阳性上差异无统计学意义(P>0.05),在合并其他自身免疫抗体上差异有统计学意义(P<0.05),合并其他抗体的NMOSD患者更易发展成中重症,见表2。
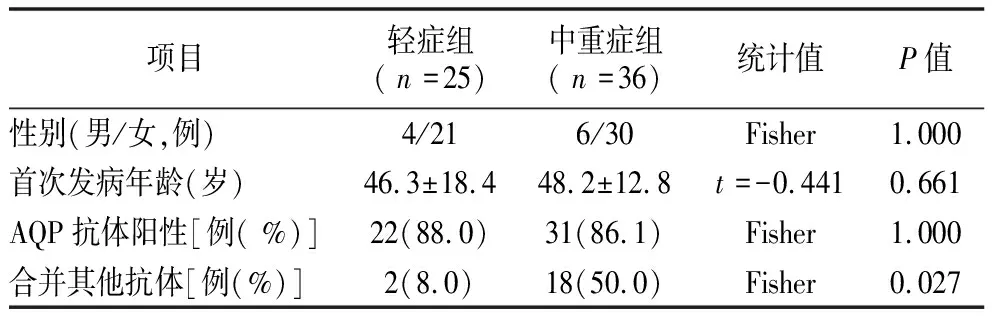
表2 NMOSD两亚组性别、年龄、抗体阳性率比较
2.4免疫炎性指标与疾病严重程度的关系 轻症NMOSD组与中重症NMOSD组相比,NLR、ELR差异有统计学意义(P<0.05),CRP、MLR、PLR差异无统计学意义(P>0.05),见表3。

表3 NMOSD两亚组免疫炎性细胞水平比较
2.5影响NMOSD病情严重程度的危险因素 将上述单因素分析中与NMOSD严重程度相关的指标纳入二元Logsitic回归分析为自变量,病情严重程度(轻症组=1,中重症组=2)作为因变量,结果表明NLR(OR=4.082,95%CI=0.970-7.177,P=0.035)、ELR(OR=5.541,95%CI=0.001-8.225,P=0.045)、合并其他抗体(OR=-2.255,95%CI=0.002-4.997,P=0.038)是NMOSD病情严重程度的独立危险因素(P<0.05),见表4。
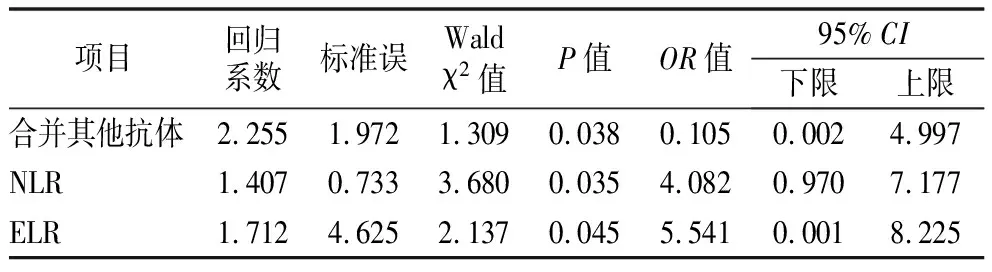
表4 影响病情严重程度指标的二元Logsitic回归分析
2.6NLR、ELR对NMOSD病情严重程度的预测价值 对NLR、ELR及其联合作用进行ROC曲线分析发现,NLR联合ELR是综合效能最高的评价病情严重程度变化的敏感指标(曲线下面积=0.885,约登指数=0.691,临界值=0.299,敏感度=0.926,特异度=0.765)。这表明NLR和ELR联合作用>0.299时,提示炎症变化失衡明显,可以作为评价疾病有中重型发展倾向的有效指标,见表5,图1。
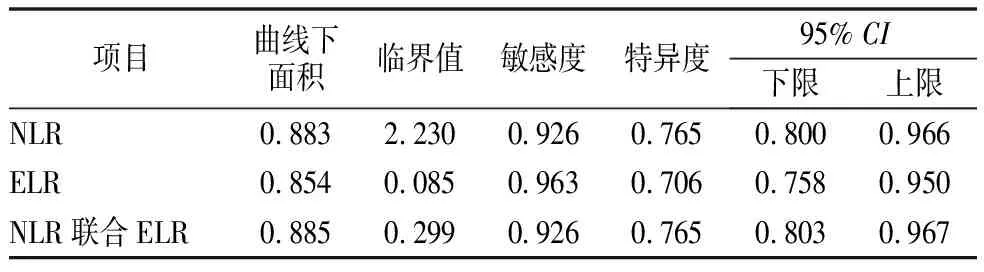
表5 影响病情严重程度各项指标比较
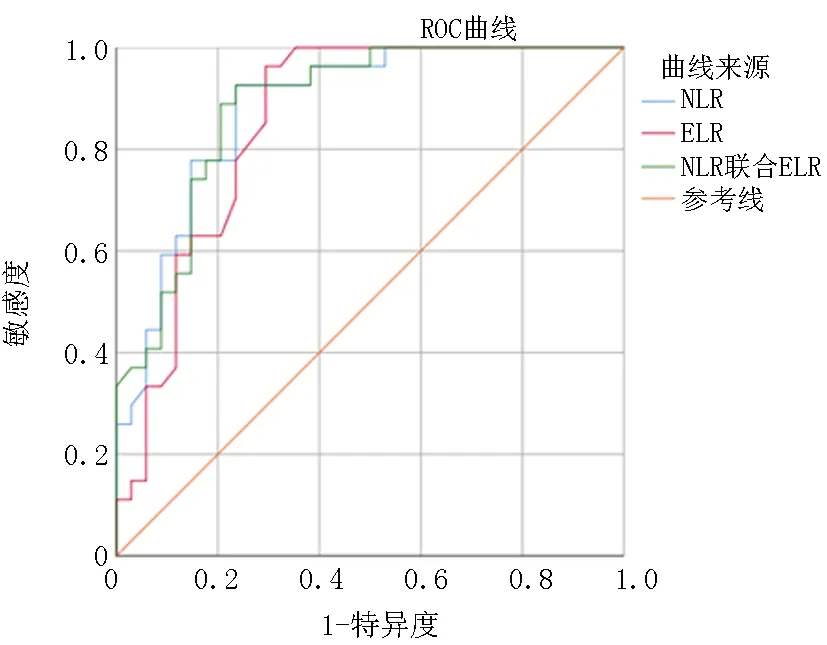
图1 NLR联合ELR评价病情严重程度变化的ROC曲线
3 讨 论
NMOSD的发病病因尚不明确。可能与雌激素水平、妊娠、维生素D水平、基因易感性、感染因素均有关系[8]。血清低维生素D水平、低T3水平可能是NMOSD病情严重程度的独立危险因素[9-10]。NMOSD的发病机制仍需完善。目前认为NMOSD通过抗原-抗体结合机制靶向攻击星形胶质细胞,这一反应引起包括中性粒细胞、嗜酸性粒细胞、淋巴细胞在内的免疫炎性细胞浸润,通过释放IL-6、IL-27在内的细胞因子形成体液免疫并形成聚合效应,通过这一系列炎症反应对NMOSD患者的星形胶质细胞聚集的部位产生破坏,在临床上体现为视力、感觉、运动等被破坏系统的残疾[11]。刘苗等[12]证明IL-6、IL-27表达水平可能与NMOSD的疾病严重程度、预后有关。在临床工作中需要一个更简易的指标去判断病情变化,而NLR、ELR通过反映机体内炎症平衡破坏的状态,更直观、快速、便捷地评估疾病严重程度。
NMOSD往往与多种自身免疫疾病共存并合并有其他自身免疫抗体,有关机制尚不明确,猜测可能用遗传易感性、体液免疫扩大化、抗体之间的分子模拟效应、其他自身免疫抗体破坏血脑屏障来解释共存关系[13]。在多因素分析中,合并其他自身免疫抗体阳性也是疾病严重程度(OR=2.255,95%CI=0.002-4.997,P=0.038)的独立危险因素。这表明,合并其他自身免疫抗体的患者更易发展为中重度残疾,这与Pereir等[14]的研究结论相一致。不同自身免疫抗体的种类也可能导致不同的残疾程度。贾红娟等[15]认为抗核抗体阳性的NMOSD患者可能有更差的疾病残疾程度。Masuda等[7]认为伴有抗甲状腺抗体的患者视力损害更差。关于NMOSD患者合并出现的不同其他自身免疫抗体对患者造成影响的机制仍有待于今后临床工作者的不断探讨。
在对NMOSD的动物脑组织活检中发现,大量中性粒细胞、淋巴细胞、嗜酸性细胞浸润在星形胶质细胞周围[16]。这说明,这些免疫炎性细胞均参与了NMOSD患者中抗体对靶细胞的破坏。目前有两种中性粒细胞对NMOSD患者产生破坏的机制。Saadoun等[17]认为中性粒细胞通过抗体-补体-中性粒细胞轴影响星形胶质细胞,抗原抗体结合后分泌C5a,进而募集和预激活中性粒细胞。Piatek等[18]则认为,在中性粒细胞升高的环境中谷氨酸稳态才能被破坏,进而损伤星形胶质细胞。另外,血清IL-6、IL-27对NMOSD与疾病病情、预后的影响也说明淋巴细胞参与了NMOSD的病情进展和演变[19]。多项研究表明,在NMOSD患者中嗜酸性粒细胞浸润明显高于其他包括多发性硬化症(MS)在内的中枢神经系统脱髓鞘疾病[20-21]。Correale等[22]通过建立小鼠模型发现,嗜酸性粒细胞在脑组织中浸润越多,病情越重。研究表明,CCL13(C-C motif chemokine ligand 13)与NMOSD病情进展变化相关,而其正是通过与嗜酸性粒细胞表面高表达的CCR3(C-C motif chemokine receptor 3)相互作用并对嗜酸性粒细胞招募形成正反馈而发挥作用。而CCR3不仅可以表达在嗜酸性细胞,还可以表达在Th2淋巴细胞上,这些细胞在疾病进展中还可以通过分泌细胞因子来形成正反馈,进一步增强体液免疫的效应[23]。
中性粒细胞、嗜酸性粒细胞和淋巴细胞在体液免疫中发挥着重要作用。中性粒细胞作为免疫应答的先驱,不仅分泌大量炎性介质,同时活化的淋巴细胞释放超氧自由基和蛋白酶,它们之间的平衡遭到破坏是炎性反应的基础。NLR可作为一种评价炎症反应的指标,与多种自身免疫性疾病有关,如MS[24]、干燥综合征[25]以及类风湿关节炎[26]。目前认为NMOSD的发病机制主要以AQP4抗体介导的体液免疫机制为主,而中性粒细胞与淋巴细胞之间的平衡破坏是其病理生理基础之一,NLR值可反映中性粒细胞与淋巴细胞平衡破坏程度。另外,嗜酸性粒细胞在NMOSD中可能发挥着独特的作用,对其指标的进一步研究可能更有助于我们鉴别NMOSD与MS。研究表明,嗜酸性粒细胞可能通过损伤血脑屏障、T细胞免疫应答、补体依赖的细胞介导的细胞毒性、抗体依赖的细胞介导的细胞毒性、分泌细胞因子与趋化因子来促进NMOSD的自身免疫炎性反应的发展[27]。ELR作为一种新型炎症标志物逐渐受到临床工作者的关注。研究表明,ELR与炎症[28-29]、癌症[30]、COVID-19[31]疾病活动及预后有关。由于各种炎性细胞易受其他因素干扰,所以各炎细胞比率也可代表炎症动态平衡的变化。目前,NMOSD与MS同样作为脱髓鞘疾病在临床工作中易误诊,其诊断的鉴别除脊髓受累节段、抗体检测、颅内病灶部位主观依据之外,ELR作为一个早期、直观、便捷、特异的指标,可能将为NMOSD的诊断及病情判断提供一定的参考价值。中性粒细胞、嗜酸性粒细胞计数易受感染、应激等其他疾病的干扰,NLR、ELR值更为稳定,可以免受其他疾病的干扰, 代表了体内体液免疫炎症失衡状态。上述研究表明,NLR、ELR值可能与NMOSD的疾病活动性相关,目前急性期NLR、ELR值是否与NMOSD的疾病严重程度相关的研究相对较少。
本研究中,NMOSD组血清CRP、NLR、ELR、MLR、PLR均显著高于健康对照组,这些指标可能都与NMOSD发病有关。在进一步分析上述指标与疾病严重程度的关系时发现,血清CRP、MLR、PLR在轻症组与中重症组中差异无统计学意义(P>0.05)。这些指标的变化可能仅参与了NMOSD疾病的产生,而对炎症对神经细胞的破坏程度并无影响。而NLR(OR=4.082,95%CI=0.970-7.177,P=0.035)、ELR(OR=5.541,95%CI=0.001-8.225,P=0.045)可以判断疾病是否更易于发展为中重症NMOSD型,NLR的临界值为2.230, 其大于2.230时,疾病更容易发展为中重型;ELR的临界值为0.085,其大于0.085时,疾病更容易发展为中重型。血清中免疫炎性细胞易于检测,但炎性细胞计数不稳定,感染、应激等情况下也会出现一过性升高。因此,探讨炎性细胞比值与自身免疫炎症疾病的病情演变成为热点。研究表明,NLR可作为系统性红斑狼疮(SLE)、MS、硬皮病(SSc)等疾病活动期的标志物[32]。曹阳月等[33]通过对9例NMOSD患者急性期、缓解期的炎性细胞比值的分析发现, NLR变化对于疾病炎症活动有着重要意义。ELR与多种自身免疫疾病、炎症、哮喘等疾病的活动性有关[12]。而ELR可能对NMOSD的病情评价更具有特异性。通过患者早期ELR的升高,在诊断中也有助于与其他脱髓鞘疾病鉴别。另外,尹文文等[34]分析血液学指标对101例NMOSD患者病情严重程度影响时在单因素分析中发现MLR、CRP在病情严重程度分组中有差异, 而多元回归分析差异无统计学意义,结果仍然显示MLR、CRP与NMOSD病情严重程度无关,这与本研究结果相一致。CRP、MLR作为重要的炎性指标,尽管参与了NMOSD的发病过程并对其产生重要作用,但对NMOSD疾病的进展、加重并无影响。
本研究通过对61例NMOSD患者的临床特点、免疫炎性指标的比较,发现合并其他自身免疫抗体阳性、NLR、ELR在诊断之初对于评价NMOSD可能造成的残疾程度具有重要参考价值,可以成为今后临床工作中判断病情变化及演变的一个风险指标。

