氢氧化钠和赤霉素协同胁迫处理对不同贮藏年限薰衣草种子萌发和幼苗生长的影响1)
孙宇婷 莫丽娜 蔺海娇 白银凤 苑泽宁
(哈尔滨师范大学,哈尔滨,150025)
种子是植物生活史的关键起始阶段,种子萌发是幼苗建成的重要基础,种子萌发能力影响个体适合度及生活史特征,体现植物对环境的适应性[1]。影响植物种子萌发和休眠的因素有多种,如种皮的不透水性、种皮中的发芽抑制物、胚胎生长抑制物等,所以,打破休眠的方法可根据休眠的类型和植物种类的不同而异[2]。赤霉素(GA3)作为常用的植物生长调节剂,在解除植物种子休眠方面,可在短时间处理后显著提高发芽率[3]。氢氧化钠(NaOH)溶液作为对种子碱蚀或增加透性物质处理种子,但较高浓度通常降低种子生活力和发芽率,甚至使种子失去生活力[4]。
薰衣草(LavandulaangustifoliaMill.)种子的种皮外表光滑、坚硬,种皮内含有萌发抑制物限制种子萌发[5-6]。赤霉素通过使种子中的化学抑制物钝化或失效,打破休眠,提高种子的活力、发芽势、发芽率、发芽指数等[7-8]。已有研究认为:质量浓度为200 mg/L的赤霉素处理8 h时,狭叶薰衣草种子发芽率显著提升至54.67%,发芽势、发芽指数也最高[9];质量浓度为300 mg/L的赤霉素浸种12 h,对伊犁法国蓝薰衣草种子促进萌发的效果最好,萌发率达到58.00%[10];质量浓度为600 mg/L的赤霉素对新疆薰衣草浸种24 h,促进效果最显著,萌发率达64.59%[11];而采用无水冰醋酸或质量分数为1%的氢氧化钠浸种,打破休眠的效果不佳[11]。
目前,薰衣草在全球的主要分布区域有法国、日本、中国,在城市绿化、旅游观光、医药保健、食品日化等领域有广泛的应用价值;在当前市场效应环境中,其种植区域和面积不断扩大[12]。薰衣草种子繁殖作为其规模化生产的重要途径之一,不但可以避免扦插繁殖容易出现的植株早衰退化、抗病虫害能力减弱等现象[13],还可以筛选优良性状,延长植株寿命,为引种驯化中良种选育提供优质资源。为此,本研究在借鉴已有研究成果的基础上,以2017、2018、2019年采自生长在哈尔滨地区哈师大薰衣草园的薰衣草种子(贮藏时间1~3 a)为研究对象,采用不同质量分数的氢氧化钠溶液与不同质量浓度的赤霉素溶液对种子进行协同胁迫处理,以发芽率、发芽势、发芽指数、活力指数为评价指标,分析氢氧化钠与赤霉素协同胁迫处理对薰衣草种子萌发的影响;以种苗的鲜质量、干质量、含水量、苗长度、苗根长度为评价指标,分析氢氧化钠与赤霉素协同胁迫处理对薰衣草幼苗生长的影响;以贮藏时间为1~3 a的种子萌发及其幼苗生长状况为评价指标,分析贮藏时间对种子萌发及其幼苗生长的影响;筛选最佳处理组合和进一步提高薰衣草种子萌发率的方法。旨在为薰衣草的引种驯化、筛选优质种苗、扩大栽培提供参考。
1 材料与方法
供试材料:薰衣草(LavandulaangustifoliaMill.)种子分别于2017、2018、2019年采自哈师大薰衣草园(东经126°32′49″~126°33′11″,北纬45°51′50″~45°52′0″)。采收的种子置于室温下晾干清选,放入贮藏瓶,于冰箱4 ℃保存备用。
试验设计:氢氧化钠溶液质量分数分别设置为0、1%、2%、3%、4%;赤霉素质量浓度分别设置为0、50、100、150、200 mg/L;共25个处理(见表1),每个处理设3次重复,每次重复30粒种子,以蒸馏水浸种为对照(CK)。
选取大小均匀、饱满的薰衣草种子用蒸馏水冲洗干净后,用氢氧化钠溶液浸泡15 min;再用蒸馏水冲净后,浸泡于赤霉素溶液中;室温处理24 h后,用吸水纸吸干种子表面水分,播种于54 cm×27 cm×6 cm播种盘中,按垄播种,再覆盖约10 mm厚的表层土,浇水浸透基质(V(营养土)∶V(蛭石)=2∶1)。将播种盘置于温室中,气温为18~28 ℃,自然光照,保持土壤湿润。以胚根突出种皮长度超过种子直径,为萌发成功[14]。自播种开始,每天监测记录种子发芽数,试验周期为14 d。试验结束时,按每个重复收获幼苗。

表1 氢氧化钠与赤霉素溶液协同胁迫处理种子的设计
薰衣草种子萌发指标测定:根据记录数据,计算种子发芽率、发芽势、发芽指数、活力指数,各指标计算公式[15]:发芽率PG=(Nj/Nz)×100%;发芽势EG=(Ng/Nz)×100%;发芽指数IG=∑(Gr/t);活力指数IV=S×IG。Nj为试验结束时正常发芽的种子数,Nz为供试验的种子总数,Ng为发芽高峰期正常发芽的种子数,Gr为播种后每日净发芽数;t为对应Gr的时间(单位为d);S为幼苗生物量(鲜质量,单位为mg)。
薰衣草幼苗生长指标测定:记录种苗数,用电子分析天平(FA2004)测种苗鲜质量,用电热鼓风干燥箱(WGL-125B)70 ℃烘干至恒质量,测种苗干质量,计算种苗含水量,用刻度尺测种苗长度、根长度。各指标计算公式[16]:鲜质量MF=m1/n;干质量MD=m2/n;含水量W=[(m1-m2)/m1]×100%。m1为收苗时每个重复的鲜质量,m2为烘干后每个重复的干质量,n为收得种苗数量。
隶属函数法综合评价种子萌发:运用隶属函数综合评价氢氧化钠和赤霉素协同胁迫处理的萌发效果,对发芽率、发芽势、发芽指数、活力指数、平均发芽时间的隶属值进行累加,求取平均值,其值越大表明萌发效果越好。计算方法[16]:X(u)=(X-Xmin)/(Xmax-Xmin)。X为某一处理的某一指标的测定值,Xmax为所有处理在该指标中的最大值;Xmin为该指标中的最小值。
数据处理:用Microsoft Excel 2016统计种子萌发进程,运用SPSS 22.0进行不同贮藏时间、不同处理及种子萌发指标间皮尔逊(Pearson)相关性分析,采用一般线性模型多因素方差分析贮藏时间和不同处理对种子萌发的影响,运用方差分析的最小显著差异法(LSD)和邓肯法(Duncan)多重比较,进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 氢氧化钠和赤霉素协同胁迫处理对薰衣草种子萌发进程的影响
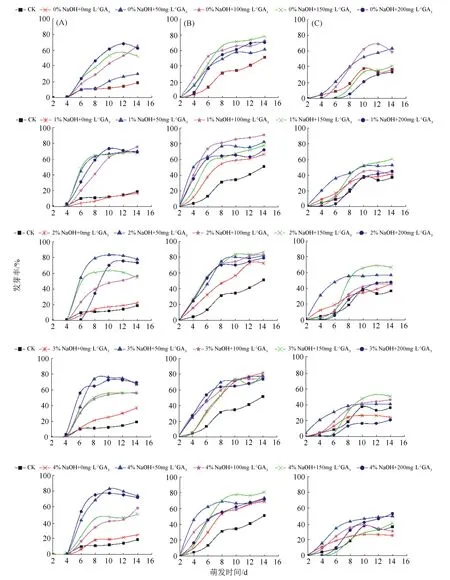
氢氧化钠和赤霉素协同胁迫处理对薰衣草种子萌发均具有促进作用(见图1)。贮藏1 a的种子,在播种4 d开始萌发;“质量分数为2%的氢氧化钠+质量浓度为50 mg/L的赤霉素”、“质量分数为3%的氢氧化钠+质量浓度为50 mg/L的赤霉素”协同胁迫处理处理,在播种8 d时萌发速率达到最大,在播种10 d后上升速度减慢。贮藏2、3 a的种子,在播种2 d开始萌发;贮藏2 a的种子,在播种8 d时萌发速率达到最大,在播种12 d后上升速度减慢;贮藏3 a的种子,在播种10 d时萌发速率达到最大,在播种12 d后上升速度减慢。从萌发速率看,由快到慢依次为贮藏1 a、贮藏2 a、贮藏3 a;从萌发进程看,贮藏2 a的种子萌发整齐度高于贮藏1、3 a的。
2.2 氢氧化钠和赤霉素协同胁迫处理对薰衣草种子萌发特性的影响
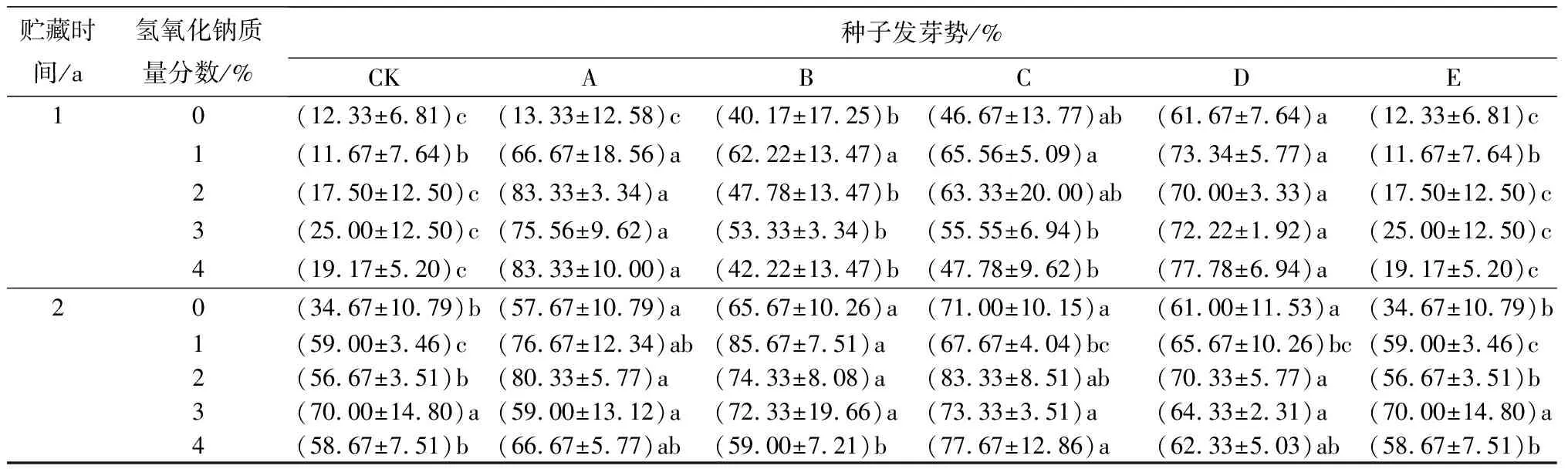
氢氧化钠和赤霉素协同胁迫处理使贮藏1、2 a的薰衣草种子发芽率和发芽势均显著高于对照组(见表2)。贮藏1 a的种子,在氢氧化钠质量分数相同时(1%~4%),发芽率在赤霉素质量浓度为50 mg/L时显著上升,随后降低,在赤霉素质量浓度为200 mg/L时发芽率又升高。当赤霉素单独胁迫处理时,发芽势随其质量浓度升高显著上升,至赤霉素质量浓度为200 mg/L时发芽势达到最高(81.67%)。当氢氧化钠和赤霉素协同胁迫处理时,在氢氧化钠的作用下,低质量浓度的赤霉素使发芽率和发芽势显著升高。贮藏2 a的种子,发芽率和发芽势高于贮藏3 a的,变化趋势均先升高后降低。贮藏2 a的种子,“质量分数为1%的氢氧化钠+质量浓度为100 mg/L的赤霉素”协同胁迫处理时,发芽率和发芽势均达到最大值,分别为91.11%、85.67%。
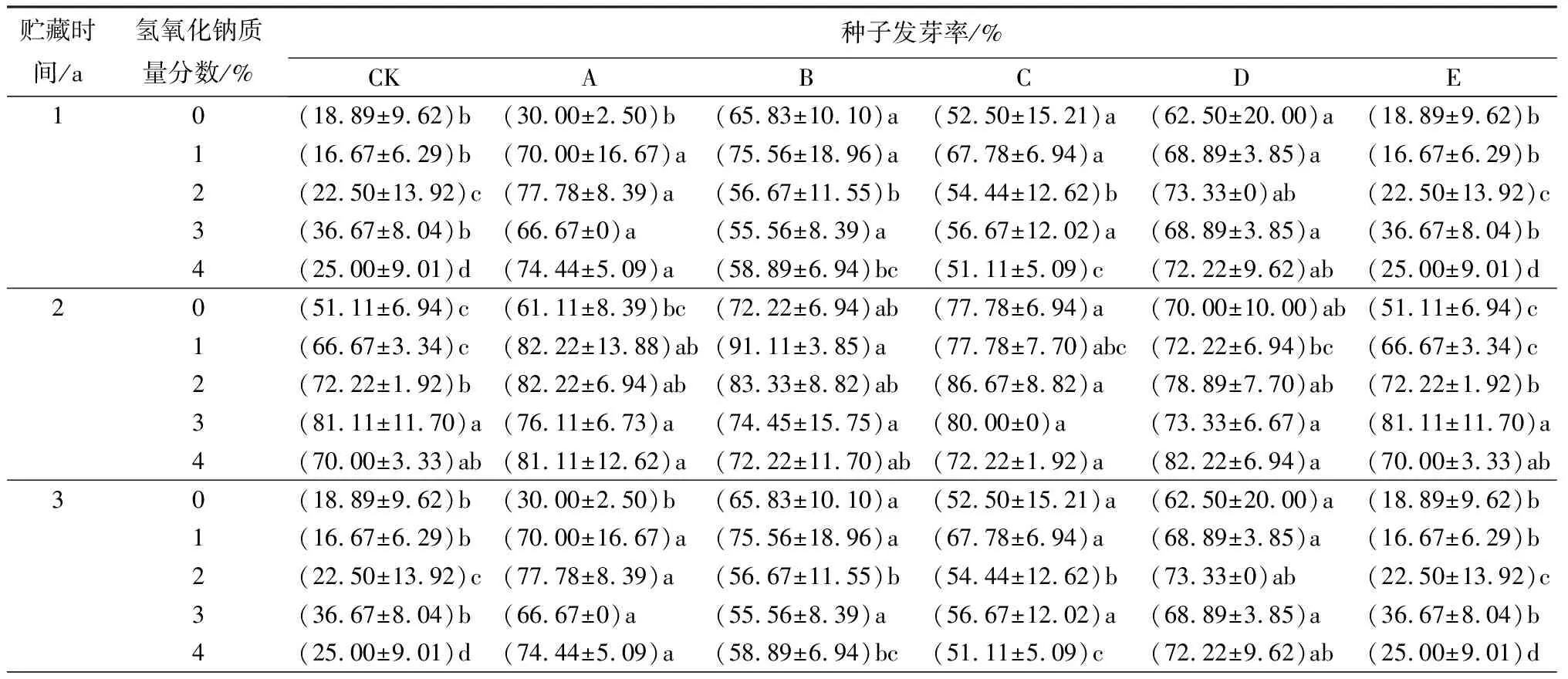
表2 氢氧化钠与赤霉素协同胁迫处理的薰衣草种子发芽率和发芽势测定结果
贮藏时间/a氢氧化钠质量分数/%种子发芽势/%CKABCDE10(12.33±6.81)c(13.33±12.58)c(40.17±17.25)b(46.67±13.77)ab(61.67±7.64)a(12.33±6.81)c1(11.67±7.64)b(66.67±18.56)a(62.22±13.47)a(65.56±5.09)a(73.34±5.77)a(11.67±7.64)b2(17.50±12.50)c(83.33±3.34)a(47.78±13.47)b(63.33±20.00)ab(70.00±3.33)a(17.50±12.50)c3(25.00±12.50)c(75.56±9.62)a(53.33±3.34)b(55.55±6.94)b(72.22±1.92)a(25.00±12.50)c4(19.17±5.20)c(83.33±10.00)a(42.22±13.47)b(47.78±9.62)b(77.78±6.94)a(19.17±5.20)c20(34.67±10.79)b(57.67±10.79)a(65.67±10.26)a(71.00±10.15)a(61.00±11.53)a(34.67±10.79)b1(59.00±3.46)c(76.67±12.34)ab(85.67±7.51)a(67.67±4.04)bc(65.67±10.26)bc(59.00±3.46)c2(56.67±3.51)b(80.33±5.77)a(74.33±8.08)a(83.33±8.51)ab(70.33±5.77)a(56.67±3.51)b3(70.00±14.80)a(59.00±13.12)a(72.33±19.66)a(73.33±3.51)a(64.33±2.31)a(70.00±14.80)a4(58.67±7.51)b(66.67±5.77)ab(59.00±7.21)b(77.67±12.86)a(62.33±5.03)ab(58.67±7.51)b
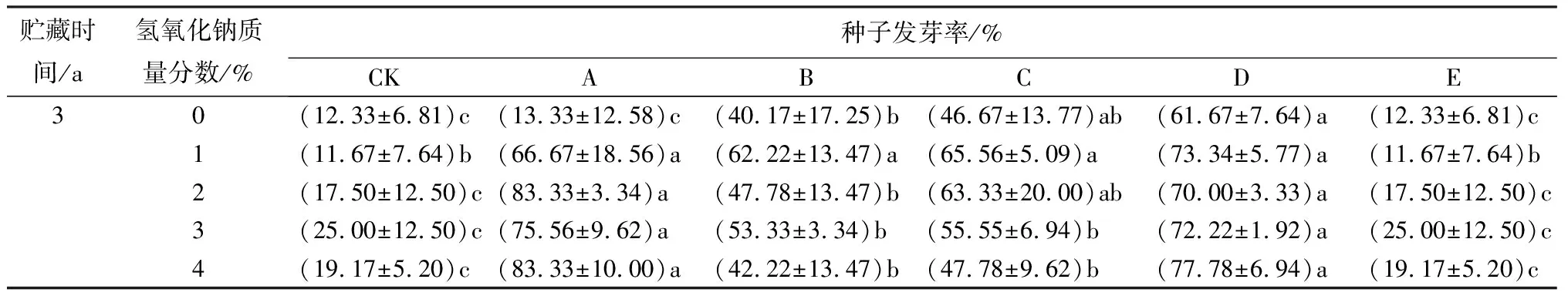
续(表2)
(A)列为贮藏时间为1 a;(B)列为贮藏时间为2 a;(C)列为贮藏时间为3 a。
氢氧化钠和赤霉素的协同胁迫处理,贮藏1、2 a的种子发芽指数和活力指数均显著高于对照组(见表3)。同一质量分数的氢氧化钠溶液与不同质量浓度的赤霉素溶液协同胁迫处理,使贮藏1 a种子的发芽指数和活力指数,均高于贮藏2、3 a种子的。贮藏1 a的种子,在“质量分数为2%的氢氧化钠+质量浓度为50 mg/L的赤霉素”协同胁迫处理时,发芽指数和活力指数与对照组相比均显著升高,分别达到4.90、114.44,是对照组的5.1、6.8倍。
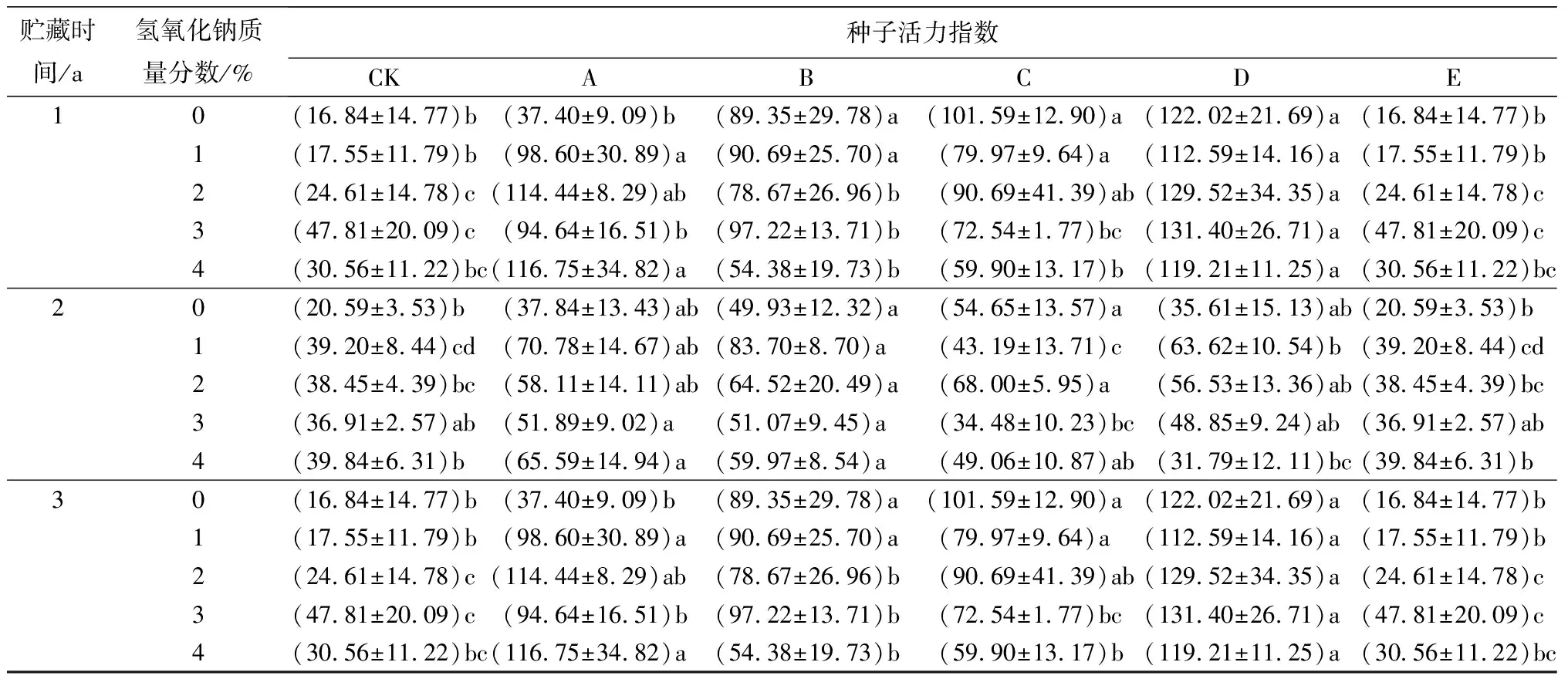
贮藏时间/a氢氧化钠质量分数/%种子活力指数CKABCDE10(16.84±14.77)b(37.40±9.09)b(89.35±29.78)a(101.59±12.90)a(122.02±21.69)a(16.84±14.77)b1(17.55±11.79)b(98.60±30.89)a(90.69±25.70)a(79.97±9.64)a(112.59±14.16)a(17.55±11.79)b2(24.61±14.78)c(114.44±8.29)ab(78.67±26.96)b(90.69±41.39)ab(129.52±34.35)a(24.61±14.78)c3(47.81±20.09)c(94.64±16.51)b(97.22±13.71)b(72.54±1.77)bc(131.40±26.71)a(47.81±20.09)c4(30.56±11.22)bc(116.75±34.82)a(54.38±19.73)b(59.90±13.17)b(119.21±11.25)a(30.56±11.22)bc20(20.59±3.53)b(37.84±13.43)ab(49.93±12.32)a(54.65±13.57)a(35.61±15.13)ab(20.59±3.53)b1(39.20±8.44)cd(70.78±14.67)ab(83.70±8.70)a(43.19±13.71)c(63.62±10.54)b(39.20±8.44)cd2(38.45±4.39)bc(58.11±14.11)ab(64.52±20.49)a(68.00±5.95)a(56.53±13.36)ab(38.45±4.39)bc3(36.91±2.57)ab(51.89±9.02)a(51.07±9.45)a(34.48±10.23)bc(48.85±9.24)ab(36.91±2.57)ab4(39.84±6.31)b(65.59±14.94)a(59.97±8.54)a(49.06±10.87)ab(31.79±12.11)bc(39.84±6.31)b30(16.84±14.77)b(37.40±9.09)b(89.35±29.78)a(101.59±12.90)a(122.02±21.69)a(16.84±14.77)b1(17.55±11.79)b(98.60±30.89)a(90.69±25.70)a(79.97±9.64)a(112.59±14.16)a(17.55±11.79)b2(24.61±14.78)c(114.44±8.29)ab(78.67±26.96)b(90.69±41.39)ab(129.52±34.35)a(24.61±14.78)c3(47.81±20.09)c(94.64±16.51)b(97.22±13.71)b(72.54±1.77)bc(131.40±26.71)a(47.81±20.09)c4(30.56±11.22)bc(116.75±34.82)a(54.38±19.73)b(59.90±13.17)b(119.21±11.25)a(30.56±11.22)bc
2.3 氢氧化钠和赤霉素协同胁迫处理对薰衣草幼苗生长的影响
对照组种苗生物量鲜质量、干质量、苗长,均为种子贮藏1 a的大于种子贮藏2、3 a的;氢氧化钠与赤霉素协同胁迫处理,使种苗鲜质量、干质量、苗长显著高于对照组,含水量普遍差异不显著,贮藏1 a种子的种苗鲜质量、干质量高于贮藏2、3 a的(见表4、表5)。“质量分数为3%的氢氧化钠+质量浓度为100 mg/L的赤霉素”协同胁迫处理,种苗鲜质量达到最大值(29.13 mg),是对照组的1.87倍;“质量分数为1%的氢氧化钠+质量浓度为100 mg/L的赤霉素”协同胁迫处理,种苗干质量达到最大值(3.15 mg),是对照组的2.17倍。同一质量分数氢氧化钠时,质量浓度为100、200 mg/L的赤霉素对贮藏1a种子的种苗鲜质量影响显著,质量浓度为100 mg/L的赤霉素对贮藏1 a种子的种苗干质量影响显著(见表4)。
贮藏1 a种子的种苗根系发达,须根明显多于贮藏2、3 a的(见图2)。在氢氧化钠与赤霉素协同胁迫处理时,贮藏1 a薰衣草种子的种苗苗长差异不显著,总体上高于贮藏2、3 a的。根长普遍差异不显著(见表5、图2)。

表4 氢氧化钠与赤霉素协同胁迫处理的薰衣草幼苗生物量和含水量测定结果

贮藏时间/a氢氧化钠质量分数/%幼苗干质量/mgCKABCDE10(1.45±0.44)b(1.89±0.32)ab(2.04±0.28)ab(2.24±0.11)b(2.24±0.12)b(1.45±0.44)b1(1.47±0.28)c(2.05±0.21)bc(3.15±0.45)a(1.66±0.06)bc(2.13±0.34)b(1.47±0.28)c2(1.55±0.05)c(2.22±0.22)b(2.81±0.03)a(1.79±0.17)bc(2.16±0.25)b(1.55±0.05)c3(1.80±0.24)cd(2.22±0.27)bc(3.06±0.30)a(1.79±0.25)cd(2.42±0.23)b(1.80±0.24)cd4(1.65±0.25)b(2.28±0.43)a(2.29±0.19)a(1.47±0.18)b(2.30±0.09)a(1.65±0.25)b20(1.04±0.12)d(1.09±0.09)cd(1.31±0.10)bc(1.84±0.21)a(1.44±0.14)b(1.04±0.12)d1(1.26±0.13)ab(1.33±0.18)a(1.46±0.09)a(1.33±0.09)a(1.38±0.18)a(1.26±0.13)ab2(1.10±0.08)a(1.52±0.35)ab(1.72±0.51)b(1.63±0.02)ab(1.34±0.21)a(1.10±0.08)a3(1.11±0.07)bc(1.45±0.12)a(1.29±0.12)ab(1.24±0.17)abc(1.37±0.09)a(1.11±0.07)bc4(1.13±0.06)ab(1.35±0.31)a(1.20±0.07)ab(1.34±0.12)a(1.25±0.09)ab(1.13±0.06)ab30(1.12±0.03)b(1.56±0.22)ab(1.43±0.61)ab(1.63±0.23)ab(1.69±0.04)a(1.12±0.03)b1(1.13±0.05)b(1.48±0.09)a(1.11±0.13)b(1.44±0.11)a(1.52±0.25)a(1.13±0.05)b2(1.28±0.06)cd(1.57±0.10)b(1.34±0.12)bcd(1.43±0.14)bc(1.82±0.24)a(1.28±0.06)cd3(1.19±0.34)a(1.51±0.08)a(5.02±5.73)a(1.53±0.08)a(1.50±0.16)a(1.19±0.34)a4(1.21±0.13)ab(1.40±0.14)a(0.89±0.32)b(1.26±0.21)a(1.31±0.16)a(1.21±0.13)ab

贮藏时间/a氢氧化钠质量分数/%幼苗含水量/g·g-1CKABCDE10(90.44±1.08)a(91.45±0.30)a(91.10±0.28)a(91.17±0.17)a(91.61±0.34)a(90.44±1.08)a1(90.24±0.90)a(90.94±0.91)a(88.24±0.88)b(91.35±0.50)a(91.12±0.53)a(90.24±0.90)a2(90.40±2.23)ab(90.48±0.60)ab(89.08±0.99)b(91.83±0.60)a(91.46±0.17)a(90.40±2.23)ab3(91.13±0.24)ab(90.28±0.84)bc(89.52±0.50)c(91.81±0.52)a(90.75±0.72)abc(91.13±0.24)ab4(91.03±1.04)ab(90.79±0.17)ab(90.25±0.53)b(92.05±0.79)a(90.54±0.83)ab(91.03±1.04)ab20(91.61±0.24)ab(92.74±0.51)a(91.53±0.39)ab(89.59±1.44)bc(88.56±3.45)c(91.61±0.24)ab1(91.90±0.48)ab(92.49±0.95)ab(92.78±0.28)a(91.18±1.29)b(92.48±0.46)ab(91.90±0.48)ab2(92.46±0.47)a(91.34±1.36)ab(90.38±1.28)b(91.59±0.55)ab(92.23±0.64)a(92.46±0.47)a3(91.58±1.13)abc(92.78±0.15)a(92.08±0.33)ab(90.13±1.23)c(90.90±1.19)bc(91.58±1.13)abc4(92.56±0.72)ab(92.81±0.38)ab(93.56±0.26)a(91.74±0.55)b(88.53±1.82)c(92.56±0.72)ab30(91.03±1.44)a(92.70±0.98)a(92.32±1.76)a(92.04±0.73)a(90.91±1.44)a(91.03±1.44)a1(93.24±0.55)a(93.61±0.20)a(71.64±39.03)a(93.02±0.09)a(92.84±0.52)a(93.24±0.55)a2(92.87±0.38)abc(94.01±0.20)a(93.58±0.26)ab(91.64±2.01)bc(92.73±0.33)abc(92.87±0.38)abc3(92.93±1.13)a(93.78±0.34)a(76.51±27.37)a(92.32±0.81)a(92.94±1.02)a(92.93±1.13)a4(93.40±0.68)a(94.26±0.31)a(93.49±0.26)a(92.77±1.18)a(92.75±0.79)a(93.40±0.68)a

表5 氢氧化钠与赤霉素协同胁迫处理的薰衣草幼苗长度和根长测定结果
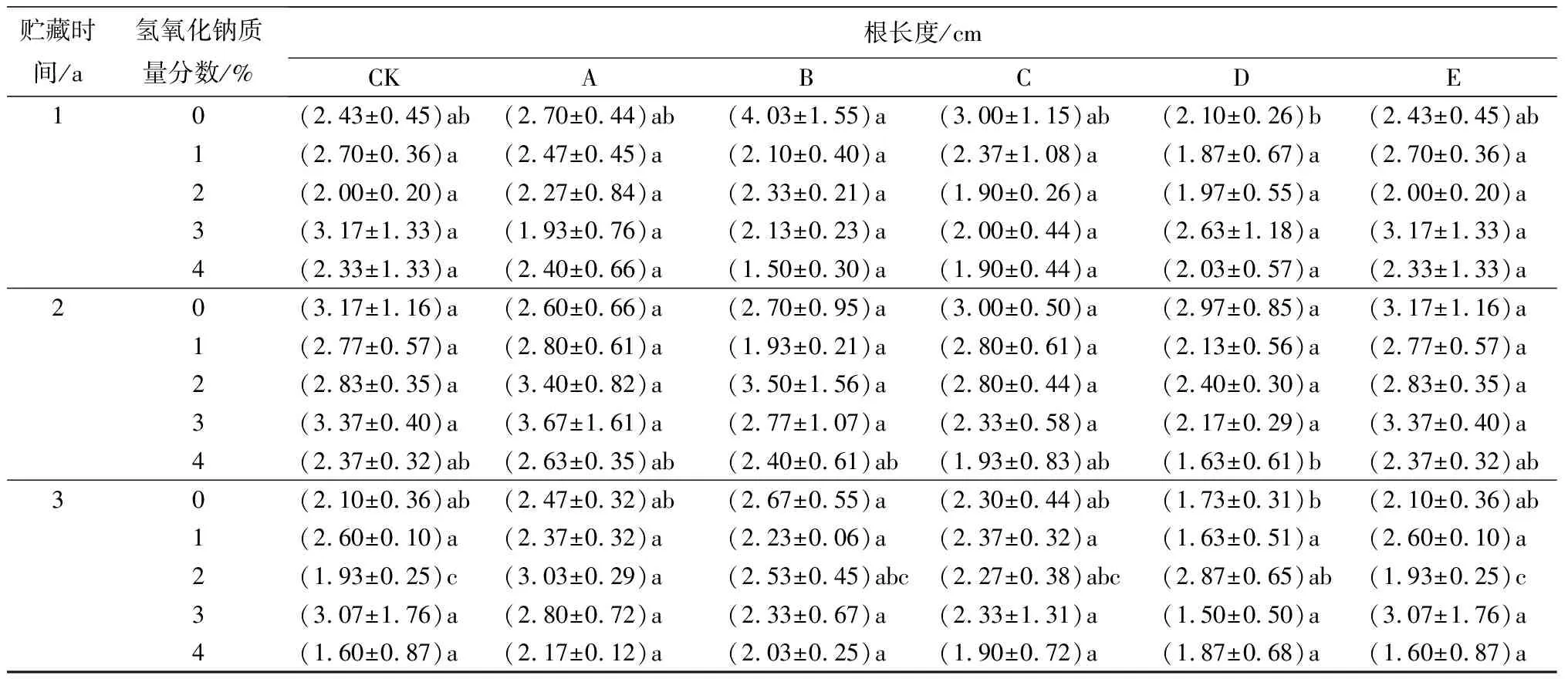
贮藏时间/a氢氧化钠质量分数/%根长度/cmCKABCDE10(2.43±0.45)ab(2.70±0.44)ab(4.03±1.55)a(3.00±1.15)ab(2.10±0.26)b(2.43±0.45)ab1(2.70±0.36)a(2.47±0.45)a(2.10±0.40)a(2.37±1.08)a(1.87±0.67)a(2.70±0.36)a2(2.00±0.20)a(2.27±0.84)a(2.33±0.21)a(1.90±0.26)a(1.97±0.55)a(2.00±0.20)a3(3.17±1.33)a(1.93±0.76)a(2.13±0.23)a(2.00±0.44)a(2.63±1.18)a(3.17±1.33)a4(2.33±1.33)a(2.40±0.66)a(1.50±0.30)a(1.90±0.44)a(2.03±0.57)a(2.33±1.33)a20(3.17±1.16)a(2.60±0.66)a(2.70±0.95)a(3.00±0.50)a(2.97±0.85)a(3.17±1.16)a1(2.77±0.57)a(2.80±0.61)a(1.93±0.21)a(2.80±0.61)a(2.13±0.56)a(2.77±0.57)a2(2.83±0.35)a(3.40±0.82)a(3.50±1.56)a(2.80±0.44)a(2.40±0.30)a(2.83±0.35)a3(3.37±0.40)a(3.67±1.61)a(2.77±1.07)a(2.33±0.58)a(2.17±0.29)a(3.37±0.40)a4(2.37±0.32)ab(2.63±0.35)ab(2.40±0.61)ab(1.93±0.83)ab(1.63±0.61)b(2.37±0.32)ab30(2.10±0.36)ab(2.47±0.32)ab(2.67±0.55)a(2.30±0.44)ab(1.73±0.31)b(2.10±0.36)ab1(2.60±0.10)a(2.37±0.32)a(2.23±0.06)a(2.37±0.32)a(1.63±0.51)a(2.60±0.10)a2(1.93±0.25)c(3.03±0.29)a(2.53±0.45)abc(2.27±0.38)abc(2.87±0.65)ab(1.93±0.25)c3(3.07±1.76)a(2.80±0.72)a(2.33±0.67)a(2.33±1.31)a(1.50±0.50)a(3.07±1.76)a4(1.60±0.87)a(2.17±0.12)a(2.03±0.25)a(1.90±0.72)a(1.87±0.68)a(1.60±0.87)a

(A)为种子贮藏时间1 a;(B)为种子贮藏时间2 a;(C)为种子贮藏时间3 a。
2.4 氢氧化钠、赤霉素、贮藏时间协同胁迫处理对薰衣草种子萌发和幼苗生长的影响
由表6可见:贮藏时间和赤霉素均对种子萌发有显著影响(P<0.01,P<0.05);除幼苗的干质量、含水量外,氢氧化钠对其他指标均有显著影响(P<0.01)。对种子萌发指标的影响程度,由大到小依次为氢氧化钠和赤霉素协同胁迫处理、贮藏时间和赤霉素协同胁迫处理、贮藏时间和氢氧化钠协同胁迫处理,P<0.01、P<0.05;“贮藏时间×氢氧化钠×赤霉素”协同胁迫处理,对种子发芽率、发芽势、发芽指数、活力指数有显著影响(P<0.01,见表6)。由F值看出,单因素影响由大到小依次为贮藏时间、赤霉素、氢氧化钠;双因素影响程度,由大到小依次为贮藏时间和赤霉素协同胁迫处理、氢氧化钠和赤霉素协同胁迫处理、贮藏时间和氢氧化钠协同胁迫处理。
2.5 薰衣草种子萌发和幼苗生长的相关性
经皮尔逊(Pearson)相关性分析,由表7可见:贮藏时间与发芽势、发芽指数、活力指数、鲜质量、干质量、苗长呈负相关(P<0.01、P<0.05);氢氧化钠与苗长呈正相关、与根长呈负相关(P<0.01);赤霉素,与发芽率、发芽势、发芽指数、活力指数、鲜质量、干质量呈正相关(P<0.01,P<0.05),与根长呈负相关(P<0.01)。由表8可见:发芽率、发芽势、发芽指数、活力指数间,呈正相关;鲜质量与发芽势、发芽指数、活力指数呈正相关,干质量与发芽指数、活力指数、鲜质量呈正相关(P<0.01),苗长与发芽率、发芽势呈负相关(P<0.01),但根长与发芽率、发芽势呈正相关(P<0.05)。

表6 氢氧化钠、赤霉素、贮藏时间协同胁迫处理对薰衣草种子萌发和幼苗生长影响的显著性
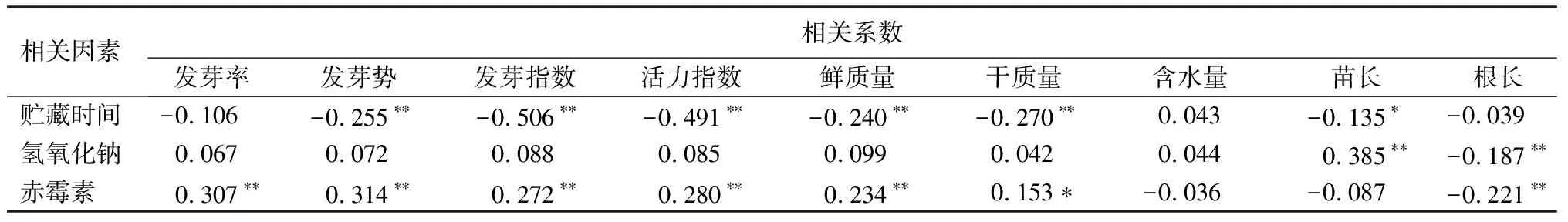
表7 氢氧化钠、赤霉素、贮藏时间的协同胁迫处理与薰衣草种子萌发和幼苗生长的相关系数

表8 薰衣草种子萌发与幼苗生长指标的相关系数
2.6 氢氧化钠与赤霉素协同胁迫处理对不同贮藏时间薰衣草种子萌发效果的综合评价
由表9可见:贮藏1年和3年的种子经“质量分数为2%的氢氧化钠+质量浓度为50 mg/L的赤霉素”协同胁迫处理,最大隶属函数值分别为0.95和0.85,贮藏2年的种子经“质量分数为1%的氢氧化钠+质量浓度为100 mg/L的赤霉素”协同胁迫处理,最大隶属函数值为1.00。可见,在NaOH的作用下,较低浓度的GA3对薰衣草种子萌发产生很好的促进效果。
3 讨论
在影响种子萌发的诸多因素中,种子休眠、贮藏时间对其萌发具有显著影响[17]。休眠虽有利于植物防御逆境,具有适应的生态学意义[18-20],但种子休眠期长导致的发芽延迟或发芽率低,则对农业生产造成影响。外源激素及化学药剂处理,是解除种子休眠常用、简单、易行、有效的方法,具有重要的实践意义[20]。
3.1 氢氧化钠和赤霉素及贮藏时间协同胁迫处理对薰衣草种子休眠的影响
种子萌发进程影响植物的幼苗生长、生物量等生活史特征[21]。本研究中,贮藏1 a的种子,在播种4 d开始萌发,播种10 d时达到最高萌发率,氢氧化钠和赤霉素对贮藏1 a的种子解除休眠作用最明显。贮藏2、3 a的种子,起始萌发时间比贮藏1 a的种子早2 d(见图1),这与贮藏时间延长使种皮内萌发抑制物减少有关;但达到最大萌发率的时间,比贮藏1 a的种子晚2 d,这与薰衣草种子细小(1.002~1.086 mg/粒),贮藏时间延长使种子内营养物质消耗,萌发速率下降有关。
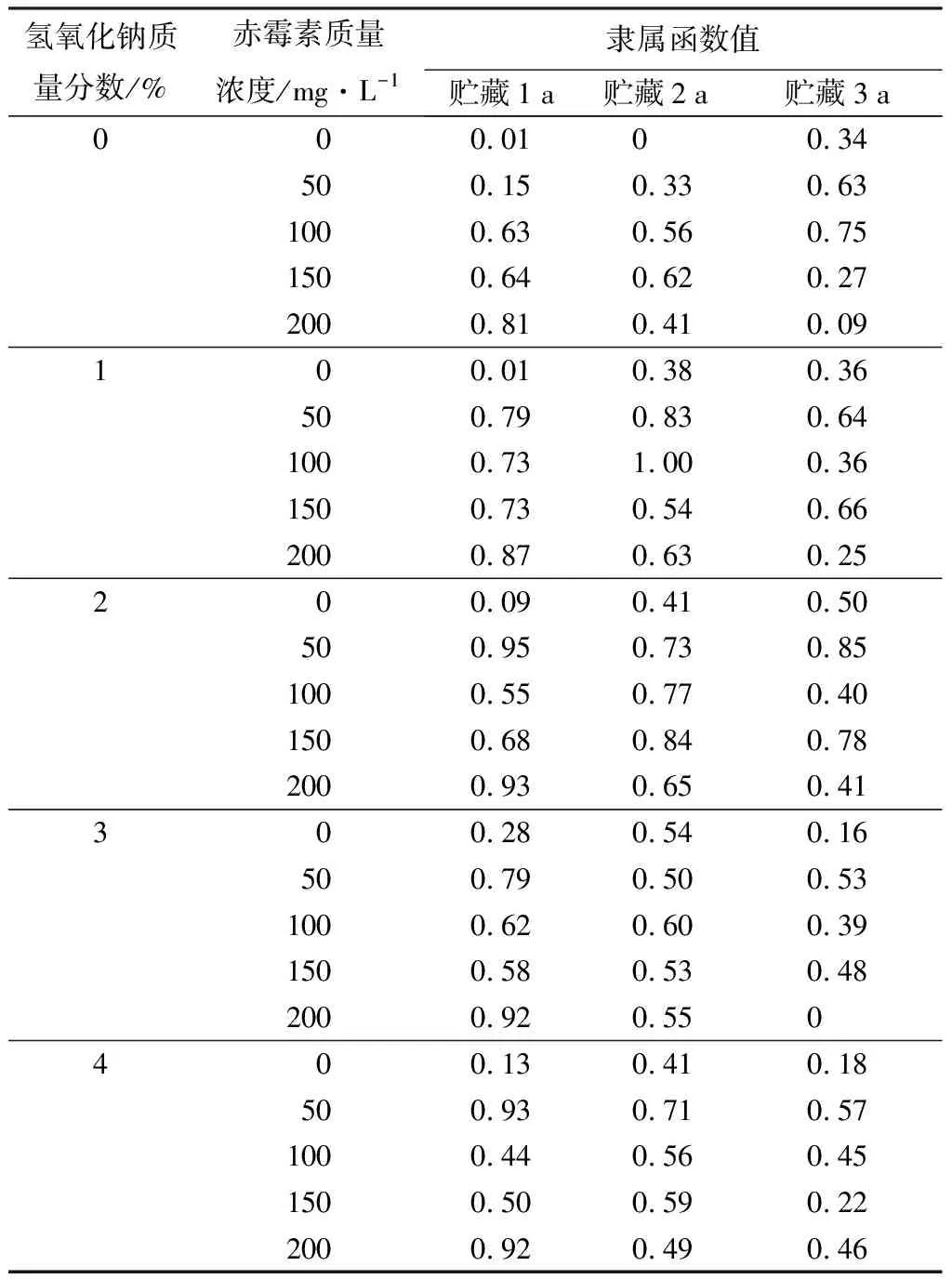
表9 氢氧化钠与赤霉素协同胁迫处理对不同贮藏时间薰衣草种子萌发效果综合评价的隶属函数值
3.2 氢氧化钠和赤霉素协同胁迫处理对薰衣草种子萌发的影响
通常,种子发芽率、发芽势、发芽指数、活力指数等指标,反映种子的活力状况[22]。在本研究中,薰衣草种子发芽率、发芽势、发芽指数、活力指数间相互均呈现正相关,表明这些指标间的影响是相互促进的(见表8)。
种子发芽质量可通过发芽率和发芽势反映,发芽势反映种子发芽快慢和整齐度,发芽势高的种子生活力强,具有一定抵抗自然灾害的能力,对田间生产具有指导作用[23-24]。有研究表明,发芽势、发芽率随着贮藏年限的增加,呈下降趋势,贮藏1 a的紫花苜蓿种子和秣食豆种子发芽率和发芽势均显著高于贮藏3 a的种子[25-26]。本研究中,贮藏1、2 a的薰衣草种子,发芽率、发芽势均大于贮藏3 a的种子(见表2),贮藏1 a的种子在“质量分数为2%的氢氧化钠+质量浓度为50 mg/L的赤霉素”、贮藏2 a的种子在“质量分数为1%的氢氧化钠+质量浓度为100 mg/L的赤霉素”协同胁迫处理时,发芽率分别达到77.78%、91.11%(见图1)。与已有研究报道的薰衣草种子发芽率(60.42%~62.22%)[11,27]相比,本研究中氢氧化钠和赤霉素协同胁迫处理,促进薰衣草种子萌发的效果更显著,且提高了种子萌发的整齐度。本研究表明,贮藏2 a的种子发芽率和发芽势,总体上略高于贮藏1 a的种子(见表2);推测,随贮藏时间的延长,种子的休眠作用减弱。
发芽指数和活力指数作为衡量种子活力的重要指标,不但使发芽率指标更细致化和深度化,而且综合了发芽速率和生长量评价种子萌发情况[28]。本研究中,薰衣草种子萌发指数、活力指数,由大到小依次为贮藏1 a、贮藏2 a、贮藏3 a(见表3);随贮藏时间延长,种子内营养成分减少,对种子活力产生一定影响[29]。贮藏时间对薰衣草种子萌发的影响,比赤霉素、氢氧化钠的影响大,且以负相关为主(见表7)。但随贮藏时间延长,薰衣草种子仍保持较高的萌发活力,贮藏3 a的种子在“质量分数为2%的氢氧化钠+质量浓度为150 mg/L的赤霉素”协同胁迫处理时,萌发率达78.89%、活力指数最高达86.68%,表明哈尔滨地区薰衣草种子的萌发能力较强,较耐贮藏,可为高寒地区薰衣草的引种驯化及推广应用提供种子资源。
3.3 氢氧化钠和赤霉素的协同胁迫处理对薰衣草幼苗生长的影响
植株的鲜质量、干质量直接反应植株的生长状况及有机物积累能力,与植株长势密切相关[30]。随着种子贮藏时间的延长,幼苗高、根长、幼苗生物量等性状呈下降趋势[25]。本研究中,薰衣草种苗生物量鲜质量、干质量、苗长,在“同一质量分数氢氧化钠和不同质量浓度赤霉素”协同胁迫处理时,均为贮藏1 a的种子苗高于贮藏2、3 a的种子(见表4);氢氧化钠和赤霉素的协同胁迫处理对幼苗生长的影响,大于贮藏时间和赤霉素的协同胁迫处理、贮藏时间和氢氧化钠的协同胁迫处理对幼苗生长的影响(见表6)。
植物幼苗地上部分光合能力较弱,根系成为营养物质吸收、传送的主要器官,细根的功能主要是吸收营养,粗根的功能主要是运输养分并使植株稳定在土壤中[31]。本研究中,贮藏1 a种子苗的根系有大量细根(见图2(A)),为种苗茁壮生长提供充足的水分及营养物质,养分通过资源分配,营养物质较多地分布到地上部分,促进种苗伸长。根分配到的营养物质相对减少,是导致贮藏1 a的种子苗根较短的原因(见表5、图2)。而贮藏2、3 a的种子幼苗,主根发达,细根极少(见图2(B)、(C)),说明随贮藏时间延长,种子的营养物质被消耗,萌发后的资源分配倾向于通过根的快速伸长,以便于从外界获取养分。这与最优分配理论和生长平衡假说所强调的,植物为更有效地获取环境中的资源,将资源分配到最需要的器官中结论相符[31]。
3.4 应用隶属函数综合分析对促进薰衣草种子萌发的最佳协同胁迫处理条件的遴选
氢氧化钠和赤霉素对不同贮藏年限的种子萌发均有一定的促进作用,但每个处理组合对不同指标的影响不同,凭某一指标难以全面评价各处理组的种子萌发效果。为此,本研究采用隶属函数综合分析,对贮藏1 a和3 a的种子萌发的最佳处理为“质量分数为2%的氢氧化钠+质量浓度为50 mg/L的赤霉素”协同胁迫处理,贮藏2 a的种子萌发的最佳处理为“质量分数为1%的氢氧化钠+质量浓度为100 mg/L的赤霉素”协同胁迫处理(见表9)。因此,在生产实践上,根据种子不同贮藏年限,采用不同氢氧化钠和赤霉素协同胁迫处理以达到较好的萌发和幼苗生长效果,可为薰衣草在我国北方高寒地区的推广应用提供技术支撑。

