红汁乳菇16个萜类合成酶基因的鉴定与表达1)
李云琴 王毅 原晓龙 杨文忠
(云南省森林植物培育与开发利用重点实验室(云南省林业和草原科学院),昆明,650201)
食用菌是一类营养丰富、可供人们食用的大型真菌的总称,菌根食用菌是外生菌根真菌中具有食用价值的大型真菌的统称[1]。食用菌富含糖类、蛋白质、矿物质、维生素,营养丰富、味道鲜美、质地脆嫩,正在发展成为动物、植物性食物之外的第3类食物[2],备受人们的青睐;除了良好的营养特性,真菌还具有多样化的生理活性功能,其子实体,菌丝体和发酵液中均富含酚酸、萜类、多糖、维生素类、嘌呤类和有机酸等多种活性物质[3],能抗氧化、抗肿瘤、抗菌和抗炎等。真菌含有结构类型丰富和生理活性多样的次生代谢产物,为现代药物获取和保健食品、化妆品等的开发提供了重要的新资源[4-5]。
萜类化合物是天然产物中的最大家族,广泛存在于真菌中[4]。目前报道的从真菌中分离得到的萜类化合物种类众多,有单萜、倍半萜、二萜和三萜类化合物,萜类化合物以其丰富的生物活性,成为有机化学、药物化学、生物学等多个学科和医药、香料、食品、农业等多种产业极其重要的天然产物研究对象[4]。萜类化合物的通用结构单元是C5前体异戊烯二磷酸(IPP)和二甲基烯丙基二磷酸(DMAPP)。DMAPP与1个或多个IPP连续缩合产生各种链长的线性二磷酸异戊烯化合物:香叶基二磷酸(C10,GPP),法呢基焦磷酸(C15,FPP),香叶基香叶基二磷酸(C20,GGPP),这些前驱体由萜类合成酶(TPS)催化生成单萜(C10)、倍半萜(C15)、二萜(C20),以及其他化合物[6]。因此,TPS被认为是萜类化合物生物合成的关键酶,由于其数量庞大,种类繁多,构成了TPS基因家族,萜类合成酶种类和功能也决定了萜类化合物的多样性,因而萜类合成酶成了萜类生物合成过程中研究最多和最深入的酶类[7]。
红汁乳菇(Lactariushatsudake)为担子菌门(Basidiomycota)伞菌目(Agaricales)红菇科(Russulaceae)乳菇属(Lactarius)的菌根食用菌,在我国广泛分布[8]。红汁乳菇菌肉肥厚、味道鲜美、风味独特,富含氨基酸、矿物质和维生素等人体所需营养物质,深受大众喜爱[9]。不仅如此,红汁乳菇还具有很好药用功效,有研究表明其提取物对小白鼠肉瘤180和艾氏癌的抑制率分别达到100%和90%[10];其乙醚和乙酸乙酯的提取物对大肠杆菌、沙门氏菌、啤酒酵母和枯草芽孢杆菌有抗菌作用[11];多糖体对肿瘤有较高的抑制率[9]。另外,红汁乳菇还可用于生产橡胶、营林[9]等,开发利用前景广阔。但是目前为止,未见关于红汁乳菇萜类活性成分及TPS基因的报道,本研究从红汁乳菇基因组中分离出TPS基因,通过生物信息学及基因功能分析,以及在不同碳氮源培养基上的相对表达量的分析,基因簇分析等,为后续对红汁乳菇中萜类活性物质的研究和开发提供一些思路与参考,也为了产业化开发红汁乳菇资源提供一定的理论支持。
1 材料与方法
1.1 试验菌种
从云南省宜良县采集大小适中且完好的红汁乳菇新鲜子实体带回实验室编号,并用75%酒精消毒,用食用菌组织分离法在无菌条件下切碎子实体后接种在MY(malt yeast extract,BD)斜面培养基上,避光28 ℃培养15 d,将菌落直径为1 cm左右无污染的菌丝转接到新的MY平板培养基上。经过ITS鉴定为红汁乳菇(Lactariushatsudake),菌株号:YAF0304。
1.2 培养基
不同碳源培养基的配制,以3.0 g·L-1的酵母提取物和6.0 g·L-1的麦芽浸粉为基础,分别添加10.0和2.0 g·L-12种质量浓度的山梨醇、肌醇、甘露糖、果糖、葡萄糖、麦芽糖、蔗糖、可溶性淀粉;不同氮源培养基的配制,以6.0 g·L-1的葡萄糖和1.8 g·L-1的麦芽糖为基础,分别添加6.0 g·L-1的马铃薯浸粉、大豆蛋白胨、胰蛋白胨、牛肉浸粉和番茄浸粉;均在28 ℃条件下固体培养,检测红汁乳菇萜类合成酶基因的表达情况。
1.3 总RNA提取和cDNA合成
将菌丝接种于上述培养基,28 ℃固体培养30 d后,菌丝体分装为小份样品(每份菌丝量50 mg),在液氮中粉碎,参照康为世纪的RNA提取试剂盒提取总RNA,使用微量分光光度计Thermo NanoDrop 2000和1.5%的琼脂糖凝胶电泳检测RNA的浓度以及完整性。参照北京全式金生物公司的试剂盒进行RNA反转录。
1.4 红汁乳菇全基因组中TPS基因的搜索与预测
我们以牛樟芝中的TPS为模板,采用本地BLAST在线软件对红汁乳菇的基因组进行比对分析,获得候选基因序列后,并将候选基因序列与NCBI蛋白数据库比对进行确定。
1.5 蛋白理化性质分析
用ExPASy protparam tool、NetPhos 3.1 service、DictyOGlyc 1.1 service、signaIP-5.0、Euk-mPLoc 2.0 server、Prabi在线软件(NPS@:SOPMA secondary structure prediction)分别分析蛋白理化性质、氨基酸序列磷酸化修饰情况、O-糖基化修饰情况、蛋白的信号肽,蛋白亚细胞定位,蛋白的二级结构。
1.6 TPS蛋白序列多重比对、保守元件、进化树构建
将TPS蛋白序列导入到DNAMAN中,进行多重序列比对,利用MEME(http://meme.nbcr.net/meme/tools/meme)对TPS蛋白保守结构域进行预测;将LhTPS蛋白序列进行BLAST比对,选择同源性较高的蛋白,再根据参考文献选择一些有功能性的真菌TPS蛋白,将这些蛋白放在利MEGA 6.0进行系统进化树构建。
1.7 基因表达分析
使用DNAMAN在线程序primer设计红汁乳菇TPS检测引物,并由上海生工合成引物。以不同培养条件的红汁乳菇cDNA作为模板,并以红汁乳菇TPS检测引物进行PCR扩增反应,同时以内参Tubulin引物作为对照。结束后用1.5%的琼脂糖凝胶电泳检测。利用Azure Biosystems成像系统软件,将图像信息转化为基因表达量数据,以此数据为基础,利用在线程序派森诺基因云(https://www.genescloud.cn/chart/)将相对表达量数据做成热图。
1.8 基因簇分析
使用在线程序antiSMASH(https://fungismash.secondarymetabolites.org)对16个红汁乳菇TPS基因所在重叠群(contig)进行基因簇预测分析。
2 结果与分析
2.1 红汁乳菇中萜类合成酶蛋白的预测
利用本地BLAST对红汁乳菇基因组数据进行分析比对,最终预测出16个LhTPS基因,分别命名为:LhTPS1、LhTPS2、LhTPS3、LhTPS4、LhTPS5、LhTPS6、LhTPS7、LhTPS8、LhTPS9、LhTPS10、LhTPS11、LhTPS12、LhTPS13、LhTPS14、LhTPS15、LhTPS16。
2.2 蛋白一级结构分析
理化性质预测分析(表1)结果表明除了红汁乳菇LhTPS4的理论等点大于7外,其他15个蛋白的理论等电点均小于7,说明其蛋白质分子中富含酸性氨基酸且酸性氨基酸数量多于碱性氨基酸;除LhTPS1、LhTPS2、LhTPS5、LhTPS9蛋白的不稳定系数小于40外,其余11个蛋白的不稳定系数均大于40,说明红汁乳菇LhTPS大多数为不稳定蛋白。氨基酸亲水性分析预测结果显示,16个红汁乳菇LhTPS的亲水性平均系数(GRAVY)均为负值,表明均为亲水性蛋白。磷酸与糖基化位点分析结果显示LhTPS蛋白均具有酸磷酸化位点,然而16个蛋白的糖基化位点数均较少甚至没有。
信号肽预测的结果显示,所有蛋白序列均无N-端信号肽存在。蛋白亚细胞定位预测结果显示,16个红汁乳LhTPS中有10个LhTPS定位于细胞质。

表1 红汁乳菇TPS蛋白理化性质分析
2.3 蛋白二级结构分析
蛋白质的二级结构主要包括α螺旋、无规则卷曲、β折叠、延伸链等一系列多肽链本身的折叠盘绕方式。预测结果显示(表1),LhTPS二级结构包含了α螺旋、无规则卷曲、β折叠、延伸链。除了LhTPS4以无规则卷曲占比最大外,其余15个蛋白均以α螺旋占比最大,β折叠、延伸链占比均较小。
2.4 蛋白序列保守结构域比对
利用MEME对红汁乳菇16个LhTPS蛋白进行保守元件分析(图1a)。motif2和motif4为红汁乳菇LhTPS蛋白最显著的保守结构域:DXXD基序和NSE结构域。LhTPS10蛋白只含有motif3;LhTPS13和LhTPS14包含3个motif,不包含motif4,仅具有萜烯合酶保守的DXXD基序;其余的蛋白均含有4个motif,均具有DXXD基序和NSE结构域。DNAMAN比对分析(图1b)也发现,LhTPS10、LhTPS13、LhTPS14仅具有萜烯合酶的DXXD保守结构域,其余的蛋白均具有DXXD和NSE保守结构域。因此可以把16个萜类合成酶分成两类,LhTPS10、LhTPS13、LhTPS14为一类,其余13个蛋白分为一类。
2.5 系统发育树构建分析
通过文献收集和BLAST在线软件同源比对,获得了一些植物及真菌的萜类合成酶基因的蛋白序列,在MEGA6.0软件上与16个红汁乳菇LhTPS蛋白构建系统发育树(图2)。结果显示,16个LhTPS可分为4个大分支,其中LhTPS6、LhTPS8、LhTPS11、LhTPS16、LhTPS7为第Ⅰ分支;LhTPS4、LhTPS2、LhTPS12、LhTPS3、LhTPS5、LhTPS15为第Ⅱ分支;LhTPS14、LhTPS10、LhTPS13为第Ⅲ分支;LhTPS1和LhTPS9为第Ⅳ分支。按已有文献分析,第Ⅰ、Ⅱ分支为倍半萜合成酶,第Ⅲ分支为倍半萜及二萜合成酶,第Ⅳ分支为倍半萜和三萜合成酶。第Ⅰ分支中LhTPS6、LhTPS8、LhTPS11、LhTPS16与发光类脐菇(OmphalotusoleariusMUStwsD_GLEAN_10000831,Δ-6 protoilludene)[12]和高卢蜜环菌(ArmillariagallicaP0DL13.1,Δ-6 protoilludene)[13]的倍半萜合酶聚在一起,由此推测LhTPS6、LhTPS8、LhTPS11、LhTPS16主要生成Δ-6 protoilludene的相似物或者衍生物;LhTPS7与发光类脐菇(OmphalotusoleariusMUStwsD_GLEAN_10000810/MUStwsD_GLEAN_10000811,γ-cadinene)[12]聚在一起,由此推测LhTPS7主要生成γ-cadinene的相似物或者衍生物。第Ⅱ分支中的LhTPS4、LhTPS2、LhTPS12、LhTPS3、LhTPS5、LhTPS15与虎乳灵芝(LignosusrhinocerusKX281944/ASK39768,δ-cadinol)[14]、发光类脐菇(OmphalotusoleariusMUStwsD_GLEAN_10001317,α-muurolene)[12]、牛樟芝(AntrodiacinnamomeaEIW57365,1-epi-cubenol)[15]的倍半萜合成酶聚在一起,由此初步推测第Ⅱ分支的红汁乳菇LhTPS主要生成δ-cadinol、α-muurolene、1-epi-cubenol的相似物或者衍生物。LhTPS14、LhTPS10、LhTPS13聚为第Ⅲ分支,与保守基序分析结果一样。LhTPS14与巨冷杉(AbiesgrandisAAC05728,γ-Humulene synthase)[16]聚在一起,初步推测LhTPS14为二萜合成酶γ-Humulene synthase;LhTPS10与毛韧革菌(StereumhirsutumXP_007299839,δ-cadinene)[17]倍半萜合成酶聚在一起,且可信度较高,由此推测LhTPS10为倍半萜合成酶,且主要生成δ-cadinene的类似物或者衍生物;LhTPS13与牛樟芝(AntrodiacinnamomeaEIW53985,nerolidol)[15]的倍半萜合成酶聚集在一起。第Ⅳ分支的可信度偏低,LhTPS1与灰盖鬼伞(CoprinuscinereusXP_001836556,germacrene A)[18]的倍半萜合成酶聚在一起,LhTPS9与香菇(LentinulaedodesGAW09328)的三萜鲨烯合酶squalene synthase聚为一起。
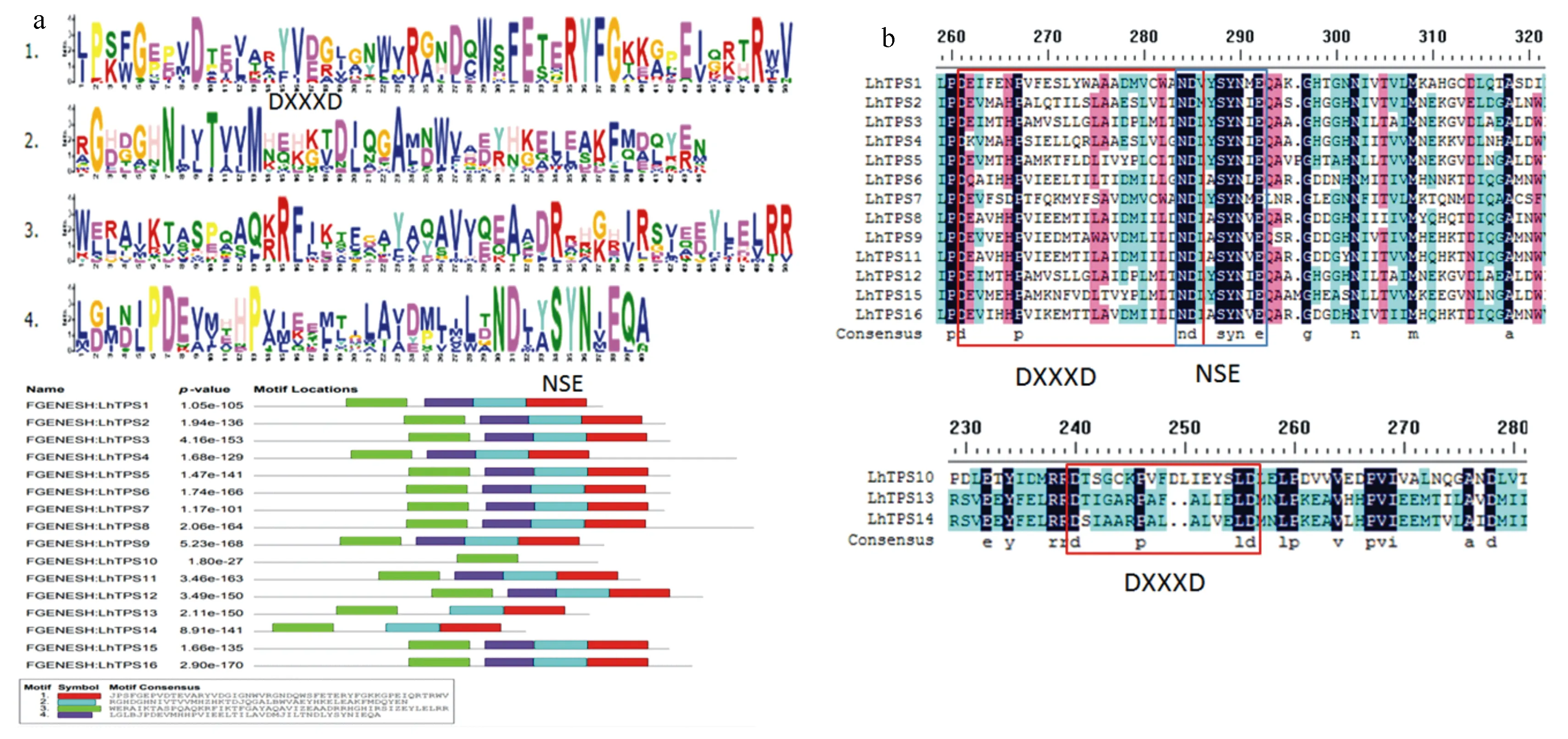
图1 LhTPS蛋白基序分析和保守结构域多重序列比对
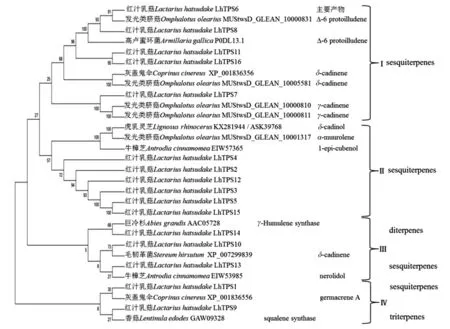
图2 红汁乳菇LhTPS蛋白系统发育树
2.6 不同培养条件下红汁乳菇LhTPS表达验证及分析
红汁乳菇16个LhTPS基因中,有些基因较小,因此没有做不同碳氮源情况的表达分析,仅对10个基因(LhTPS2、LhTPS3、LhTPS4、LhTPS5、LhTPS6、LhTPS7、LhTPS8、LhTPS12、LhTPS15、LhTPS16)进行分析,并制作成表达热图(图3),其结果显示10个LhTPS基因在不同碳氮源培养基培养条件下均有表达,总体情况来看,红汁乳菇10个LhTPS基因分别依次在2.0 g·L-1山梨醇培养基、10.0 g·L-1肌醇培养基、番茄浸粉培养基、牛肉浸粉培养基、番茄浸粉培养基、胰蛋白胨培养基、番茄浸粉培养基、番茄浸粉培养基、10.0 g·L-1山梨醇培养基、番茄浸粉培养基培养的菌丝体中表达量最高;不同氮源的培养基培养条件下的表达情况整体上要优于不同碳源的培养基培养条件下的表达情况。在不同碳源及不同质量浓度培养基培养条件下,红汁乳菇10个LhTPS基因分别在2.0 g·L-1山梨醇、10.0 g·L-1肌醇、10.0 g·L-1山梨醇、2.0 g·L-1山梨醇、10.0 g·L-1肌醇、10.0 g·L-1麦芽糖、10.0 g·L-1山梨醇、2.0 g·L-1甘露醇、10.0 g·L-1山梨醇、10.0 g·L-1山梨醇培养基上表达量最高;因此,在不同碳源及质量浓度培养基中,以10.0 g·L-1山梨醇培养基为最优,然后依次是10.0 g·L-1肌醇培养基,2.0 g·L-1山梨醇培养基。在不同氮源培养基培养条件下,红汁乳菇10个LhTPS基因分别在番茄浸粉、番茄浸粉、番茄浸粉、番茄浸粉、牛肉浸粉、胰蛋白胨、番茄浸粉、番茄浸粉、番茄浸粉、番茄浸粉培养基中表达量最高;因此,在不同氮源培养基中以番茄培养基为最优培养基。
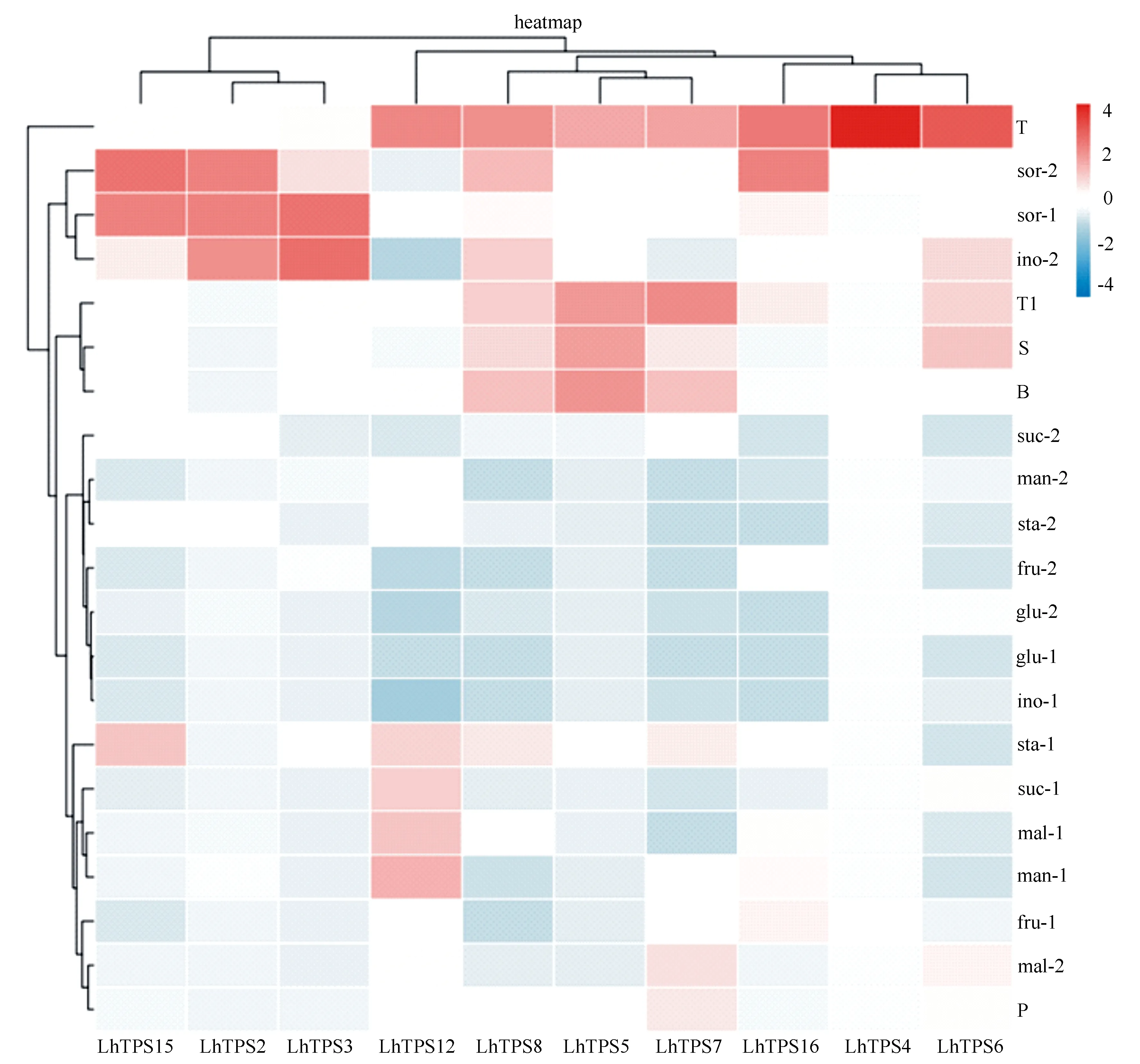
mal-1为2.0 g·L-1麦芽糖;mal-2为10.0 g·L-1麦芽糖;man-1为2.0 g·L-1甘露醇;man-2为10.0 g·L-1甘露醇;fru-1为2.0 g·L-1果糖;fru-2为10.0 g·L-1果糖;suc-1为2.0 g·L-1蔗糖;suc-2为10.0 g·L-1蔗糖;sor-1为2.0 g·L-1山梨醇;sor-2为10.0 g·L-1山梨醇;glu-1为2.0 g·L-1葡萄糖;glu-2为10.0 g·L-1葡萄糖;ino-1为2.0 g·L-1肌醇;ino-2为10.0 g·L-1肌醇;sta-1为2.0 g·L-1可溶性淀粉;sta-2为10.0 g·L-1可溶性淀粉;S为大豆蛋白胨;P为马铃薯浸粉;B为牛肉浸粉;T1为胰蛋白胨;T为番茄浸粉。
2.7 基因簇预测分析
对16个红汁乳菇LhTPS蛋白编码基因所在重叠群进行基因簇分析后发现,LhTPS2、LhTPS3、LhTPS6、LhTPS8、LhTPS9、LhTPS10、LhTPS15编码基因所在重叠群有基因簇的存在。其中,LhTPS9、LhTPS15的编码基因所在重叠群有细胞色素P450氧化还原酶基因存在,可能为TPS与P450组成的基因簇(图4)。
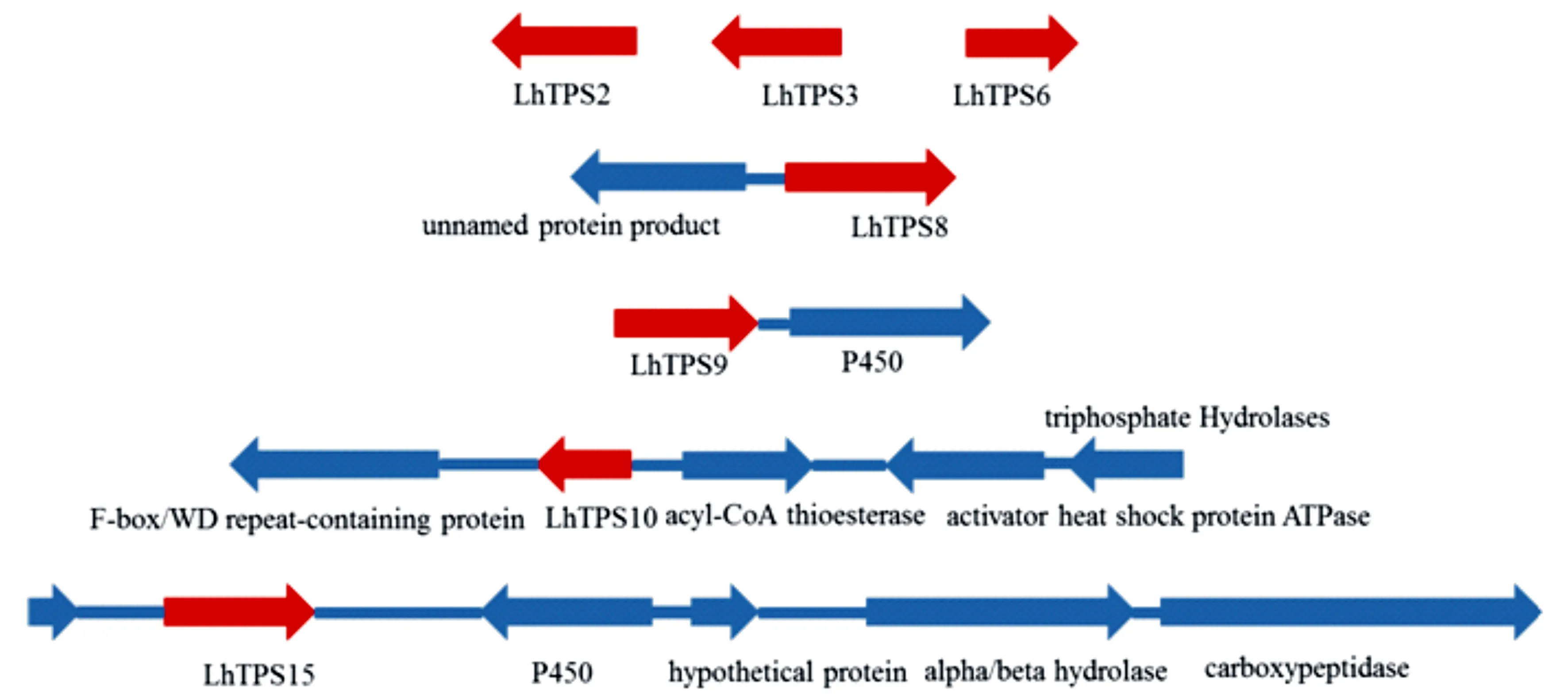
图4 5个红汁乳菇TPS基因簇预测
3 结论与讨论
现代药学对于新化合物的需求不断增加,而微生物资源的开发与利用为药物研发带来了新的机遇,从微生物次级代谢产物中获得天然产物是新的前体化合物的重要来源[19]。研究发现具有新的结构与活性的次生代谢产物超过50%来源于真菌[20],因此深度挖掘真菌中天然活性化合物对药物研发具有重要的意义。
红汁乳菇不仅是人们最喜欢的野生食用菌之一,它还具有多种活性成分,开发利用前景广阔,但是目前,对红汁乳菇TPS基因的分析研究尚未见报道。本研究从红汁乳菇全基因组中分离获得16个萜类合成酶基因,基序分析将16个LhTPS分成两类,仅有DXXD基序的分为一类,有DXXD基序和NSE结构域归为另一类;系统发育树的构建将16个LhTPS分为4个大分支,仅有DXXD基序的聚集为一个分支。推测第Ⅰ、Ⅱ分支为倍半萜合成酶,第Ⅲ分支为倍半萜及二萜合成酶,第Ⅳ分支为倍半萜和三萜合成酶。其中第Ⅰ分支中的LhTPS6、LhTPS8、LhTPS11、LhTPS16主要生成Δ-6 protoilludene的相似物或者衍生物,LhTPS7主要生成γ-cadinene的相似物或者衍生物;第Ⅲ分支中的LhTPS10为倍半萜合成酶,且主要生成δ-cadinene的类似物或者衍生物。
真菌基因组蕴含着大量次生代谢产物生物合成基因簇[20-21],大部分基因簇在常规的培养条件下是“沉默”的,在实验室培养条件下,只有10%~20%次生代谢产物生物合成基因簇能从其发酵粗提物中检测到相应的产物[22],说明还有大量结构新颖的潜在活性化合物未从“沉默”基因簇中鉴定出来[22]。因此,挖掘真菌的潜在新化合物正成为国内外研究的热点。研究者使用Helge等提出的单菌多产物(One Strain-Many Compounds,OSMAC)策略[23],从真菌中分离鉴定了一系列结构新颖、具有多种活性的化合物,通过培养基筛选,从毛韧革菌(Stereumhirsutum)发酵产物中分离鉴定了4个倍半萜,还有氨基酸杂合的季铵盐Stereumamides A-D,具有一定的抗菌活性[24];通过改变培养水,使用自来水和蒸馏水培养植物伴生真菌Paraphaeosphaeriaquadriseptata,主代谢产物发生了变化,得到的其中2个化合物对肿瘤细胞株NCI-H460,MCF-7和SF-268有较为显著的细胞毒活性[25];通过海洋真菌Libertellasp.与细菌α-proteobacterium联合培养,得到了分别培养所没有得到的化合物对人结肠癌HCT-116具有较强的细胞毒活性[26]。本研究通过仅改变碳源添加物及质量浓度和氮源添加物来探究不同培养基对红汁乳菇萜类合成酶基因表达的影响。结果显示在加有不同氮源的培养基培养条件下的表达情况整体上要优于不同碳源的培养基培养条件下的表达情况,且以10.0 g·L-1山梨醇、10.0 g·L-1肌醇为碳源的培养基和番茄浸粉为氮源的培养基上表达量相对较高,与原晓龙等[27]研究红汁乳菇Lhpks1基因表达情况一致。对红汁乳菇LhTPS基因簇分析发现LhTPS2、LhTPS3、LhTPS6、LhTPS8、LhTPS9、LhTPS10、LhTPS15编码基因所在重叠群有基因簇的存在,但仅LhTPS6、LhTPS8、LhTPS10初步推断出其功能,后续研究可以在对推测出的功能基因和基因簇进行进一步验证分析的基础上,根据OSMAC策略以及一些激活沉默基因和基因簇的方法如强启动子替换[28]、基因的过表达、异源表达、转录调控、重构生物合成基因簇[24-25]等等来刺激不同的基因或基因簇,以得到目标化合物或获取一些新的活性物质,以此挖掘红汁乳菇中可能蕴藏的潜在化合物。
真菌次生代谢产物合成途径中往往包括多样化的氧化过程,细胞色素P450能够催化不同类型的氧化反应而参与到真菌次生代谢产物的合成途径中[29],参与次生代谢产物合成途径的细胞色素P450往往会出现在次生代谢产物合成酶基因簇区域[30]。基因簇分析发现LhTPS9、LhTPS15的编码基因所在重叠群有细胞色素P450氧化还原酶基因存在。下一步研究可开展对于红汁乳菇中与活性天然产物相关的细胞色素P450的氧化途径、结构与功能的进一步揭示与阐明。
本研究为红汁乳菇潜在次生代谢产物合成基因的挖掘和深度研究红汁乳菇中天然活性化合物奠定基础。

