牛蒡子苷减轻脂多糖诱导人鼻咽上皮细胞炎症损伤的作用
聂发龙 赵显芳 朱紫陌 江自鲜 代蓉 李秀芳
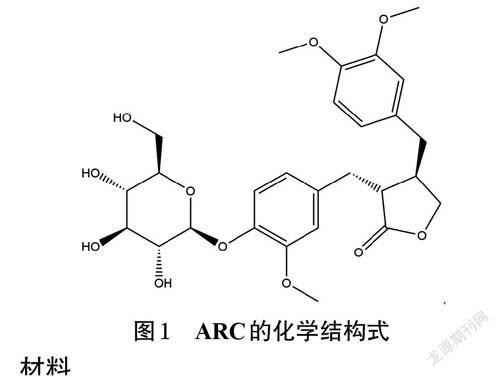


关键词牛蒡子苷;脂多糖;NP-69细胞;炎症反应;鼻黏膜上皮屏障
上呼吸道感染(upper respiratory tract infection,URTI)是鼻、咽、喉急性炎症的总称,是危害人类健康的常见疾病之一,且大多由病毒和细菌感染所致[1-2]。作为与外界直接相连的器官,鼻咽上皮细胞在呼吸时会暴露于空气当中,容易受到病毒、细菌、真菌等病原微生物攻击,作为机体防御URTI 的首道屏障,鼻咽上皮细胞对维持上呼吸道的稳定具有重要作用[3]。病原微生物致感染或炎症信号增强等多种因素的作用会导致鼻黏膜上皮细胞受到损伤并发生功能紊乱,进而易使外界病原体或机会致病菌进入黏膜,最终引发URTI[4]。牛蒡子为菊科植物牛蒡Arctium lappa L.的干燥成熟果实,是中医临床治疗URTI 的常用药材,牛蒡子苷(arctiin,ARC,化学结构式见图1)是其主要活性成分之一[5]。研究发现,ARC具有抗炎、抗病毒、保护肝脏、改善内皮细胞损伤的作用[6-9]。基于ARC在抗炎和保护细胞方面均具有较好的作用,考虑到上皮细胞是先天免疫和炎症反应的重要参与者之一[10],本课题组推测ARC可能具有改善鼻黏膜上皮细胞炎症损伤的作用。因此,本研究采用脂多糖(lipopolysaccharide,LPS)刺激人鼻咽上皮细胞NP-69 复制炎症损伤模型,从抗炎、促进受损上皮细胞迁移等方面探讨ARC 对人鼻咽上皮细胞炎症损伤的改善作用,旨在为后续深入研究ARC在增强鼻黏膜上皮屏障中的作用奠定基础。
1 材料
1.1 主要仪器
本研究所用的主要仪器包括Infinite M200 Pro 型酶标仪(瑞士Tecan 公司)、311 型二氧化碳(CO2)细胞培养箱(美国Thermo Fisher Scientific 公司)、Ti-S 型倒置显微镜(日本Nikon 公司)、Mx3005P 型实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,q-PCR)仪(美国Agilent 公司)、Bio Spectrum 型凝胶成像系统(美国Spectrum 公司)、SN310C型高壓蒸汽灭菌器(日本Yamato 公司)、XS125A型分析天平(瑞士Precisa公司)、CF16RX型低温高速离心机(日本Hitachi 公司)、UPH-III-20T 型超纯水系统(四川优普超纯科技有限公司)等。
1.2 主要药品与试剂
ARC对照品(批号LE207100,纯度98%)购自北京百灵威科技有限公司;LPS(批号O19M4009V)购自美国Sigma-Aldrich 公司;RPMI 1640 培养基(批号2103012)购自美国Bimake 公司;青链霉素双抗(批号1744939)购自美国Gibco 公司;BCA 蛋白浓度检测试剂盒(批号P0010)购自上海碧云天生物技术有限公司;MTS细胞增殖试剂盒(批号0000408248)购自美国Promege 公司;一氧化氮(nitric oxide,NO)试剂盒(批号20210727)购自北京索莱宝科技有限公司;人肿瘤坏死因子α(tumor necrosisfactor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、IL-1β酶联免疫吸附测定(enzyme linked immunosorbentassay,ELISA)试剂盒[批号分别为20210105(H052-1-2)、20210105(H007-1-2)、20210105(H002-1-2)]均购自南京建成生物工程研究所;TRIZOL 试剂、RNA逆转录试剂盒、胎牛血清(批号分别为15596-018、k1622、1601001)均购自美国Thermo Fisher Scientific 公司;鼠源胞质紧密连接蛋白1(zonula oecludens protein 1,ZO-1)单克隆抗体、鼠源信号转导及转录活化因子3(signal transducerand activator of transcription 3,STAT3)单克隆抗体、鼠源Janus 激酶1(Janus kinase 1,JAK1)单克隆抗体、鼠源β-肌动蛋白(β-actin)单克隆抗体、辣根过氧化物酶标记的山羊抗鼠免疫球蛋白G二抗、灵敏ECL化学发光增强试剂盒(批号分别为21773-1-AP、10003218、10004856、20536-1-AP、SA00001-1、B500023)均购自美国Proteintech公司;鼠源β-防御素3(β-defensins 3,BD3)多克隆抗体(批号GR3207641-3)购自英国Abcam 公司;q-PCR 检测试剂盒(批号31598800)购自瑞士Roche 公司;其余试剂均为分析纯,水为超纯水。
1.3 细胞
人鼻咽上皮细胞株NP-69(货号49415)购自苏州北纳创联生物技术有限公司。
2 方法
2.1 NP-69 细胞增殖的检测
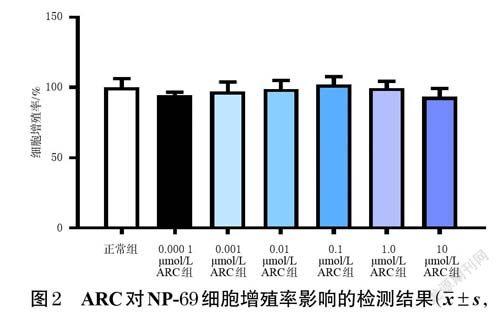
取对数生长期的NP-69 细胞,制成细胞悬液,计数并调整细胞密度至4×105个/mL,接种于96 孔培养板中,每孔100 μL。将细胞分为空白组(只加培养基,不加细胞)、正常组(正常培养细胞)、不同浓度(0.000 1、0.001、0.01、0.1、1.0、10 μmol/L[11])ARC组,每组设置6 个复孔。ARC 组细胞加入含相应浓度药物的完全培养基(即含10%胎牛血清及1%青链霉素双抗的RPMI 1640 培养基,下同),正常组加入完全培养基,于37 ℃、5%CO2条件下培养24 h。每孔加入MTS试剂20 μL,同条件孵育2 h 后,使用酶标仪于490 nm波长处测定各孔的光密度(optical density,OD)值,按下式计算细胞增殖率:细胞增殖率(%)=(实验组OD值-空白组OD值)/(正常组OD值-空白组OD值)×100%。
2.2 ARC对NP-69 细胞迁移影响的检测
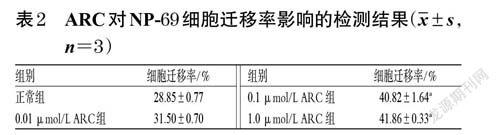
取對数生长期的NP-69 细胞,制成细胞悬液,计数并调整细胞密度至4×105个/mL,接种于6 孔培养板中,每孔2 mL。将细胞分为正常组和不同浓度(0.01、0.1、1.0 μmol/L,浓度参考“2.1”项下结果设置)ARC组,每组设置3 个复孔。ARC组细胞用含相应浓度药物的完全培养基培养24 h,正常组用完全培养基培养24 h。用无菌枪头在皿底作等宽的直线划痕,并用无菌磷酸盐缓冲液(PBS)清洗3 次。分别在同条件培养0、24 h 时于倒置显微镜下观察、拍照并采集图片,采用Image J V1.8.0 软件分析划痕宽度并计算细胞迁移率:细胞迁移率(%)=(0 h 划痕宽度-24 h 划痕宽度)/0 h 划痕宽度×100%。
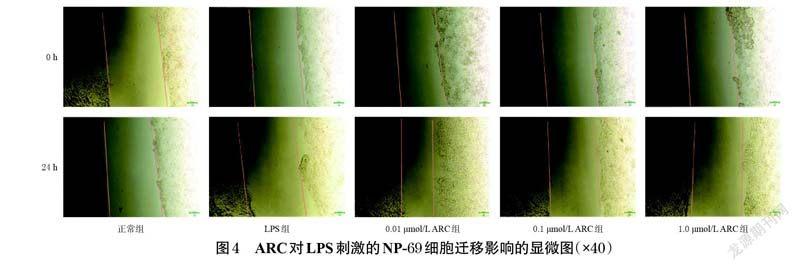
2.3 ARC对LPS刺激的NP-69细胞迁移影响的检测
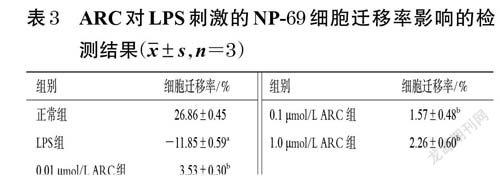
取对数生长期的NP-69 细胞,制成细胞悬液,计数并调整细胞密度至4×105个/mL,接种于6 孔培养板中,每孔2 mL。同条件培养至细胞铺满孔板底部。将细胞分为正常组、LPS 组(1.0 μg/mL[11])和不同浓度(0.01、0.1、1.0 μmol/L,浓度参考“2.1”项下结果设置)ARC组,每组设置3 个复孔。ARC组细胞用含相应浓度药物的完全培养基培养24 h,正常组和LPS 组用完全培养基培养24 h;随后,ARC 组和LPS 组细胞用相应浓度的LPS刺激24 h。用无菌枪头在皿底作等宽的直线划痕,并用无菌PBS清洗3 次。分别在刺激0、24 h 时于倒置显微镜下观察、拍照并采集图片,采用Image J V1.8.0 软件分析划痕宽度并按“2.2”项下方法计算细胞迁移率。
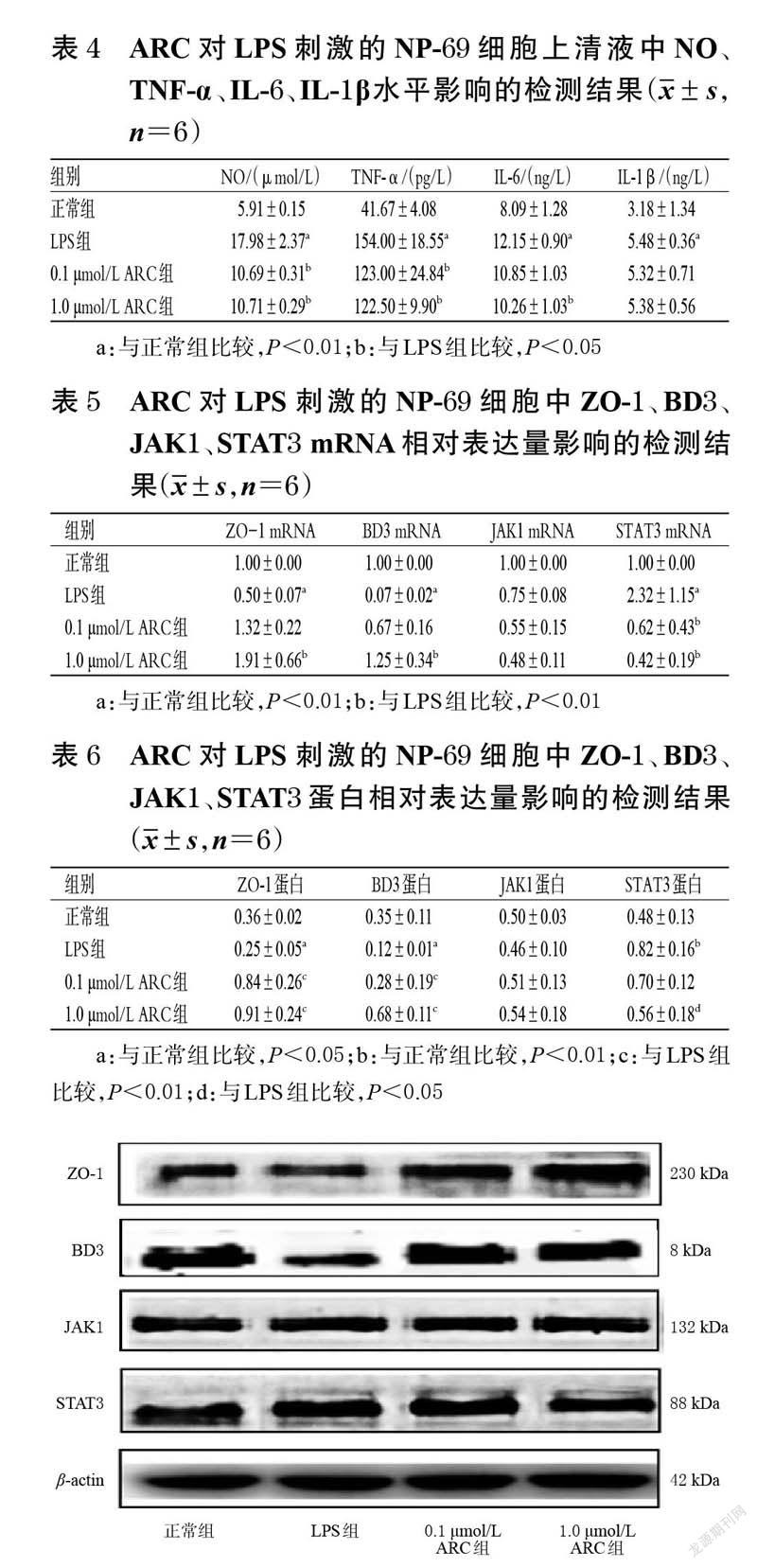
2.4 ARC 对LPS 刺激的NP-69 细胞上清液中NO、TNF-α、IL-6、IL-1β水平影响的检测
取对数生长期的NP-69 细胞,制成细胞悬液,计数并调整细胞密度至4×105个/mL,接种于6 孔培养板中,每孔2 mL。将细胞分为正常组、LPS组(1.0 μg/mL[11])和不同浓度(0.1、1.0 μmol/L,浓度参考“2.1”项下结果设置)ARC组,每组设置6 个复孔。ARC组细胞用含相应浓度药物的完全培养基培养24 h,正常组和LPS 组用完全培养基培养24 h;随后,ARC组和LPS 组用相应浓度的LPS 刺激24 h。收集各组细胞上清液,检测其中NO、TNF-α、IL-6、IL-1β水平,严格按照各试剂盒说明书方法操作。
2.5 ARC 对LPS 刺激的NP-69 细胞中ZO-1、BD3、JAK1、STAT3 mRNA表达影响的检测
同“2.4”项下方法进行细胞分组(每组设置6 个复孔)及干预,于LPS 刺激24 h 后收集各组细胞,采用TRIZOL 法提取RNA,采用q-PCR 法检测细胞中ZO-1、BD3、JAK1、STAT3 mRNA 的表达水平:PCR 扩增体系包括上/下游引物各0.6 μL、cDNA 1.0 μL、ddH2O 7.8 μL。扩增程序为95 ℃预变性15 min;95 ℃变性10 s,60 ℃退火30 s,共45 个循环。随后,进行溶解曲线分析,以β-actin 为内参,以正常组为参照,运用2-ΔΔCt法确定各目的基因mRNA的相对表达量。目的基因的引物信息如表1所示(内参略)。
2.6 ARC 对LPS 刺激的NP-69 细胞中ZO-1、BD3、JAK1、STAT3 蛋白表达影响的检测
同“2.4”项下方法进行细胞分组(每组设置6 个复孔)及干预,于LPS 刺激24 h 后收集各组细胞,采用Western blot 法检测细胞中ZO-1、BD3、JAK1、STAT3 蛋白的表达情况:于各组细胞中加入细胞裂解液(含1%蛋白酶抑制剂的裂解液)100 μL,冰上裂解5 min 后,以14 000 r/min 离心5 min,取上清液采用BCA法检测细胞总蛋白浓度后进行高温变性。取变性蛋白30 μg 进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(分离胶电压为70 V,浓缩胶电压为110 V,电泳时间为90 min),然后转移到聚偏二氟乙烯膜(电流为200 mA;转膜时间根据蛋白分子量决定,一般1 kDa 蛋白转膜1 min)上,用5%脱脂奶粉于室温摇床上封闭2 h,加入相应一抗(目的蛋白的稀释比例均为1 ∶ 500,β-actin 的稀释比例为1 ∶2 000),4 ℃孵育过夜;用TBST缓冲液洗膜5 min×4次,加入二抗(稀释比例为1 ∶2 000),室温下摇床孵育2 h;用TBST 缓冲液洗膜5 min×4 次,以ECL 显色后于凝胶成像系统上成像并拍照,利用Image J V1.8.0 软件进行图像灰度值处理,以目的蛋白与内参蛋白(β-actin)的灰度值比值作为前者的相对表达量。
2.7 统计学方法
分别采用SPSS 23.0、Graphpad Prism 8.0 软件进行统计分析、绘图。数据以x±s 表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t 检验(方差齐)或Tamhane’s T2分析(方差不齐)。检验水准α=0.05。
3 结果
3.1 ARC对NP-69 细胞增殖率的影响
在0.000 1、0.001、0.01、0.1、1.0、10 μmol/L 浓度下,ARC对NP-69 细胞均无明显毒性;ARC组细胞增殖率与正常组比较,差异均无统计学意义(P>0.05)。结果见图2。
3.2 ARC对NP-69 细胞迁移的影响
与正常组比较,经0.1、1.0 μmol/LARC干预后,细胞的迁移率均显著升高(P<0.05)。结果见表2、图3。
3.3 ARC对LPS刺激的NP-69细胞迁移的影响
与正常组比较,LPS 组出现细胞损伤脱落现象,细胞迁移率显著降低(P<0.01);与LPS 组比较,不同浓度的ARC 均可使NP-69 细胞的迁移率显著升高(P<0.01)。结果见表3、图4。
3.4 ARC 对LPS 刺激的NP-69 细胞上清液中NO、TNF-α、IL-6、IL-1β水平的影响
与正常组比较,LPS 组细胞上清液中NO、TNF-α、IL-6、IL-1β水平均显著升高(P<0.01)。与LPS 组比较,0.1、1.0 μmol/LARC组细胞上清液中NO、TNF-α、IL-6 水平(0.1 μmol/LARC组除外)均显著降低(P<0.05);各药物组IL-1β水平虽有降低趋势,但组间比较差异均无统计学意义(P>0.05)。结果见表4。
3.5 ARC 对LPS 刺激的NP-69 细胞中ZO-1、BD3、JAK1、STAT3 mRNA表达的影响
与正常组比较,LPS 组NP-69 细胞中ZO-1、BD3mRNA 的相对表达量均显著降低(P<0.01),STAT3mRNA的相对表达量显著升高(P<0.01)。与LPS 组比较,1.0 μmol/L ARC组细胞中ZO-1、BD3 mRNA的相对表达量均显著升高(P<0.01),0.1、1.0 μmol/L ARC组细胞中STAT3 mRNA的相对表达量均显著降低(P<0.01);各药物JAK1 mRNA的相对表达量虽有降低趋势,但组间比较差异均无统计学意义(P>0.05)。结果见表5。
3.6 ARC 对LPS 刺激的NP-69 细胞中ZO-1、BD3、JAK1、STAT3 蛋白表达的影响
与正常组比较,LPS 组细胞中ZO-1、BD3 蛋白的相对表达量均显著降低(P<0.05),STAT3 蛋白的相对表达量显著升高(P<0.01)。与LPS 组比较,0.1、1.0 μmol/LARC组细胞中ZO-1、BD3 蛋白的相对表达量均显著升高(P<0.01),1.0 μmol/LARC组细胞中STAT3 蛋白的相对表达量显著降低(P<0.05);各药物组JAK1 蛋白的相对表达量虽有升高趋势,但组间比较差异均无统计学意义(P>0.05)。结果见表6、图5。
4 讨论
由于引起URTI 的高致病性病原体(如冠状病毒、鼻病毒、呼吸道合胞病毒等)大多是从口鼻入侵,故覆盖于鼻腔结构的鼻黏膜是机体与病毒接触的首个部位[12]。鼻上皮细胞与内皮细胞组成细胞片层,构成了鼻黏膜的第1 道屏障,其结构和功能的完整性对于防御病原体经鼻入侵、维持机体内环境稳态均具有至关重要的作用[13]。由于直接与外界相通,鼻黏膜上皮细胞不可避免地经常受到细菌、病毒、吸入颗粒物的损伤。正常情况下,当上皮屏障受损时,上皮细胞将迅速启动伤口修复机制,以保持上皮屏障的完整性,其中上皮细胞快速迁移是上皮屏障修复中最早出现且较为重要的修复途径之一,这一过程对于受损气道上皮细胞的修复和再生格外重要[14]。上皮细胞迁移受到多种因素的影响,有研究证实炎症反应可明显抑制气道上皮细胞的迁移[15]。
本研究结果显示,不同浓度(0.1、1.0 μmol/L)的ARC均能促进NP-69 细胞的迁移,表明该成分具有促进细胞迁移的作用。随后,本研究采用LPS 刺激NP-69 细胞以复制细胞炎症损伤模型,以细胞划痕实验再次考察ARC对NP-69 细胞迁移的影响。结果显示,经LPS刺激后,细胞损伤脱落,细胞迁移率显著降低,说明炎症环境抑制了上皮细胞的黏附和迁移能力;与此同时,细胞上清液中炎症介质NO和炎症因子TNF-α、IL-1β、IL-6 水平均显著升高。经不同浓度ARC预先干预后,NP-69 细胞损伤有所恢复,细胞迁移率显著升高,细胞上清液中NO、TNF-α、IL-6 水平均有不同程度降低,提示该成分具有促进上皮屏障损伤愈合的作用。
有研究指出,ZO-1 是上皮细胞维持细胞极性的重要结构蛋白,也是鼻黏膜物理屏障的重要构成部分,具有防止病原体入侵的重要作用[16]。在炎症环境下,NP-69 细胞中ZO-1 mRNA 和蛋白表达均显著降低,说明上皮屏障结构受损、物理屏障功能减弱;预先给予ARC干预后,ZO-1 mRNA和蛋白的表达得以上调,说明ARC可以增强鼻黏膜上皮细胞的物理屏障功能。
BD主要分布于鼻黏膜上皮及呼吸道黏膜下腺体组织中,是具有独特二硫键的阳离子抗菌肽,其不但可通过靶向细菌细胞膜和病毒外壳蛋白的方式来快速杀灭病原微生物,而且可通过提高免疫细胞的活性及趋化性调节作用来增强呼吸道黏膜的防御功能[17]。近年来,BD因其独特的组织分布、作用特点及对URTI 的影响而受到了学者的广泛关注。本研究结果显示,经LPS 刺激后,NP-69 细胞中BD3 mRNA 和蛋白的表达均显著降低,提示在炎症环境中,上皮屏障的抗菌肽表达减少,屏障的免疫防御功能有所减弱。预先给予ARC 干预后,BD3 mRNA和蛋白的表达均明显上调,说明ARC可以提高鼻黏膜上皮屏障的免疫防御功能。
有研究报道,当上皮屏障受损时,在没有任何外界刺激或非上皮细胞参与的情况下,受损部位邻近的上皮细胞能以35~45 μm/s 的速度迅速迁移到受损部位并覆盖受损区域,增加受损区域内的细胞总数,同时可分化为具有不同功能的上皮细胞(如基底细胞、黏液分泌细胞),从而完成对上皮屏障的修复[18]。上皮细胞的快速迁移是由IL-6/JAK1/STAT3 蛋白激酶信号通路介导并精密调控的[19]。其中,STAT3 在多种细胞和组织中都有表达,对调节正常细胞的增殖、分化、生存、凋亡均具有重要作用[20]。研究表明,特异性敲除STAT3 基因的肠上皮细胞不但对葡聚糖硫酸钠盐引起的炎症性肠炎易感,而且使受损上皮屏障的愈合速度也明显减慢[21]。STAT3 可被多種配体激活,其中IL-6 是STAT3 的重要细胞内调节分子之一,当细菌或病毒入侵上呼吸道后可诱导呼吸道释放IL-6、IL-8,后者与IL-6 受体α(interleukin-6 receptoralpha,IL-6Rα)特异性结合,引起糖蛋白130(glycoprotein130,gp130)的同源二聚化,JAK 与gp130 的胞质区交联,使gp130 磷酸化,进一步促进了STAT3 激活,从而发挥促进细胞增殖、迁移和抑制细胞凋亡等作用;但当STAT3 过度表达时,则可引起炎症及肿瘤的发生[22]。本研究结果显示,NP-69 细胞经LPS 刺激后,其上清液中IL-6 水平明显上升,中下游效应因子JAK1 mRNA和蛋白虽未及时上升(可能与药物作用时效性有关),但同样上调了非磷酸化STAT3 mRNA 和蛋白的表达,提示IL-6/JAK1/STAT3 信号通路被激活。预先给予ARC 干预后,该信号通路受到明显抑制,提示ARC 可抑制由STAT3 过度激活所造成的炎症反应。
综上所述,ARC具有明显减轻LPS致NP-69 细胞炎症损伤的作用,并可增强炎症环境下鼻黏膜上皮屏障的物理及免疫防御功能;上述作用可能与抑制IL-6/JAK1/STAT3 蛋白激酶信号通路相关。

