萝卜根肿病抗感品种间侵染过程及生理生化差异分析
孙胜男,刘凡,曾令益,陈旺,任莉,徐理,方小平
(中国农业科学院油料作物研究所/农业农村部油料作物生物学与遗传育种重点实验室,湖北 武汉,430062)
十字花科根肿病是由芸薹根肿菌(Plɑsmodiophorɑ brɑssicɑeWoronin)引起的一种世界性病害,寄主范围广,严重威胁着十字花科作物的生产。根肿病为土传病害,其休眠孢子能在土壤中存活多年,防治困难。十字花科作物中萝卜对根肿菌的抗性整体上比白菜、油菜和甘蓝等抗性强[1,2],前期也有通过远缘杂交将萝卜中的抗病基因导入到甘蓝型油菜中的案例[3]。但远缘杂交困难,需要不断回交亲本,周期长,并且对受体亲本有负面连锁累赘性状的影响。总体而言油菜的抗根肿病育种在我国的进展也较为缓慢。因此利用对萝卜等其它抗病材料的研究,有助于我们了解根肿病的抗病机制,制定根肿病的防治策略,并且能够利用优质的抗病资源增加油菜品种的遗传多样性。
根肿菌侵染过程一般分为两个阶段,即根毛(初级)侵染和皮层(次级)侵染[4]。在根毛侵染阶段,休眠孢子萌发释放初级游动孢子,初级游动孢子形成初级原生质团,然后割裂分化成次级游动孢子囊,寄主的表型在此阶段没有变化;而在皮层侵染阶段,次级游动孢子囊萌发产生次级游动孢子会侵染皮层[5],次级游动孢子在皮层细胞内会逐渐发育并分化成大量的休眠孢子囊,造成寄主的根部异常膨大。
根肿菌侵染植物前期没有任何症状,但后期寄主根龟裂腐烂,大量的休眠孢子会被释放到土壤中,其发病周期长,这给根肿菌的早期防治带来困难,并且增大了防治难度。随着分子生物学技术的不断发展和应用,PCR 作为一种快速精确的技术能够可靠地检测植物和土壤中的病原菌含量。关格格等[6]通过优化PCR 反应体系对根肿菌含量进行检测和病害评估,此方法检测根肿菌DNA 时不受细菌和寄主植物内生菌等的干扰。因此,通过PCR 技术可以对寄主根内以及土壤中的根肿菌含量进行定量,为根肿病的早期病害诊断和防治提供依据。
植物在被病原菌侵染后会产生一系列防御反应,一些防御酶包括过氧化物酶(POD),超氧化物歧化酶(SOD), 过氧化氢酶(CAT)等可能通过参与清除细胞内的活性氧从而起着重要的调控作用,因而防御酶的活性变化与植物的抗病性紧密相关[7]。植物体内受活性氧水平升高毒害时,SOD 最先表现出在植物中的抗逆作用[8]。POD 则可以通过抗氧化作用保护细胞膜[9],同时POD 活性在特定的组织中随着环境的改变(生物胁迫)发生急剧变化,参与多种植物防御机制,比如发生在细胞壁的木质化反应[10]。POD、SOD 以及CAT 均在植物抗病机制中起到一定作用,但酶活与植物抗病的相关性结果在前人研究中存在分歧,防御酶在植物抗根肿病机制中的作用有待进一步明确。
可溶性糖作为一类渗透调节物质,包括蔗糖、果糖和葡萄糖等。相关研究结果表明可溶性糖含量的变化与病害的抗性有关。Evans 等[11]研究了根肿菌未侵染和侵染后拟南芥中蔗糖的积累情况,结果显示受根肿菌侵染后的拟南芥叶片中未能观察到蔗糖积累,说明寄主植物在被根肿菌侵染后增加了对糖的需求。从目前的研究结果看,可溶性糖含量升高可以增加植物抗性。但可溶性糖在根肿病中的相关作用还有待探究。
本研究前期通过对十字花科植物进行根肿病抗性鉴定,发现油菜缺乏抗病品种,而萝卜整体上抗性高于油菜及其它十字花科作物,因此我们对多个萝卜品种进行了筛选,并鉴定到一个免疫萝卜品种。通过抗、感病萝卜接种根肿菌后的侵染过程观察,比较接菌后萝卜根毛和皮层侵染差异,根内含菌量的变化、抗、感萝卜根内防御酶活性和可溶性糖含量变化的测定,以期探索萝卜抗病机理,为制定油菜等十字花科作物对根肿病的防治策略提供新思路。
1 材料和方法
1.1 材料
供试菌株和萝卜品种:根肿病发病病根(油菜)采自湖北省宜昌市枝江市,提取休眠孢子后用Williams 鉴别系统鉴定为根肿菌4 号生理小种[5],-80℃冰箱保存备用。两个萝卜品种为‘JYY’和‘GLS’,分别购买自北京京研益农科技发展中心和台湾兴农种业公司。
1.2 方法
1.2.1 制备根肿菌孢子悬浮液病及接种 根肿病病根抽提得到休眠孢子悬浮液[3,12,13],用血球计数板调整孢子悬浮液孢子浓度为5×107/mL。培养土按照营养土和蛭石体积1:1的比例,混合均匀。每40 g培养土装于直径8 cm,高度8 cm 的营养钵中,每一个钵子5 株苗。培养条件为20℃,光周期设置16 h光照8 h黑暗。采用注射法[13]对苗期7 d的两个品种的萝卜进行接种,每一个钵子接种20 mL的菌液,对照采用等量蒸馏水处理。
1.2.2 病害分级标准以及病情指数计算 根肿菌病害分级分为4 级[14]。0 级:寄主的根正常发育;1级:主根正常发育,少部分侧根有肿大;2 级:主根发育正常,大部分侧根形成肿瘤;3 级:主根膨大并有部分侧根会形成肿瘤。
萝卜接种根肿菌45 d后,每个重复取30株萝卜根清洗干净,调查发病情况,计算发病率并按照根肿菌的病害分级标准计算病情指数,最终结果为3个重复的平均值。发病率计算如下:
发病率=[n(发病株数)/N(调查总株数)]×100%
病情指数计算:
病情指数=[Σ(各级发病株数×级数)]/(调查总株数×最高病情级数)×100
1.2.3 侵染过程观察 根肿菌接种萝卜后3、11和14 d 分别取萝卜根部,每个处理每个时期取3~4 株幼苗根放置于苯胺蓝染液(50%乙酸配制,浓度为125 mg/L)中染色1 min,切下靠近主根上部的侧根2~3 cm,然后用蒸馏水洗去浮色,置于载玻片上用显微镜(DMRX50)进行根毛侵染过程的观察[15,16]。
取接种后13、23 和33 d 的萝卜茎根连接处2~3 cm,然后置于固定液中(乙醇:乙酸=1:1),每个处理每个时期3株用于后续石蜡切片。皮层侵染的石蜡切片和组织染色由武汉赛维尔生物科技有限公司完成。石蜡切片的步骤为:先将新鲜组织固定并修切好组织,然后进行组织脱水、包埋和切片。组织番红固绿染色的步骤为:先将石蜡切片脱蜡后并酒精梯度复水后用番红染液染色,洗去多余染料并脱色后再用固绿染液染色,最后脱水将切片透明封片[17]。制备好的切片用显微镜(DMRX50)进行皮层侵染过程的观察。
1.2.4 根内含菌量测定 为了监测抗感病萝卜接种后不同时期根内含菌量的变化,提取根肿菌DNA后 梯 度 稀 释 为108fg、107fg、106fg、105fg、104fg 和103fg,采用qPCR 制作标准曲线;取对照及接种处理后7、13、32 和45 d 的萝卜根,每个处理取3~4 株,3次重复,液氮快速冷冻后放置于-80℃冰箱保存备用。
用绝对定量法测定接种后不同时期萝卜根内含菌量。称取研磨后的0.1 g 萝卜根用CTAB 法提DNA,用于PCR 检测含菌量大致情况和qPCR 对萝卜根内的根肿菌进行定量(提取根肿菌DNA 后根据qPCR 的Ct 值,对应标准曲线计算根肿菌含量)。PCR 反应体系为:模板DNA 1µL,2×Taq Plus Master Mix 10 µL,Primer F 0.5 µL,Primer R 0.5 µL,补充RNase-free ddH2O 至20 µL;扩增程序为:95℃预变性4 min,95℃变性30 s,55℃退火30 s,72℃延伸45 s,34 个循环,72℃延伸10 min。qPCR 用三步法,qPCR 反应体系为:样品DNA 2 µL,2×Real universal Mix(SYBR Green blue)10 µL,Primer F 和Primer R分别为0.5 µL,补充RNase-free ddH2O 至20 µL。qPCR 扩增程序为:95℃预变性15 min,95℃变性10 s,58℃退火20 s,72℃延伸20 s,40个循环。
2×Taq Plus Master Mix 购于南京诺唯赞生物科技 股 份 公 司;2×Real universal Mix(SYBR Green blue)购于天根生化科技有限公司。普通PCR 和定量PCR(qPCR)的引物[18](表1)合成由武汉擎科有限公司完成。

表1 PCR和qPCR引物序列Table 1 Primers sequences of PCR and qPCR
1.2.5 根部防御酶活性和可溶性糖含量测定 取对照及接种处理后3、13 和25 d 的萝卜根用于酶活和可溶性糖含量测定,每个时期每个处理取0.1 g根作为1次重复,共设置3次重复。过氧化物酶(POD)活性检测试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒、过氧化氢酶(CAT)活性检测试剂盒以及植物可溶糖含量检测试剂盒均购于北京索莱宝科技有限公司。
POD 活性的测定:称取0.1 g组织,加1 mL 提取液冰浴匀浆。8000g,4℃离心10 min,取上清置于冰上待测。1 mL 比色皿中加入实验试剂(样本用提取液稀释5 倍后加入)混匀,并记录样品在470 nm下30 s 的吸光值A1 和90 s 的吸光值A2,△A=A2-A1。然后根据公式计算POD活性(W为样本质量):
POD活性(U/g)=35665×△A÷W
SOD 活性的测定:称取0.1 g 组织,加0.5 mL 提取液冰浴匀浆;放置于离心机8000g,4℃离心10 min,取上清置于冰上待测。样品测定时在1、2、3和4 号管加入实验试剂后混匀并置于1 mL 玻璃比色皿测定在560 nm 下的吸光度,△A 测定=A1-A2,△A空白=A3-A4。先计算抑制百分率:
抑制百分率=(△A空白-△A测定)÷△A空白×100%
保证抑制百分率在30%~70%范围内,再根据SOD 计算公式SOD 活性(W:样本质量,F:稀释倍数):
SOD 活性(U/mg)=11.4×抑制百分率÷(1-抑制百分率)÷W×F
CAT 活性的测定:称取0.1 g 组织,加入1 mL 提取液后进行冰浴匀浆。放置于离心机8000g,4℃离心10 min,取上清置于冰上待测。样品测定时实验试剂加入1 mL比色皿中,室温下立即测定240 nm下的初始吸光值A1 和1 min 后的吸光值A2,计算△A=A2-A1。最后根据公式计算样品中CAT 的活性(W为样本质量):
CAT活性(U/mg)=678×△A÷W
可溶糖含量测定:先将标准品用蒸馏水梯度稀释0.3、0.2、0.1、0.05、0.025和0.0125 mg/mL;然后空白管1、测定管2 和标准管3 加入实验试剂,混匀后95℃水浴10 min,冷却室温后取200µL 转移至96孔板,于620 nm 处测定吸光值,记为A1、A2 和A3,计算△A=A2-A1,△A 标准=A3-A1。以吸光度A(x)为横坐标,浓度(y)为纵坐标,建立标准曲线。根据标准曲线,计算出△A,再根据可溶糖计算公式,可溶糖(mg/g)=10y ÷ W,计算出样品中可溶糖的含量(W为样本质量)。
1.3 数据分析
采用Excel 2010和GraphPad Prism(8.0)软件进行数据分析,应用多重比较法(HSD)进行差异显著性检验。
2 结果与分析
2.1 不同萝卜品种对根肿菌的抗病性
对两个萝卜品种接种45 d 后的发病情况进行调查,感病萝卜品种‘GLS’的发病率为92.3%,病情指数为76.49;抗病萝卜品种‘JYY’的发病率为0,病情指数为0。

表2 两萝卜品种的发病率和病情指数Table 2 Disease incidence and disease index of two radish varieties
2.2 抗、感病萝卜接种根肿菌后的表型
对抗、感病萝卜接种后不同时期的根部表型进行观察。在接种后第25 d(图1A),感病萝卜根部开始出现轻微肿大;在接种后第33 d(图1B),感病萝卜根部出现明显的肿大并形成根瘤,大量侧根形成肿瘤,根表面成灰黑色;在接种后第45 d(图1C),感病萝卜主根异常膨大,呈不规则状,有较大的黑疤面积,部分侧根也有较大肿瘤。抗病萝卜在接种后不同时期,根部发育正常,侧根发达并且无肿瘤产生。表型观察表明接菌后第25 d 到第45 d 是根肿菌快速繁殖及病害发展的关键时期。

图1 两个萝卜品种接菌后第25 d(A)、33 d(B)和45 d(C)的根部表型Fig.1 Disease symptom of two radish varieties after 25(A),33(B),45(C)days post-inoculation with P.brassicae
2.3 抗、感病萝卜接种根肿菌后的组织学特征
2.3.1 根肿菌侵染抗、感病萝卜的根毛 分别对接种3、5、9、11 和14 d 萝卜的根部取样进行根毛侵染观察,其中对照组萝卜根毛无侵染(图2A、B),而接种根肿菌的抗、感病萝卜均能看到明显的根毛侵染。接种第3 d 为根毛吸附阶段,感病品种的根毛外吸附了大量的根肿菌休眠孢子,游动孢子将其原生质体注入根毛,空的孢子囊呈絮状粘附在根毛细胞上(图2C);而抗病品种的根毛周围有少量的根肿菌休眠孢子,并且游动孢子大部分吸附于主根上(图2D)。接种后第11 d,受侵染的大部分根毛内由原生质团形成了游动孢子囊,感病品种中游动孢子囊的分化处于高峰期(图E);而抗病品种受侵染根毛内形成游动孢子囊的根毛数量相对较少(图F)。至接种第14 d,感病品种可以观察到表皮侵染(图G);而抗病品种还处于游动孢子囊分化阶段(图H)。结果表明,不管是感病品种还是抗病品种受根肿菌侵染后,根部都能发生根毛侵染,但皮层侵染仅发生在感病品种中。不仅抗、感病萝卜中根肿菌发育进程有差异,同一品种根肿菌发育程度也存在很大差异,同一时期根内出现根肿菌的不同发育的阶段,有些根毛内根肿菌还处于次级原生质团阶段,但有些根毛内的根肿菌已经分化成次级游动孢子囊。

图2 抗、感病萝卜的根毛侵染过程Fig.2 Dynamics of root hair infection by P.brassicae in susceptible and resistant varieties
2.3.2 抗、感萝卜皮层侵染的组织学观察 进一步对接种后13、23、和33 d 的抗、感病品种的根进行组织切片以观察皮层侵染。结果显示,接种后第13 d感病品种和抗病品种的根横剖面没有太大的区别(图3A-D),但在感病品种中,几个相邻细胞之间的细胞壁开始溶解并相互融合成一个大的细胞,数量较多(图3A-B)。在接种后第23 d,感病品种皮层细胞大部分处于次级原生质团分化成休眠孢子囊的阶段,开始出现淀粉粒,细胞排列略为混乱(图3E-F);抗病萝卜远离维管束的皮层细胞有少量的原生质团状态的根肿菌,但没有能够进一步发育成成熟次级原生质团,并且根部的维管束结构完整(图3G-H)。在接种后第33 d,感病品种的皮层细胞充满着大量的休眠孢子囊,细胞膨大的数量较多,并挤压维管束,组织细胞形态部分变形(图3I-J);抗病品种的皮层细胞排列正常,没有休眠孢子囊形成(图3K-L)。对比接种后抗感萝卜的皮层侵染切片,根肿菌正常完成次级侵染并产生休眠孢子囊是感病品种根部膨大的主要原因。

图3 抗、感病萝卜皮层侵染过程观察Fig.3 Dynamics of cortical infection by P.brassicae in susceptible and resistant varieties
2.4 抗、感病萝卜接种根肿菌后的根内含菌量检测
为了监测抗、感病萝卜接种后不同时期根内含菌量的变化,对各个时期的萝卜根提取DNA 后进行含菌量检测。PCR 结果显示对照组未被污染并且引物具有良好特异性;抗病品种和感病品种接种后各时期均能检测到根肿菌,但是感病品种各个时期的扩增条带均亮于抗病品种(图4A)。
通过qPCR 构建不同浓度标准曲线,根肿菌含量与循环阈值Ct 的线性回归方程为Y= -3.906X +44.08(R2= 0.9999>0.99),线性关系良好(图4B)。根肿菌接种后,抗病萝卜根内的根肿菌含量在25 d达到峰值后下降,在第45 d 根内含菌显著低于第25 d;感病品根内含菌量在接种后7~25 d 差异不显著,但是在接种后25~45 d 的根中显著增长。接种后第7 d,抗病品种根内含菌量显著低于感病品种(HSD,P<0.05);在接菌后第13 d 和25 d,抗感病萝卜根内含菌量无明显差异;但在接菌后第45 d,抗病品种中的根内含菌量极显著低于抗病品种(HSD,P<0.01,图4C)。这与表型观察结果一致,接菌后25~45 d,根肿菌在感病植株体内快速繁殖(图1),是其根部肿大形成肿瘤的直接原因。。
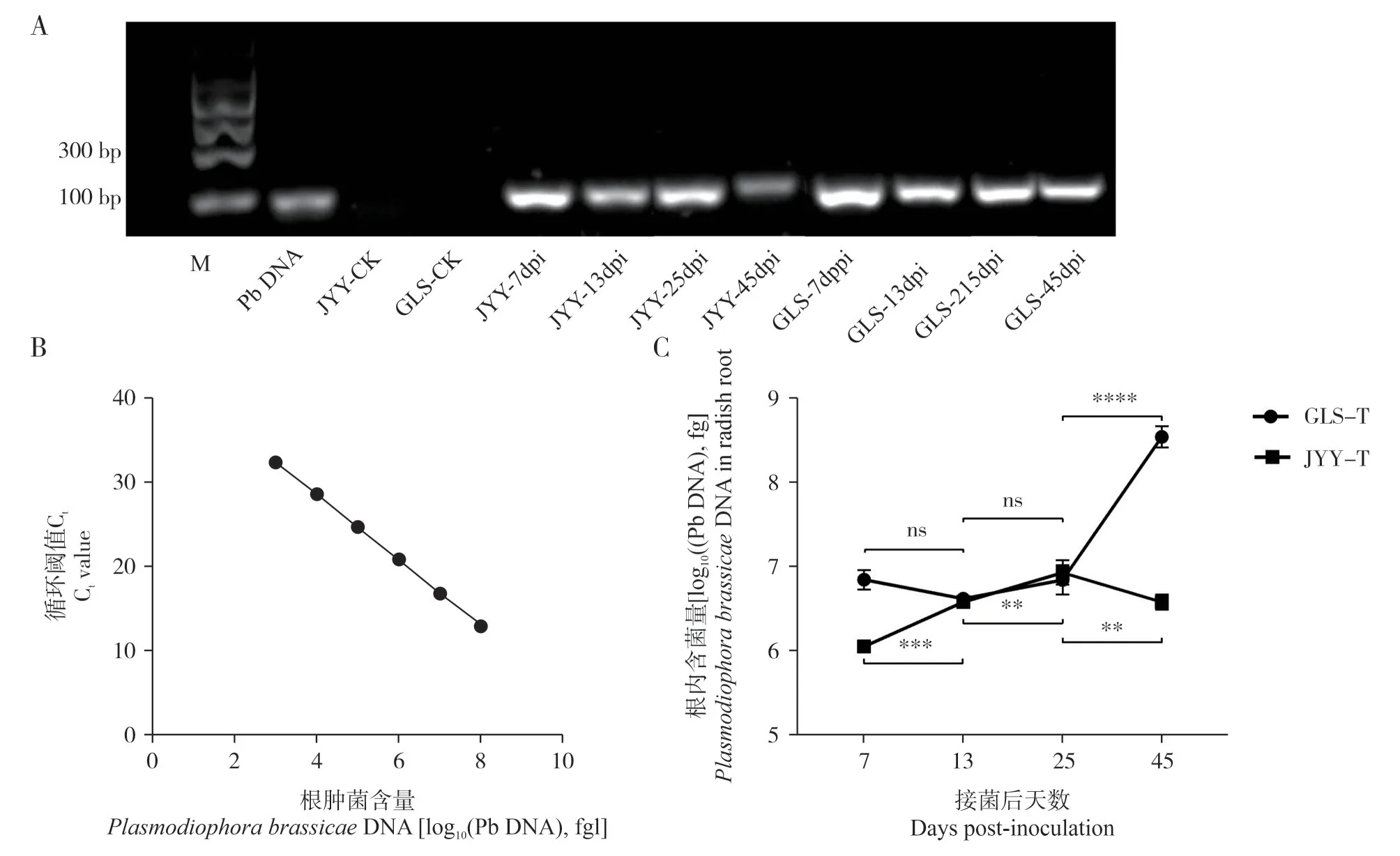
图4 抗、感萝卜接种后不同时间根内含菌量的变化Fig.4 PCR detection of P.brassicae in roots of 2 radish varieties at 7,13,25 and 45 d post-inoculation
2.5 抗、感萝卜接种根肿菌后根部防御酶及可溶性糖含量差异分析
2.5.1 抗、感萝卜接种后不同时间根部防御酶活性分析 植物在遭受病原物侵染时候,植物体内的防御酶会有不同程度的变化。为了了解抗、感萝卜接种后的防御酶活性差异,对接种后不同时间的抗、感萝卜根部的防御酶活性进行测定。结果显示,感病萝卜在接种后第13 d POD 活性显著高于对照组(HSD,P<0.05);而抗病萝卜在接种后第3 d POD 活性显著高于对照组(HSD,P<0.05);抗病萝卜在接种后第3 d 和第25 d 后POD 活性显著高于感病萝卜(HSD,P<0.05)。抗病萝卜在接种后第3 d SOD 活性显著高于对照组,为对照组活性的2.7倍;抗病萝卜在接种后第3 d SOD 活性显著高于感病萝卜,是感病萝卜活性的2.4 倍。感病萝卜在接种后第3、13、25 d CAT 活性分别为431.03 U·g-1、552.81 U·g-1和443.72 U·g-1,CAT 活性显著高于对照组(HSD,P<0.05);抗病萝卜在接菌后第25 d CAT 活性显著高于对照组(HSD,P<0.05);感病萝卜在接种后第3、13 和25 d CAT 活性均显著高于抗病萝卜(HSD,P<0.05)。
2.5.2 抗、感萝卜接种后不同时间根部可溶糖含量分析 可溶性糖是植物抗病中重要的非酶类物质,为探究可溶糖在植物抗病过程中的作用,对抗、感病萝卜接菌后不同时期根部的可溶糖含量进行测定。首先构建了可溶性糖浓度与吸光度的标准曲线,得到可溶性糖和吸光度之间的线性回归方程为Y=0.3204X-0.007941(R2=0.9983 >0.99),线性关系良好。抗、感病萝卜在接种后第13和25 d根部可溶糖含量均显著大于其对照组(HSD,P<0.05)。抗病萝卜在接种后第3 d 的根部可溶糖含量显著大于感病萝卜(HSD,P<0.05);而在接种后第13 d 显著低于感病萝卜(HSD,P<0.05)。
结果说明,在接种后第13 d和第25 d(次级侵染期),根肿菌均会诱导抗、感萝卜根内可溶糖的积累。在根肿菌建立初侵染时期感病萝卜较抗病萝卜积累较多的可溶糖,但是在次级侵染时期,抗病萝卜相对于感病积累更多的糖。
3 讨论
油菜作为我国的重要油料作物,近年来其生产严重受到根肿病的威胁,尽管前期培育了具有抗根肿病品种的油菜,比如华双5R 和华油杂62R[19,20]等,但长期种植单一抗病位点的材料,并随着生理小种的不断变异,抗病品种会发生抗性丧失的现象。本研究中的萝卜材料对多个地区的生理小种均表现出免疫,对萝卜的初步抗病研究,有助于我们了解不同十字花科作物对病原菌的表现,并且为制定根肿病防治计划提供了依据。
根肿菌侵染过程包括根毛侵染和皮层侵染,大量研究结果表明根肿菌接种抗病寄主、感病寄主以及非寄主植物后均会发生根毛侵染[21,22]。本实验结果显示在抗、感萝卜中观察到根毛侵染,与前人研究一致,并且在感病萝卜中观察到次级游动孢子囊的时期要早于抗病品种。在感病萝卜中,次级游动孢子产生的次级原生质团逐渐增多并发育成熟,形成大量的休眠孢子囊,细胞组织变形;而在抗病萝卜皮层细胞中,次级游动孢子不能发育成成熟的次级原生质团,不能形成休眠孢子囊,组织细胞正常无变形,证实皮层侵染只发生在感病寄主中。抗、感病萝卜表型观察结果也与组织切片的结果一致,皮层侵染的发生是根肿菌寄主感病的直接原因[22,23]。推测在抗病萝卜中,次级原生质团的形成过程中可能会引发其产生抗病反应,阻断根肿菌的进一步繁殖。
根肿菌侵染植物发病周期长,并且早期根部无症状,不利于根肿病的早期诊断和防治。常规的PCR 检测可以检测病原菌的有无,但无法进行精确定量。而实时荧光定量PCR 能够准确对检测潜伏的病原菌并进行定量[24],灵敏度高,在植物病害流行研究中广泛使用[25]。qPCR 技术也被用于根肿病的病害研究上,运用此技术能够检测不同抗病性寄主(甘蓝型油菜ECD02、白菜ECD05 和ECD13、甘蓝ECD15 以及两个油菜品种P2008-6 和P2008-10)和非寄主小麦在接种后不同时期根内的根肿菌含量,结果表示最早可以在接种后第5 d 对寄主根内根肿菌精确定量[26]。本实验在接种后第7 d的抗、感品种中检测到的根肿菌含量为107fg/g 和108fg/g,感病萝卜的根内含菌量极显著高于抗病萝卜,可用于鉴别抗病和感病萝卜,推测油菜相关的根肿病研究中,也可用此方法进行材料鉴定,提早预防。抗病品种根内含菌量先上升后下降,而感病品种中根内含菌量上升,与表型观察的结果一致。此外,与Cao 等[26]检测高抗寄主和高感寄主根中的含菌量时的结果一致。寄主体内含菌量的测定,不仅可以监测根肿菌在寄主体内的动态变化,并且为萝卜和油菜等十字花科作物的生产上根肿病早期诊断和预测提供研究基础。

图5 抗、感萝卜品种在接种根肿菌后不同时间根部防御酶活性Fig.5 Defensive enzyme activities in roots of two radish varieties at different times after inoculation
植物识别到病原菌入侵后,能够激活植物体内抗病反应,其中包括产生氧爆发引起细胞程序性死亡。氧爆发产生的活性氧对植物信号传导及调节多种细胞过程都有重要作用[27],但过多的活性氧不被清除,则会毒害细胞。植物为了阻止此现象,建立了抗氧化保护系统,其中就包括POD、SOD和CAT等防御酶系[28]。SOD 在清除自由基上发挥作用,而CAT 和POD 则是清除植物组织中过多的H2O2,帮助H2O2分解成氧气和水,增强植物抗逆水平。CAT 能通过催化分解氧爆发产生过量的H2O2产生水和氧气,减轻氧化伤害,增强植物的抗逆水平。对不同抗枯萎病类型的棉花品种中POD 和SOD 活性的研究结果表示,在田间发病条件下,感病品种中SOD和POD 活性最高,而抗病品种最低,说明可以用酶活性差异来鉴别棉花品种的抗病类型[29]。两个抗感性不同的萝卜品种受根肿菌休眠孢子侵染之后,抗病萝卜接菌后的POD 活性和SOD 活性均高于感病萝卜,与Xu等[30]在易感蚜小麦中与抗病相关酶变化的研究结果中POD 的变化一致。POD 与植物抗病性有关,可能是因为其与木质素合成有关,木质素含量可以影响细胞壁的强度,抵御病原物的入侵[31]。抗病萝卜的CAT 活性在接种根肿菌后始终低于感病品种萝卜,推测CAT 活性与抗病性成负相关,这与山茶花对灰斑病研究结果一致[32]。植物在逆境胁迫后,具有CAT 活性的相关蛋白能更够结合水杨酸(SA)抑制CAT 活性,H2O2浓度的升高进而激活寄主体内一些抗病基因的表达,从而提高植物的抗性[33]。综上,萝卜在被根肿菌侵染后,防御酶活性会发生不同程度的变化。其中,抗病萝卜根部POD 和SOD活性高于感病品种,而CAT 的活性低于感病品种,表明较高的POD 和SOD 活性和较低的CAT 活性有利于萝卜对根肿菌的抗性。

图6 抗、感病萝卜接种后根内可溶性糖含量变化Fig.6 Soluble sugar contents in roots of two radish varieties at different times after inoculation
关于可溶性糖与抗病性之间的关系有两种说法,一种认为可溶性糖含量和寄主抗病程度没有直接关系,不同组分糖在病原与寄主的互作过程中的作用也可能不同[34];另一种则认为可溶性糖的含量与寄主抗病性有关,例如黄瓜对霜霉病的抗性被激活后导致可溶糖含量增加[35],李淼等[36]也认为猕猴桃抗溃疡病的品种体内可溶糖含量要高于感病品种。本试验测定的可溶性糖与萝卜根肿病有一定的相关性,抗病品种萝卜接菌后的可溶糖总体上高于感病萝卜,说明可溶糖含可能参与萝卜对根肿菌的抗性反应。
病原菌侵染植物后会造成植物一系列变化,植物产生抗病包括抗病信号识别传递,酶促反应。采用qPCR 对不同抗感萝卜根内的含菌量测定并结合表型分型,为十字花科根肿病的早期防治提供理论依据。根肿菌接种抗感萝卜后,防御酶系统被破坏,自由基的代谢失衡。对抗感萝卜生理生化差异分析结果表示,SOD、POD和CAT以及可溶性糖参与了植物抗病过程,这为萝卜和根肿菌的互作机理研究提供了研究基础。此外,油菜接种根肿菌后根部生理生化的变化与萝卜中是否相似还待进一步研究。目前油菜中没有发现表现优异抗性的材料,对筛选到的其它十字花科作物的免疫品种的研究,能够从新的角度去探究根肿病的抗病机制,对理解油菜抗性丧失和油菜根肿病防治提供新思路。

