人脐带间充质干细胞分泌因子脂质体治疗黑素细胞痣激光治疗后皮肤损伤疗效观察
袁佩雯 王培森 侯秀英 李勤雨 李丽 张宝林 聂君毅 彭艳
[摘要]目的:探讨人脐带间充质干细胞分泌因子脂质体用于黑素细胞痣激光治疗后皮肤损伤的疗效。方法:将56例激光治疗后的黑素细胞痣患者随机分为对照组和治疗组各28例,对照组术后用空白脂质体涂抹治疗,治疗组术后用人脐带间充质干细胞分泌因子脂质体涂抹治疗,比较两组患者的损伤反应、伤口愈合时间、皮肤镜下愈合情况及总有效率。结果:术后不同时间点两组损伤反应评分呈递减趋势,术后2 d及术后4 d治疗组损伤反应弱于对照组(P<0.05),治疗组伤口愈合时间明显短于对照组(P<0.05),皮肤镜下愈合情况优于对照组,总有效率(100.00%)显著高于对照组(78.57%,P<0.05)。结论:人脐带间充质干细胞分泌因子脂质体用于黑素细胞痣激光治疗后皮肤损伤有较好疗效,值得临床推广应用。
[关键词]人脐带;间充质干细胞;脂质体;创面修复;激光;黑素细胞痣
[中图分类号]R739.5 [文献标志码]A [文章编号]1008-6455(2022)05-0010-04
Effect of Human Umbilical Cord Mesenchymal Stem Cell Secretory Factor Liposome on Skin Damage after Laser Treatment of Melanocytic Nevus
YUAN Peiwen1,WANG Peisen1,HOU Xiuying2,LI Qinyu2,LI Li2,ZHANG Baolin2,NIE Junyi1,PENG Yan1
(1.The First Clinical Medical College of Shanxi Medical University,Taiyuan 030001,Shanxi,China;2.The First Hospital of Shanxi Medical University,Taiyuan 030001,Shanxi,China)
Abstract: Objective To observe the therapeutic effect of human umbilical cord mesenchymal stem cell secretory factor liposome on skin injury of melanocyte nevus after laser treatment. Methods 56 cases of melanocyte nevus after laser treatment of the patients were randomly divided into control group and treatment group. The control group was treated with blank liposome and the treatment group was treated with human umbilical cord mesenchymal stem cell secretory factor liposome. The injury response, wound healing time, cutaneous healing and total effective rate were compared between the two groups. Results The injury response scores of the two groups at different postoperative time points showed a decreasing trend, and the injury response of the treatment group at all other time points except 0 d after surgery was weaker than that of the control group (P<0.05), and the wound healing time was significantly shorter than that of the control group (P<0.05), the healing condition under dermoscopy was better than that of the control group, and the total effective rate (100.00%) was higher than that of the control group (78.57%, P<0.05). Conclusion Human umbilical cord mesenchymal stem cell secretory factor liposome has a significant effect on skin injury after laser treatment of melanocyte nevus. It is worthy of clinical application.
Key words: human umbilical; cord mesenchymal stem cell; liposome; wound repair; laser; melanocytic nevus
黑素細胞痣(Melanocytic nevus),是最常见的一种良性皮肤肿瘤,由表皮、真皮内黑素细胞数目增多引起[1]。对于较小的黑素细胞痣来说,二氧化碳激光可在对病变处切割和灼烧的过程中瞬间完成气化作用,以达到治疗目的[2]。但不足的是,激光治疗后,短时间内会对患者皮肤造成损伤,若处理不当则极易形成瘢痕及色素沉着,为此临床医生采用了多种方法解决激光后皮肤损伤问题。间充质干细胞(Mesenchymal stem cells, MSCs)是一类具有强大自我更新和分化能力的多能干细胞,在组织工程和再生医学中发挥着重要作用[3]。人脐带间充质干细胞(Human umbilical cord mesenchymal stem cells,hUC-MSCs)易于获取,其分泌因子中含有血管内皮生长因子、白细胞介素8和单核细胞趋化蛋白1等细胞因子可诱导新生血管的形成、加速角质形成细胞迁移及肉芽组织形成,促进创面愈合。脂质体作为一种特殊性质的磷脂,与皮肤角质层具有相似的脂质双分子层结构[4-5],将hUC-MSCs分泌因子包裹在脂质体中可以有效促进分泌因子的透皮吸收,加快创面愈合。为此,本课题组将先前制备的人脐带间充质干细胞分泌因子脂质体[6]用于黑素细胞痣激光治疗后的皮损创面,探究其对损伤反应、愈合时间、色素沉着及瘢痕形成的影响,现报道如下。
1 资料和方法
1.1 一般资料:收集2018年12月-2020年3月就诊于笔者医院整形科的黑素细胞痣患者共56例,男26例,女30例,按随机数字表法分为两组(n=28)。对照组男12例,女16例;年龄17~42岁,平均(28.00±7.06)岁;黑素细胞痣分布,上肢8例,颜面部10例,躯干10例;痣直径1.2~3.0 mm,平均(2.28±0.56)mm。治疗组男14例,女14例;年龄16~42岁,平均(27.07±6.84)岁;黑素细胞痣分布,上肢8例,颜面部13例,躯干7例;痣直径1.6~3.0 mm,平均(2.42±0.44)mm。两组一般资料对比,差异无统计学意义,有可比性(P>0.05)。
1.2 纳入标准:自愿接受本次研究并签署知情同意书的患者;年龄16~45岁;临床诊断为黑素细胞痣;痣直径<3.0 mm;符合激光清除黑素细胞痣治疗指征;能全程在笔者科室进行换药和随访管理。
1.3 排除标准:合并有其他影响伤口愈合的基础疾病(如糖尿病、自身免疫性疾病、恶性肿瘤、肝肾功能衰竭、贫血等);有恶性黑色素瘤病史或家族史;曾多次或严重晒伤;接受紫外线光疗;增生性瘢痕或瘢痕疙瘩病史;怀孕或哺乳期女性;光敏感史或口服光敏药物等。
1.4 治疗方法
1.4.1 激光去除黑色素痣:所有患者均接受激光治疗(JZ30GZ型CO2激光治疗机,北京光电技术研究所),波长10.6μm,TIMER模式,功率4.0 W,脉冲加载时间0.15 s。由皮损的表面逐层向深部汽化,每次汽化1遍,用生理盐水擦拭创面,以肉眼监测到黑色素组织完全被去除为治疗终点。术后用碘伏消毒创面3次,用无菌纱布擦干。
1.4.2 创面用药:治疗组激光治疗完成后30 min内用hUC-MSCs分泌因子脂质体0.1 ml涂抹创面,静置1 min后用无菌纱布覆盖创面并固定。术后第1天和第2天依前法换药并观察创面情况,此后每2天换药1次,直到第14天。对照组每次用空白脂质体0.1 ml涂抹。换药时间同治疗组。
从治疗首日至最后换药日共14 d,每组均换药9次。两组患者每次换药前观察创面外观及分泌物情况,观察有无感染及皮疹等不良反应。
1.5 观察指标
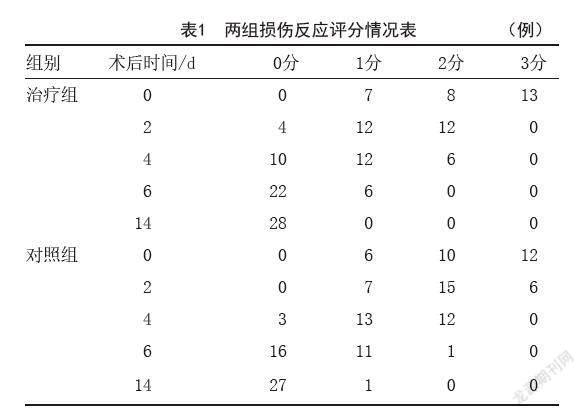
1.5.1 损伤反应指标:术后当天和术后2、4、6、14 d分别对两组患者受试部位红肿、渗出、出凝血等情况和患者局部灼热、疼痛等症状进行半定量判定。0分为无上述症状;1分为红肿、灼热;2分为明显红肿灼热,局部轻微渗血有灼痛感;3分为明显的红肿、灼热、灼痛,单位面积内明显渗血。
1.5.2 创面愈合时间:以创面干燥结痂并脱落为标准,记录从受伤日到结痂脱落的天数。
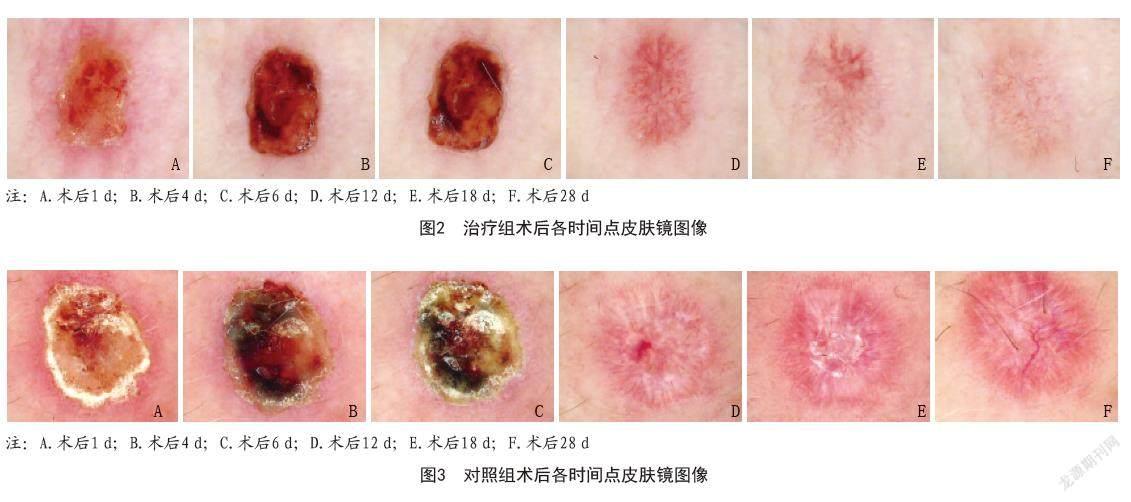
1.5.3 皮肤镜下愈合情况:分别于术后1、4、6、12、18、28 d,以30倍放大倍数皮肤镜(CH-DS50,广州创弘医疗科技有限公司)对创面进行摄影,评估患者伤口的大体病情变化,包括组织坏死、渗出、炎症反应、结痂、色素沉着、瘢痕及血管的形成与分布等。
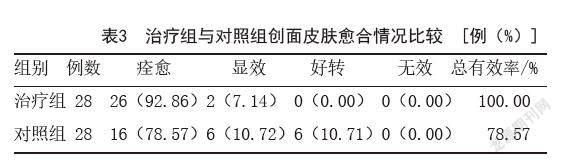
1.5.4 疗效评估:术后28 d时,由非治疗的医师根据观察结果及照片进行疗效评估。疗效分为4级:①痊愈,即皮损完全消失,无色素残留,外观基本上与正常皮肤一致,基本无瘢痕形成;②显效,即皮损消失70%以上,外观除有少数色素残留外,余与正常皮肤无差异,略有瘢痕形成;③好转,皮损消失50%以上,外观有较多色素残留外,与正常皮肤差异较大,瘢痕形成明显;④无效,即皮损仍然存在,有较多色素残留或瘢痕增生。总有效率=(痊愈+显效)例数/总例数×100%。
1.6 统计学分析:采用SPSS 22.0统计学软件对临床数据进行分析:计量资料采用(x¯±s)表示,等级资料应用重复测量方差分析,组间比较应用Fisher精确检验,P<0.05为差异有统计学意义。
2 结果
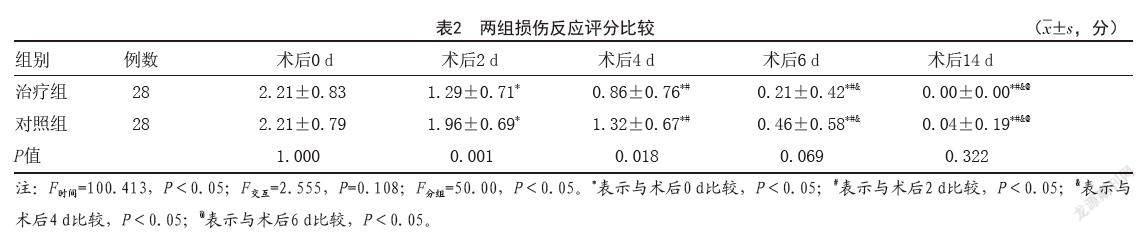
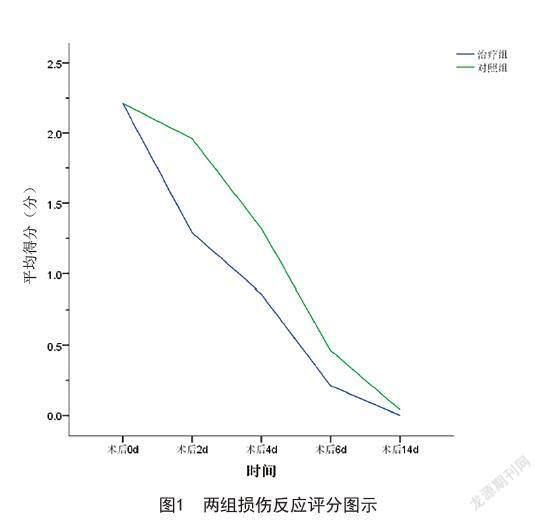
2.1 两组损伤反应评分比较:表1为两组患者术后0、2、4、6、14 d受试部位的创面损伤反应评分情况。组内对比,术后随着时间的推移,组内患者的损伤反应得分呈下降趋势,差异有统计学意义(P<0.05);组间对比,术后2 d及术后4 d治疗组损伤反应评分低于对照组,差异有统计学意义(P<0.05)。
2.2 两组伤口愈合时间比较:治疗组患者激光治疗部位皮肤创面愈合时间为(6.89±1.17)d,对照组患者皮肤创面愈合时间为(9.21±1.66)d,治疗组患者愈合时间短于对照组,两组伤口愈合时间对比,差异有统计学意义(P<0.05)。
2.3 两组各时间点镜下皮肤愈合情况:如图2所示,早期治疗组伤口血痂形成薄,周围红肿消退快,血痂完全脱落后创面光滑,纤维形成少,与周边正常皮肤大部分融合,创面下色素残留和扩张血管不多,瘢痕形成不明显;如图3所示,对照组血痂干燥且较厚,周围红肿消退慢,放射状条形纤维形成明显,创面下血管有明显的增生和扩张,有较多瘢痕形成。
2.4 临床疗效:术后28 d时,治疗组总有效率为100.00%,对照组总有效率为78.57%,根据样本量采用Fisher精确检验,结果显示P=0.023,提示治疗组治疗效果更佳,差异有统计学意义(P<0.05)。见表3。
3 讨论
近年研究发现MSCs可通过旁分泌作用改善组织的病理微环境,修复组织器官,在组织工程和再生医学中发挥着重要作用[9-11]。MSCs外泌体(MSCs-exosomes, MSCs-Ex)作为MSCs旁分泌作用中传递信号的重要载体,主要通过转运膜表面信号分子[12]、释放膜融合后的内容物[13],或释放内部信号分子作用于细胞膜表面受体发挥作用。MSCs-Ex可携带mRNA、miRNA、蛋白质、脂质等生物信息[14],诱导血管再生、促进细胞增殖等[15],在组织再生和修复领域具有广阔的治疗前景。脐带具有不涉及道德、伦理和法律方面的问题等诸多优点,被广泛用于hUC-MSCs的提取。许多研究证明脐带MSCs分泌因子具有较好的组织损伤修复及促进新生血管的生长等作用:Hu等[16]发现hUC-MSC来源的外泌体富有miR-21-3p,可促进创伤部位血管生成及诱导成纤维细胞迁移。Fang等[17]通过高通量测序发现脐带MSC外泌体中有一组特异microRNA(miR-21、miR-23a、miR-125b和miR-145)通過抑制α-平滑肌肌动蛋白与转化生长因子-β/SMAD2信号通路活性相关的胶原沉积,抑制肌成纤维细胞的形成。也有学者证明脐带来源的MSCs外泌体同样具有对淋巴细胞增殖和细胞因子分泌的抑制作用,能够抑制宿主抗移植物排斥反应,减轻局部的炎症反应[18]。
本研究以脂質体为载体,将hUC-MSCs分泌因子作用于黑素细胞痣激光治疗后的皮肤创面,治疗过程中治疗组较对照组炎症反应轻,组织坏死少,肉芽组织新生速度快,结痂薄,色素沉着少,且创面愈合时间显著短于对照组。在瘢痕形成方面,治疗组愈合后创面平整、基本无瘢痕形成。其主要机制可能是hUC-MSCs依靠其旁分泌作用产生的营养因子,可促进上皮细胞的早期增殖、分化和移行,调控胶原的合成与降解不平衡,抑制成纤维细胞大量增生[7-8]。
但是,本研究的局限性在于所选创面面积较小,仅对激光治疗后形成的创面进行试验,对于其他类型的创面是否能产生类似的效果不能明确;未能对hUC-MSCs分泌因子干预后的创面取材进行组织学分析,两组的瘢痕厚度、不同类型的胶原比例及核心蛋白多糖等指标未能量化,具体机制有待进一步研究。
目前,MSCs的研究正逐步应用于临床,但其分泌因子中的各种物质成分及作用机制有待进一步明确。除此之外,具有特定效用的MSCs分泌因子的纯化分离、快速制备以及临床使用的安全性、具体剂量问题也亟需研究。基于hUC-MSCs分泌因子脂质体在黑素细胞痣的患者接受激光治疗后促进创面愈合、抑制瘢痕形成方面的作用,值得临床应用研究和进一步开发,为“无细胞”临床治疗提供新思路。
[参考文献]
[1]Damsky W E,Bosenberg M.Melanocytic nevi and melanoma: unraveling a complex relationship[J].Oncogene,2017,36(42):5771-5792.
[2]Zeng Y,Zheng Y Q.Successful treatment of congenital melanocytic nevus on tragus with CO2 laser[J].J Dermatolog Treat,2014,25(4):
287-289.
[3]Naji A,Eitoku M,Favier B,et al.Biological functions of mesenchymal stem cells and clinical implications[J].Cell Mol Life Sci,2019,76(17):3323-3348.
[4]Jøraholmen M W,Basnet P,Acharya G,et al.PEGylated liposomes for topical vaginal therapy improve delivery of interferon alpha[J].Eur J Pharm Biopharm,2017,113:132-139.
[5]董王明,江昌照,叶金翠,等.经皮给药制剂促透方法研究进展[J].中国新药杂志,2020,29(18):2089-2097.
[6]刘美林,傅松涛,王培森,等.人脐带间充质干细胞条件培养基脂质体修复大鼠皮肤创面损伤[J].中国组织工程研究,2019,23(5):734-740.
[7]Hu P,Yang Q,Wang Q,et al.Mesenchymal stromal cells-exosomes: a promising cell-free therapeutic tool for wound healing and cutaneous regeneration[J].Burns Trauma,2019,7:38.
[8]Wu P,Zhang B,Shi H,et al.MSC-exosome: A novel cell-free therapy for cutaneous regeneration[J].Cytotherapy,2018,20(3):291-301.
[9]Zhao L,Liu X,Zhang Y,et al.Enhanced cell survival and paracrine effects of mesenchymal stem cells overexpressing hepatocyte growth factor promote cardioprotection in myocardial infarction[J].Exp Cell Res,2016,344(1):30-39.
[10]Dittmer J,Leyh B.Paracrine effects of stem cells in wound healing and cancer progression[J].Int J Oncol,2014,44(6):1789-1798.
[11]Mirotsou M,Jayawardena T M,Schmeckpeper J,et al.Paracrine mechanisms of stem cell reparative and regenerative actions in the heart[J].J Mol Cell Cardiol,2011,50(2):280-289.
[12]Ti D,Hao H,Tong C,et al.LPS-preconditioned mesenchymal stromal cells modify macrophage polarization for resolution of chronic inflammation via exosome-shuttled let-7b[J].J Transl Med,2015,13:308.
[13]Montecalvo A,Larregina A T,Shufesky W J,et al.Mechanism of transfer of functional microRNAs between mouse dendritic cells via exosomes[J].Blood,2012,119(3):756-766.
[14]Kourembanas S.Exosomes:vehicles of intercellular signaling,biomarkers,and vectors of cell therapy[J].Annu Rev Physiol,2015,77:13-27.
[15]Su D,Tsai H I,Xu Z,et al.Exosomal PD-L1 functions as an immunosuppressant to promote wound healing[J].J Extracell Vesicles,2019,9(1):1709262.
[16]Hu Y,Rao S S,Wang ZX,et al.Exosomes from human umbilical cord blood accelerate cutaneous wound healing through miR-21-3p-mediated promotion of angiogenesis and fibroblast function[J].Theranostics,2018,8(1):169-184.
[17]Fang S,Xu C,Zhang Y,et al.Umbilical cord-derived mesenchymal stem cell-derived exosomal micrornas suppress myofibroblast differentiation by inhibiting the transforming growth factor-β/smad2 pathway during wound healing[J].Stem Cells Transl Med,2016,5(10):1425-1439.
[18]楊向荣,丁娟,徐正阳,等.人脐带间充质干细胞来源外泌体的生物学特性研究[J].华中科技大学学报(医学版),2016,45(2):154-159.
[收稿日期]2020-11-11
本文引用格式:袁佩雯,王培森,侯秀英,等.人脐带间充质干细胞分泌因子脂质体治疗黑素细胞痣激光治疗后皮肤损伤疗效观察[J].中国美容医学,2022,31(5):10-13.

