持续光照建立斑马鱼失眠模型及评价
冉思邈,夏 婧,夏乐旋,王 平
失眠是以频繁而持续的入睡困难和睡眠维持困难并导致睡眠感不满意为特征的一种睡眠障碍。各种原因导致的睡眠不足均对健康有着负面影响[1]。严重的睡眠障碍不仅影响患者的身心健康,也影响了患者的生活和工作质量,长期失眠对个人和社会造成了严重的负担[2]。
斑马鱼与人类基因高度同源,可以通过光照、咖啡因、持续流动水流、感官刺激、电刺激、物理摇晃等方式对斑马鱼进行睡眠剥夺[3-7],但目前尚未见斑马鱼成鱼失眠模型的报道。该研究探索建立一种斑马鱼成鱼失眠模型,并通过比较睡眠剥夺后斑马鱼的运动行为、学习记忆能力、生物钟基因表达和脑部超微结构的改变进行评价,以期为失眠的机制和动物模型研究提供借鉴和参考。
1 材料与方法
1.1 实验动物4月龄同批次野生型AB系雄性斑马鱼160尾,购自国家斑马鱼资源中心,饲养在湖北中医药大学老年医学研究所斑马鱼实验室,房间内温度为(28.5±1)℃,光照条件为14 h光照,10 h黑暗,用自动计时器设置每天8:00开灯,22:00关灯,养鱼水pH值在7.0~8.0之间,导电率在450~500 μs/cm之间。每天早晚饲喂孵化好的丰年虾各1次。
1.2 主要试剂与仪器荧光定量试剂盒、逆转录试剂盒(日本TaKaRa公司),集中式斑马鱼养殖系统(青岛金水海洋生物设备有限公司),净水供水单元(上海海圣生物实验设备有限公司),斑马鱼行为分析系统、T迷宫行为学追踪系统(法国View Point Life Sciences公司),PCR仪器(美国Bio-Rad 公司)。
1.3 方法
1.3.1造模方法 将160尾雄性斑马鱼随机分为对照组(n=20,记为CK组)和睡眠剥夺组(n=140,记为SD组),睡眠剥夺组分别设置不同剥夺时长(1~7 d)的亚组,即SD1、SD2、SD3、SD4、SD5、SD6和SD7组。CK组斑马鱼保持正常的14 h/10 h光暗周期,SD组的斑马鱼根据组别给予相应时长的持续光照。
1.3.2斑马鱼行为学检测 光照结束后,每组随机选取6尾斑马鱼进行运动及学习记忆能力的检测。利用斑马鱼行为分析系统追踪斑马鱼的运动,设置追踪参数Movement Threshold,Small/Large:25,Inact/Small:5。将4月龄斑马鱼放入直径为15 cm的养鱼缸中,缸中加入养鱼水至鱼缸的1/3,斑马鱼可以在缸中自由活动,行为学分析系统会自动追踪斑马鱼的运动并给出运动轨迹和数据分析,追踪时间为24 h。利用改良后的T迷宫测试各组斑马鱼的学习记忆能力,测试前一天,让斑马鱼在迷宫内自由活动20 min以适应环境,减少新环境对斑马鱼的干扰。测试当天,在甬道起点放入测试鱼,让其在T迷宫中自由活动,测试时间为6 min,观察并记录鱼从起点到找到TA区(当鱼找到并停留30 s后才算进入了TA区)的潜伏时间,测试结束后给予食物奖励。未找到TA区的鱼,在6 min后引导其进入TA区并停留30 s,同样给予食物奖励。每条测试鱼都有一个对应编号的独立容器, 测试结束后放回各自容器中。每天测试4次,分别于8:00、12:00、16:00、20:00准时测试,记录每次潜伏时间,以次日第5次潜伏时间作为考察其学习记忆能力的主要指标。
1.3.3qRT-PCR检测相关基因的表达 光照结束后,每组随机取3尾斑马鱼,在4 ℃冰水混合物中处死斑马鱼,随即在冰上操作取脑,TRIzol 法提取脑组织总RNA,利用M-MLV反转录酶反转录为cDNA,以cDNA为模板进行qRT-PCR实验。以Gapdh为内对照,以对照组为外对照,利用Light Cycler 480荧光实时定量PCR仪进行扩增,以2-ΔΔCt方法计算基因相对表达量。所用引物序列如表1所示。

表1 基因引物序列表
1.3.4透射电镜观察斑马鱼大脑超微结构 实验结束后,每组各取1尾斑马鱼,在4 ℃冰水混合物中处死斑马鱼,随即在冰上断头并剥离出完整的大脑,置于电镜固定液中固定。室温下固定2 h,再转移至4 ℃保存备用,制作切片。利用透射电子显微镜观察各组斑马鱼大脑神经元,比较不同组斑马鱼脑组织神经元细胞器和超微结构的改变。
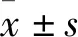
2 结果
2.1 各组斑马鱼运动情况与CK组斑马鱼对比,SD1、SD2、SD3组静息时间均增多(P<0.05),SD4~SD7组斑马鱼静息时间未见明显变化(P>0.05),可能当睡眠剥夺时长超过3 d时,斑马鱼在持续光照条件下逐渐耐受,故该实验选取了SD1~SD3各组斑马鱼进行进一步的探索。见图1、2。图3为各组斑马鱼大、小运动时间,大、小运动距离,大、小运动计数汇总,其中SD3组大运动时间及大运动计数较CK组减少,差异有统计学意义(P<0.05),而各组间大运动距离、小运动时间、小运动距离、小运动计数对比则无明显差异(P>0.05)。

图1 各组斑马鱼静息时间与CK组比较:*P<0.05

图2 各组斑马鱼运动轨迹

图3 各组斑马鱼大小运动计数、时间及距离与CK组比较:*P<0.05
2.2 各组斑马鱼学习记忆能力情况图4为各组斑马鱼T迷宫5次测试结果,第5次测试结果显示,CK组与SD各组间比较,CK组斑马鱼学习记忆能力较SD1组强(P<0.05),CK组斑马鱼学习记忆能力比SD2、SD3组强(P<0.01);SD各组间对比,SD1组斑马鱼学习记忆能力较SD2、SD3组斑马鱼强(P<0.01),SD2组斑马鱼学习记忆能力较SD3斑马鱼强(P<0.01),见图4、5。

图4 各组斑马鱼学习记忆能力统计图
2.3 各组斑马鱼生物钟基因变化情况各组斑马鱼脑组织qRT-PCR检测结果显示,SD3组斑马鱼脑部Per1a、Per2、Bmal1、Cry1b mRNA水平表达与CK组相比,差异有统计学意义(P<0.05),而其余各组之间比较差异无统计学意义(P>0.05)。见表2。

表2 各组斑马鱼各指标mRNA水平表达
2.4 各组斑马鱼大脑病理变化情况透射电子显微镜下可见CK组斑马鱼大脑神经元细胞结构完整,细胞核(N)结构完整,染色质颜色稍浅,团聚在核内,线粒体(M)丰富且结构完整,可见散在分布的粗面内质网(rER)。SD2及SD3组斑马鱼大脑神经元出现坏死现象,镜下可见细胞核塌陷,边界破解甚至溶解,染色质固缩,线粒体出现肿胀,甚至大量空泡。见图6。

图5 各组斑马鱼T迷宫轨迹图

图6 各组斑马鱼大脑神经元病理改变 ×1 200A~D:CK组、SD1组、SD2组、SD3组
3 讨论
斑马鱼和人类一样,白天活跃,夜间因褪黑激素达到顶峰,进入睡眠阶段,具有明显的昼夜节律,研究[8]显示了其与人类慢波睡眠和快速眼动睡眠相似的慢爆发睡眠和传播波睡眠,因此,选择斑马鱼作为失眠动物模型具有良好的优势。
光照可以明显抑制斑马鱼的睡眠,当斑马鱼在生物夜晚的最后6 h暴露在150 lux的光线下,睡眠时间减少90%以上,但长时间在恒定150 lux光照条件下,1~2周内睡眠逐渐恢复[9]。正如光照影响小鼠的睡眠一样[10]。该研究观察到光照4~7 d的斑马鱼静息时间与空白组未见差异,这可能是斑马鱼耐受光照开始恢复睡眠,因此,未选择此阶段的斑马鱼进行失眠状态的模拟。完全睡眠剥夺24 h后斑马鱼出现认知损害[11],该研究观察到进行光照后的斑马鱼学习记忆能力下降。这与人类失眠后出现的健忘、记忆力下降的表现具有相似性,因此,运用斑马鱼模拟失眠是切实可行的。
光照时间太短可能不能模拟失眠,时间过长斑马鱼可能出现光照耐受,形成光照条件下的睡眠节律而恢复睡眠。该研究在行为学结果的基础上设置了1、2、3 d的不同光照时间,比较不同光照时间下斑马鱼的运动行为、学习记忆能力、时钟基因以及脑部超微结构。结果显示,随着光照时间的延长,斑马鱼的学习记忆能力持续下降。而运动形式和生物钟基因均在光照3 d时才出现改变,SD3组斑马鱼大运动时间、计数均较CK组减少,大运动指的是斑马鱼在运动中整个身体的运动幅度超过了设置值的上限,为过度行为,此行为可间接说明其活动过度,与人类失眠后焦虑、易激惹、活动过度行为相吻合。昼夜节律的产生和维持与生物钟基因的周期性表达有关,生物节律是由一组生物钟基因如Bmal1、Clock、Cry和Per等调控的,目前人类在哺乳动物中发现的时钟基因Per、Cry、Clock、Bmal对生物体内的生物钟都起着重要的调控作用[12]。Perl和Per2基因可能是光信号转导过程中的靶基因,因为这两个基因对光的反应非常强烈,Per基因可以通过自身节律表达的变化,实现对中枢节律的调控,从而对生物的昼夜节律产生影响。Bmal1是调节生物节律的重要转录因子,在时钟体系中发挥着重要的作用。在对Cry的研究中表明,持续黑暗的条件下Cry1突变会使生物体内的生物钟节律加快,光照条件对其有较大的影响。该研究选用常见的生物钟基因Per1a、Per2、Bmal1、Cry1b观察其mRNA表达水平来反映光照对其影响,结果显示这些指标均在连续光照3 d时出现改变。电镜下观察到光照2 d后的斑马鱼出现神经元损伤和细胞凋亡,当光照时间延长到3 d时,神经元损伤情况则加重。因斑马鱼脑部体积较小,该次脑部取材为完整大脑,未能单独取到与失眠、生物钟关系最为密切的相关脑区,需要进一步研究。

