百香果皮总黄酮提取工艺优化及其抗氧化活性研究
景继月,许梦圆,田永涛,田海龙,王文蜀*
(1.民族地区生态环境国家民委重点实验室(中央民族大学),北京 100081;2.中央民族大学 生命与环境科学学院,北京 100081)
西番莲属(PassifloraLinn.)起源于巴西,果实大多香气浓郁、酸甜可口,富含维生素、氨基酸和矿物质等营养成分[1-3],受到国内外消费者的喜爱。我国于1901年从日本引入紫皮百香果(PassifloraedulisSims),现在南方等地广泛种植[4-5]。以百香果为原料的食品日益丰富,将其作为调味品添加到饮料、甜点以及菜品中可赋予相关产品更多味觉感受,深受大众尤其是年轻人的青睐,至今我国的相关专利已超过300项。百香果皮含有多糖、生物碱、酚类等活性物质[6-7],其中的黄酮被报道具有抗炎、抗菌、降血糖、保护神经、抗焦虑与镇静等生理功能[8-11],并被证实具有清除DPPH自由基、羟基自由基、超氧阴离子自由基和亚硝酸根离子的抗氧化能力[12-13],显示了被开发为天然抗氧化剂的潜力。
超声辅助提取法与其他方法相比有适应性广、溶剂消耗量少等优点,但其提取活性物质会受到多种因素影响[14-15]。因此采用响应面实验设计,全面考察因素与因素之间的相互关系,通过浸膏得率、总黄酮含量和抗氧化能力3个响应值,优化百香果皮中总黄酮提取工艺,并评价提取物的抗氧化活性,为百香果开发为功能性食品以及调味品等相关产业绿色发展提供科学数据。
1 材料与方法
1.1 原料与试剂
紫皮百香果:广西壮族自治区北流市;无水乙醇、无水甲醇、冰醋酸、醋酸钠、盐酸(分析纯)、过硫酸钾、氯化铁、硫酸亚铁:北京化工厂;无水三氯化铝:北京偶合科技有限公司;Trolox(6-Hydroxy-2,5,7,8-tetramethylchromane-2-
carboxylic acid)、ABTS[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)]、BHT(2,6-Di-tert-butyl-4-methylphenol):上海麦克林公司;芦丁、TPTZ(tripyridyl triazine):上海源叶生物科技有限公司;DPPH(1,1-Diphenyl-2-picrylhydrazyl):日本东京化成工业株式会社。
1.2 仪器与设备
BT224S电子分析天平 北京赛多利斯仪器系统有限公司;Espire酶标仪 美国PerkinElmer公司;V750紫外分光光度计 日本JASCO株式会社;J-HH-6A精密数显恒温水浴锅 上海胜卫电子科技有限公司;RE-2000旋转蒸发器 上海洪旋实验仪器有限公司;MZX-D循环水式真空泵 北京精锐泽祥实验仪器有限公司。
1.3 方法
1.3.1 百香果皮黄酮提取
将完整的百香果的果汁与果皮分开。果皮用蒸馏水洗净,切成1 cm3大小的方块,置于通风、干燥处阴干,备用。称取4 g干燥的百香果皮置于圆底烧瓶中,在对应液料比、乙醇百分含量和超声时间下,充分振摇,放入水浴锅中进行充分冷凝回流,对应提取时间,至黄酮类物质基本提取完全,之后用真空泵抽滤,收集滤液,40 ℃真空浓缩直至无乙醇味。分液漏斗过滤,吹干,得浸膏,并称取质量。按照下列公式计算浸膏得率:
浸膏得率(%)=浸膏质量/干燥百香果皮×100%。
1.3.2 百香果皮总黄酮含量测定
百香果总黄酮含量测定采用AlCl3比色法,70%乙醇配制样品和AlCl3溶液,在10 mL具塞比色管中放入0.8 mL 0.2 mol/L AlCl3溶液与不同浓度芦丁标准品,超纯水定容,反应25 min,将芦丁换成纯水作为空白对照。以芦丁标准溶液浓度为横坐标,吸光度值为纵坐标绘制标准曲线:y=0.0481x+0.0965,R2=0.9998(n=3)。实验表明,在0.8~4.8 μg/mL范围内,芦丁浓度与吸光值有良好的线性关系。将样品所得吸光度值代入标准曲线,计算其总黄酮含量,所得结果用芦丁当量(rutin equivalent)表示,即为 mg RT/g DW。
1.3.3 百香果皮抗氧化活性测定
1.3.3.1 清除DPPH自由基能力测定
采用Kivrak[16]的方法并作适当调整。用甲醇溶解DPPH,并配制成0.1 mmol/L的工作液,在96孔板中加入100 μL工作液与100 μL不同浓度的待测样品。阳性对照 BHT 代替待测样品,同样按上述方法进行测试,空白对照仅甲醇与工作液,平行3次,充分混合后,避光反应30 min,于517 nm处测定吸光度值。所得清除DPPH自由基能力计算公式为:
DPPH自由基清除率(%)=[1-(A1-A2)/A0]×
100%。
式中: A0为空白对照的吸光度值;A1为样品与DPPH溶液混合后混合液的吸光度值;A2为样品溶液与甲醇混合后混合液的吸光度值,通过SPSS计算半数清除率(half maximal scavenging concentration),所得结果用SC50(mg/mL)表示。
1.3.3.2 清除ABTS自由基能力测定
实验方法采用Li等[17]的方法并作适当调整,将 0.2 mL 7.4 mmol/L ABTS溶液与0.2 mL 2.6 mmol/L K2S2O8溶液混合,置于黑暗室温条件下反应,混合液用无水甲醇稀释,直至混合液在紫外分光光度计下测得吸光度为0.70±0.02。在96孔板中加入180 μL混合液与20 μL不同浓度的Trolox标准液,于734 nm处测定吸光度值,得标准曲线。以Trolox 标准溶液浓度为横坐标,吸光度值为纵坐标绘制标准曲线,将样品所得吸光度值代入标准曲线,计算其抗氧化能力,所得结果用Trolox当量表示,即为mmol/L TE/g。
1.3.3.3 铁离子还原能力测定
本实验按照Benzie等[18]的方法并进行适当调整。超纯水配制20 mmol/L FeCl3·6H2O溶液,40 mmol/L 盐酸配制得到10 mmol/L TPTZ溶液,用醋酸钠、TPTZ溶液和FeCl3·6H2O溶液按照10∶1∶1的比例充分混合后得到FRAP工作液。使用超纯水和硫酸亚铁配制得到100 mmol/L FeSO4·7H2O母液,在96孔板中加入180 μL FRAP工作液与20 μL不同浓度的FeSO4·7H2O 溶液充分混合均匀后,于593 nm处测定吸光度值,样品的测试方法与上述方法一致。以 Fe2+浓度为横坐标,吸光度值为纵坐标绘制标准曲线。将样品所得吸光度值代入标准曲线,计算其还原能力,所得结果用Fe2+当量表示,即为mmol/L Fe2+/g。
1.4 实验设计
1.4.1 单因素实验设计
根据所查文献,选用液料比、乙醇百分含量、超声时间和提取时间4个因素设计单因素实验,液料比分别设置为20∶1、30∶1、40∶1、50∶1、60∶1,乙醇百分含量分别设置为40%、50%、60%、70%、80%,超声时间分别设置为10,15,20,25,30 min,提取时间分别设置为60,90,120,150,180 min,按照1.3.1步骤进行实验,以浸膏得率作为考察指标。
1.4.2 响应面实验设计
中心组合设计(CCD) 实验通过两两因素的考察,使点线延伸到面,呈现出三维立体效果,直观反映因素与因素之间的相互关系。根据CCD原理,以单因素实验为基础,选取液料比(A)、乙醇百分含量(B)、超声时间(C)3个因素为自变量,而且在保证浸膏得率(R1)较高的同时,增加总黄酮含量(R2)与清除DPPH自由基能力(R3)共3个响应值,建立模型,筛选百香果皮黄酮最佳提取工艺,因素与水平设计见表1。
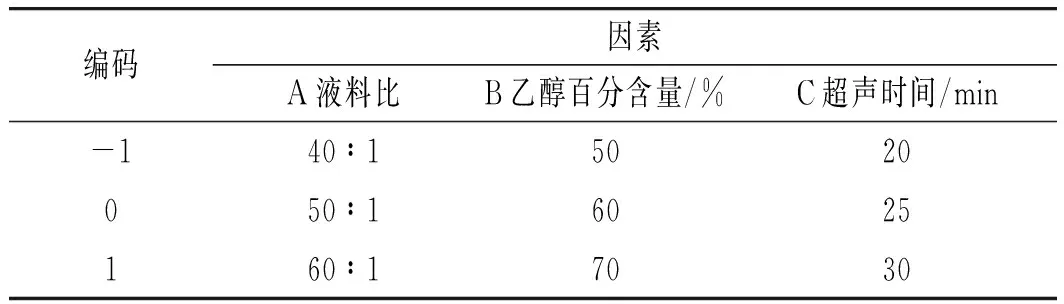
表1 响应面实验因素与编码表Table 1 Factors and codes of response surface experiment
1.5 数据处理与分析
采用Excel和Design Expert 8.0.5软件对实验数据进行分析,所有处理均进行3次重复实验。
2 结果与讨论
2.1 单因素实验结果
2.1.1 液料比对浸膏得率的影响

图1 液料比对百香果皮总黄酮浸膏得率的影响Fig.1 Effect of liquid-solid ratio on extraction yield of total flavonoids from P. edulis Sims peel
分别设置液料比为20∶1、30∶1、40∶1、50∶1、60∶1,固定乙醇浓度60%,超声时间20 min,提取时间120 min,计算浸膏得率。由图1可知,在一定范围内,随着液料比增加,浸膏得率也随之增加。在液料比为50∶1时,浸膏得率达到最大值。上述现象的原因可能是在液料比为50∶1时,提取物已基本溶出,继续增加溶剂的使用量会使较多其他化合物溶出,导致提取液总体黏度增加而抑制原有提取物与溶剂结合,减少其溶出,因此浸膏得率降低[19]。此外,溶剂用量较大时还会造成实验条件控制成本增加,所以选择50∶1作为最佳液料比。
2.1.2 乙醇百分含量对浸膏得率的影响
分别设置乙醇百分含量为40%、50%、60%、70%、80%,固定液料比40∶1,超声时间20 min,提取时间120 min,计算浸膏得率,提取结果见图2。
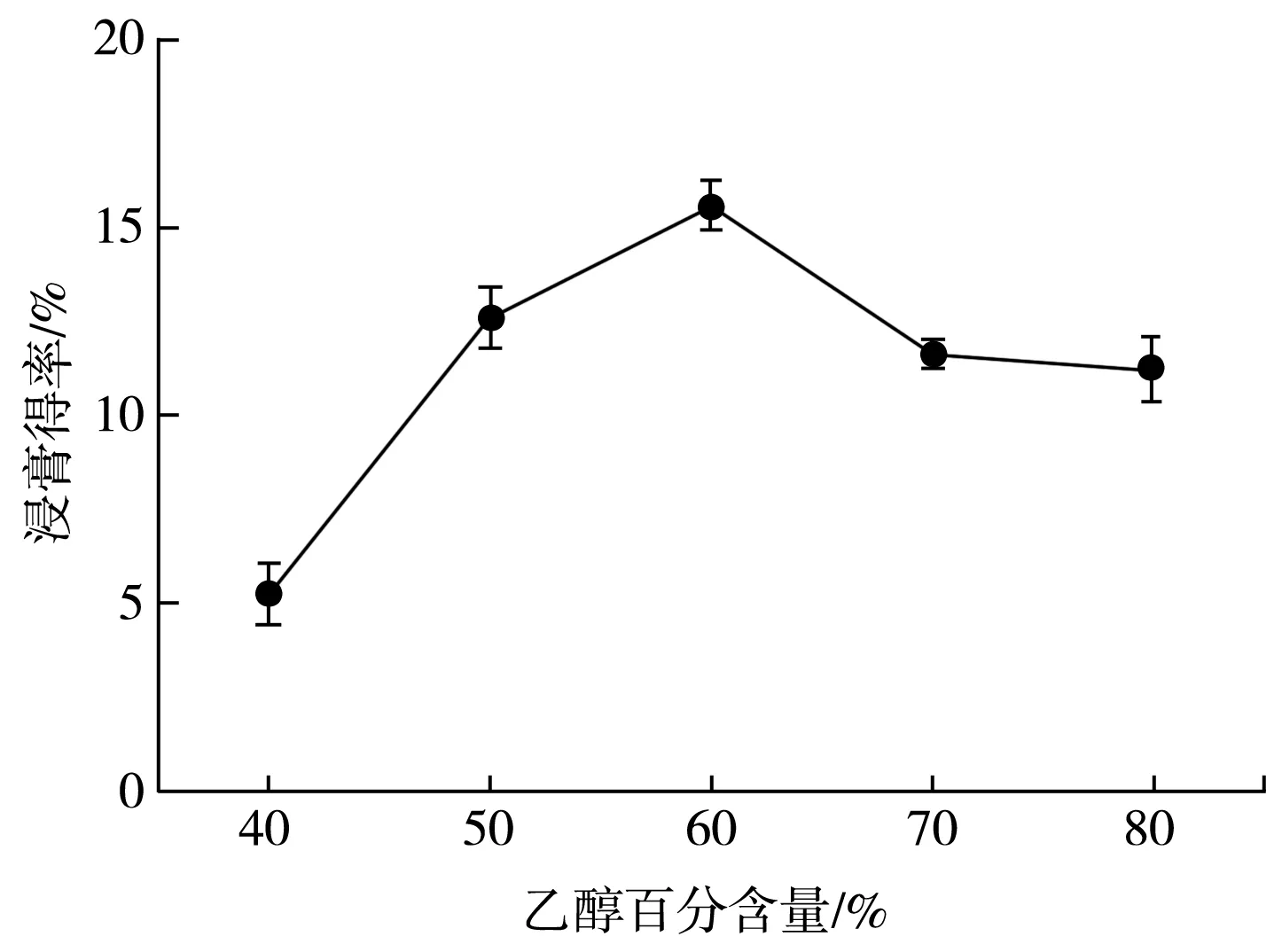
图2 乙醇百分含量对百香果皮总黄酮浸膏得率的影响Fig.2 Effect of ethanol content on extraction yield of total flavonoids from P. edulis Sims peel
由图2 可知,在实验所选乙醇百分含量范围内,随着乙醇百分含量增加,浸膏得率总体呈先升高后降低的趋势。这可能是因为乙醇百分含量较低时,百香果皮在溶剂中泡发,有利于黄酮溶出。当乙醇百分含量为60%时,浸膏得率达到最大值。根据相似相溶原理,随着乙醇百分含量继续增多,混合提取剂总极性降低,造成极性较大的黄酮难以溶出,最终导致黄酮提取率降低[20],所以选择60%作为最佳乙醇百分含量。
2.1.3 超声时间对浸膏得率的影响
分别设置超声时间为10,15,20,25,30 min,固定液料比40∶1,乙醇百分含量60%,提取时间120 min,计算黄酮浸膏得率,提取结果见图3。
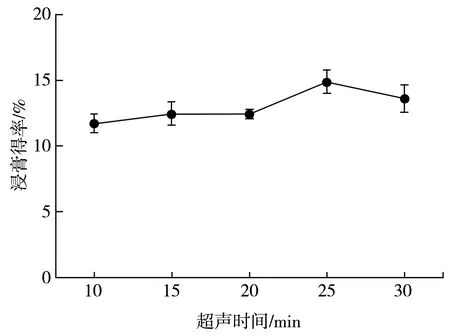
图3 超声时间对百香果皮总黄酮浸膏得率的影响Fig.3 Effect of ultrasonic time on extraction yield of total flavonoids from P. edulis Sims peel
由图3可知,在10~25 min内,浸膏得率随着超声时间的延长而缓慢增加,这是由于时间较短时,提取物还没有完全溶出,延长超声时间有助于增强溶剂对植物基质的渗透,从而提高其得率。但当超过一定时间,可能由于超声波较强的剪切作用,长时间作用下会破坏提取物分子结构,导致其降解转化不再溶出,最终观察到浸膏得率降低[21],因此选择25 min作为最佳超声时间。
2.1.4 提取时间对浸膏得率的影响
分别设置提取时间为60,90,120,150,180 min,固定液料比40∶1,乙醇百分含量60%,超声时间20 min,计算黄酮浸膏得率,提取结果见图4。
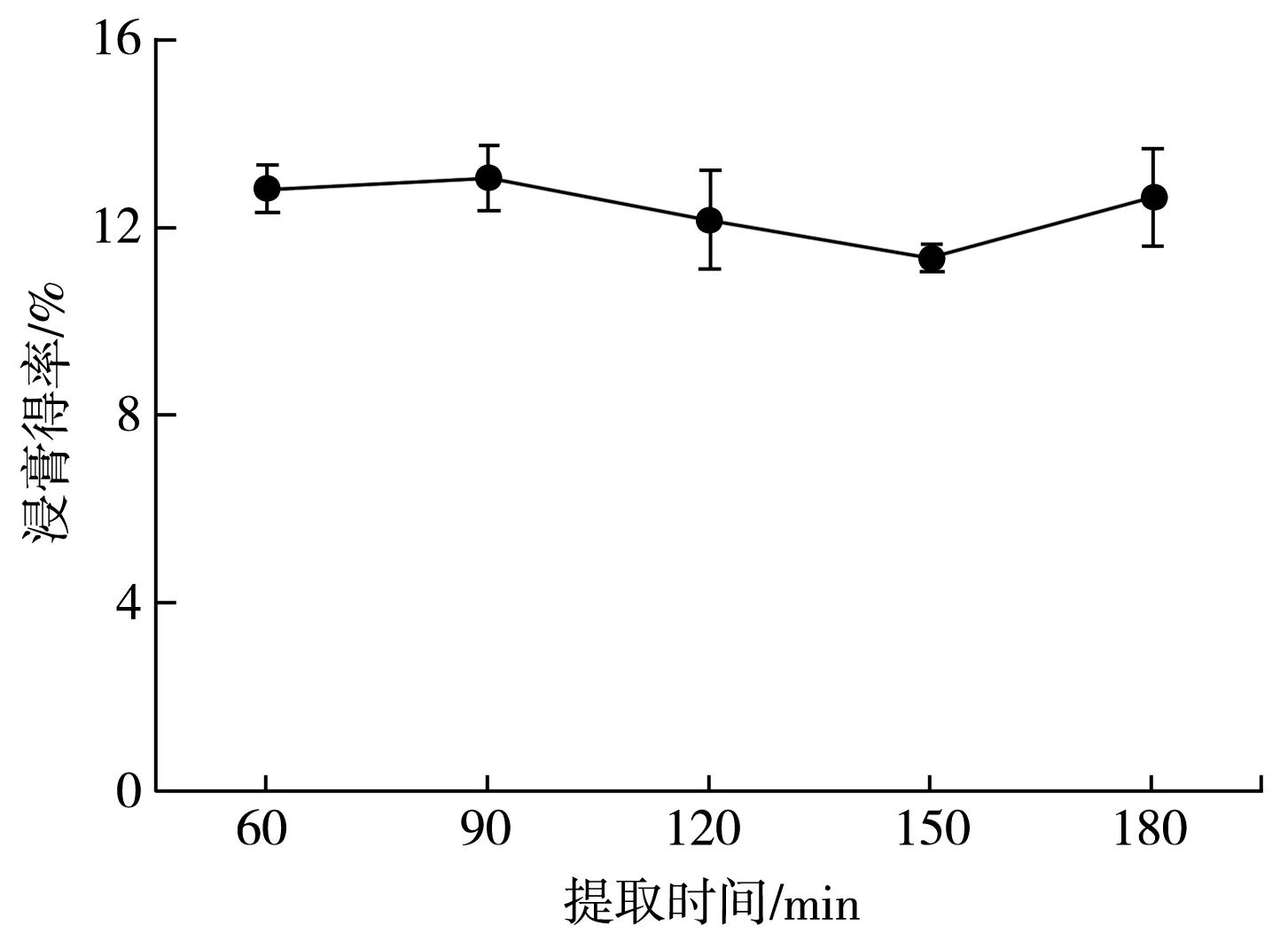
图4 提取时间对百香果总黄酮浸膏得率的影响Fig.4 Effect of extraction time on extraction yield of total flavonoids from P. edulis Sims peel
由图4可知,提取时间对浸膏得率的影响较小。在90 min时,浸膏得率较高,当超过90 min后,浸膏得率降低,可能是由于提取时间过长,热效应使部分提取物分解反而不再溶解于溶剂中,提取率下降[22]。综合考虑能源成本,选择90 min作为最佳提取时间。
2.2 百香果皮黄酮提取物响应面优化
2.2.1 响应面结果与交互作用分析
在单因素实验的基础上,应用Design Expert 8.0.5软件对数据进行分析,实验设计与结果见表2。
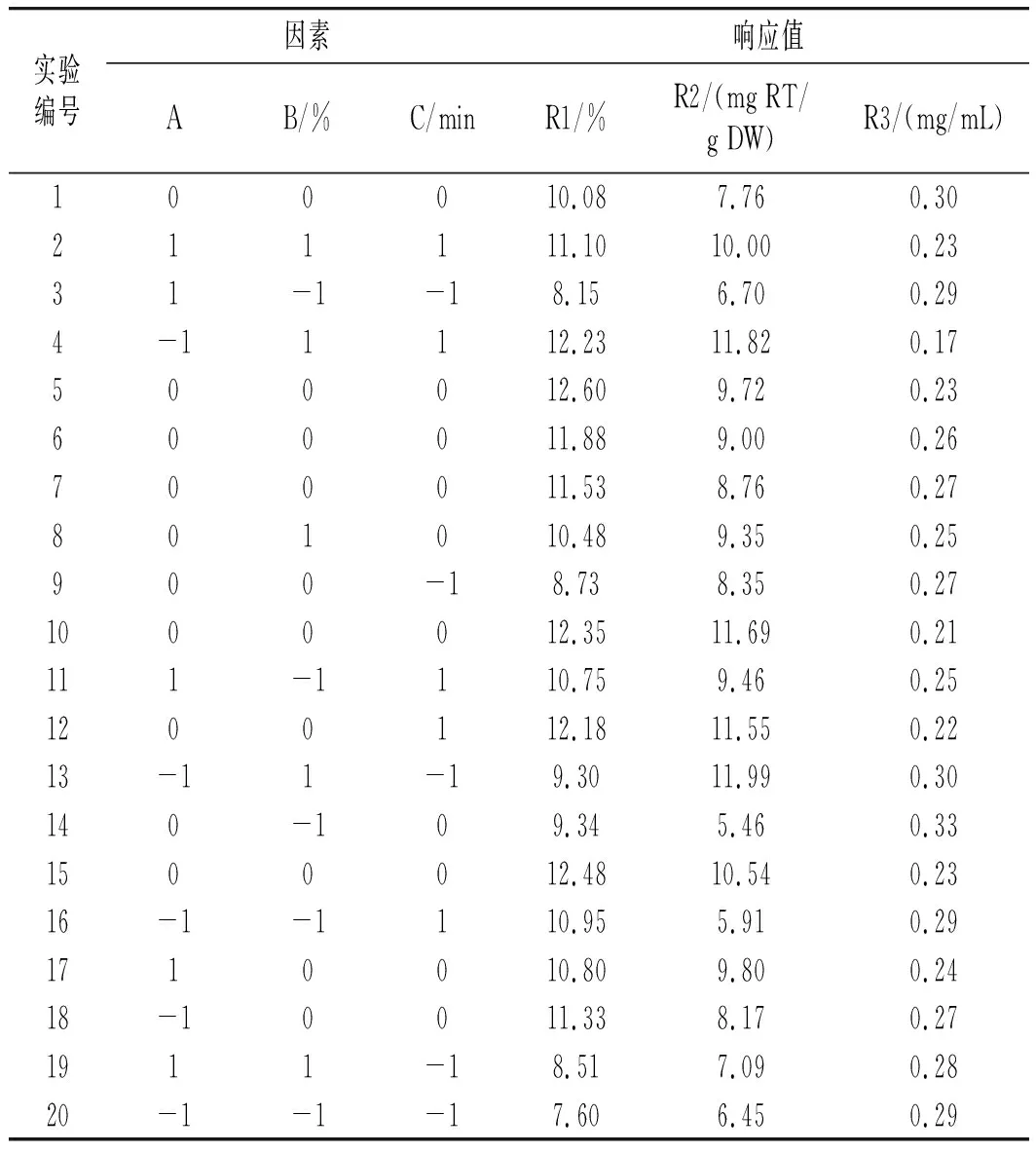
表2 百香果皮总黄酮响应面分析实验设计与结果Table 2 Experimental design and results of response surface analysis of total flavonoids from P. edulis Sims peel
通过分析20组实验数据可知,浸膏得率、总黄酮含量和抗氧化能力三者之间无明显线性关系,仅仅考察单一响应值是片面的。因此,通过考察多个响应值,筛选出最优提取工艺,可制备出浸膏得率高、总黄酮含量高以及抗氧化能力良好的百香果皮黄酮提取物。

表3 响应面模型的二次多项回归方程和统计参数Table 3 Quadratic polynomial regression equations and statistical parameters of response surface model
由表3可知,模型(R1)的p=0.0031<0.01且失拟项的p=0.8016>0.05,说明该模型极显著并且模型失拟度不显著,由此可见该模型可用来分析和预测各因素对百香果皮总黄酮浸膏得率的影响。由F值可判断出3个因素中,超声时间对浸膏得率的影响最大,其次是乙醇百分含量和液料比。对于两两因素的交互作用见图5中a,当液料比最小(40∶1),乙醇百分含量在63%~68%范围内时,浸膏得率达到最大值。图5中b显示乙醇百分含量在60%~65%范围内,超声时间最长(30 min)时,浸膏得率达到最大值。图5中c显示在液料比最小(40∶1)、超声时间最长(30 min)时,浸膏得率达到最大值。
由表3可知,模型(R2)的p=0.0128<0.05且失拟项的p=0.7584>0.05,说明该模型达到了显著水平并且模型失拟度不显著,该模型可用来分析和预测各因素对百香果皮黄酮含量的影响。由F值可判断出3个因素的影响程度大小,乙醇百分含量对总黄酮含量的影响最大,其次是超声时间和液料比。其中交互项AB在p<0.05水平上显著,BC、AC项不显著,表明仅液料比与乙醇百分含量的交互作用显著。超声时间(25 min)恒定,液料比和乙醇百分含量交互作用见图6中a,在液料比最小(40∶1),乙醇百分含量最大(70%)时,总黄酮含量达到最大值。
由表3可知,模型(R3)的p=0.0407<0.05且失拟项的p=0.8089>0.05,说明该模型达到了显著水平并且模型失拟度不显著,该模型可用来分析和预测各因素对百香果皮总黄酮清除DPPH自由基能力的影响。由F值可判断出3个因素的影响程度大小,乙醇百分含量对清除DPPH自由基能力的影响最大,其次是超声时间和液料比。其中交互项AB在p<0.05水平上显著,BC、AC项不显著。由于总黄酮含量与清除DPPH自由基能力存在一定的线性关系[23],因而提取条件对清除DPPH自由基能力的影响与提取条件对总黄酮含量的影响有相似性。对于两两因素的交互作用见图7中a,在较高的乙醇百分含量(70%)和较低的液料比时,SC50值最小即抗氧化能力最强。
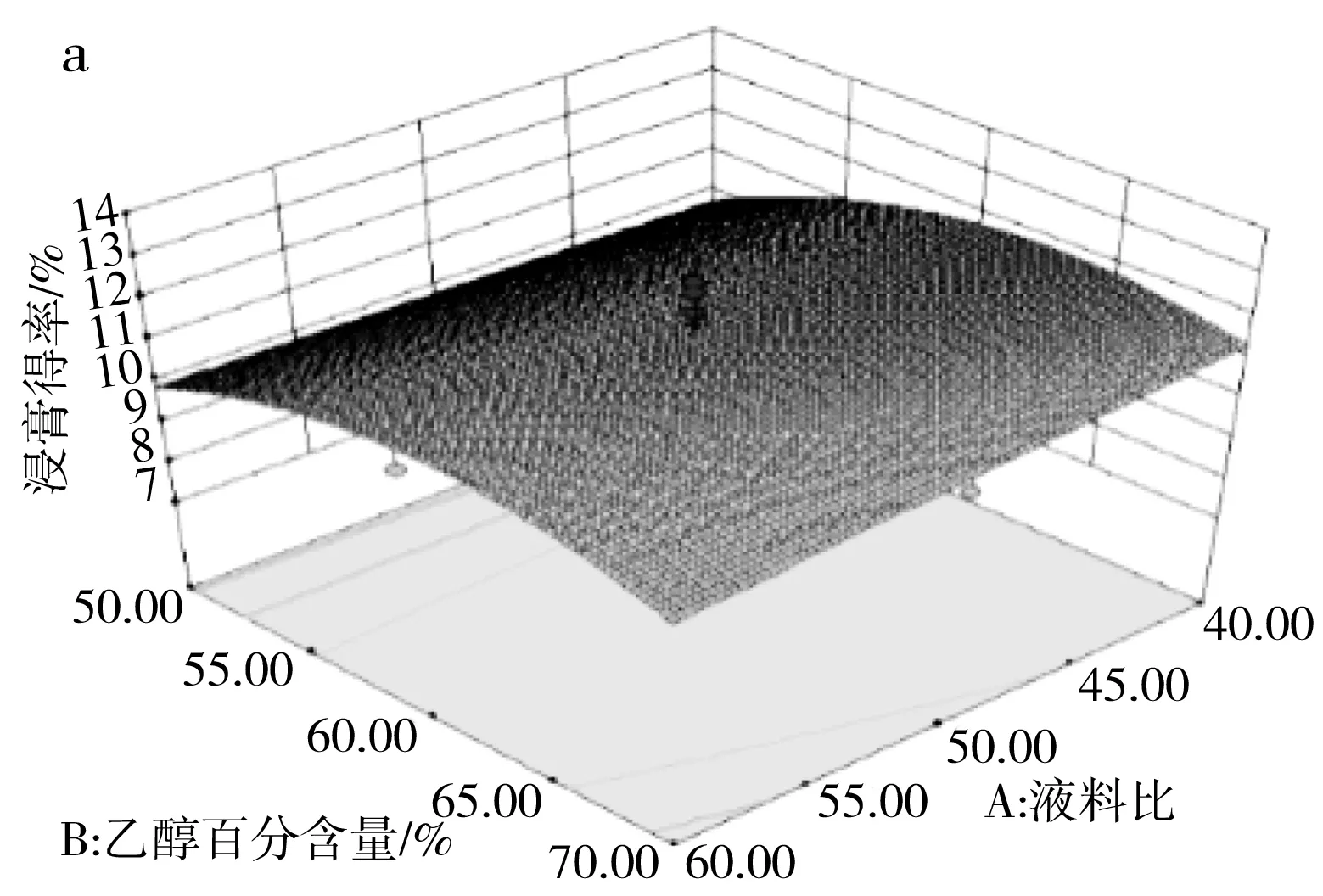
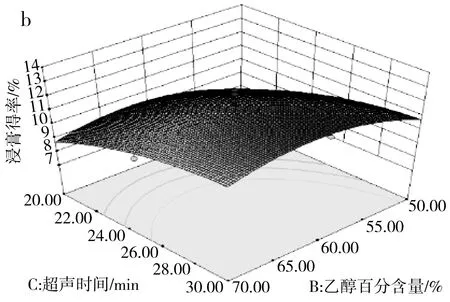

图5 三因素交互作用对浸膏得率的响应面图Fig.5 Response surface diagrams of the interaction of three factors on the extraction yield
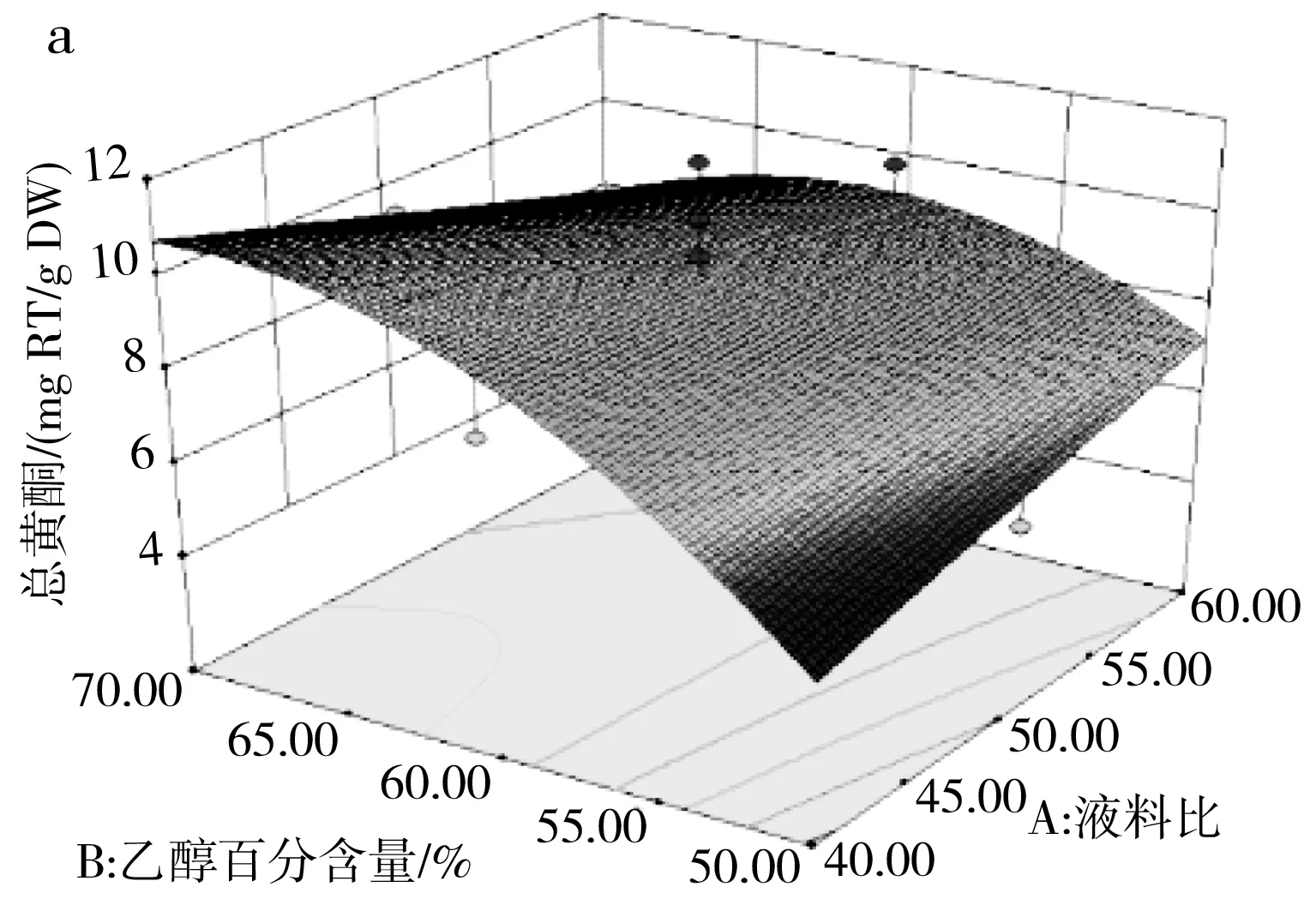
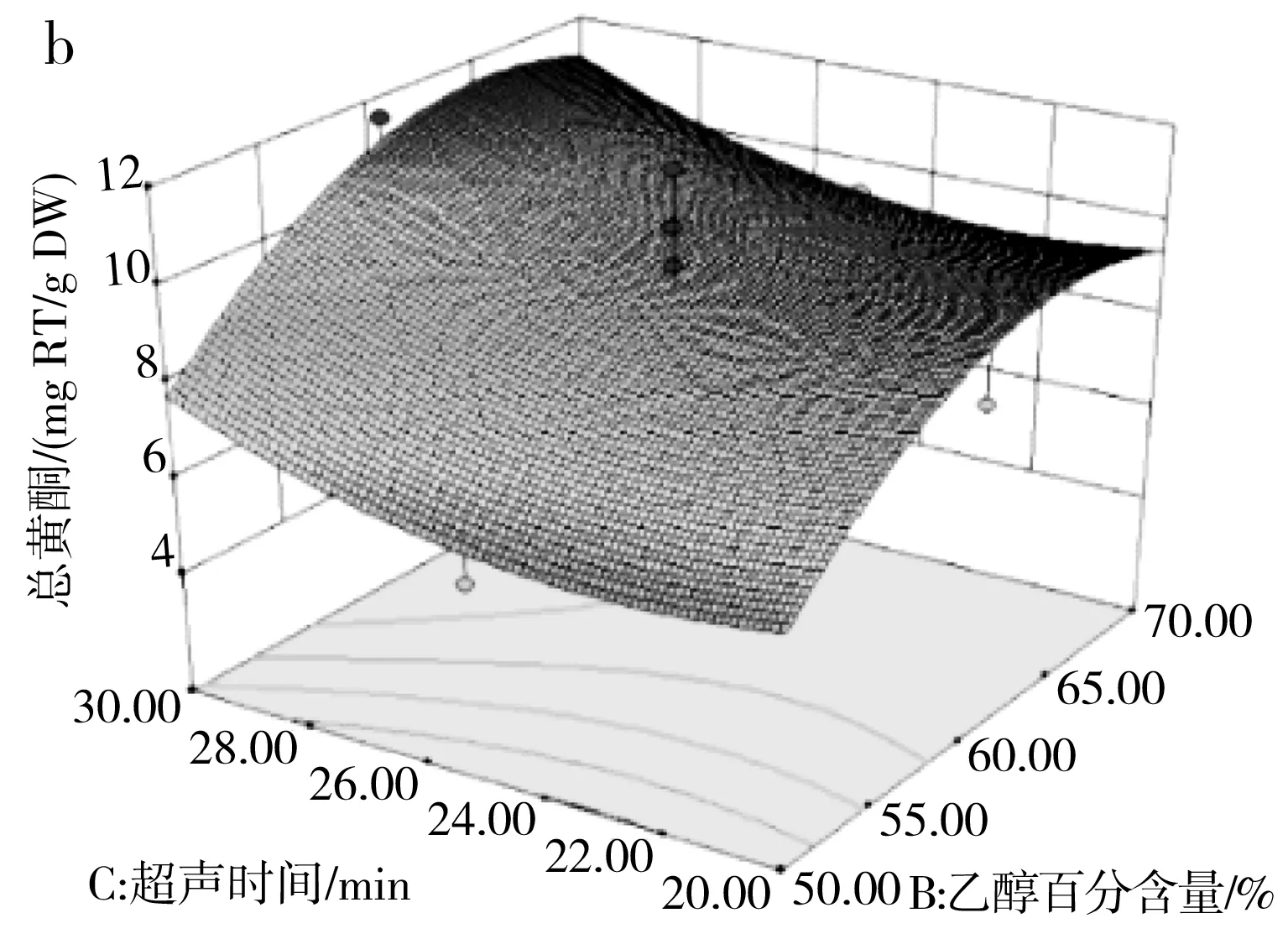

图6 三因素交互作用对总黄酮含量的响应面图Fig.6 Response surface diagrams of the interaction of three factors on the content of total flavonoids


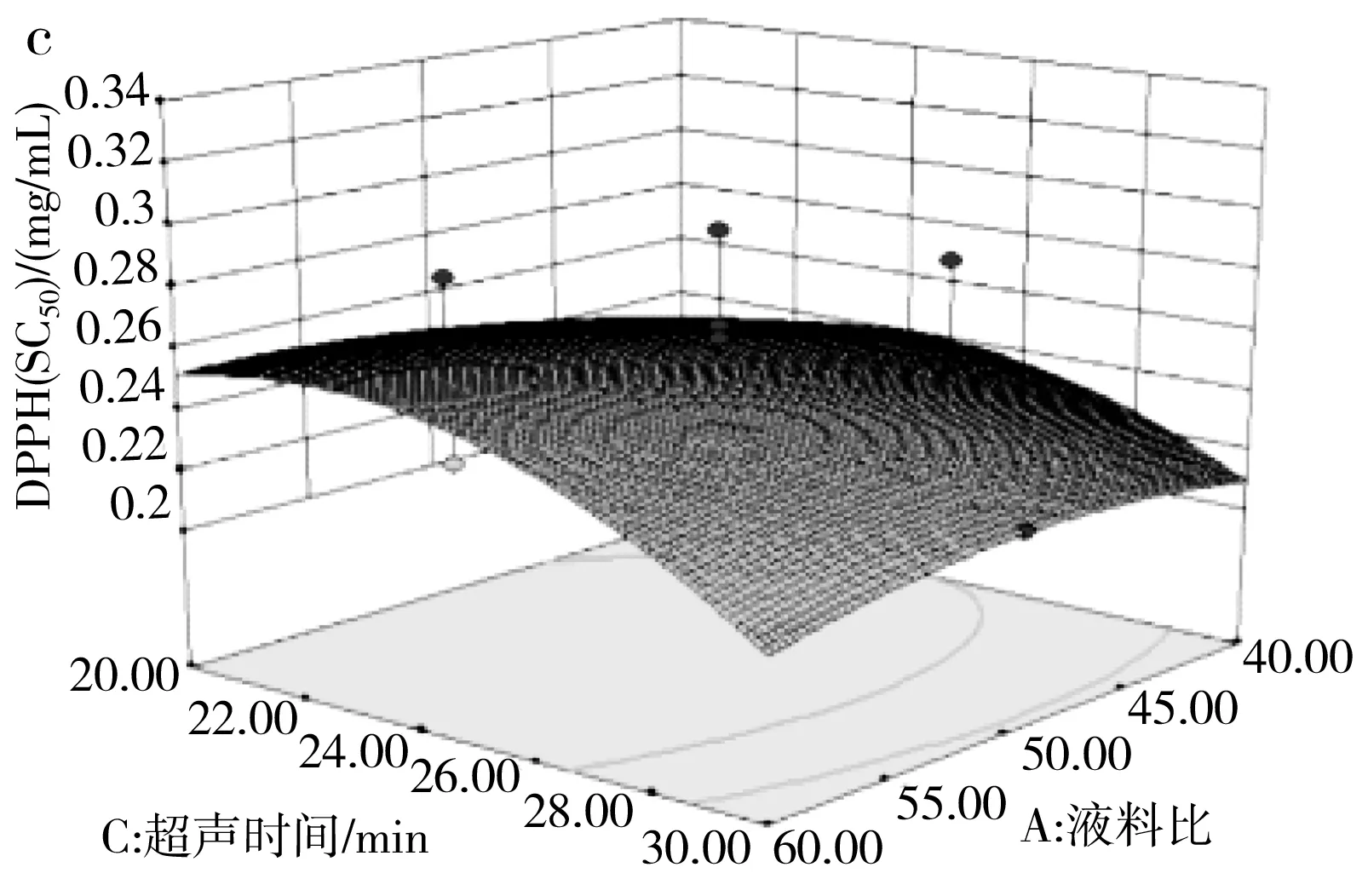
图7 三因素交互作用对清除DPPH自由基能力的响应面图Fig.7 Response surface diagrams of the interaction of three factors on the DPPH free radical scavenging ability
2.2.2 响应面优化验证实验
综合响应值浸膏得率(R1)、总黄酮含量(R2)和清除DPPH自由基能力(R3),得到百香果皮总黄酮最优提取条件为液料比40∶1,乙醇百分含量67%,超声时间30 min。在该条件下进行3次实验验证,取其平均值,得到总黄酮浸膏得率为12.58%,总黄酮含量为11.56 mg RT/g DW,清除DPPH自由基能力SC50值为0.19 mg/mL。验证实验响应值与理论响应值(R1 12.61%、R2 11.91 mg RT/g DW、R3 0.07 mg/mL)基本一致,表明回归模型与实际情况拟合较好,可以有效反映各因素对百香果皮总黄酮提取的影响。因此,通过响应面法综合优化得到的最佳工艺条件的回归模型符合实际,对今后黄酮提取工艺参数选择具有一定指导意义。
2.3 百香果皮总黄酮抗氧化实验结果与分析
采用DPPH自由基清除能力和ABTS自由基清除能力以及铁离子还原能力3个实验综合评判响应面优化后所得百香果皮总黄酮体外抗氧化能力。
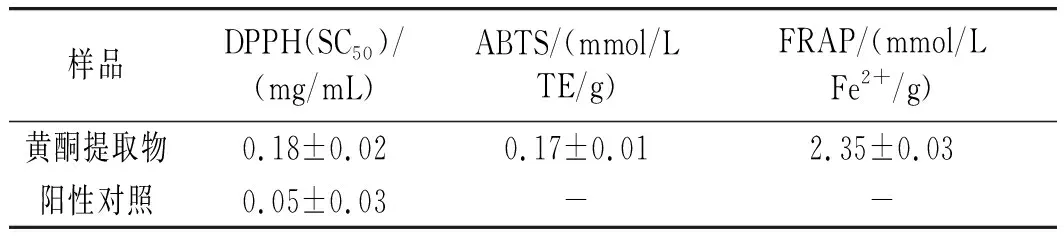
表4 百香果皮总黄酮体外抗氧化活性Table 4 Antioxidant activity of total flavonoids from P. edulis Sims peel in vitro
由表4可知,百香果皮总黄酮对脂溶性DPPH自由基具有较好清除作用,半抑制率清除浓度(SC50)为(0.18±0.02) mg/mL。总黄酮也显示了对水溶性ABTS自由基的清除能力((0.17±0.01) mmol/L TE/g)。在铁离子还原能力实验中,总黄酮显示了抗氧化活性((2.35±0.03 ) mmol/L Fe2+/g)。由上述实验数据可知,百香果皮总黄酮抗氧化活性良好,与合成抗氧化剂相比有制备过程简易、毒副作用小的优势,可开发为食品天然抗氧化剂[24]。
3 结论
应用响应面法优化百香果皮提取总黄酮的最优工艺参数为:液料比40∶1,乙醇百分含量67%,超声时间30 min。在此条件下总黄酮浸膏得率为12.58%,总黄酮含量为11.56 mg RT/g DW,清除DPPH自由基SC50值为0.19 mg/mL。本实验建立的回归模型有效可行,可用来预测百香果皮总黄酮的3个响应值。进一步抗氧化实验结果显示:总黄酮提取物具有较好的DPPH自由基清除能力、ABTS自由基清除能力和良好铁离子还原能力。综上,响应面法多指标优化提取工艺,可高效制备抗氧化活性良好的百香果皮总黄酮。实验结果为百香果皮开发为抗氧化能力良好的食品及调味品提供了基础数据,有助于我国百香果资源经济效益、生态效益和社会效益的二次增值。

