FSH 对缺血缺氧诱导的小鼠卵巢颗粒细胞凋亡的保护作用
王 菲, 田 媛, 郝 耀, 刘心蕊, 张淑雅, 杨延周, 裴承斌, 王燕蓉, 裴秀英
(宁夏医科大学基础医学院,生育力保持教育部重点实验室,宁夏生殖与遗传重点实验室,银川 750004)
目前癌症诊疗手段已进入逐步稳定的状态,但由于放化疗导致的卵巢早衰、卵泡激活障碍等卵巢不可逆损伤问题仍然存在[1]。近年来,卵巢冻存及移植作为保存癌症患者生育力的一种方法,被广泛应用于肿瘤生殖领域[2]。而冻存卵巢无血管吻合移植术后的缺血缺氧,是移植失败的主要原因。移植后缺血再灌注将导致卵泡丢失[3]、卵巢颗粒细胞凋亡[4-5]、卵巢血管严重受损[6-7];且移植早期的缺氧及随后的复氧[8],使得细胞内活性氧(ROS)增加,过量的ROS 产生可诱导蛋白质、脂质和DNA 修饰,从而导致细胞损伤[9]。促卵泡刺激素(FSH)在卵泡发育和颗粒细胞增殖中发挥重要作用[10]。研究[11]发现,在卵巢冻存过程中添加FSH 能够提高移植卵巢存活率,抑制缺血缺氧导致的细胞凋亡,增强移植物血流重建。而在缺氧诱导的卵巢颗粒细胞中,FSH 干预可通过上调缺氧诱导因子(HIF-1α)的表达,进而诱导颗粒细胞自噬,这对颗粒细胞的增殖和卵泡发育具有保护作用[12]。本研究以小鼠卵巢颗粒细胞为研究对象,在细胞层面模拟卵巢移植早期缺血缺氧状态,探讨FSH 对缺血缺氧诱导的卵巢颗粒细胞凋亡的保护作用。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物 选取70 只21 日龄清洁级雌性ICR 小鼠为研究对象,小鼠购自宁夏医科大学实验动物中心[许可证号:SCXK(宁)2020-0001],光照时间周期为12 h 照明/12 h 黑暗,动物室温度保持在(24±2)℃,湿度保持在40%~50%,定期更换鼠笼、水粮、垫料并消毒。
1.1.2 主要试剂 注射用重组人促卵泡刺激素(BA060658,德国Merck 公司),注射孕马血清(PMSG,B210125,宁波三生生物科技有限公司),Annexin V-FITC/PI 双染细胞凋亡检测试剂盒(BB-4101-100T,上海贝博生物科技有限公司),TUNEL 检测试剂盒(A113-02,南京诺唯赞生物科技有限公司),HE 染色试剂盒(G1121,北京索莱宝科技有限公司),FSHR 兔多克隆抗体(bs-0895R,北京博奥森生物技术有限公司),β-actin兔多克隆抗体(bs-0061R,北京博奥森生物技术有限公司),Bcl-2兔多克隆抗体(Ab-AF6139,江苏亲科生物研究中心有限公司),Bax 兔多克隆抗体(2772,美国CST 公司),FITC 标记山羊抗兔IgG(ZF-0311,北京中杉金桥生物技术有限公司),辣根酶标记山羊抗兔IgG(ZB-2301,北京中杉金桥生物技术有限公司),DMEM-F12 培养基(SH30023.01,HyClone 公司),胎牛血清(1925624,BI 公司),DAPI 溶液(C0065,北京索莱宝科技有限公司)。
1.2 实验方法
1.2.1 原代卵巢颗粒细胞的分离培养及鉴定 10只21 日龄雌性ICR 小鼠,每只腹腔注射PMSG 10 IU·mL-1,42 h 后脱颈处死小鼠,在无菌环境下迅速剥离卵巢并放入PBS 缓冲液中,用PBS清洗3 次以后置于DMEM/F12(含10%胎牛血清+1%青链霉素)培养液中,在体视镜下,用1 mL 注射器针头固定并刺破卵巢表面的次级卵泡,使颗粒细胞释放于DMEM/F12 培养液中。将含有颗粒细胞的培养液用200 目的细胞筛过滤,滤液以1 000 r·min-1于4 ℃离心5 min 后弃上清,加入新的培养基吹打混匀,按1.2×106个/mL 接种于6 孔板中,置于37 ℃、5%CO2温箱中培养24 h,镜下观察是否污染及细胞的生长情况,去除未贴壁细胞,此后隔日换液1 次。细胞长至60%~70%时HE 染色观察细胞形态,用FSHR 细胞免疫荧光染色鉴定所分离的颗粒细胞的纯度,细胞纯度=阳性细胞数量/计数细胞总数×100%,纯度达到90%以上进行后续实验。
1.2.2 实验分组 将60 只21 日龄ICR 雌鼠分离培养的颗粒细胞分为6 组。对照组:正常培养的颗粒细胞;单纯缺血缺氧组:颗粒细胞正常培养48 h 后,换成无血清培养基并置于缺氧培养箱(94%N2+5%CO2+1%O2)中培养24 h;缺血缺氧FSH 干预组:颗粒细胞正常培养48 h 后,换成无血清培养基并添加不同浓度的FSH(0.1、0.2、0.4、0.6 IU·mL-1),置于缺氧培养箱中培养24 h。
1.2.3 细胞免疫荧光 将细胞悬液接种在含有细胞爬片的24 孔板中,待其生长至60%~70%,弃去培养液,PBS 洗3 次,3 min/次;4%多聚甲醛室 温 固 定15 min,PBS 洗3 次,3 min/次;0.1%Triton X-100 室温通透3 min,PBS 洗3 次,3 min/次;5%山羊血清37 ℃封闭30 min,PBS 洗3 次,3 min/次;将FSHR 抗体(1∶200)稀释后滴加在爬片上,4 ℃孵育过夜。次日将细胞爬片室温复温1 h,PBS 洗3 次,3 min/次;滴加FITC 标记的荧光二抗(山羊抗兔),37 ℃避光孵育30~40 min(后续操作均在避光的条件下进行),PBS 洗3 次,8 min/次;加DAPI 染核液染色5 min,PBS 洗3次,10 min/次;最后加入抗荧光淬灭剂封片后用荧光显微镜进行拍照。
1.2.4 细胞HE 染色 将细胞悬液接种在含有细胞爬片的24 孔板中,待其生长至60%~70%,弃去培养液,PBS 洗3 次,3 min/次;4%多聚甲醛室温固定15 min,PBS 洗3 次,3 min/次;苏木素染色2 min,自来水冲洗10 s;分化液分化2 s,自来水冲洗20 s;反蓝液反蓝1 min,自来水冲洗20 s;伊红染色1 min,自来水冲洗10 s;脱水、透明并封片后用DP Ctroller 3.1.1.267 图像采集系统明场拍照。
1.2.5 流式细胞术检测凋亡 将各组细胞消化收集至离心管,400×g 离心5 min 后弃培养基;预冷的PBS 洗涤细胞2 次,用400 μL 1× Annexin V重悬细胞后加入5 μL Annexin V-FITC 染色液,于4 ℃避光孵育15 min;随后加入10 μL PI 染色液于4 ℃孵育5 min,立即用流式细胞仪进行检测。
1.2.6 TUNEL 检测细胞凋亡 细胞爬片的准备及固定和通透步骤与1.2.3(细胞免疫荧光)步骤一致。随后滴加100 μL 1×Equilibration Buffer,室温平衡孵育30 min;然后滴加50 μL TdT 孵育缓冲液,湿盒内37 ℃避光孵育60 min,PBS 洗2次,5 min/次;2 μg·mL-1的DAPI 染核液避光复染5 min,PBS 洗3 次,5 min/次;滴加抗荧光淬灭剂封片后用荧光显微镜在(620±20)nm 的荧光下观察Bright Red 红色荧光,在460 nm 的荧光下观察DAPI 蓝色荧光。于高倍镜下随机选取3 个视野,统计凋亡细胞数量,计算凋亡率;凋亡率=(凋亡细胞数/细胞总数)×100%。
1.2.7 Western blot 检测凋亡相关蛋白 用蛋白裂解液将细胞裂解后,13 000 r·min-1、4 ℃离心15 min 取上清;用BCA 法测定浓度并定量;取30 μg 蛋白样品按照常规方法进行SDS-PAGE凝胶电泳后湿转至PVDF 膜上;5%脱脂奶粉室温封闭1 h 后分别加入一抗Bcl-2、Bax 在4 ℃孵育过夜;次日用TBST 清洗后加入辣根过氧化物酶标记山羊抗兔二抗(1∶10 000)室温孵育1 h;洗膜后滴加化学发光液,于Bio-Rad 公司的Chemi DOCTMXRS+化学发光系统中曝光拍照。用Image J 软件测量条带灰度值,目的条带与内参β-actin 蛋白条带灰度值之比即为该蛋白的相对表达量。
1.3 统计学方法
数据采用SPSS 18.0 软件进行统计学分析。计量资料以均数±标准差(±s)表示,两组间均数比较采用t 检验,多组均数比较采用单因素方差分析。P≤0.05 为差异有统计学意义。
2 结果
2.1 小鼠原代卵巢颗粒细胞的分离培养及鉴定
刚分离的小鼠原代卵巢颗粒细胞呈圆形,具有一定的折光性;培养2 h 后,细胞开始贴壁生长;体外培养24 h 后,细胞呈梭形或多边形;培养48 h 后,细胞呈单层生长并伸出伪足(图1A)。卵巢颗粒细胞特异性标记物FSHR 免疫荧光鉴定结果显示,FSHR 在细胞质和细胞膜均有表达且呈绿色细小颗粒状(图1B)。本实验得到的细胞纯度为(93.54±2.3)%,达到后续实验要求。HE染色显示颗粒细胞呈多角梭形,大小均一,形态完整,边缘清晰,胞质内含有许多颗粒(图1C)。Western blot 结果显示,FSHR 在小鼠卵巢颗粒细胞中高表达,在对照组的小鼠胚成纤维细胞中不表达(图1D)。
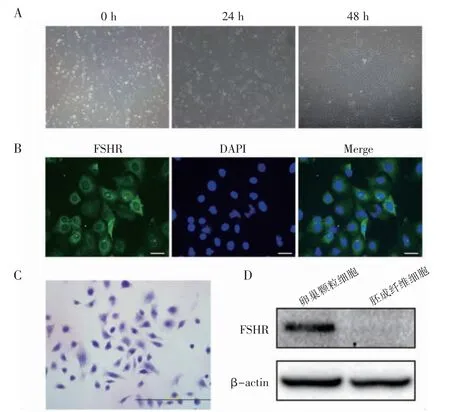
图1 小鼠原代卵巢颗粒细胞的培养及鉴定
2.2 TUNEL 检测细胞凋亡
经TUNEL 染色后检测各组细胞凋亡结果显示:单纯缺血缺氧组TUNEL 阳性细胞数最多,细胞凋亡率最高,高于对照组及其他干预组(P 均<0.01);在添加了不同浓度的FSH 进行干预后,细胞凋亡率不同程度地下降,其中0.4、0.6 IU·mL-1FSH 干预组TUNEL 阳性细胞数较其他干预组减少,细胞凋亡率较其他干预组降低(P 均<0.01),证明FSH 可以抑制缺血缺氧损伤导致的卵巢颗粒细胞凋亡,见图2。

图2 TUNEL 检测细胞凋亡(×200)
2.3 流式细胞术检测细胞凋亡
与对照组相比,其他各组的细胞凋亡率均增加(P 均<0.01);0.4 IU·mL-1FSH 干预组细胞凋亡率低于单纯缺血缺氧组和0.1 IU·mL-1FSH 干预组(P 均<0.05),见图3。

图3 流式细胞术检测细胞凋亡
2.4 Western blot 检测Bcl-2、Bax 蛋白表达量
与对照组相比,其余各组Bcl-2 蛋白表达量均降低,0.2、0.4、0.6 IU·mL-1FSH 干预组Bcl-2蛋白表达量均高于单纯缺血缺氧组,且0.4 IU·mL-1FSH 干预组Bcl-2 蛋白表达量高于其他3 个干预组(P 均<0.01)。与对照组相比,其余各组Bax蛋白表达均上调,0.1、0.2 IU·mL-1FSH 干预组Bax 蛋白表达量高于单纯缺血缺氧组,0.4、0.6 IU·mL-1FSH 干预组Bax 蛋白表达量低于其他两个干预组(P 均<0.05)。与对照组相比,其他各组Bcl-2/Bax 比值均降低,0.4、0.6 IU·mL-1FSH 干预组的Bcl-2/Bax 比值均高于单纯缺血缺氧组,其中0.4 IU·mL-1FSH 干预组Bcl-2/Bax 比值高于其他干预组(P 均<0.01),见图4。

图4 Western blot 检测凋亡相关蛋白Bcl-2、Bax 的表达
3 讨论
卵巢冻存及移植是儿童、青少年及不能推迟放化疗的妇女保留生育能力的最有效的选择之一,被广泛应用于肿瘤生殖领域[13]。在卵巢无血管吻合移植术后,早期缺血缺氧将导致大量原始卵泡丢失[5],延迟的血流重建及缺氧复氧后大量活性氧的聚集[8]使卵母细胞、颗粒细胞、膜脂凋亡及损伤[3,14]。为了降低卵巢冻存及移植过程中的缺血缺氧损伤,研究者试图通过添加一些保护因子,以减少冻存及移植对卵巢带来的损害。有研究[14]表明,白藜芦醇可以通过抗炎和抗氧化机制提高自体卵巢移植的疗效;碱性成纤维细胞生长因子(bFGF)及血管内皮细胞生长因子(VEGF)联合使用可促进移植卵巢的卵泡存活、血管生成和移植小鼠动情周期的恢复[15]。FSH 作为参与卵巢的卵泡发育、卵母细胞成熟、排卵以及黄体生成等过程的一种促性腺激素[10],也被广泛应用于卵巢冻存及移植过程中。研究[16-17]表明,在卵巢冻存过程中添加一定量的FSH,能提高卵泡存活率并减少卵巢颗粒细胞凋亡,增强移植卵巢血供;与此同时,FSH 与卵巢颗粒细胞上的FSHR 结合,通过激活PI3K-AKT 途径,能够抑制窦状卵泡中颗粒细胞的凋亡并防止卵泡闭锁[18-19]。在牦牛卵巢颗粒细胞中,FSH 可通过对FOXO3a 及凋亡相关基因Fas、Fas L、Bax、Bcl-2、Bim、BCL-xl、Caspase-3 mRNA 表达水平的调节来阻止颗粒细胞的凋亡,进而抑制卵泡闭锁[20]。本课题组前期研究[21]结果表明,在冻存卵巢经肾背膜移植后2 d,凋亡主要集中在次级卵泡及闭锁卵泡的颗粒细胞中。卵巢颗粒细胞的凋亡通常被认为是卵泡闭锁的主要原因[22-25]。因此本研究聚焦卵巢颗粒细胞,在体外模拟卵巢冻存及移植早期缺血缺氧对卵巢颗粒细胞的损伤,探究FSH 对因缺血缺氧引起的卵巢颗粒细胞凋亡的保护作用。
细胞凋亡,是机体应对各种外源性损伤及应激的一种独特的、重要的“程序性”细胞死亡模式,它通过清除体内受损及机体不需要的细胞,使体内细胞数量不断保持平衡[26]。细胞凋亡主要有两条途径:外在途径,即死亡受体途径;内在途径,即线粒体途径。启动细胞凋亡的外在途径涉及细胞外信号与细胞膜上死亡受体的相互作用,最典型的配体和相应的死亡受体包括FasL/FasR、TNF-α/TNFR1、Apo3L/DR3、Apo2L/DR4 和Apo2L/DR5,继而引发Caspase-8 的激活,细胞凋亡的执行命令就会被触发。而内源性途径是一种由线粒体相关刺激信号引起的,不依赖受体介导的细胞凋亡方式,其中Bcl-2 蛋白家族通过控制线粒体膜的通透性来调节线粒体中细胞色素c的释放,随后细胞色素c 与凋亡蛋白酶激活因子1(Apaf-1)进一步作用形成复合物并诱导凋亡小体的产生。目前,在Bcl-2 家族中共鉴定出了25个基因,包括促凋亡蛋白Bcl-10、Bax、Bak、Bid、Bad、Bim、Bik 和Blk 等及抗凋亡蛋白Bcl-2、Bcl-x、Bcl-XL、Bcl-XS、Bcl-w 和BAG 等[27-28]。本研究结果表明,小鼠原代卵巢颗粒细胞在缺血缺氧刺激下,细胞凋亡增加,而在不同浓度的FSH 干预下,细胞凋亡被抑制,其中0.4 IU·mL-1FSH 抑制凋亡效果最为明显,推测FSH 在缺血缺氧条件下,可通过凋亡内在途径增加抗凋亡蛋白Bcl-2的生成,减少促凋亡蛋白Bax 的产生,Bcl-2 与Bax的比值通常决定细胞命运[29-30],故而可抑制卵巢颗粒细胞的凋亡。
综上所述,FSH 能够抑制缺血缺氧导致的卵巢颗粒细胞凋亡,降低细胞凋亡率,增强细胞的抗凋亡能力。FSH 抑制颗粒细胞凋亡的机制可能通过上调抗凋亡蛋白Bcl-2 的表达,下调凋亡蛋白Bax 的表达,抑制细胞的氧化损伤[31-33]。这些结果可为提高冻存移植卵巢内卵泡的存活、降低颗粒细胞的凋亡提供新的思路。

