血清sICAM-1、VEGF在缺血性脑卒中致血管性痴呆患者中的表达及临床意义*
孙娜,马先军,肖辉,杜青,王惠,宁倩
(南京中医药大学连云港附属医院脑病科,江苏连云港 222001)
血管性痴呆(vascular dementia, VD)是脑血管疾病所致的严重认知功能障碍综合征,缺血性脑卒中是其主要致病因素之一,缺血性脑卒中后VD 的发生率为18.2%~34.2%[1]。神经细胞发生缺血、缺氧性损伤的过程中,部分生物标志物的变化通常先于临床症状变化。因此,探寻敏感性、特异性、准确性较高的生物标志物对VD 的预防具有重要意义。可溶性细胞间黏附分子-1(soluble intercellular adhesion molecule-1, sICAM-1)、血管内皮生长因子(vascular endothelial growth factor, VEGF)是与神经损伤密切相关的因子。缺血性脑卒中患者治疗后sICAM-1、VEGF 水平较治疗前明显降低[2-3]。另有研究[4-5]表明,血清sICAM-1、VEGF 水平与痴呆性疾病密切相关,但关于两者在VD 中表达意义的报道较少。本研究回顾性分析缺血性脑卒中患者的临床资料,探讨血清sICAM-1、VEGF 在缺血性脑卒中致VD 患者中的表达及对VD 发生的预测价值。现报道如下。
1 资料与方法
1.1 研究对象
回顾性分析2020年1月—2021年6月南京中医药大学连云港附属医院112 例缺血性脑卒中患者的临床资料。所有缺血性脑卒中患者均在3 个月后复诊,发生VD 的31 例为VD 组,其余81 例为非VD组。另选取本院同期体检的健康人员55 例为健康组,健康组体检指标正常,认知功能正常,简易精神状态检查(MMSE)量表分数为27~30 分。纳入标准:①符合《中国急性缺血性脑卒中诊治指南2014》[6]的诊断标准,VD 诊断符合美国国立卫生院与瑞士日内瓦国际神经科学研究协会制定的NINDS-AIREN 标准[7],经颅脑MRI 检查证实;②发病至就诊< 7 d;③临床资料完整。排除标准:①出血性脑卒中、脑血管畸形、脑创伤、硬膜下水肿或积液、颅内肿瘤或颅内手术患者;②多器官功能异常、呼吸衰竭、凝血功能异常;③脓毒症、重症肺炎等严重感染性疾病;④长期使用化疗药物、激素和/或免疫抑制剂;⑤皮质下缺血性血管性痴呆、混合型痴呆及多发梗死性痴呆等其他类型痴呆;⑥精神疾病患者。本研究经医院医学伦理委员会批准,受试者均自愿签署知情同意书。
1.2 方法
1.2.1 血清sICAM-1、VEGF 水平检测健康组体检时、缺血性脑卒中患者入院后次日清晨采集肘部静脉血5 mL,3 500 r/min 离心20 min,取上清液4℃冷藏保存。采用双抗体夹心法检测sICAM-1 水平,酶联免疫吸附试验检测VEGF 水平,均经全自动生化分析仪测定,试剂盒购自上海泽叶生物科技有限公司。
1.2.2 观察指标收集缺血性脑卒中患者的临床资料,包括年龄,性别构成,体质量指数(BMI),饮酒,吸烟,VD 家族史,高盐饮食(每日摄入食盐量>6 g),高脂血症,糖尿病,冠心病,高血压,美国国立卫生研究院脑卒中量表(NIHSS)评分,多发性脑梗死,脑梗死病史,脑白质疏松,脑梗死部位(额叶、颞叶、顶叶、枕叶、基底节、丘脑),梗死范围[腔梗(梗死最大径线< 3.0 cm)、中面积(3.0 cm≤梗死最大径线≤5.0 cm)、大面积(梗死最大径线> 5.0 cm)][8],职业类型(体力、脑力)。
1.3 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或重复测量设计的方差分析;计数资料以例(%)表示,比较用χ2检验;绘制ROC 曲线;影响因素的分析用多因素逐步Logistic 回归模型;P<0.05 为差异有统计学意义。
2 结果
2.1 3组血清sICAM-1、VEGF水平比较
健康组、非VD 组、VD 组血清sICAM-1、VEGF 水平比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,非VD 组、VD 组血清sICAM-1、VEGF 水平较健康组升高(P<0.05);与非VD 组比较,VD 组血清sICAM-1 水平升高(P<0.05),血清VEGF 水平降低(P<0.05)。见表1。
表1 3组血清sICAM-1、VEGF水平比较 (±s)
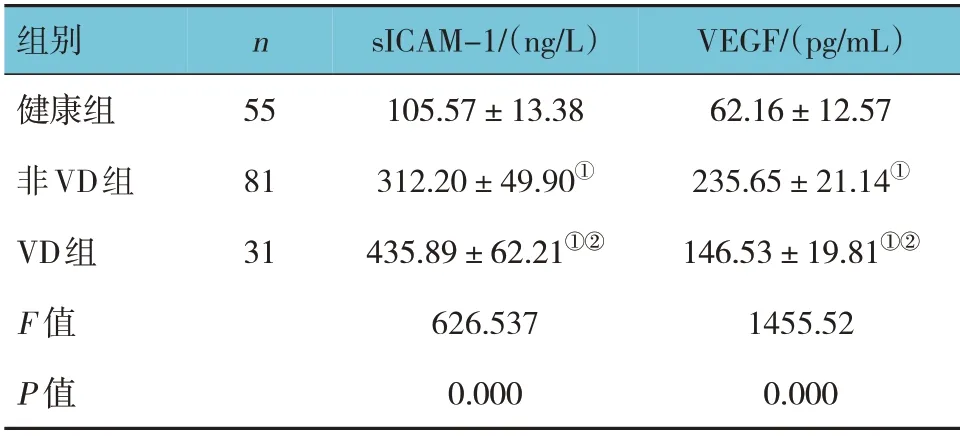
表1 3组血清sICAM-1、VEGF水平比较 (±s)
注:①与健康组比较,P<0.05;②与非VD组比较,P<0.05。
组别健康组非VD组VD组F 值P 值VEGF/(pg/mL)62.16±12.57 235.65±21.14①146.53±19.81①②1455.52 0.000 n 55 81 31 sICAM-1/(ng/L)105.57±13.38 312.20±49.90①435.89±62.21①②626.537 0.000
2.2 两组临床资料比较
VD 组和非VD 组的吸烟占比、高血压及NIHSS评分比较,差异有统计学意义(P<0.05),VD 组较非VD 组高;VD 组和非VD 组的年龄、性别构成、BMI、饮酒、VD 家族史、高盐饮食、高脂血症、糖尿病、冠心病、多发性脑梗死、脑梗死病史、脑白质疏松、脑梗死部位、梗死范围、职业类型比较,差异无统计学意义(P>0.05)。见表2。

表2 两组临床资料比较
2.3 缺血性脑卒中后发生VD 影响因素的多因素逐步Logistic回归分析
以发生VD(无= 0,有= 1)为因变量,以吸烟(否= 0,是= 1)、高血压(无= 0,有= 1)、NIHSS评分(取原始数值)、脑梗死部位(额叶= 0,颞叶=1,顶叶= 2,枕叶= 3,基底节= 4,丘脑= 5)、sICAM-1(取原始数值)、VEGF(取原始数值)为自变量,行多因素逐步Logistic 回归分析(α入=0.05,α出=0.10),结果显示,吸烟[=1.881(95% CI:1.521, 2.242)]、 高血压[=7.043 (95% CI:4.123,9.963)]、NIHSS 评分[=4.674(95% CI:2.379,6.969)]、额叶脑梗死[=2.396(95% CI:1.985,2.808)]、sICAM-1 [=4.591 (95% CI:2.379, 6.802)]、 VEGF [=4.889 (95% CI:2.147,7.631)]均是缺血性脑卒中后发生VD 的危险因素(P<0.05)(见表3)。
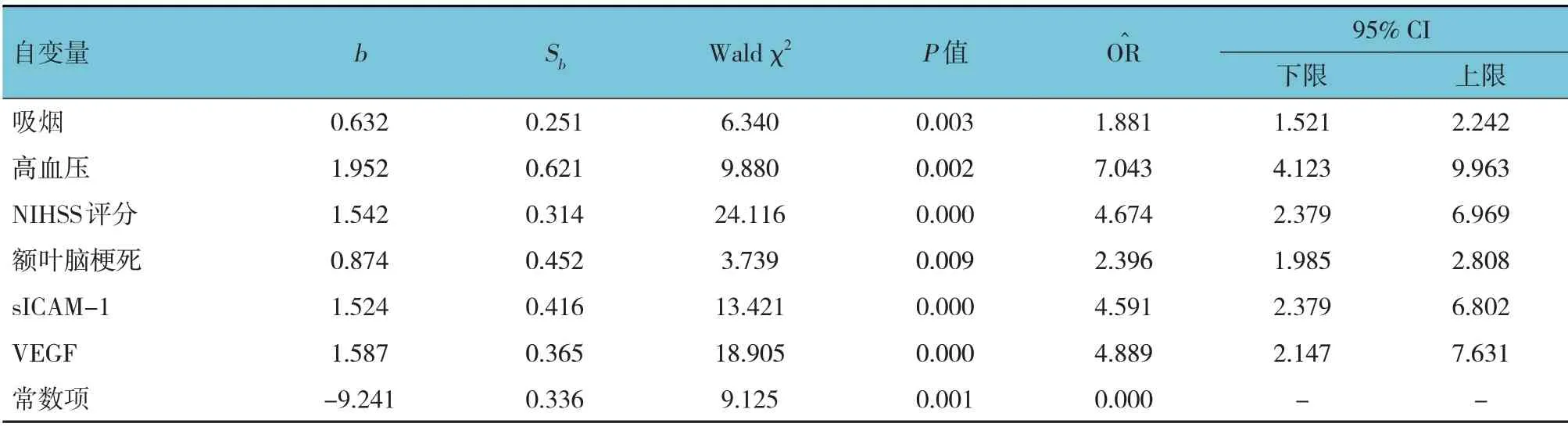
表3 缺血性脑卒中后发生VD影响因素的多因素逐步Logistic回归分析参数
2.4 血清sICAM-1、VEGF 单独及联合检测对缺血性脑卒中后发生VD的预测效能分析
ROC 曲线显示,血清sICAM-1、VEGF 预测缺血性脑卒中后发生VD 的最佳截断值为365.41 ng/L 和216.52 pg/mL,两者单独及联合检测缺血性脑卒中后发生VD 的AUC 分别为0.754(95% CI:0.664,0.830)、0.793(95% CI:0.706,0.864)、0.868(95% CI:0.791,0.925)。见表4和图1。
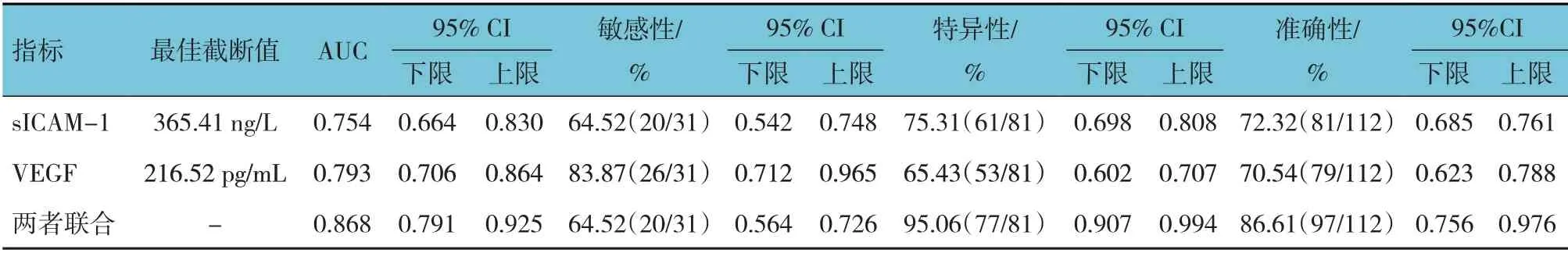
表4 血清sICAM-1、VEGF单独及联合检测对缺血性脑卒中后发生VD的预测效能分析
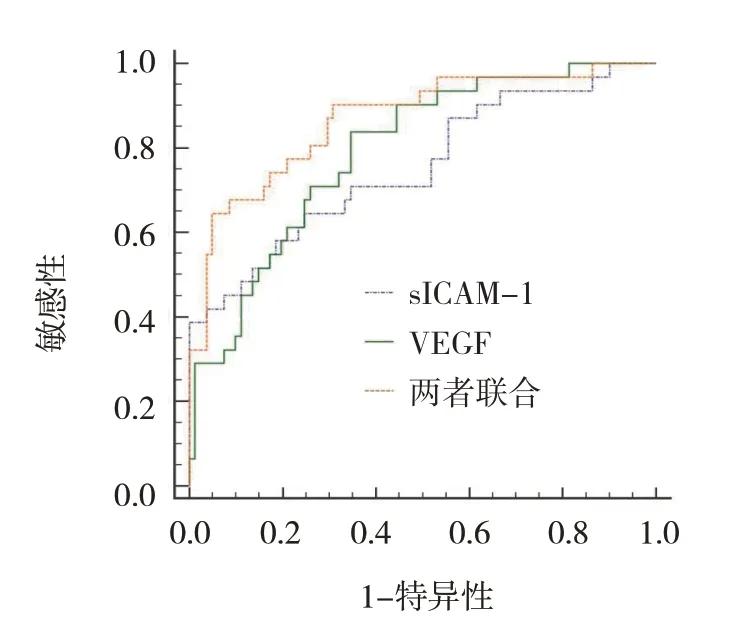
图1 血清sICAM-1、VEGF单独及联合检测预测缺血性脑卒中后发生VD的ROC曲线
3 讨论
缺血性脑卒中后因再灌注损伤与供血、供氧障碍,往往伴有不同程度的神经损伤以及运动、认知及语言功能异常,特别是合并脑动脉硬化时组织血流量及神经元细胞供氧量减少,出现缺血性坏死及神经功能减退,从而诱发VD[9-10]。缺血性脑卒中后VD 主要表现为大脑皮层高级功能发生进行性衰退,脑组织容量变化导致大脑皮层与皮层下的联系中断,引发脑脊液循环障碍与神经递质变化,损伤大脑优势半球功能。研究发现[11],VD具有可预防性,早期干预可有效降低其发生率。
本研究结果显示,与非VD 组比较,VD 组吸烟占比、高血压、NIHSS 评分、血清sICAM-1 水平升高,血清VEGF 水平降低,且多因素逐步Logistic回归分析显示,吸烟、高血压、额叶脑梗死,NIHSS 评分及血清sICAM-1、VEGF 水平均是缺血性脑卒中后发生VD 的危险因素。香烟中的一氧化氮与尼古丁不仅会损伤血管内皮细胞,而且会导致胆固醇升高,激活凝血因子,导致动脉硬化;烟雾将对肺部氧气交换造成影响,增加血浆中红细胞浓度,阻碍脑部微循环,增加VD 发生风险[12]。高血压损伤脑血管内皮细胞,使血液长期处于高凝状态,加剧动脉硬化,进而导致血管壁厚度增加、管腔狭窄严重时闭塞,脑部血流及脑细胞血氧供应减少,能量代谢功能降低,导致神经元丢失及脑萎缩,最终引发VD。JIA 等[13]在研究中国60 岁及以上成年人痴呆和轻度认知障碍的患病率及危险因素时发现,高血压患者发生VD 的风险明显升高。脑梗死部位与VD 的发生密切相关。有研究认为[14],额叶纤维分布、走行密集,当其发生缺血性脑卒中时纤维被阻断,正常代谢功能受到影响,引发额叶为主的脑循环障碍,扣带回皮层功能被抑制,促进认知功能障碍及VD 发生。此外,大脑前动脉血循受阻通常发生在额叶内侧受累患者,进而诱发边缘系统病变,损伤丘脑、内囊、皮层及皮层下白质发生,导致认知功能障碍。也有学者认为[15],除额叶外,丘脑、颞叶等部位梗死也易导致VD,但是本研究结果并未发现,需要增加样本量进一步探讨。NIHSS 评分可全面评价缺血性脑卒中患者的意识、感觉、反应等,其分数越高缺血性脑卒中患者卒中程度及脑损伤越严重,发生VD 的风险更高。sICAM-1 是免疫球蛋白超家族成员,主要表达于血管内皮细胞表面,是白细胞整合素CD11a/CD18、CD11b/CD18 的配体,故可牢固黏附白细胞与血管内皮细胞。在正常状态下,sICAM-1 稳定低表达,缺血性脑卒中后经活化的血小板与炎症因子诱导大量生成,并自血管内皮细胞脱落至血液循环[16]。因炎症反应与缺血性脑卒中后继发性神经炎损伤的关系密切,sICAM-1 又在白细胞渗出至损伤区域、白细胞与内皮细胞黏附中起重要作用,在缺氧、再氧合的刺激下脑微血管上皮细胞中sICAM-1 的表达明显增加[17]。此外,缺血性脑卒中患者通常合并长期的动脉粥样硬化,动脉内膜上沉积大量颈动脉斑块,斑块位置的sICAM-1 表达明显高于其他部位,且其表达越高,斑块稳定性越差、脱落风险越高,缺血性脑卒中病情加重及发作频率增加,导致VD[18]。血管因素是缺血性脑卒中后VD 的重要致病因素之一,其中VEGF 作为血管新生的关键性活性因子,可通过诱导内皮细胞增殖,促进侧支循环的建立,增加脑缺血区域血流量、促进血管新生发挥神经保护作用;维持血管内皮的完整性,参与、诱导新生血管重建;诱导血管内皮细胞释放组织蛋白酶,加快细胞外基质的降解,从而增加毛细血管的通透性,有助于血管损伤的修复;与血管生成素2 共同作用,促进内皮细胞通过出芽的形式加快血管生成,维持血管可塑性并加快其重构;促进一氧化氮释放,维持血管舒张及正常的内皮功能。缺血性脑卒中后VEGF 大量表达,可有效减少神经元细胞凋亡,促进神经再生,减轻缺血、缺氧引发的损伤,并具有长期修复功能,避免脑细胞退化及萎缩[19]。
本研究ROC 曲线结果显示,血清sICAM-1、VEGF 预测缺血性脑卒中后发生VD 的最佳截断值分别为365.41 ng/L 和216.52 pg/mL,两者单独及联合检测缺血性脑卒中后发生VD 的AUC 分别为0.754、0.793、0.868,提示两者联合检测预测缺血性脑卒中后VD 发生的效能高于单独检测。尽管血清sICAM-1、VEGF 作为神经功能损伤的相关标志物对VD 的发生具有预测作用,但检测结果易被外界因素干扰,准确性有待提升,两者联合可减少外界因素干扰,提升整体预测价值。
综上所述,缺血性脑卒中致VD 患者血清sICAM-1 高表达,VEGF 低表达,两者单独及联合检测对缺血性脑卒中后VD 的发生具有较高的预测价值。本研究仍然存在一定不足,所选样本量较少,样本来源有一定局限性,仅纳入住院患者,无门诊患者,可能会导致选择偏倚。在今后研究中需扩大样本量及患者来源,提高研究结果的可信度。

