低温胁迫时四季秋海棠叶片花色素苷组分构成及相关基因表达量1)
姚珂心 王瑞博 刘静 白雪 齐睿 刘胜男 李永华 张开明
(河南农业大学,郑州,450002)
许多观赏园艺作物的叶片会在逆境下形成从绿至红、紫等各种颜色(著名的“秋季红叶”景观[1]),这主要归功于植物体内一种黄酮类物质——花色素苷。植物在遭受多种环境胁迫(包括低温、高光、旱涝、营养缺乏等)时,应激合成花色素苷。花色素苷除了呈色之外,其在植物体内的另一个显著功能是强抗氧化能力;已有研究表明,植物体内合成花色素苷后,不仅观赏价值大大增加,对低温、高光等多种逆境的抗性也显著增强[2]。花色素苷的生物合成是多种花色素苷合成基因共同表达的结果,其合成途径上的结构基因分为——早期生物合成基因(PAL、C4H、4CL、CHS、CHI、F3H、F3′H等),它们编码相应的花色素苷合成酶催化生成肉桂酸、4-香豆酸、4-香豆酰CoA、4,2′,4′,6′-四羟查尔酮、黄烷酮、二氢黄酮醇、二氢槲皮素等;晚期生物合成基因(DFR、LAR、ANS、ANR、UFGT等),其对应的酶类催化生成无色花色素和各类花色素苷(如矢车菊类花色素苷、天竺葵类花色素苷、飞燕草类花色素苷)[3]。GST为花色素苷转运基因,可与花青素结合形成谷胱甘肽转移酶-类黄酮复合体,促进类黄酮物质的跨膜转运或囊泡转运[4]。
四季秋海棠(Begoniasemperflorens)是秋海棠科(Begoniaceae)秋海棠属(Begonia)的观赏花卉,为多年生常绿草本,因叶形独特、叶色翠绿、四季开花不断,而广泛用于花坛、花镜、盆花、吊盆等,在园林绿化和装饰中有着独特的应用价值。四季秋海棠叶片在低温、高光等环境胁迫时,叶片也会变红,变红后的叶片含有大量的花色素苷,对四季秋海棠观赏价值有重要影响。为此,本研究以四季秋海棠为研究对象,选择状态良好、长势一致的幼苗,进行低温胁迫处理;通过实时荧光定量聚合酶链式反应(qRT-PCR)测定花色素苷合成相关结构基因和转运基因低温时的表达量;采用高效液相色谱分析法和液相色谱串联质谱(LC-MS-MS)相结合的方法,分析低温处理对四季秋海棠叶片花色素苷组分的影响;探索低温时四季秋海棠叶片花色素苷合成结构基因表达量与花色素苷质量分数之间的关系。旨在为选育高抗性和高观赏性的四季秋海棠提供参考。
1 材料和方法
将四季秋海棠绿叶红花“超级奥林匹克”的种子播种于基质(V(泥炭土)∶V(蛭石)∶V(珍珠岩)=3∶1∶1)中后,放置于培养箱中进行培养(条件:白天25 ℃、10 h,夜晚15 ℃、14 h,光照300 μmol·m-2·s-1,相对湿度保持为85%左右),待株高长至10 cm左右时,选取状态良好、长势一致的幼苗用于低温胁迫处理。低温处理条件,温度为白天15 ℃、夜晚5 ℃,其他条件与培养时条件保持一致。分别在0、1、3、6、9、24、48、96、144、264 h采集叶片样品(选择第2~3片展开的健康嫩叶),用于后续试验。
采用改良的十六烷基三甲基溴化铵(CTAB)法[5]从混合四季秋海棠叶片样本中提取总RNA,使用反转录试剂盒(Takara)反转录得到cDNA第一条链。
用引物设计软件(Primer 3)在线设计实时荧光定量聚合酶链式反应(qRT-PCR)的基因特异性引物(见表1),送华大公司合成。
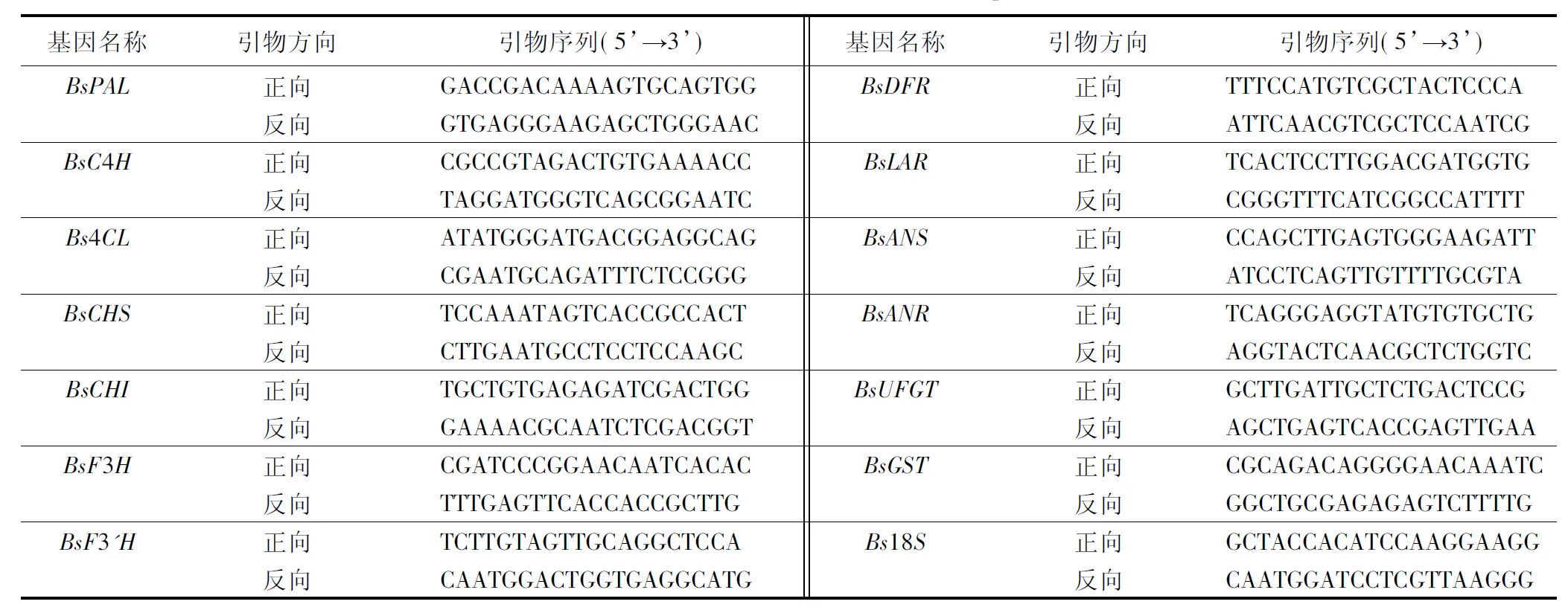
表1 四季秋海棠叶片花色素苷合成基因和内参基因的qRT-PCR扩增引物序列
实时荧光定量聚合酶链式反应试剂盒(TB Green®Premix Ex TaqTMII(Tli RNaseH Plus)RR820A)购自Takara公司,具体操作按照试剂盒说明书进行。反应体系:10 μL甲苯胺蓝绿色预混液(TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus),2X);1 μL正向引物(10 μmol/L),1 μL反向引物(10 μmol/L);0.4 μL 6-羧基-X-罗丹明参比染料(ROX Reference Dye Ⅱ(50X));1 μL cDNA;6.6 μL双蒸水(ddH2O);总体系20 μL。扩增程序:50 ℃反应2 min;95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火34 s,40个循环。内参基因选用Bs18S(基因登陆号No.KJ959633)。
四季秋海棠叶片花色素苷组分鉴定的样品制备:将经过液氮处理的叶片放入2 mL离心管中,在研磨仪中,在45 Hz条件下用4 min将叶片研磨至粉末状;在离心管中放入0.1 g粉末,取1 mL盐酸体积分数为10%的盐酸甲醇溶液进行溶解,黑暗4 ℃条件下过夜提取,黑暗期间涡旋3次;第二天在9 360 r/min条件下离心10 min,取上清液后用0.22 μm微孔滤膜过滤后放入进样瓶中,-20 ℃条件下保存。
色谱分析柱:C18色谱柱(250×4.6 mm,5 μm);流动相A为体积分数为5%的甲酸水溶液,流动相B为甲醇溶液;柱温35 ℃;流速为0.8 mL/min;进样量为20 μL;检测波长为520 nm;洗脱梯度见表2。
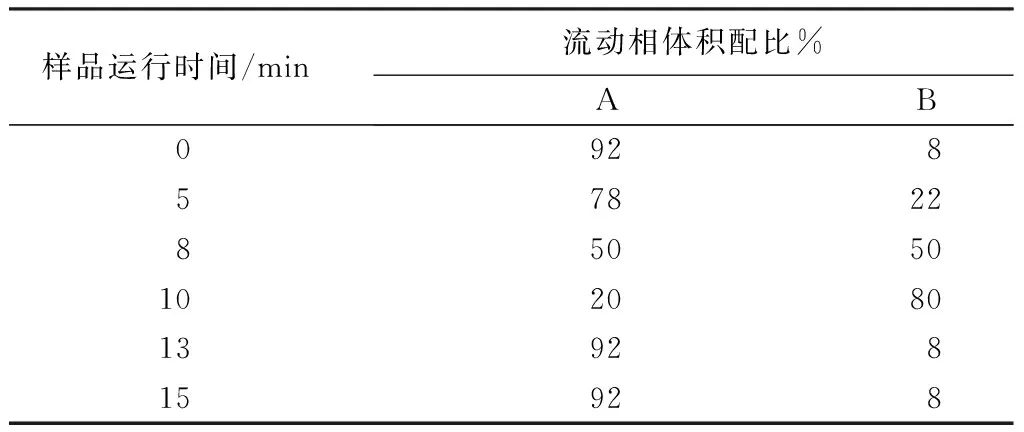
表2 高效液相色谱检测流动相洗脱梯度
2 结果与分析
2.1 低温处理对四季秋海棠叶片表型的影响
由图1可见:低温处理初期,叶片还处于绿色状态,未发生明显变化;在处理24 h时,发现有一两片叶子开始泛黄;处理48 h时,大部分叶子有变黄的趋势;处理96 h时,已有1/4左右的叶片发红,叶片有变红的趋势;处理144 h时,有1/2左右的叶片变红;直到处理264 h时,叶片几乎全变红。

图1 四季秋海棠叶片低温处理时的表型
2.2 低温处理对四季秋海棠叶片花色素苷结构基因及相关转运基因BsGST表达量的影响
为了研究低温处理过程中,花色素苷相关结构基因在不同处理时长的表达量的变化,对各个时间点的样品进行实时荧光定量聚合酶链式反应试验(见表3、表4)。在未低温处理(处理时间为0)时,各个基因的表达量几乎都在1左右。经过低温处理后,各基因表达水平都发生了显著变化,且在处理后期表达量都明显上调。花色素苷合成上游基因BsC4H、Bs4CL、BsCHI、BsF3H表达量都在9 h显著表达,而且在264 h基因表达量都出现最大值,其中BsCHI基因的最大表达量约是未低温处理(处理时间为0)时的38倍。BsPAL基因在6 h时已显著表达,而BsCHS基因在48 h时才显著表达,两者也分别在264 h时达到最大表达量。花色素苷合成下游基因BsLAR、BsANR、BsANS都在6 h时表达量显著增加,在264 h时表达量达到最大值,其中BsANS基因的最大表达量是未低温处理(处理时间为0)的63倍左右。BsDFR基因从处理开始表达量一直呈上升趋势,直至处理结束时表达量达到最大。BsF3′H基因在9、48、264 h时的表达水平都非常显著,其中在48 h时的表达量最大,约是未低温处理(处理时间为0)的20倍。BsUFGT基因在时表达3 h量出现显著变化,在48 h时表达量出现最大值,其余时间表达量都无显著变化。
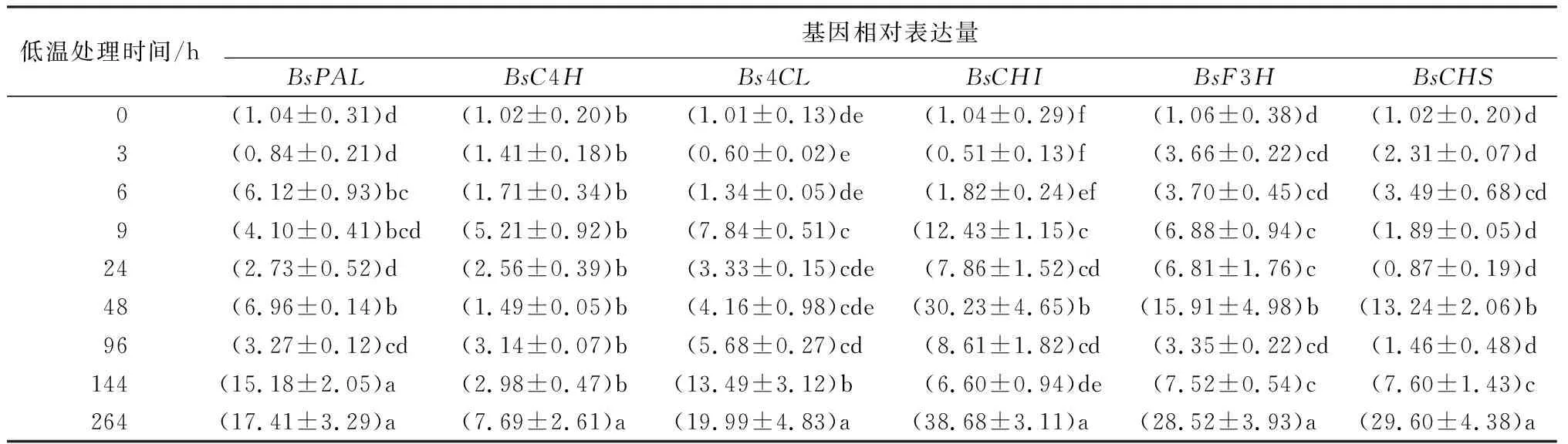
表3 低温处理持续过程中叶片花色素苷合成上游结构基因相对表达量
由表4可见:BsGST基因在3 h时开始出现表达,在24 h后表达量显著增加,在48 h时表达量达到未低温处理(处理时间为0))时的22倍左右,之后又显著下降,在96 h后表达量持续增加;在264 h时达到最大值,约为未低温处理(处理时间为0)的56倍。
2.3 低温处理对四季秋海棠叶片花色素苷组分的影响
2.3.1低温处理264 h后四季秋海棠叶片花色素苷组分构成
用高效液相色谱将低温处理264 h的四季秋海棠叶片花色素苷分离后,先后共出现4个有效峰(见图2)。发现混合标准品中矢车菊素-3-O-半乳糖苷出峰时间为10.71 min、矢车菊素-3-O-葡萄糖苷出峰时间为10.83 min,分别与样品的1号峰(出峰时间为10.72 min)和2号峰(出峰时间为10.84 min)出峰时间相对应;由此推断,四季秋海棠叶片1号峰和2号峰物质,分别为矢车菊素-3-O半乳糖苷、矢车菊素-3-O-葡萄糖苷。
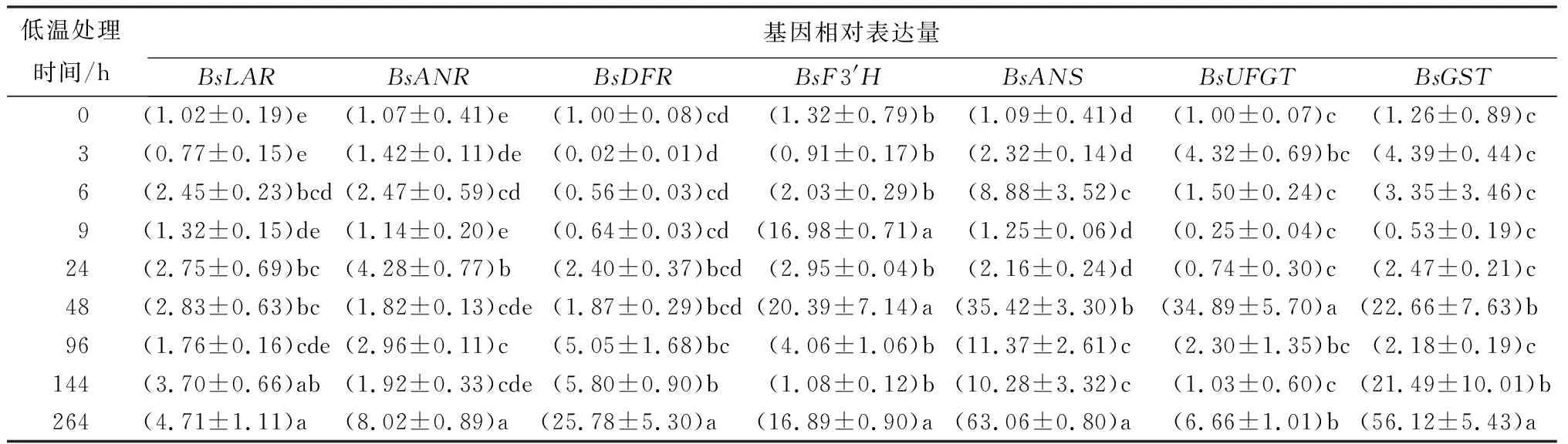
表4 低温处理持续过程中叶片花色素苷合成下游结构基因和转运基因(BsGST)相对表达量

A为低温处理264h后四季秋海棠叶片样品;B为矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷混合标准品。
由图3可见:10.61~10.95 min峰,子离子碎片质荷比(m/z)为286.6,与矢车菊素苷元相对应;由母离子质荷比448.7可知,丢失的碎片离子质荷比(m/z)为162,与葡萄糖基或半乳糖基相吻合;推测,此峰为矢车菊素-3-O-葡萄糖苷或矢车菊素-3-O-半乳糖苷,结合前面高效液相色谱试验结果,再次印证1号峰为矢车菊素-3-O-半乳糖苷、2号峰为矢车菊素-3-O-葡萄糖苷。同样的分析方法,10.12~10.38 min峰与天竺葵素苷元相符合,进而推测3号峰为为天竺葵素-3-O-葡萄糖苷;12.22~12.47 min峰与飞燕草素苷元相符合,进一步判断4号峰为飞燕草素-3-O-半乳糖苷。
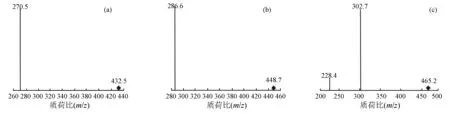
(a)为质谱多反应检测(MRM),出峰时间为10.12~10.38 min,母离子质荷比为432.5;(b)为质谱多反应检测,出峰时间为10.61~10.95 min,母离子质荷比为448.7;(c)为质谱多反应检测,出峰时间为12.22~12.47 min,母离子质荷比为465.2。
2.3.2低温处理对四季秋海棠叶片花色素苷组分质量分数的影响
采用分析对比得到的最佳色谱条件对低温处理0、3、6、9、24、48、96、144、264 h时间点的提取样品,进行高效液相色谱检测。将液相色谱面积代入标准方程中,得到不同时间花色素苷各组分在提取液中的质量分数(见表5)。
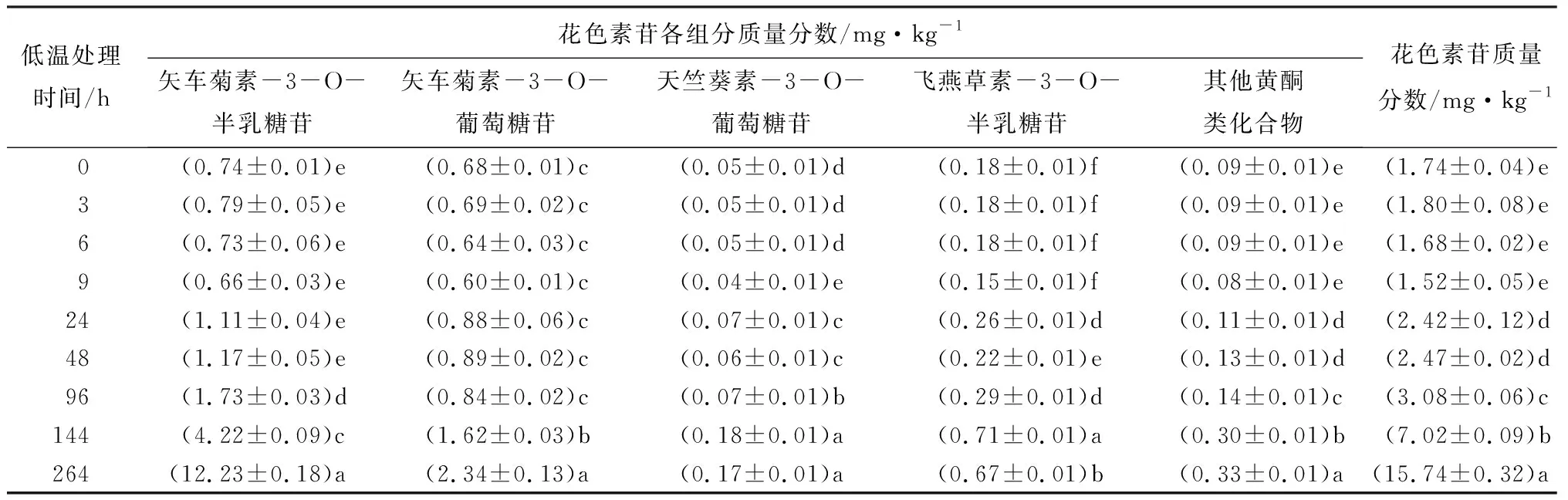
表5 不同低温处理时四季秋海棠叶片花色素苷质量分数
应用高效液相色谱对不同低温处理时的四季秋海棠叶片花色素苷组分质量分数进行测定,结果表明,随着低温处理时间的延长,花色素苷总质量分数明显增加,其中低温处理24 h时出现显著增加,低温处理264 h时花色素苷总质量分数达到最大值,这与四季秋海棠叶片表型变化结果相一致。在花色素苷各组分中,矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷的质量分数增加较明显,而其他组分无显著变化。在低温处理的初期,矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷的质量分数分别是总花色素苷的40%左右。矢车菊素-3-O-半乳糖苷在低温处理96 h时质量分数显著增加,超过了总花色素苷的50%;而矢车菊素-3-O-葡萄糖苷在低温处理144 h时,质量分数才显著增加。低温处理结束时,与矢车菊素-3-O-葡萄糖苷相比,矢车菊素-3-O-半乳糖苷质量分数显著增加,其质量分数约为低温处理前的16倍,占总花色素苷质量分数的70%以上。在低温处理全过程中,矢车菊素-3-O-半乳糖苷的增加速率和最终质量分数(12.23 mg·kg-1),都高于矢车菊素-3-O-葡萄糖苷。由此可知,低温胁迫主要促进矢车菊素-3-O-半乳糖苷的大量合成,因此推测,低温胁迫时矢车菊素-3-O-半乳糖苷是导致四季秋海棠叶片变红的主要物质。
3 结论与讨论
本研究结果表明,低温花色素苷合成途径中,早期合成基因BsPAL、BsCHS、BsCHI、BsF3H、BsF3′H,几乎都是在低温处理6、9 h出现显著表达;后期合成基因BsDFR、BsANS、BsUFGT和转运基因BsGST,则都是在低温处理48、96 h才显著表达;且基本上在低温处理结束时,表达量达最大值。此外,花色素苷主要成分矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷的质量分数,分别在低温处理96、144 h时开始显著积累,在低温处理264 h时质量分数最高。这与低温处理的四季秋海棠叶片,在24 h时有叶子开始泛黄、96 h时已有叶片发红、264 h时叶片几乎全变红的结果相对应。
低温处理时,四季秋海棠叶片花色素苷合成结构基因、转运基因相对表达量显著升高,进而使花色素苷质量分数明显增加,其中花色素苷组分矢车菊素-3-O-半乳糖苷的质量分数、质量分数增加速率最高,最终导致四季秋海棠叶片逐渐变红。本研究结果表明,四季秋海棠叶片花色素苷的组成成分包括:矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷、天竺葵素-3-O-葡萄糖苷、飞燕草素-3-O-半乳糖苷;其中矢车菊素-3-O-半乳糖苷是导致四季秋海棠叶片变红的主要成分。
本研究表明,秋季低温增强了四季秋海棠花色素苷合成途径的相关酶和运输花色素苷的谷胱甘肽巯基转移酶(GSTs),最终导致在叶片和茎部积累了大量的花色素苷。已有研究表明,低温时,花色素苷的合成与碳水化合物的积累和活性氧(ROS)的产生有关。低温通过限制碳源利用和减少库的容量,而对碳水化合物的代谢有较大的影响[6]。例如:低温时,四季秋海棠的叶脉和茎的韧皮部显著积累大量的胼胝质,而胼胝质的积累能够阻断碳水化合物的运输,使消耗降低,随之叶片和茎部的碳水化合物质量分数显著增加,最终促进花色素苷的合成[1]。所以,一般都认为碳水化合物的积累是低温诱导花色素苷发生的原因。已有研究表明,多种环境胁迫均会使植物产生活性氧,而活性氧也被证明与多种逆境下的花色素苷合成相关[7],由BsRbohD基因产生的活性氧参与了低温诱导四季秋海棠叶片花色素苷的合成[8]。而过氧化氢(H2O2)作为活性氧的一种,也是低温诱导花色素苷合成过程的一个重要信号分子[9],适度环境胁迫产生的过氧化氢也能够诱导花色素苷的合成[10]。在拟南芥(Arabidopsisthaliana)中,过氧化氢通过上调花色素苷的晚期合成基因(TT3、TT18)和转录因子(PAP1、TT8、MYB113、MYB114)的表达,促进花色素苷的积累[11]。
影响花色素苷合成的除了结构基因外,还有调控基因,主要包括MYB、bHLH、WD40三大类,它们通过调控结构基因,进而影响花色素苷的合成。在低温时,MdbHLH3因磷酸化而增加与结构基因启动子的结合,促进了花色素苷的合成[12]。在拟南芥中,R2R3-MYB与bHLH、WD40构成MYB-bHLH-WD40(MBW)转录复合物,激活花色素苷晚期合成基因(DFR、ANS、UFGT)的表达,进而使植物体内花色素苷积累[13]。本研究表明,低温处理后,使得前期四季秋海棠叶片花色素苷结构基因上调表达,从而导致后期花色素苷的大量积累,最终导致其叶片变红,这其中也一定有相关调控基因的参与,还需接下来深入研究。
已有研究表明,秋海棠花中的花色素主要为矢车菊素[14],秋海棠科植物叶片花色素苷中50%以上属于矢车菊素类花色素苷[15]。本研究表明,正常条件时,四季秋海棠叶片中的矢车菊素类花色素苷占花色素苷的85%左右。因此推测,低温时,四季秋海棠叶片大量合成矢车菊素类花色素苷,可能是因为秋海棠科植物易于形成矢车菊素。已有研究表明,自然界中的三类花色素苷(花葵素苷、花青素苷、翠雀素苷)分别为砖红色、红色、蓝色。矢车菊素与糖苷结合后属花青素苷,颜色上主要对应红色,其根据结合糖苷的不同可分为矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷等。其中矢车菊素-3-O-半乳糖苷已被证实在很多物种主要花色素苷中占比较高,例如:红皮梨主要花色素苷质量分数最高的是矢车菊素-3-O-半乳糖苷[16]。王甜元等[17]研究表明,套袋苹果梨(PyrusbretschneideriRehd.‘Pingguoli’)解袋后,矢车菊素-3-O-半乳糖苷质量分数最高约占总质量分数的90%,而矢车菊素-3-O-葡萄糖苷的质量分数较少。肖长城等[18]研究表明,红梨果皮中花色素苷的主要成分为矢车菊素-3-O-半乳糖苷、矢车菊素-3-O-葡萄糖苷,其中矢车菊素-3-O-半乳糖苷质量分数最高,约占总花色素苷质量分数的66.37%。李永洲等[19]则研究表明,红瓤核桃叶片在生长初期最重要的两种花青苷,是飞燕草-3-O-半乳糖苷、矢车菊素-3-O-半乳糖苷。
本研究中,四季秋海棠低温胁迫后,矢车菊素-3-O-半乳糖苷质量分数、质量分数增加速率,都高于矢车菊素-3-O-葡萄糖苷,这与平衡状态下呋喃糖构型和吡喃糖构型比例以及蔗糖质量分数增加有关。已有研究表明,半乳糖苷和葡萄糖苷为差向异构体[20],两者在水溶液的平衡组成上存在明显差异,葡萄糖苷中几乎没有呋喃构型,而半乳糖苷中约有7%的呋喃构型。呋喃构型中含有较大的集团—CH(OH)CH2OH为五元环,比吡喃构型环张力大,构型能量相对较高,因此含有半乳糖苷的化合物比葡萄糖苷化合物具有更强的稳定性[21]。此外,已有研究表明,低温时,四季秋海棠叶片中碳水化合物质量分数以蔗糖增加最为明显[6]。而在苹果着色期,与矢车菊素-3-O-葡萄糖苷相比,矢车菊素-3-O-半乳糖苷与蔗糖质量分数存在更加显著的正相关性[22]。

