培养高阶思维能力的化学实验教学研究
——以“科学认识含氯消毒剂”为例
颜 乐 缪向光 占文芳
(福建省福安市第一中学,福建 福安 355000)
《普通高中化学课程标准(2017 年版2020 年修订)》主题1“化学科学与实验研究中”提出:“改变在实验中注重动手但缺少思考的现状,强调高级思维过程。”[1]2017 年,美国推出一个新的学生评价改革体系,素养成绩单(Mastery Transcript Consortium,MTC)应用于高中生申请美国大学。MTC 主要涉及八种高阶思维能力的评价,其中与高中化学学科特点及学习要求最契合的包括以下三种:“问题求解能力”,即能对具挑战性的化学实验问题的有关信息进行分析综合、抽象概括,以理解实验问题,选择实验试剂、实验装置与实验方法,控制实验变量,形成实验方案,并能安全顺利地完成实验。“批判性思维”更重视实验现象的感知与推理,遇到实验过程中的生成性问题,如出现不符合预期的实验现象时,敢于质疑和具有挑战性的想法,勇于并有能力根据事实,改进方案,实践探求真理。“决策能力”,是基于已有的事实作出判断,然后做出行动方案的能力。
进入实验室后,在“教师讲方法,学生操作验证目的,撰写报告,教师检查”的传统模式下,学生较多关注实验步骤和仪器,对于为什么要这样做思之甚少[2]。目前的实验创新大多由教师主导,从仪器创新的角度去改进教材中某些现象不明显、存在有毒有害物质排放的实验,而鲜有学生的参与。以上方式在培养学生的思维能力方面大多处于低阶层次[3]。
一堂精心设计的实验课,不仅包含丰富的科学知识,还可以了解和模拟科学家们进行科学发现的探索过程。教师通过改变教学方式和学习方法,通过规划教学及实验探究:如学生动手实操、发现问题、质疑和批判、探索改进、归纳总结等步骤,激发学生的思维品质,挖掘化学实验承载的巨大思维价值。
一、培养高阶思维能力的实验教学设计思路
(一)选择蕴含丰富思维价值的课例
2019 年鲁科版高中化学必修一中微项目“科学使用含氯消毒剂”一节:在知识层面上是深化核心概念“氧化还原反应原理”在实际问题中的应用;在情感层面上是一场穿越百年的含氯消毒剂发展之旅;在能力层面上,通过有梯度的实验活动,让学生体会从感性认知向理性探究转变,通过多次的问题解决助力学生高阶思维水平的提升。
(二)挖掘教学内容与思维价值内涵的联系
对选择的教学课例进行设计时,应重点分析教学内容与思维能力价值内涵的关联,并根据思维能力的要点确定教学目标,再结合学情特点确定教学内容,具体见表1。

表1 根据思维能力的要点确定的教学目标和教学内容
(三)开展有思维梯度的实验探究活动
如何高效地制备“84”消毒液?如何探究影响ClO-氧化性的因素?如何检验HOCl 见光分解的产物?该节课设计了如下的实验探究活动:制备“84”消毒液、NaClO 氧化性的验证、“84”消毒液与石蕊试液的反应、“84”消毒液和CO2或盐酸的反应、HOCl 的见光分解实验,旨在发展学生的高阶思维能力。
二、“科学认识含氯消毒剂”的教学过程
(一)“84”消毒液的制备
【案例1】[引入]课前教师通过班级群推送了论文《含氯消毒剂次氯酸钠的发展史》[4]。学生已了解了从1774 年舍勒合成氯气,到1916 年英国化学家达金通过将碳酸钠与漂白粉混合制备“达金溶液”,并在“一战”期间用于受伤士兵伤口的杀菌消毒,直到1984 年北京的金耀光成功制备了高浓度的次氯酸钠溶液,即“84”消毒液。请选择方案制备“84”消毒液。
[学生A]方案一:将浓盐酸滴入MnO2中,加热后制得的氯气,经饱和食盐水净化后,通入NaOH 浓溶液中,即制得“84”消毒液。
[学生B]方案二:利用Ca(ClO)2溶液与Na2CO3溶液反应,可制备次氯酸钠溶液和CaCO3沉淀,过滤可得到含氯酸钠的溶液。
[教师]提供以下试剂(物品):MnO2固体、浓盐酸、NaOH 溶液、Ca(ClO)2固体、饱和碳酸钠溶液、红色布条。请分组实验,用以上两种方案制备“84”消毒液,并根据实验过程,对所选方案进行评价。
[学生A]方案一涉及氧化还原反应,化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。
所得溶液用红色布条检验,布条10 秒褪色。此法的优点:浓盐酸与MnO2生成氯气的速率很快,操作简单,NaClO 浓度高。缺点:氯气与NaOH 溶液反应速率较慢,造成大量氯气逸出,反应难以控制,也造成环境污染。
[学生B]方案二涉及复分解反应,化学方程式为:Ca(ClO)2+Na2CO3=CaCO3↓+2NaClO。
用红色布条检验产物,布条2 分钟褪色。此法的优点:无有害气体产生,绿色环保。缺点:Ca(ClO)2在水中溶解缓慢,反应后的溶液需过滤除去CaCO3,操作烦琐,所得溶液中NaClO 浓度低。
[教师]方案一具有反应速率快、产品浓度高等显著优点,如何改进以避免Cl2逸出?
[演示实验]方案三:采用图1 所示装置,电解饱和食盐水,阳极产生的Cl2与阴极生成的NaOH 溶液反应得到“84”消毒液,此法基本无Cl2逸出,反应后的溶液用红色布条检验,布条6 秒褪色。

图1 电解饱和食盐水制备“84”消毒液
【案例分析】学生将理论知识应用到真实情景中:如何制备“84”消毒液,自主设计实验方案,选择合适的试剂和仪器达到预期目的,此过程侧重于对学生决策能力的培养。基于操作和现象做出分析和评价,得出方案一反应速率快、产品浓度高的优点,以及存在污染的缺点;方案二无污染的优点,反应速率慢、操作烦琐的缺点。此过程旨在发展学生的批判性思维的同时,激发学生解决问题的兴趣,速率快、无污染的方案三应运而生。
小结:相比于传统的教师演示,探究性的项目式教学突出了学生为主体,教师发挥引导作用,从知识的应用发展到能力的培养。
(二)探究NaClO 溶液的性质
【案例2】[过渡]“84”消毒液的有效成分为NaClO,其消毒原理是什么?如何验证?
[学生]NaClO 中氯元素为+1 较高价态,预测其具有强氧化性。可用还原性试剂:KI、Na2SO3、FeCl2等溶液验证。
[分组实验A]向2mL 淀粉-KI 溶液中滴加少量NaClO 溶液(方案三制备,稀释5 倍),溶液迅速变深蓝,继续滴加NaClO 溶液,深蓝色褪去。
[学生A]I-被氧化成I2,故溶液变蓝,证明NaClO具有氧化性,过量的NaClO 具有漂白性,溶液蓝色褪去。
[学生B]I-被氧化成I2,故溶液变蓝,证明NaClO具有氧化性,过量的NaClO 将I2进一步氧化成IO3-,溶液蓝色褪去。
[教师]如何验证猜测?
[学生]往褪色的溶液中继续滴加稀盐酸,观察蓝色是否恢复。
[分组实验]向B 组所得溶液中滴加稀盐酸,溶液变蓝,但颜色较之前浅。证明过量的NaClO 既有漂白性,又将部分I2氧化成IO3-。
[追问]请尝试写出KI 溶液与少量NaClO 溶液反应的离子方程式。
[学生A]离子方程式为:
ClO-+2I-+H2O=I2+Cl-+2OH-
[学生B]离子方程式为:
ClO-+2I-+2H+=I2+Cl-+H2O
[教师]请围绕两个离子方程式讨论:写法不同的原因是什么?
[学生]反应液的酸碱性不同,可用酸碱指示剂如石蕊试液检验。
[分组实验]向NaClO(方案三制备,稀释5 倍)溶液中滴加几滴石蕊试液,溶液变蓝,2 分钟内未观察到明显褪色。说明NaClO 溶液呈碱性。学生A 的方程式正确。
[教师]为何未观察到溶液褪色?
[学生]稀释后的NaClO 溶液浓度较稀,与空气中CO2生成强氧化性HOCl,所需时间长。
[追问]如何加快HOCl 的生成,实现快速漂白?
[学生]利用强酸制弱酸的原理,可以加入酸性强于次氯酸的酸溶液,如碳酸、盐酸等。
[分组实验]如图2 所示:分别向a、b、c 试管中加入3mL 蓝色的石蕊-NaClO 溶液,通过吸管向b 中连续吹气数次,c 中滴加2-3 滴盐酸。观察到:a 中溶液无明显变化、b 中溶液褪色、c 中溶液迅速褪色。
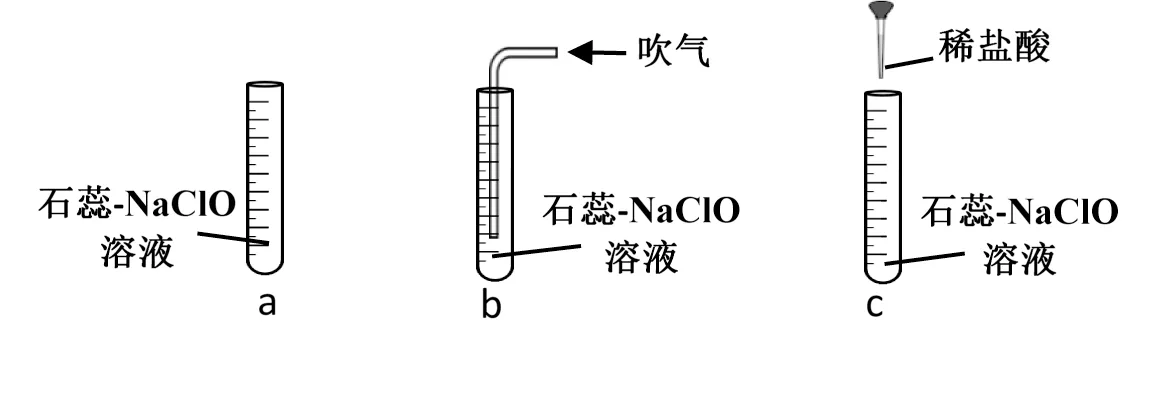
图2
[教师]请尝试用离子方程式解释上述现象。
[学生]上述现象表明:随溶液酸性增强,ClO-的氧化性增强。往石蕊-NaClO 溶液中通入CO2,或滴加盐酸,均可生成HOCl,增强氧ClO-的氧化性,使溶液褪色。离子方程式为:
试管b 中:ClO-+H2O+CO2=HOCl+HCO3-
试管c 中:ClO-+H+=HOCl
[学生]某小组不慎将整滴管盐酸加入了c 试管,观察到:溶液迅速褪色,而后呈浅黄色,有少量气泡冒出,试管口闻到刺激性气味。
[学生]随盐酸的加入量增多,溶液的酸性增强,ClO-与Cl-发生氧化还原反应生成Cl2。涉及的反应式为:ClO-+2H++Cl-=Cl2↑+H2O。
[追问]如何避免有毒气体Cl2逸出造成污染?
[学生]在试管口放置浸有NaOH 溶液的棉花。其原理为:Cl2+2OH-=ClO-+Cl-+H2O。
【案例分析】“84”消毒液的漂白能力受酸碱性环境影响较大:碱性时,ClO-的氧化性较弱;弱酸性时,以酸碱反应为主,生成HOCl,漂白能力较强;随酸性增强则趋于发生氧化还原反应,其过程可用图3 表示。可见,物质性质的多样性及化学反应的复杂性。

图3 ClO-的性质受溶液酸碱性的影响
【小结】学生从验证“84”消毒液的强氧化性的实验过程中,捕捉到异常现象,并层层深入酸碱性环境改变对ClO-性质的影响,从表观到反应的本质,进而拓展到含氧酸根性质的多样性,并建构思维模型。整个探究过程环环相扣、一气呵成,学生在不断地发现问题、解决问题、构建模型,学生的思维始终处于活跃的高阶水平。
(三)探究HOCl 的光分解产物
【案例3】[过渡]“84”消毒液的漂白性主要源于HOCl,为何不直接用HOCl 溶液?
[学生]HOCl 中O 为-2 价,Cl 为+1 价,易发生氧化还原反应而分解失效。
[教师]请根据氧化还原规律,预测HOCl 的分解产物,并设计检验方案。
[学生]HOCl 分解的还原产物为Cl2,可通过观察颜色来验证;氧化产物为O2,可用带火星的木条来检验。
[分组实验]如图4:取方案三制备的“84”消毒液于烧杯,充分吹气后,取样装满试管;将试管倒扣在装有水的水槽;用紫外灯照射5 分钟。观察到:试管内液面下降至约五分之一处,试管内气体无明显颜色;延长光照至15 分钟,未观察到明显变化;取下试管,插入带火星的木条,无明显复燃。

图4
[学生]可能由于HOCl 的分解速度较慢,氯气含量低,故无明显黄绿色,生成的氧气量少,不足以使木条复燃。
[演示实验]结合手持技术在图4 基础上加以改进,实现装置见图5:取方案三制备的“84”消毒液于烧杯,充分吹气。用紫外灯照射,同时打开传感器采集数据。所得曲线如图6、图7。
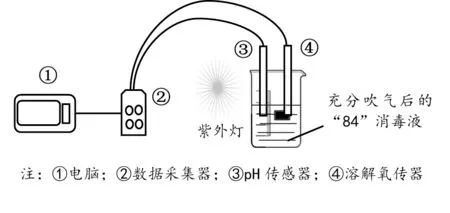
图5 手持技术测定紫外光下“84”消毒液的pH 值和溶解氧
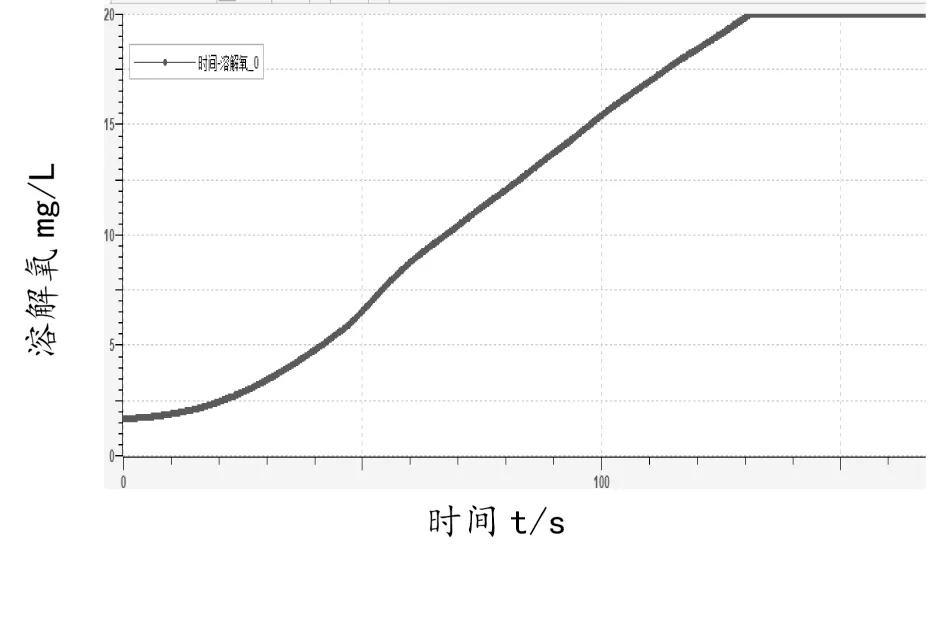
图6 溶解氧随紫外光照时间的曲线

图7 pH 值随紫外光照时间的曲线
[教师]请分析图6-7 曲线的意义。
[学生]紫外灯开启后,溶解氧含量从初始1.76 mg/L 迅速增大,约130 秒后达到最大值19.86mg/L,而后基本不变,证明HOCl 分解的氧化产物为O2;溶液初始pH 位1.13,200 秒时减小到0.86,而后基本不变,证明HOCl 分解的还原产物应为HCl,HCl 的生成使溶液pH 下降。综上分析,HOCl 分解的反应式为:
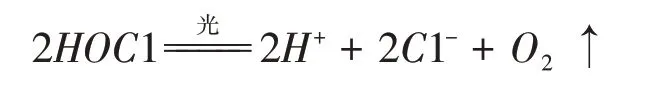
【案例分析】HOCl 在紫外光下约2 分钟即分解为HCl 与O2,故将其转化成钠盐而利于保存。但传统的实验手段难以验证其分解产物。如何将实验结果显现化?由此将学生的思维方式从定性发展到定量表征。借助数字化实验的引入,让学生体会科技创新在科学探究中的应用。
【小结】这样初步建立了设计实验方案的基本思路:从物质中元素和价态出发,预测物质的化学性质;设计科学实验方案;基于实验证据进行推理,敢于质疑和挑战,改进方案,进一步实践;最终得到结论。以上5 组实验活动的设计不是为了探究过程的程序化和表象化,而是层层递进、环环相扣的5 组不同水平的实验,旨在引导学生在实验过程中运用原理、发现问题和解决问题,以此开拓学生的思维深度和广度,发展高阶思维能力。
三、结语
该节新授课在探究性实验室进行,学生课堂参与度高,实验热情高涨。通过课后学生自主设计的“84”消毒液的使用说明书,反馈出学生对知识的掌握较好。该节课最成功之处在于发挥了化学实验在培养高阶思维能力的功能:三种“84”消毒液制备实验的设计过程,让学生在实践中锻炼实验能力,学会对比、分析,并依据证据和目的做出正确的决策;NaClO 的性质探究实验中,丰富的反常现象和问题的解决培养了学生的智慧,激发了学生的好奇心;HOCl光解实验的失败,发展了学生的批判性思维,数字化实验的引入让学生对化学知识的浩瀚充满憧憬和期待。

