一测多评法测定双黄连注射液中4 种成份的含量
王奎鹏,徐兴敏,方清朝,王均伟,王祖红
1 河南中医药大学第一附属医院,郑州 450000;
2 河南科技大学法医学院,洛阳 471000;3 河南福森药业有限公司,南阳 474450
双黄连注射液由金银花、黄芩和连翘按1∶1∶2的比例配伍,并经过提取精制而成。其具有清热解毒、清宣风热之功效,可治疗外感风热引起的发热、咳嗽、咽痛,也适用于病毒及细菌感染所致的上呼吸道感染、肺炎、扁桃体炎、咽炎等,收载于原《中华人民共和国卫生部药品标准中药成方制剂》第18册[1]。现行国家药品标准WS3-B-2104-96-2010通过测定绿原酸、咖啡酸、黄芩苷和连翘苷4 个成份的含量,对双黄连注射液进行质量评价。目前双黄连注射液的含量测定均采用外标法(external standard method,EMS),即在相同的色谱条件下,以待测组份的纯品为对照,比较对照品和样品中待测组份的响应信号进行定量[2-6]。中药成份复杂,仅检测单一药效成份无法作出客观全面的评价,而多组份同时测定要求具备多个对照品,部分中药对照品不易购置或制备,影响了中药质量评价的研究进程[7]。一测多评法(quantitative analysis of multi-components by single marker,QAMS)基于多指标质量控制的研究思路,解决了参比物质价格高或制备困难等难题,可实现同时检测多指标成份,已成为中药及其制剂质量评价的新模式[8]。当前国内外尚无采用QAMS 测定双黄连注射液成份含量的报道。基于此,本实验以连翘苷为内标参照物,计算绿原酸、咖啡酸、黄芩苷的相对校正因子(fs/i),并测定各成份含量。采用EMS 同步测定,验证QAMS 的准确性和可行性,为评价双黄连注射液的质量提供参考依据。
1 材料
1.1 仪器
Agilent 1260 高效液相色谱仪[包括四元泵、VWD 检测器、ChemStation 化学工作站,安捷伦科技(中国)科技有限公司];BP211D 电子分析天平(德国赛多利斯公司);YMC-C18 色谱柱(150mm×4.6mm,5μm,日本YMC 公司);KQ-700VDE 型双频数控超声波清洗器(昆山市超声仪器有限公司);YB-Z 型真空恒温干燥箱(天津药典标准仪器厂)。
1.2 试药
绿原酸(批号:110753-201817,纯度96.8%)、咖啡酸(批号:110885-201703,纯度99.7%)、黄芩苷(批号:110715-201821,纯度95.4%)、连翘苷(批号:110821-201816,纯度95.1%)均购自中国食品药品检定研究院;乙腈(色谱纯,美国霍尼韦尔公司);甲酸(色谱纯,中国医药集团有限公司);超纯水(河南福森药业有限公司);双黄连注射液(河南福森药业有限公司,批号:202009061、202009071、202009081、202009091、202009101)。
2 方法与结果
2.1 色谱条件
采 用YMC-C18 色 谱 柱(150mm×4.6mm,5μm);以乙腈-0.2%甲酸为流动相进行梯度洗脱(见表1),程序结束后运行5min;检测波长为324nm(绿原酸、咖啡酸)和280nm(黄芩苷、连翘苷);柱温为35 ℃;进样量10μl;流速为1.0ml/min。理论板数按连翘苷峰计算应不低于6000,绿原酸、咖啡酸、黄芩苷、连翘苷与相邻色谱峰的分离度应达到1.5 以上。
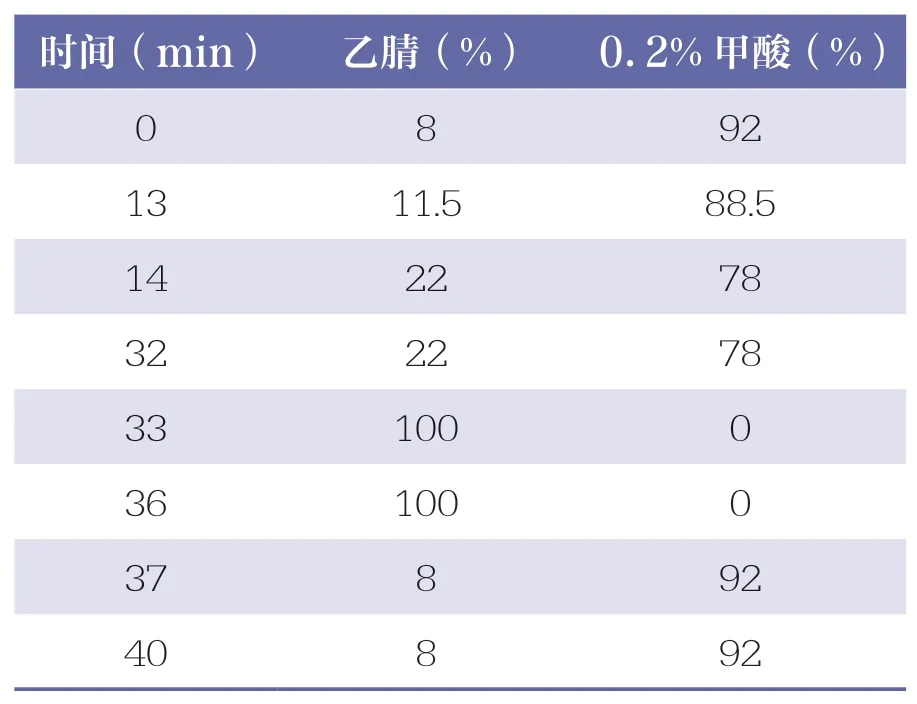
表1 洗脱梯度程序
2.2 溶液制备
2.2.1 混合对照品溶液的制备
精密称取绿原酸、咖啡酸、黄芩苷和连翘苷对照品适量,置棕色量瓶中,加 50%甲醇制成质量浓度分别为40、30、60、60μg/ml 的混合对照品溶液,室温保存,备用。
2.2.2 供试品溶液的制备
精密移取供试品2ml,置50ml 棕色量瓶中,加50%甲醇稀释至刻度,摇匀,过滤,即得。
2.2.3 阴性对照品溶液的制备
按双黄连注射液的生产工艺,制备无黄芩、金银花、连翘的阴性样品,按“2.2.2”项下方法制备阴性对照品溶液。
2.3 方法学考察
按“2.1”项下色谱条件,分别精密吸取混合对照品溶液、供试品溶液和阴性对照品溶液10μl,注入液相色谱仪,记录色谱图,见图1。
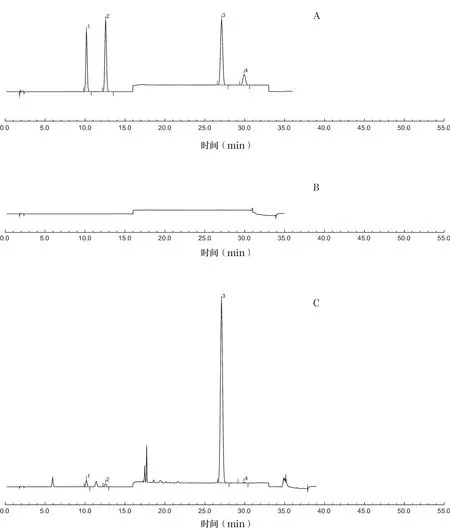
图1 混合对照品(A)、阴性对照品(B)和样品(C)的高效液相色谱(HPLC)图
2.3.1 线性关系
分别精密吸取“2.2.1”项下混合对照品溶液1、3、5、10、15、20、30、50、80、100μl,按“2.1”项下色谱条件进行测定,记录色谱图。以进样量(X)为横坐标,峰面积(Y)为纵坐标进行线性回归,详见表2。结果表明,各成份在各自范围内的线性关系均良好。
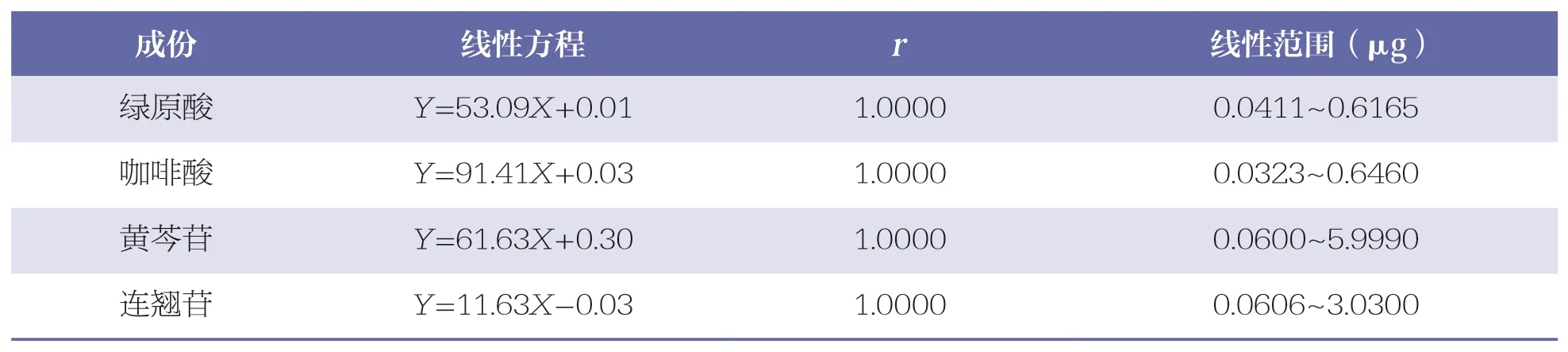
表2 4 种成份线性关系
2.3.2 精密度试验
取同一供试品(批号:202009101),按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,连续进样 6 次,测得绿原酸、咖啡酸、黄芩苷和连翘苷的峰面积RSD 分别为0.18%、0.43%、0.18%、1.67%,表明仪器精密度良好。详见表3。
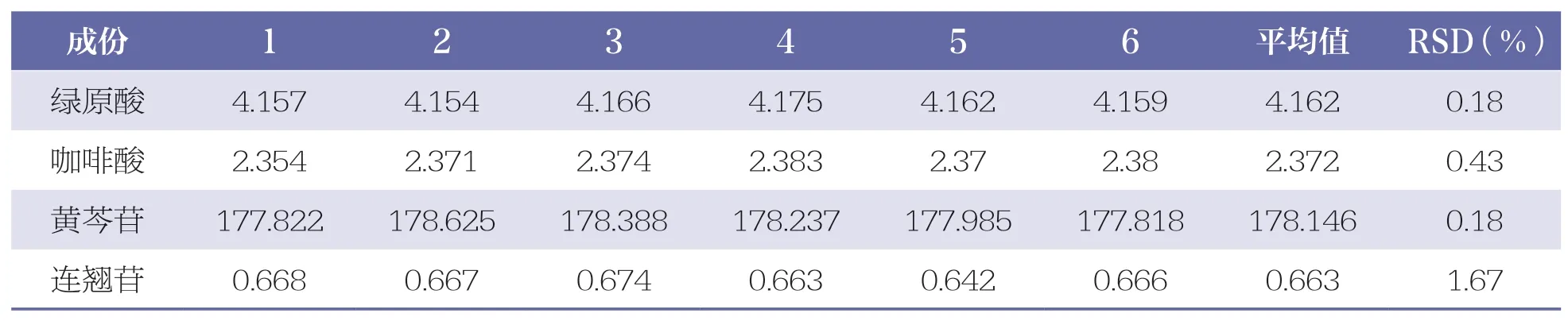
表3 4 种成份精密度试验结果
2.3.3 重复性试验
取同一供试品(批号:202009101)6 份,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,记录各色谱峰峰面积。绿原酸、咖啡酸、黄芩苷、连翘苷的平均含量分别为0.195、0.065、7.108、0.143 mg/ml,RSD 分别为0.21%、0.63%、0.21%、0.86%,表明该方法重复性良好。详见表4。
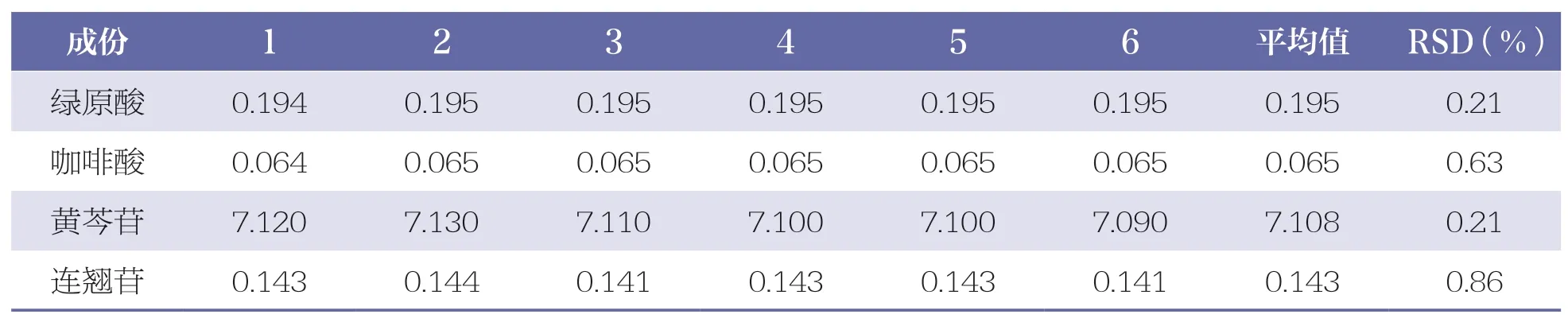
表4 4 种成份重复性试验结果
2.3.4 稳定性试验
取同一供试品(批号:202009101),按“2.2.2”项下方法制备供试品溶液,分别于0、2、4、6、8h进样测定,测得绿原酸、咖啡酸、黄芩苷、连翘苷的RSD 分别为0.11%、0.29%、0.04%、1.42%,表明供试品溶液在8h 内稳定性良好。详见表5。

表5 4 种成份的稳定性试验结果
2.3.5 加样回收率试验
分别精密吸取含量已知的样品溶液(批号:202009101)2.0ml,共6 份,分别加入各对照品溶液适量,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件测定含量,计算加样回收率和RSD。绿原酸、咖啡酸、黄芩苷、连翘苷的平均加样回收率分别为100.97%、100.08%、94.49%、101.10%,RSD 分别为0.26%、0.25%、0.32%、0.45%,表明测定结果准确。详见表6。
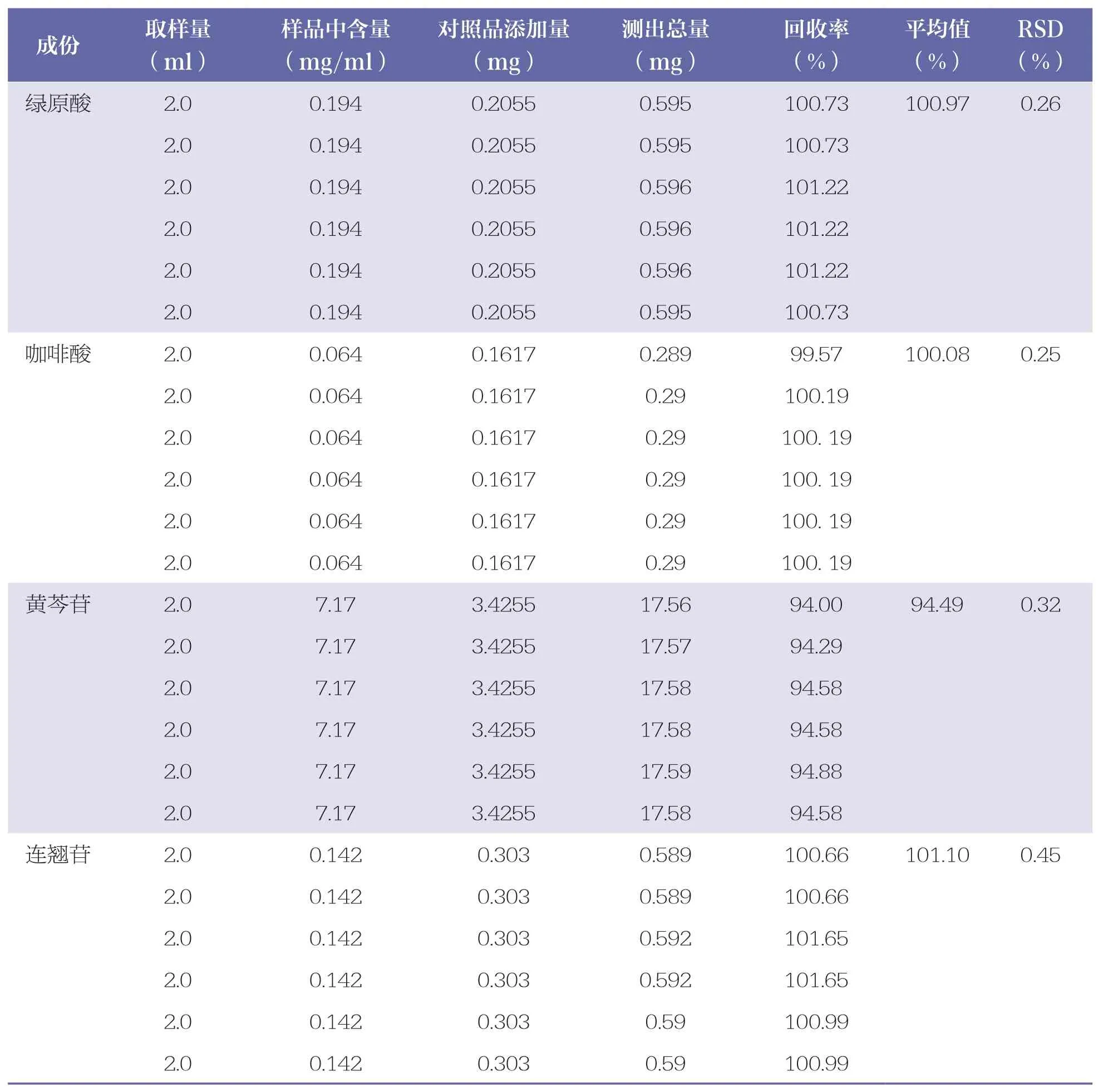
表6 4 种成份的加样回收率试验
2.4 相对校正因子(fs/i)的建立及耐用性评价
2.4.1 相对校正因子(fs/i)的建立
精密吸取“2.2.1”项下混合对照品溶液1、3、5、10、15μl,按“2.1”项下色谱条件进行测定,记录各对照品中各组份的峰面积。以连翘苷为内标参照物,根据公式fs/i=(Wi×As)/(Ws×Ai),分别计算绿原酸、咖啡酸、黄芩苷的相对校正因子。式中,fs/i为相对校正因子;Ws为内标参照物的质量(μg);As为内标参照物的峰面积;Wi为待测成份的质量(μg);Ai为待测成份的峰面积。详见表7。
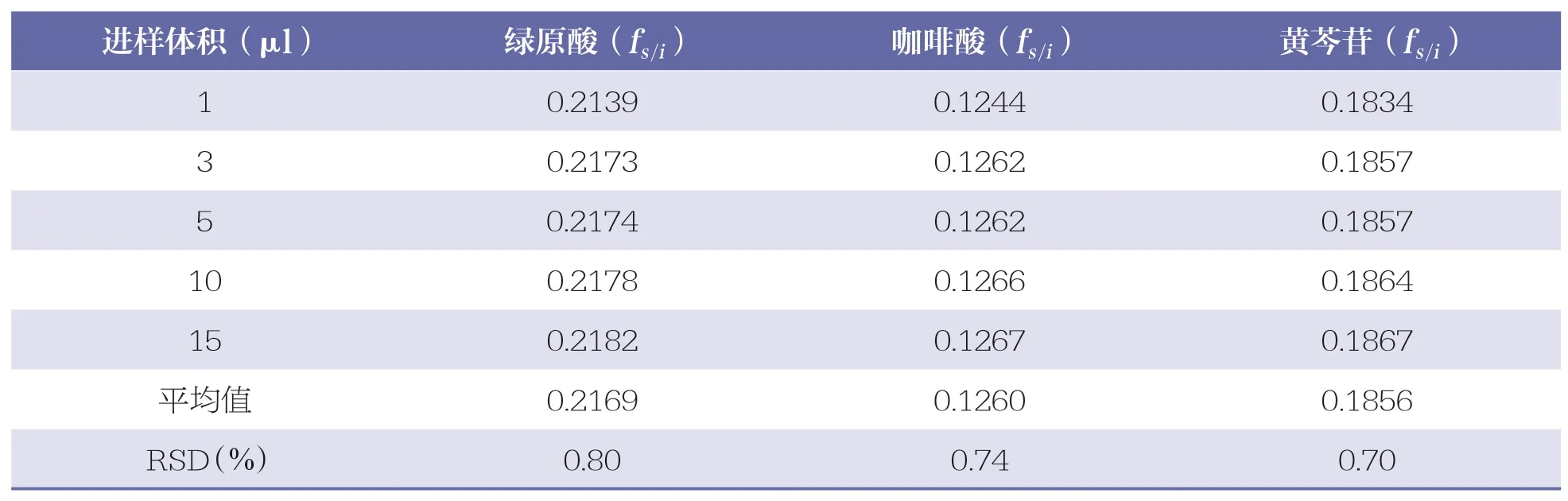
表7 样品中待测成份的相对校正因子
2.4.2 相对校正因子(fs/i)的耐用性评价
考察不同高效液相色谱仪(Agilent 1260、赛默飞 DGP-3600SDN 和Waters E2489)对待测成份相对校正因子(fs/i)的影响。结果绿原酸、咖啡酸、黄芩苷的相对校正因子(fs/i)RSD 分别为 0.79%、0.76%、0.70%,表明不同色谱仪对3 种成份的相对校正因子(fs/i)无显著影响。
考察不同型号色谱柱[Agilent Zorbax SBC18(150mm×4.6mm,5μm)、Syncronis C18(150mm×4.6mm,5μm)、YMC-C18(150mm×4.6mm,5μm)]对待测成份相对校正因子(fs/i)的影响。结果绿原酸、咖啡酸、黄芩苷的相对校正因子(fs/i)RSD 分别为1.20%、1.90%、1.50%,表明不同色谱柱对3 种成份的相对校正因子(fs/i)无显著影响。
2.5 连翘苷对照品溶液的稳定性试验
取连翘苷(批号:110821-201816,纯度95.1%)对照品溶液,分 别于0、1、2、3、4、5、6、7个月进样测定,测定连翘苷对照品的含量分别为99.98%、100.43%、101.58%、99.97%、98.96%、100.38%、100.30%、99.68%,RSD 为0.09%, 表明连翘苷对照品溶液在7 个月内稳定性良好。
2.6 样品含量测定
精密吸取 5 个批次的双黄连注射液供试品溶液各10μl,按“2.1”项下色谱条件进样测定。采用EMS[9]和QAMS 分别计算供试品中各待测成份的含量,详见表8。EMS 和QAMS 所计算出的结果无统计学差异(P>0.05),表明QAMS 可用于双黄连注射液中绿原酸、咖啡酸、黄芩苷、连翘苷的定量分析。

表8 4 种成份的含量测定结果
3 讨论
3.1 检测波长的选择
依据2020 年版《中国药典》和紫外扫描测定结果可知,黄芩苷、连翘苷、绿原酸、咖啡酸分别在274、280、324、323nm 处有最大吸收,在同一波长处同时测定4 种成份具有难度。由于连翘苷的含量较低,且在324nm 处基本无吸收,因此确定连翘苷与黄芩苷的检测波长为 280nm,并在检测时增加进样量[5];绿原酸类化合物和咖啡酸均含有咖啡酰结构,在 324nm 处有最大吸收,故设定绿原酸和咖啡酸的检测波长为324nm[6]。综合考虑各峰高及峰面积的比例,选择324nm 和280nm 为最终检测波长,在线进行波长切换检测。
3.2 流动相和洗脱梯度的选择
试验中考察了乙腈-0.07%甲酸溶液[3]、0.6%冰醋酸水溶液-乙腈[10]、乙腈-0.2%甲酸[11]等不同流动相以不同比例进行成份洗脱,最终以乙腈-0.2%甲酸为流动相进行梯度洗脱。该条件下样品分析时间短(40min 内即完成一针进样检测),柱效高,色谱图基线平稳,峰形对称,对照品出峰时间适中,主峰与其他峰的分离度、主峰的理论板数等色谱参数均符合2020 年版《中国药典》的要求。
3.3 内标参照物的选择
连翘苷不耐高温,50℃以上会破坏连翘苷的结构使其变性,但在室温条件下稳定性良好;溶液的酸碱度对连翘苷稳定性影响显著,pH 为7 时最稳定;连翘苷的光稳定性好[12]。本试验在7 个月内连续8次测定同批号的连翘苷对照品,结果表明其稳定性良好。
综上,2015 年版《中国药典》将QAMS 用于中药提取物及中药制剂的多指标质量控制。近年来在中药材、中药饮片及中药制剂的质量控制中,QAMS 的应用范围已由同类成份的测定扩展至多类成份的测定[13]。本研究结果表明,QAMS 具有简便可行、准确、快速、重现性好、专属性强的特点,可有效降低质控成本、提高质控效率,可用于双黄连注射液的质量评价。

