生物活性物质递送体系下丝素蛋白微胶囊的研究进展
吴建兵, 耿涵枭, 顾舒婷, 孙银银, 王永峰
(1.常熟理工学院 纺织服装与设计学院,江苏 苏州 215500; 2.中国科学院苏州纳米技术与纳米仿生所国际实验室,江苏 苏州 215123)
生物活性物质是指对人类生命活动起调节功能的生理活性成分,能维持人体健康状态和预防慢性疾病[1]。然而,在使用过程中,许多生物活性物质例如多酚、黄酮类、维生素、益生菌、蛋白多肽等,易受到温度、酸碱性、离子强度、光照等外界因素影响,导致其活性迅速降低[2]。因此,开发一种递送体系实现其高效装载、持久稳定活性及可控释放是目前研究中亟须解决的问题。
递送体系是将生物活性物质装载在载体基质中,保护活性免遭破坏的同时控制释放速率,提高利用率[3]。递送体系的载体基质形式有多种,其中微胶囊具有力学性能优异、稳定性好、装载量高、壁材通透性可控等优点,是一种理想载体基质[4]。微胶囊具有完整囊膜的中腔结构,粒径约为1~1 000 μm[4],形状各异,其中以球形居多,囊膜厚度与层数可控。微胶囊可装载固体、液体或气体多种形式的物质,稳定其生物活性,同时可利用囊膜的选择通透性调控释放速率[5]。一般将被装载的物质称为芯材,用于装载的物质称为壁材。
目前,用于制备微胶囊壁材的材料主要包括天然高分子[6]、合成高分子[7]和无机材料[8]。天然高分子通常具有低毒性和高生物相容性,有利于生物活性物质的装载、稳定及修饰。常用的天然高分子主要包括壳聚糖[9]、明胶[10]和藻酸盐[11]。尽管这些材料在生物活性物质的递送体系中作用突出,但仍存在不足,例如阳离子的壳聚糖细胞毒性强[12-13],且易在酸性下溶解[14];明胶在体内降解速率较快、机械性能差[15];藻酸盐受钙离子的浓度影响较大,以凝胶材料为主,应用范围受限[16]。丝素蛋白具有优异的生物相容性[17]、极低的免疫原性[18],大量研究证实了其对生物活性物质有高度的亲和性[19],是最为理想的稳定生物活性物质的天然高分子之一[20]。全水相条件纯化下的丝素蛋白溶液可塑性强,可通过简单、温和的方法下制备成膜、凝胶、纳微米球、支架、微针、微胶囊等多种形态的材料[21],并在酶[22]、胰岛素[23]的装载、稳定及递送方面取得了丰富的研究成果。其中,微胶囊的研究最为活跃[24],其具有制备方法相对简单、理化性能可控、生物活性物质装载效率高、易化学修饰改性等优势,因此,在生物活性物质的稳定、可控释放及递送方面的潜力巨大。
近年来,由于纳米技术的突飞猛进使得国内外研究人员对丝素蛋白微胶囊在生物活性物质的持久稳定及高效递送体系中的应用产生了浓厚的兴趣。本文重点综述丝素蛋白微胶囊作为生物活性物质递送体系的研究进展。首先对丝素蛋白成囊的机理进行深入分析,其次对其制备方法进行详细比较,然后对其理化性能及影响因素进行阐述,最后介绍其用于生物活性物质递送体系下的应用现状,以期为丝素蛋白微胶囊在递送体系中的开发利用提供参考。
1 丝素蛋白成囊机理
Hermanson等[25]以重组蜘蛛丝蛋白(C16)为例,对蛋白质在乳液(甲苯和水)界面处的动态行为进行深入研究,结果表明蛋白质通常会在界面处发生吸附和变性。如图1所示[25],蜘蛛丝蛋白在水和甲苯液滴界面处自组装成囊共涉及3个过程:1) 蛋白质吸附;2) 蛋白质分子折叠;3) 蛋白质重折叠和组装成膜。因此,结合前人的研究工作[25-26],笔者认为丝素蛋白成囊的机理需要经历4个阶段:1) 共混液中形成分散相(芯材)和连续相(壁材),芯材可以是液体或者固体;2) 丝素蛋白分子中的疏水氨基酸残基向芯材界面区域扩散并吸附在芯材表面,此时蛋白质分子可以是部分折叠或未折叠状态;3) 在外界条件刺激下(喷雾干燥[24]、甲醇[27]、乙醇[28]、高浓度氯化钠[29]、低pH值[30]、聚乙二醇[31]),丝素蛋白分子可通过氢键、分子间作用力的非共价键(疏水作用力)、共价键等方式诱导丝蛋白分子重折叠和自组装;4)丝素蛋白进一步自组装形成纳米结晶体并聚集增大,沉积在芯材表面,在界面处形成完整的囊膜(整个吸附和组装过程小于30 s)。成囊过程可通过对丝素蛋白的浓度、芯材的尺寸和外界刺激等因素进行调控。

图1 蜘蛛丝蛋白在水和甲苯液滴界面处通过自组装成囊过程示意
2 丝素蛋白微胶囊的制备方法
2.1 喷雾干燥法
基于上述成囊机理,喷雾干燥法[32]制备微胶囊需经历4个过程:1) 制备共混乳液;2) 高压均质化乳液;3) 高压雾化形成微细液滴;4) 在干燥气流下,微细液滴表面的水快速蒸发,丝素蛋白迅速固化包覆芯材形成微胶囊(图2)[32]。Hino等[33]将连续相的丝素蛋白乳液在较高温度下送入干燥室,随着水分快速蒸发形成囊膜,最大程度上稳定芯材(茶碱)的活性。另外,探讨了丝素蛋白微胶囊的二级结构与空气湿度的关系,结果表明无规卷曲的丝素-茶碱微胶囊易在室温、89%湿度条件下发生构象转变(β-折叠),进而提高其稳定性。Wang等[24]通过喷雾干燥法制备了姜黄素-丝素蛋白微胶囊,并分析了姜黄素的装载量与喷雾干燥参数(进出口温度、进料流速、喷嘴口尺寸、雾化压力)及丝素蛋白浓度之间的关系。尽管喷雾干燥法具有流程简单、过程易控制及可工业化生产等优势,但是仍存在微胶囊易聚集、芯材包覆效率低及生产成本高等问题。
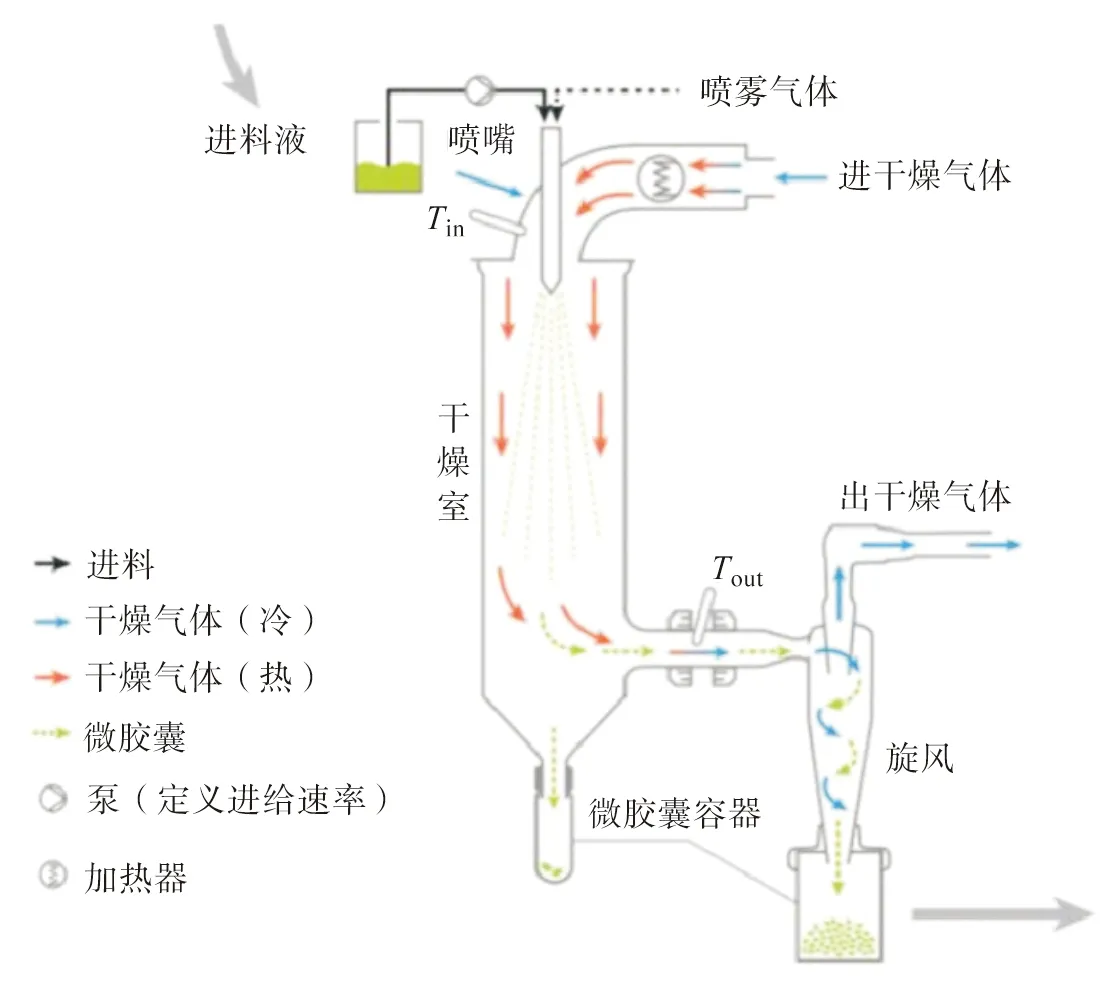
图2 喷雾干燥法制备丝素蛋白微胶囊的过程示意
2.2 复凝聚法
在复凝聚法中,一般将不同电荷的聚合物作为壁材引物,再将芯材分散在壁材引物的水溶液中。在一定条件下,电性相反的聚合物引物就会迅速相互吸引,发生凝聚形成复合聚合物,并析出沉积在芯材表面形成囊膜。Basal等[34]首先将正二十烷分散在带负电荷的丝素蛋白溶液中,并加入司盘-20降低乳液的表面张力;然后,向上述溶液中加入带正电荷的壳聚糖溶液,使相反电荷的丝蛋白与壳聚糖迅速相互吸引,并调节pH值使复合物凝聚析出,不断沉积在乳液界面处,进一步加入戊二醛交联以提高微胶囊的稳定性。此方法制备的微胶囊形貌不规整、易团聚、分散性差,另外戊二醛等交联剂的使用也会影响载体基质的生物安全性。
2.3 层层组装法
层层组装(Layer-by-layer,LBL)法需要以不同形状的硬质材料(无机或聚合物)为模板,将丝素蛋白分子通过静电、氢键、非共价键或共价接枝等方式吸附到其表面,紧接着在变性剂和交联剂的作用下诱导丝素蛋白自组装形成稳定的囊膜,再将模板溶蚀(物理或化学)后得到中空的微胶囊,整个过程需要循环多次。Shchepelina等[35]将丝素蛋白分子通过疏水和氢键作用吸附到球形二氧化硅模板上,再利用甲醇诱导其构象转变(无规卷曲到β-折叠),促进其自组装结晶沉积到模板上,周而复始多次形成微胶囊(图3(a));Ye等[36]先分别利用聚L-谷氨酸和聚赖氨酸对丝素蛋白中的丝氨酸和酪氨酸进行改性接枝,得到不同电荷的聚合物,紧接着通过电荷作用将其吸附在经聚乙烯亚胺(PEI)处理的二氧化硅微球上,如此循环多次,最后利用交联剂(EDC)稳定微胶囊(图3(b));同样思路,Geryak等[37]先将胺基聚合物(SF-PL)与聚乙二醇(PEG)共价接枝得到带正电荷的SF-PL-PEG聚合物,再与负电荷的羧基聚合物(SF-PG)相互吸附、沉积,反复多次,最后通过EDC交联形成SF-PL-PEG/SF-PG微胶囊。Du等[38]以聚乳酸-羟基乙酸共聚物(PLGA)微球为模板,利用乙醇增强丝素蛋白与PLGA之间的疏水作用力,进而促进丝素蛋白的吸附和自组装,再通过乙腈与1-甲基-2-吡咯烷酮溶蚀PLGA微球,得到单层丝素蛋白微胶囊。Drachuk等[39]先通过PEI处理二氧化硅以固定DNA,再以此为模板吸附丝素蛋白分子,同样在甲醇诱导下加快丝素蛋白自组装沉积形成稳定的膜,再利用氢氟酸(HF)溶蚀二氧化硅得到丝素蛋白微胶囊,并为金纳米粒子(AuNPs)和抗体(IgG)的功能化设计提供载体基质。LBL法制备的微胶囊可实现复杂结构和理化性能的精细调控,也可引入功能性基团对微胶囊进行化学修饰,赋予微胶囊功能化和智能化响应。然而其制备方法繁琐,涂层的成囊影响因素多(丝蛋白相对分子质量、浓度、电荷密度、pH值、离子浓度),化学交联剂(EDC或戊二醛)的引入会降低其生物安全性。

图3 LBL法制备丝素蛋白微胶囊的过程示意
2.4 乳液模板自组装法
水油两相界面存在热力学不稳定的问题,可通过加入乳化剂吸附在其界面处稳定液滴。乳液模板自组装法是利用高分子材料的乳化特性,能在界面处稳定液滴的同时进而固化形成囊膜的基础上发展起来的技术[40]。氨基酸组成的丝素蛋白具有双亲性,已证实可作为天然乳化剂用于纳米乳液的稳定[41]。受上述丝素蛋白成囊机理启发,先利用丝素蛋白吸附在两相界面处稳定乳液形成模板,再经外界刺激诱导丝素蛋白自组装固化形成稳定的囊膜附着在液滴表面,其过程包括3个阶段:1) 可添加表面活性剂或固体粒子(Pickering效应),进一步降低两相(连续相和分散相)之间的界面张力,得到稳定的乳液;2) 引入丝素蛋白的不良溶剂,促使丝素蛋白分子暴露疏水基团,引发自组装;3) 通过疏水作用在芯材液滴表面沉积,最终包覆液滴表面以形成微胶囊。Cheng等[42]用丝素蛋白纳米纤维乳化油滴形成乳液(图4(a)),并深入研究了丝素蛋白的浓度、构象、乳化转速和乳化时间等参数对乳液稳定性的影响,另外选择了不同极性的油相(正己烷、正己醇、十二烷、丁酸丁酯)来验证丝素蛋白作为乳化剂的适用性。研究结果发现,高晶丝素蛋白纳米纤维形成的乳液具有优异的均一性、分散性和持久稳定性(长达6个月),这可能与丝素蛋白在界面处的吸附能力、排列紧密程度和界面强度有关。Wang等[24]先以二氧化硅稳定油相形成Pickering乳液,再加入丝素蛋白溶液经高速搅拌、匀浆共混。研究过程中发现,丝素蛋白分子能均匀扩散至二氧化硅颗粒之间,以及二氧化硅与油相的界面处,在Pickering乳液界面周围形成三维网络薄层结构,使乳液稳定,这可能与大量氢键的形成有关。紧接着加入PEG诱导丝素蛋白疏水区暴露,丝素蛋白由无规卷曲向α-螺旋转变并自组装析出,形成稳定的囊膜(图4(b))。乳液模板自组装法制备方法简单、温和、高效,无有机溶剂和交联剂的添加,也不需强酸溶蚀模板,使得丝素蛋白微胶囊的生物安全性得以保证,有望工业化生产。

图4 乳液模板自组装法制备丝素蛋白微胶囊的过程示意
3 丝素蛋白微胶囊的理化性能
3.1 粒 径
丝素蛋白微胶囊的粒径会直接影响其机械性能和活性物质的扩散及释放速率。粒径越小,其比表面积越大,扩散和释放速率越快;同时,粒径越小,其机械强度相对越高。由表1可知,喷雾干燥法、复凝聚法、LBL法及乳液模板自组装法中,微胶囊的粒径分布主要受喷嘴类型和流量、固体模板尺寸、自组装次数、乳化剂、搅拌速度、丝素蛋白浓度等因素影响。

表1 不同方法制备丝素蛋白微胶囊的粒径及影响因素
3.2 壁厚和粗糙度
壁厚和粗糙度是丝素蛋白微胶囊完整性的重要指标,也是其装载生物活性物质、功能化设计的前提和保证。相比于喷雾干燥法、复凝聚法,以LBL法和乳液模板自组装法制备并探究丝素蛋白囊膜的壁厚和粗糙度的较多。Shchepelina等[35]探究了经LBL法(疏水作用)制备的丝素蛋白微胶囊膜的壁厚和粗糙度的影响因素,发现壁厚和粗糙度与自组装层数并不是完全的线性关系,这可能与丝素蛋白在LBL成囊过程中的吸附和沉积协同作用相关。而有意思的是Ye等[47]利用SF-PL与高疏水的氧化石墨烯经LBL法制备微胶囊,研究结果表明壁厚与自组装层数呈线性关系(每层均增加了5.7 nm),这可能与丝素蛋白仅吸附在氧化石墨烯表面,无法向层间扩散有关。紧接着Ye等[36]研究了SF-PG与SF-PL经LBL法(静电作用)形成的囊膜的壁厚和粗糙度,结果表明囊膜的厚度从19 nm(3层)显著升高到了277 nm(9层),粗糙度也从4.4 nm增加到11.4 nm。相比于疏水作用,电荷作用形成的囊膜厚度和粗糙度均呈指数型增长,这与聚电解质在LBL过程中存在剧烈的界面扩散及高效的络合作用有关。在此基础上,Ye等[44]继续深入探究了不同pH值及交联剂处理时间长短对壁厚与粗糙度的影响,当pH值为5.5时,5层囊膜厚度为87 nm,而当pH值分别为2.0和11.5时,厚度分别增加到204 nm和201 nm;同样囊壁的粗糙度也由15.5 nm分别增加到27.5 nm和37.5 nm,这与在极性条件下SF-PG与SF-PL的离子键的减少有关。另外,交联时间的延长可促使囊膜更致密(厚度从48 nm降低到44.5 nm)。Du等[38]利用单层自组装法(去溶剂法)制备了壁厚为22.42 nm、表面粗糙度为4.09 nm的丝素蛋白微胶囊,并认为微胶囊的壁厚和粗糙度与β-折叠的形成有关。另外,该单层微胶囊的囊膜粗糙度,与上述LBL经疏水作用的第一层结果一致[35],但要比LBL经静电作用的略高[36]。总而言之,囊膜的厚度、粗糙度与LBL法中的作用方式(疏水、静电)、pH值、交联剂的添加、处理时间、囊膜基质的性质(丝素蛋白构象)及制备方法等众多因素有关。
3.3 机械性能
微胶囊的机械性能是评估其稳定性和使用价值的核心指标之一。Hermanson等[25]通过原子力显微镜对基因重组蜘蛛丝蛋白微胶囊的机械性能进行测试,并经计算得出杨氏模量达到0.7~3.6 GPa,接近于天然的蚕丝(10 GPa),展现出了优异的化学稳定性。Shchepelina等[35]研究了厚度为20~100 nm的薄丝素蛋白膜的杨氏模量达到惊人的6.5 GPa,经甲醇处理后膜的极限强度达到100 MPa。Ye等[36]分别研究了经EDC交联的PEI-SF-PG/SF-PL微胶囊在干湿态时的机械性能,干态下微胶囊的杨氏模量最高达到1.8 GPa;湿态下经EDC交联160 min的微胶囊的杨氏模量(15 MPa)比未交联的(3.5 MPa)高出了5倍。除此之外,Ye等[44]也比较了不同pH值对囊膜机械性能的影响,相比于pH值为7.5时(杨氏模量为8.5 MPa),在极端酸碱性的条件下(pH值分别为1.5和11.5),杨氏模量骤降到了1 MPa以下(分别为0.6 MPa和0.4 MPa),这与此时囊膜中的丝素蛋白骨架结构(多孔结构)较松散有关。随后Ye等[47]将氧化石墨烯与SF-PL经LBL法形成囊膜,测试结果发现杨氏模量达到470 MPa,比纯丝素蛋白囊膜高2倍,说明氧化石墨烯的加入(约占20%)有助于提升囊膜的机械性能。Wang等[24]通过添加纳米二氧化硅制备丝素蛋白微胶囊的杨氏模量达到95.2 MPa,分别比利用丝素蛋白纳米纤维[42](27.4 MPa)和对丝素蛋白接枝改性[37](19.1MPa)制备的微胶囊的杨氏模量高3~5倍。上述研究结果表明,无机纳米粒子的引入可显著提升囊膜的机械性能。总之,微胶囊的机械性能与丝素蛋白的晶体结构、无机纳米粒子的添加、交联剂的添加及处理时间、pH值、丝素蛋白的相对分子质量及聚集形态等因素有关。
3.4 通透性
微胶囊的选择通透性是生物活性物质能否递送并发挥作用的关键指标。根据生物活性物质的特性来灵活调控囊膜的通透性一直是研究人员研究的落脚点。Shchepelina等[35]通过LBL法制备了多孔、渗透性可控的丝素蛋白微胶囊,选择了相对分子质量为20~2 000 kDa的葡聚糖对囊膜的通透性进行验证。研究结果表明,随着自组装层数的增加,囊膜的通透性逐渐降低,自组装5层时(壳的孔隙约为25 nm),尺寸为22.9 nm的葡聚糖(500 kDa)可通过,而尺寸为31.8 nm的葡聚糖(2 000 kDa)却无法通过,囊膜的孔隙直接决定了其通透性。另外当自组装12层后(孔隙约为7 nm),其选择通透性的葡聚糖的相对分子质量阈值为70~150 kDa(尺寸约为5.8~9.6 nm)。此外,通过疏水作用形成囊膜的通透性远高于经电荷作用形成的囊膜,这可能与丝素蛋白自组装和沉积方式(氢键和疏水作用)形成的多孔结构有关[36]。并且对于LBL法形成的囊膜,可通过改变自组装的层数(孔隙大小)来调控其通透性,比乳液法制备的微胶囊的优势显著(只能通过27 kDa)[25-26]。基于该研究基础,Ye等[44]深入研究了不同pH值、交联剂的添加对囊膜通透性的影响。尽管自组装层数在一定程度上可调控囊膜的通透性,但是对于经电荷作用形成的微胶囊会受限。研究发现9层囊膜在pH值为5.5时,无法通过相对分子质量为20 kDa的葡聚糖,而当pH值为11.5时可顺利通过,这可能与在极端酸碱性下聚电解质分子之间的电荷作用减弱,通透性增加有关。基于此规律,可通过调控pH值实现微胶囊的智能装载和释放;当pH值从11.5降低到7.5时,利于葡聚糖的高效装载;当pH值从7.5升高到11.5时,利于葡聚糖的快速释放。另外,交联剂的添加也在一定程度上降低了囊膜的通透性(更致密)[44]。因此,囊膜的通透性与LBL法中疏水作用下的自组装层数、电荷作用下的pH值及交联程度有关。
4 丝素蛋白微胶囊在生物活性物质递送体系中的应用现状
Li等[46]首次利用LBL法制备丝素蛋白微胶囊用于质粒DNA(pDNA)的装载及递送,并分别对pDNA的装载方式(前装载和后装载,图5(a))、体外释放、细胞毒性及增强型绿色荧光蛋白(eGFP)的表达水平进行了研究,结果发现前后装载方式均可有效延缓(pDNA)的释放(3 d),表明蛋白酶的存在可加速释放。相比于PEI/pDNA复合物,经丝素蛋白微胶囊(尤其1 μm微胶囊)装载的pDNA表现出了更高的转染效率和更低的细胞毒性。因此,丝素蛋白微胶囊可用于pDNA的局部递送。Drachuk等[39,48]首次将具有编码翻译激活核糖开关的DNA模板和RNA核酸适配子装载在丝素蛋白微胶囊中(图5(b))。在自组装过程中,通过调控聚合物引物、丝素蛋白浓度及DNA含量,得到通透性可控、生物相容性优异的微胶囊。将DNA固定在微胶囊膜内,不仅提高了其长期存储的稳定性(2年),同时也改善了空间受限DNA编码传感元件的输出响应。在体外转录/翻译过程中,通过囊膜对细胞游离组分的选择通透性激活特异性分析物,合成多个mRNA和绿色荧光蛋白(GFPa1)。此外,进一步地利用金纳米粒子(AuNPs)和抗体(IgG)对微胶囊进行功能化设计,也证实了其装载传感元件的适用性,有望用于复杂生物标记物的多重生物传感设计。Cao等[49]利用丝素蛋白制备了双凹面形和球形两种微胶囊(粒径1.8 μm、壁厚20 nm),并比较了细胞摄取、生物相容性和体内生物分布(图5(c))。经小鼠尾静脉注射研究发现,当两种微胶囊经血液循环时,相比于圆形微胶囊,双凹面形的微胶囊更能减少被肾脏、肝脏代谢,延长其在血液中的循环时间,并最终在肺部组织中堆积。这可能是双凹面形的微胶囊与红细胞的形状类似,比表面积高、水动力学小,可向血管内壁侧向漂移且能实现可逆变形,有利于其在狭窄的空间内自由通过,且能逃避不同类型细胞的内化作用。该实验数据可为通过灵活设计微胶囊的形状,高效装载生物活性药物用于治疗肺部疾病(肺纤维化、哮喘和肺癌)提供有益参考。目前,关于丝素蛋白微胶囊的递送研究仍集中在对葡聚糖的通透调控上,而其在生物活性物质递送方面的应用研究才刚起步,近几年相关的研究仍然比较少。一方面是制备方法相对比较复杂,形成的微胶囊需后处理提高水不溶性,生物活性物质高效负载受限。例如LBL法过程精细、流程繁琐;喷雾干燥法制备的丝素蛋白微胶囊形成时间短,构象无法瞬时从无规卷曲向β-折叠转变,仍需利用水蒸气等方式进行后处理,这在一定程度上增加了制备难度。另一方面是丝素蛋白微胶囊理化性能的限制,例如丝素蛋白微胶囊的机械性能和通透性等难以精确调控,而这些因素又都会反过来影响生物活性大分子的递送。尽管存在挑战,但是丝素蛋白微胶囊已在姜黄素、奥氮平、葡聚糖、DNA等不同生物活性物质的装载、稳定及递送等方面的研究取得了一些成果,这可为下一步开发新型营养制剂、给药制剂、食品保护剂及生物传感器等提供材料选择。

图5 丝素蛋白微胶囊在生物活性物质递送体系下的递送模式
5 结 论
丝素蛋白对生物活性物质具有高度的亲和性,已被作为乳化剂用于活性纳米乳液的稳定。丝素蛋白微胶囊具有成型简单、内部空间大、囊膜薄且稳定、通透性可控的优势,是活性物质的装载、稳定、递送的理想载体材料。本文从材料选择、丝素蛋白微胶囊的成囊机理、制备方法、理化性能的影响因素及在生物活性物质递送体系中的应用现状5个角度进行了全面总结,阐述了丝素蛋白微胶囊形成机理中4个阶段并深入分析了其不同阶段对微胶囊粒径、壁厚及粗糙度、机械性能和通透性等的影响,厘清了丝素蛋白微胶囊的形成、结构、理化性能和活性物质递送方面的相互关系。当前,丝素蛋白微胶囊在生物活性物质递送方面的应用研究,尤其是不同分子量活性物质的高效装载、长久稳定和可控释放等方面取得了一定的进展,有望为下一步开发新型营养制剂、给药制剂、食品保护剂及生物传感器等提供材料选择。
尽管前景乐观,但是丝素蛋白微胶囊在制备工艺、理化性能和微胶囊活性物质产品开发上仍存在一系列的问题和挑战:1) 为了提高囊膜的稳定性,LBL法需在制备过程中添加有机溶剂和交联剂,生物安全性难以保证;2) LBL法制备流程复杂,对成囊的要求较高,难以产业化;3) 乳液模板自组装法形成的微胶囊通透性差,难以用于大分子量蛋白质等的递送。因此,科研工作者应重点在丝素蛋白微胶囊的制备方法(安全性和工业化生产)、理化性能的调控和提升、不同特性的生物活性物质的装载及稳定、特定递送体系需求的功能化和智能化设计等方面进行深入研究。

《丝绸》官网下载

中国知网下载

