AM真菌对高寒草地2种禾本科牧草的接种效果研究
张海娟, 芦光新*, 范月君, 周华坤, 周学丽, 窦声云, 姚世庭, 颜珲璘,赵阳安, 马坤, 祁岩慧, 邱鹏滢
(1.青海大学农牧学院, 青海 西宁 810016; 2.中国科学院西北高原生物研究所, 青海省寒区恢复生态学重点实验室,青海 西宁 810008; 3.青海农牧科技职业学院, 青海 湟源 812100; 4.青海省草原改良试验站, 青海 共和 813000)
高寒草地是青藏高原最主要的生态系统,总面积约为1.4亿hm2,占青藏高原面积的53%左右[1-2],具有支撑草牧业发展、调节区域气候和维护生物多样性等生态功能[3-4]。但在全球气候变化和人类活动的共同驱动下,高寒草地面临着严重退化问题。为此,国家采取了围栏封育、补播、施肥和建植人工草地等一系列恢复改良措施[5-6],取得了一定的成效。在退化高寒草地适应性管理的情势下,人工补播结合土壤微生物调控等辅助措施是当前退化高寒草地生态恢复的关键手段[1]。
‘川草2号’老芒麦(Elymussibiricus‘Chuancao No.2’)和‘阿坝’垂穗披碱草(Elymusnutans‘Aba’)2种多年生禾本科牧草因具高产、优质、抗寒、耐贫瘠等特点,是当前应用于高寒草地的主要播种植物[7-9],但在高寒地区极端的环境条件下,生长极易受限。丛枝菌根(Arbuscular mycorrhizal,AM)真菌是土壤中普遍存在的一种共生微生物,研究表明,它能与禾本科、豆科和莎草科等80%以上的陆生高等植物及大部分水生、半水生植物建立互惠共生关系[10-12],从宿主植物处获得碳源,供自身生长和繁殖,同时,为植物提供氮和磷等矿质养分[13-14]。因此,利用AM真菌促进多年生禾本科牧草在极端环境的生长对退化高寒草地生态修复具有十分重要的意义。
目前有关AM真菌促进禾本科牧草生长的研究已有很多,但多以盆栽接种试验为主[15-20],鲜见其促进禾本科牧草在高寒草地等自然生境中生长的研究。鉴于此,本文通过盆栽与大田相结合的试验方法,研究了根内球囊霉(Glomusintraradices,GI)和摩西球囊霉(Glomusmosseae,GM)对‘川草2号’老芒麦和‘阿坝’垂穗披碱草生长的影响,以期为植物微生物联合生态修复技术在退化高寒草地恢复治理中的应用提供技术指导和理论依据。
1 材料与方法
1.1 试验材料
‘川草2号’老芒麦和‘阿坝’垂穗披碱草购自四川省草原科学研究院。种子播种前,用10%H2O2消毒10 min,无菌水冲洗5次,滤纸吸干水分后使用。供试AM真菌为根内球囊霉和摩西球囊霉,通过白三叶草(Trifoliumrepens)扩繁筛选后使用。栽培基质为青海省草原改良试验站的田间土,养分含量为:总氮1 469.56 mg·kg-1,氨态氮21.89 mg·kg-1,硝态氮64.98 mg·kg-1,有机质4.07%。基质晾干后过2 mm土壤筛,经121℃高压蒸汽灭菌2 h后使用。培养盆钵为规格18 cm × 15 cm×13 cm(上口径×下口径×高)的塑料花盆,用75%的酒精反复擦拭消毒后使用。
1.2 试验设计
1.2.1盆栽试验 试验设置接种根内球囊霉(GI)、接种摩西球囊霉(GM)和不接种(Control check,CK)3个处理,每个处理3次重复,2种牧草各9盆,共有18盆,随机排列,隔天调换位置。每盆装培养基质500 g,供试AM真菌菌剂20 g[21-22],牧草种子播量均为50粒·盆-1,出苗7 d后定苗至30株·盆-1。试验在青海大学农牧实验楼草地微生物实验室进行,在光照培养箱中培养,温度设为22℃/20℃(D/N,16/8 h),湿度均为60%,光照为52 000/0 lx(D/N,16/8 h)。栽培周期为2个月(2021年6月9日至2021年8月9日),栽培期间每周浇1次Hoagland营养液[23-25],每次每盆100 mL。
1.2.2大田试验 2021年6月3日,在青海省草原改良试验站项目试验地的试验小区(小区建于2020年5月,面积均为3 m × 5 m,条播,每个小区10条,图1)单播种植2种多年生禾本科牧草‘川草2号’老芒麦和‘阿坝’垂穗披碱草,随机选择有机肥(有机质含量≥ 45%,N + P2O5+ K2O ≥ 5%,购自蒲江县绿地秸秆科技有限公司)施用量分别为0(L1,P1)和5.25 t·hm-2(L4,P4)的4个试验小区进行AM真菌接种试验。具体接种方法为:于每个小区中间4行随机选择9条长势基本一致的30 cm的牧草样带(每个处理各3段),清除周围杂草石粒后,用75%酒精反复擦拭消毒的铲子挖开样带根围的土壤,深度为10 cm,取适量根样装在自封袋里带回实验室检测土著菌根侵染情况,然后用消毒处理的塑料隔断将样段周围围起(深度15 cm),均匀撒上供试AM真菌菌剂后覆原土,菌剂剂量均为300 g,在大田下生长3个月后检测菌根形成情况和菌根侵染率及牧草生长状况。

图1 野外试验小区布置图Fig.1 Layout of test plot in the field
1.3 取样及测定
1.3.1菌根侵染率 每个处理随机取15株完整的植物根系,洗净后用甲醛-乙酸-乙醇固定液(Formaldehyde acetic acid,FAA)固定过夜,次日采用台盼蓝染色法检测菌根结构[25],并按Biermann等的方法计算菌根侵染率[26]。
1.3.2牧草生长指标 盆栽试验结束后,用直尺测定植物株高,每个处理随机测定10株,3次重复;随机取5株健康植株,表面清洗干净后用滤纸擦干,分别测定单株地上和地下生物量,每个处理重复3次。大田接种试验结束后,分别测定植物株高、叶片数、穗长、节数和出土第2节直径,每个处理3次重复;同时,取适量植物根系测定菌根侵染率。
1.4 数据分析
用Excel软件整理数据并作图,IBM SPSS 26.0软件做单因素方差分析(One-Way ANOVA),Duncan法做多重比较。
2 结果与分析
2.1 接种AM真菌对2种盆栽多年生禾本科牧草菌根形成及侵染率的影响
GI和GM均能侵染‘川草2号’老芒麦和‘阿坝’垂穗披碱草的根系形成菌丝和泡囊等菌根结构(图2)。GI或GM对2种多年生禾本科牧草的菌根侵染率无显著差异。2种AM真菌对2种禾本科牧草的菌根侵染率均为GI组显著高于GM组和CK组(P< 0.05),GI对‘川草2号’老芒麦和‘阿坝’垂穗披碱草的侵染率分别是GM的1.21倍和1.36倍(表1)。

图2 2种盆栽禾本科牧草根系菌根形成情况Fig.2 Mycorrhizal formation of two potted gramineous herbages注:L代表‘川草2号’老芒麦;P代表‘阿坝’垂穗披碱草;a,b,c分别代表不接种、接种根内球囊霉和接种摩西球囊霉Note:L indicates Elymus sibiricus ‘Chuancao No.2’;P indicates Elymus nutans ‘Aba’;a,b,c indicate no inoculation,inoculation with Glomus intraradices,and inoculation with Glomus mosseae

表1 接种AM真菌对2种盆栽禾本科牧草菌根侵染率的影响Table 1 Effects on mycorrhizal infection rate of two potted gramineae herbages of AM fungi
2.2 接种AM真菌对2种盆栽禾本科牧草生长的影响
接种GI和GM 2个月后,‘川草2号’老芒麦和‘阿坝’垂穗披碱草的株高与不接种的CK处理相比无显著差异。接种GM的‘阿坝’垂穗披碱草的地上生物量和‘川草2号’老芒麦的地下生物量显著高于GI组和CK组(P< 0.05)(图3)。
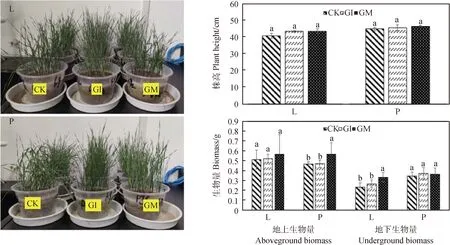
图3 接种AM真菌对2种盆栽多年生禾本科牧草株高和生物量的影响Fig.3 Effects on height and aboveground and underground biomass of two potted gramineae herbages of AM fungi
2.3 大田下2种禾本科牧草根系土著菌根形成及侵染情况
‘川草2号’老芒麦和‘阿坝’垂穗披碱草单播种植1年后,根系均受土著AM真菌侵染,施有机肥(L4,P4)增加了孢子和菌丝等菌根结构。方差分析结果表明,‘阿坝’垂穗披碱草的土著菌根侵染率显著高于‘川草2号’老芒麦(P< 0.05),施有机肥(L4,P4)的土著菌根侵染率显著高于不施肥的CK处理(L1,P1)(P< 0.05)(图4)。

图4 大田下2种禾本科牧草根系土著菌根形成情况及菌根侵染率Fig.4 Mycorrhizal formation and infection rate of two gramineae herbages of indigenous mycorrhizal in the field注:L1,P1和OR-代表不施有机肥;L4,P4和OR+代表有机肥施量为5.25 t·hm-2。下同Note:L1,P1 and OR- indicate organic fertilizer rate is 0;L4,P4 and OR+ indicate organic fertilizer rate is 5.25 t·hm-2. The same as below
2.4 接种AM真菌对2种大田禾本科牧草菌根形成及侵染率的影响
大田下接种GI和GM 3个月后,‘川草2号’老芒麦和‘阿坝’垂穗披碱草根系的泡囊等菌根结构明显多于不接种的CK处理(图5),施有机肥(L4,P4)显著增加了‘川草2号’老芒麦和‘阿坝’垂穗披碱草根系的菌根结构,菌根形态从6月份的孢子结构为主,变为以泡囊结构为主。菌根侵染率分析结果表明,GI和GM对‘川草2号’老芒麦和‘阿坝’垂穗披碱草的菌根侵染率均显著高于CK处理(P<0.05),GI组的菌根侵染率均显著高于GM组,施肥处理组显著高于不施肥处理组(P<0.05)。


图5 大田下接种AM真菌对2种禾本科牧草根系菌根形成及侵染率的影响Fig.5 Effect on mycorrhizal formation and infection rate of two gramineae herbages inoculated with AM fungi in the field
2.5 接种AM真菌对2种大田禾本科牧草生长的影响
大田下接种GI和GM 3个月后,‘川草2号’老芒麦和‘阿坝’垂穗披碱草的生长与不接种的CK处理相比有所差异(表2)。经分析,在不施有机肥(L1,P1)时,GM组的‘川草2号’老芒麦的株高显著低于GI组和CK组(P<0.05),GI和GM组的穗长显著低于CK(P<0.05),GM组的出土第2节直径显著低于CK组(P<0.05),叶片数和节数在GI,GM和CK组间均无显著差异;‘阿坝’垂穗披碱草的各项生长指标在GI,GM和CK组间均无显著差异;在施有机肥时(L4,P4),GI组的‘川草2号’老芒麦的株高显著低于GM组和CK组(P<0.05),GM组的叶片数显著高于GI组和CK组(P<0.05),穗长、节数和出土第2节直径在GM,GM和CK组间无显著差异;GI组和GM组的‘阿坝’垂穗披碱草的株高和穗长均显著低于CK组(P<0.05),其余指标在不同接种处理间均无显著差异。

表2 大田环境下接种AM真菌对2种禾本科牧草生长的影响Table 2 Effect on growth of two gramineae herbages inoculated with AM fungi in the field
3 讨论
3.1 栽培条件对AM真菌促生效果的影响
AM真菌侵入寄主植物根系皮层细胞形成菌根后,能扩大寄主植物在土壤中的有效吸收范围,加强植物对根际以外的水分和矿质营养的吸收[27],进而促进牧草生长。本研究在控制温度和水分等盆栽条件下对‘川草2号’老芒麦和‘阿坝’垂穗披碱草分别接种GI和GM后,2种多年生禾本科牧草的地上生物量均不同程度增加。然而,在大田环境下,对2种多年生禾本科牧草接种GI和GM后,‘川草2号’老芒麦和‘阿坝’垂穗披碱草的生长情况与CK相比无显著差异。这可能是因为土壤中微生物种类繁多,它们与AM真菌之间存在复杂的种间关系,其中不乏抑制AM真菌生长的菌种,进而影响了植物生长。同时,大田环境下不可控因素过多,如温度、光照和水分等,也会影响AM真菌促生功能的正常发挥[28]。其他研究者也做了相似研究,得出的结论也有所差异。如高亚敏等对燕麦(Avenasativa)接种从祁连山退化高寒草地优势种植物钝裂委陵菜(Potentillachinensis)根围分离出的AM真菌后,燕麦幼苗的株高、茎粗和叶绿素b含量等增加[20],这与本研究结果一致。王新军等通过盆栽和野外相结合的试验研究了摩西球囊霉等3种AM真菌对青藏高原路域星星草(Puccinelliatenuiflora)生长的影响,结果显示盆栽接种AM真菌能显著增加星星草的株高和生物量,野外接种AM真菌同样也显著增加了植被株高和覆盖度[29]。这与本研究结果不同,可能是由研究对象、接种时间和接种方法等不同所致。曹丽霞等对退化羊草(Leymuschinensis)草原接种土著AM真菌后发现,植物群落的高度、盖度、地上生物量和物种丰富度增加[30]。这可能是由供试AM真菌不同引起,土著AM真菌具有一定的环境适应性,更容易在高海拔极端环境下生存,而AM真菌的最适生长温度在15℃以上[31],外源AM真菌适应高寒冷凉环境需要较高的能量支撑。钱洁鑫以未退化草场5~20 cm土层的根土混合样为菌根接种源对内蒙古锡林郭勒盟严重退化草原地段人工接种AM菌根后补播羊草,结果羊草盖度增加了3.3倍,地上部生物量增加了1.6倍[32],这可能是因为接种源和接种方法等不同导致。然而,石伟琦通过原位试验对内蒙古草原大针茅(Stipagrandis)群落接种AM真菌后,短期内植物群落的物种丰富度、多样性、植物群落的结构和净初级生产力均未发生显著变化[33]。蔡晓布等采用草地均匀打孔法,研究了接种AM真菌对长芒草(stipabungeana)的侵染效应及对其生长的影响,结果表明,接种处理根围土壤AM真菌孢子密度和菌根侵染率等显著提高,对植株地上部生长无显著影响[34]。本研究也得出与上述相似的结论,即接种AM真菌对植物生长无显著影响,却能显著提高菌根侵染率。这可能是因为外界环境因素干扰较大,AM真菌需要消耗更多能量来适应环境,供给寄主植物的能量较少所致。
3.2 施肥对菌根侵染率的影响
本研究结果显示施有机肥的地块,‘川草2号’老芒麦和‘阿坝’垂穗披碱草根系的土著菌根侵染率显著高于不施肥处理,外源接种AM真菌后,施有机肥处理的菌根侵染率亦显著高于不施肥的对照处理,表明施有机肥能促进AM真菌对禾本科牧草的侵染。原因可能是施有机肥增加了土壤中氮磷等养分含量[35],激发了土壤中AM真菌的活性[36],促使其为宿主植物提供更多的矿质能量[37],也有可能是因为施有机肥引入了新的微生物菌种,影响了AM真菌的群落结构,进而影响了AM真菌对禾本科牧草的侵染[38]。
4 结论
大田环境下根内球囊霉和摩西球囊霉均能成功侵染高寒草地多年生禾本科牧草‘川草2号’老芒麦和‘阿坝’垂穗披碱草根系,施有机肥能增强接种丛枝菌根真菌的菌根侵染率,但在短期内对多年生禾本科牧草生长无显著影响。因此,以后可以结合施肥等田间管理措施开展丛枝菌根真菌接种效应研究,增加丛枝菌根真菌应用于退化草地生态修复等领域中的可能。

