绵羊体外胚胎高效利用的研究
陈 莹,鲁凤霞,田文丽,仇春娟,梅 荣,范利宏,陈大勇,吴阳升,林嘉鹏,黄俊成,刘明军,汪立芹
(1.石河子大学动物科技学院,新疆 石河子 832000;2.内蒙古四子王旗乌兰花镇人民政府,内蒙古 乌兰察布 011800;3.内蒙古四子王旗脑木更苏木人民政府,内蒙古 乌兰察布 011800;4.内蒙古赛诺种羊科技有限公司,内蒙古 乌兰察布 011800;5.农业农村部草食家畜遗传育种与繁殖重点实验室,乌鲁木齐 830011;6.新疆动物生物技术重点实验室,乌鲁木齐 830011)
【研究意义】超数排卵及胚胎移植(MOET)技术,是以生产体内囊胚或桑椹胚,移植至同期发情的受体内获得后代的技术。因能加快供体的繁殖效率,在牛、绵羊、山羊等家畜的良种扩繁中应用广泛。但该技术应用于绵羊,需要通过手术方式回收胚胎,对供体造成损伤较大。多次处理易使供体卵巢、子宫、输卵管等相互粘连,而无法继续繁殖,此时的供体大部分仍处于青壮年时期,淘汰尤为可惜。体外胚胎生产(In vitro embryo production, IVP)技术,可充分利用这些供体卵巢上卵泡能正常发育的特点进行体外胚胎生产。通过外源激素诱导卵泡发育,采集卵丘—卵母细胞复合体(COCs),对其进行体外成熟(In vitro maturity, IVM)、体外受精(In vitro fertilization, IVF)和体外培养(In vitro embryo culture, IVC),从而获得不同发育时期的胚胎。该项研究不仅有助于了解哺乳动物早期胚胎的发育机制,还可用于保存较高遗传价值的动物种质资源;再加上微创采卵技术的研发,将大大加快良种家畜的繁殖速度和遗传改良进程[1]。目前,IVP技术在良种羊上的应用率仍然较低,主要与体外胚胎发育率不稳定、利用率不高等因素有关。【前人研究进展】充分了解胚胎质量并合理制定移植计划是胚胎高效利用的关键。受精卵裂时间作为无创性的胚胎质量预测指标,可用于移植前胚胎的选择和评估。卵裂快慢对于胚胎的发育潜能及移植后妊娠结局具有重要影响。在人[2-3]和小鼠[4]、牛[5]、马[6]、猪[7]、猫[8]等动物中均有研究。通过对绵羊体外胚胎延时摄影的最新研究发现,卵裂较快胚胎具有较高的囊胚率[9],但还不清楚不同卵裂速度的胚胎对怀孕率的影响。通常认为体外胚胎的质量相对较差,本团队移植绵羊早期体外胚胎时,发现移植2枚体外胚胎才具有类似于单枚体内胚胎的怀孕率[10]。在体外胚胎移植时,理论上被移植的胚胎越早进入体内环境,更有利于着床和发育。但铁新琴等[11]在人的IVF-ET研究中指出,囊胚期胚胎移植可明显提高胚胎植入率及妊娠率。而曾梅芳[12]研究指出卵裂期胚胎冷冻复苏移植与囊胚期胚胎冷冻复苏移植二者妊娠结局没有差异,说明发育时期对妊娠结局的影响不是一定的,除人以外的其他哺乳动物中有关体外胚胎发育时期对移植后怀孕率影响的研究较少。移植胚胎数也是影响受体怀孕率的因素之一,受体母牛移植2枚鲜胚(B级胚胎)的妊娠率与移植切割后新鲜双半胚和单枚鲜胚的妊娠率相比,差异虽不显著(P>0.05),但移植2枚鲜胚(B级胚胎)的效果最好[13]。另外,铁新琴等也指出人类囊胚移植时双胚移植为最好选择。【本研究切入点】为充分挖掘良种肉羊的繁殖潜能,本研究从淘汰杜泊母羊卵巢获取卵丘—卵母细胞复合体,结合IVP技术,分析卵裂快慢的早期胚胎和囊胚对移植怀孕率的影响,从而提高体外胚胎利用率,以期每只供体获得更多的后代。【拟解决的关键问题】通过探究绵羊体外胚胎卵裂快慢与其发育潜能的关系以及对受胎的影响,为绵羊体外胚胎高效利用奠定基础。
1 材料与方法
1.1 试验材料
供体母羊为来自内蒙古赛诺种羊科技有限公司(内蒙古),健康状况良好、体格健硕、繁殖性能优秀但因多次超排导致冲胚困难的杜泊羊。受体羊为来自内蒙古四子王旗乌兰花镇和脑木更苏木的蒙古羊。杜泊细管冻精购自ALLSTOCK(WA)公司(澳大利亚)。卵泡刺激素(FSH)、孕马血清促性腺激素(PMSG)等均购自宁波三生药业有限公司(宁波);海绵栓购自新西兰辉瑞公司。体外胚胎生产使用的IVM、IVF及IVC培养液均为博瑞鼎®体外胚胎培养系列产品(新疆畜牧科学院生物技术研究所,乌鲁木齐)。Triton X-100、抗荧光淬灭剂购自北京索来宝公司;DAPI染液购自 Genview公司。其它生化试剂除特别注明外均为国药集团分析纯产品。
1.2 体外胚胎生产
1.2.1 供体处理及活体采卵 因多次超数排卵—胚胎移植(MOET)等原因导致输卵管、子宫角、腹膜相互粘连而无法继续使用的纯种杜泊母羊作为供体,激素处理方法同文献[14]。简单地讲,在其阴道内放置海绵栓进行同期发情处理,埋栓第9天供体开始注射FSH,分6次注射,每次间隔12 h,总剂量为 240 IU。第6针结束后12~13 h 进行活体采卵(采卵后撤去海绵栓)或屠宰采卵。活体采卵手术前供体羊禁水禁食24 h。
1.2.2 卵母细胞体外成熟、体外受精和胚胎体外培养 回收的卵丘—卵母细胞复合体(COCs),经抽卵液和成熟液逐步洗涤后,按50~80枚/孔置于内含600 μL IVM培养液孔中,于5%CO2、38.6 ℃、饱和湿度的二氧化碳培养箱中进行成熟培养22 h。将体外成熟COCs移至0.1%的透明质酸酶液滴中,轻轻吹吸去除卵母细胞外围扩展的大块卵丘细胞,按50~70枚/孔置于内含500 μL IVF液孔中。冻精经解冻复苏,上游获能,取上层精子与成熟后的卵母细胞共孵育,培养条件与体外成熟相同。
分别在体外受精后的24、36、48 h 观察胚胎卵裂情况,将卵裂胚胎挑出分组培养。受精24 h(24 hour post insemination,24 hpi)观察时卵裂的胚胎记作卵裂快组,受精36和48 h观察新增加的卵裂胚胎统称为卵裂慢组(36 和48 hpi组),舍弃48 hpi还未卵裂的卵母细胞。不同组的胚胎分别置于新的平衡好的IVC液中,发育至第7天时统计囊胚数量、囊胚率和囊胚细胞数。
1.3 细胞核的染色和计数
统计囊胚的细胞数。使用Van等[15]描述的方法并稍作改进,对发育至囊胚阶段的胚胎进行细胞核染色。将透明带完整的囊胚转移至洗液(PBS+0.2%BSA)中洗涤2次,转移至通透液(PBS+0.25% Triton X-100)中 5 min,洗液洗涤2次,在DAPI液中染色4 min,随后再用洗液洗涤3次。最后用一滴抗荧光淬灭剂将胚胎固定在玻璃载玻片上,用盖玻片覆盖胚胎并压片,荧光显微镜拍照并对囊胚细胞核计数统计细胞数。
1.4 受体羊胚胎移植
保证受体羊在移植时所处的生殖系统状态与胚胎发育时期处于同期。受体羊与供体羊同步埋栓,在供体注射第5针FSH时,受体羊撤栓并肌肉注射PMSG(330 IU/只)。受体羊手术前24 h 禁食禁水。
早期胚胎(2~8细胞期)移植:将早期胚胎吸入移植针管,以常规手术将受体羊卵巢和输卵管暴露于体外,将移植管插入输卵管伞部深入5~10 cm,将胚胎注入输卵管内,稍作停留,撤出移植管。
囊胚移植:腹腔镜手术,找到受体母羊的子宫角,将子宫角顺势缓慢牵引出体外,露出子宫角末端,用灭菌处理的回形针尖在子宫角上穿刺打孔,移植针通过孔径将囊胚注入子宫角内。同时肌肉注射黄体酮(0.1 mL/只)。
1.5 胚胎移植对怀孕率的影响实验分组
第1组为移植不同数量的卵裂快或慢早期胚胎:①单枚卵裂快的早期胚胎,②双枚卵裂快的早期胚胎,③单枚卵裂慢的早期胚胎,④双枚卵裂慢的早期胚胎。第2组为移植不同数量的囊胚:⑤单枚囊胚,⑥双枚囊胚。第3组为受精后不同时间移植卵裂快的早期胚胎:受精后24 h 时移植,受精后48 h 时移植。第4组为移植经形态学分级的卵裂快组早期胚胎。卵裂快组早期胚胎培养至48 h进行形态学质量综合评分,分为A和B级,进行单胚移植,同时设一个不分级的随机单胚移植作对照组。分级标准:A级胚胎(卵裂球大小均匀且数目均等,胞质均匀、胞内无空泡,碎片不超过5%的胚胎);B级胚胎(卵裂球大小均匀或大致均匀,数目均等或大致均等,胞质均匀、胞内无空泡,碎片占5%~10%的胚胎)。
1.6 数据统计与分析
记录体外胚胎生产过程中的卵裂率(卵裂胚胎数/可用卵数),囊胚率(囊胚数/卵裂胚数)。胚胎移植40~45 d,用B超检测受体怀孕率(怀孕母羊数/移植受体数)。采用 SPSS 22.0 统计学软件的 t 检验或LSD对数据进行方差分析,以平均数±标准误(Mean±SE)和百分率 (%) 表示,P<0.05 为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 胚胎卵裂快慢所占比例
由图1显示,在24 h 观察到的胚胎卵裂数是1916枚,卵裂率是69.15%;24~36 h 的新增卵裂胚胎456枚,卵裂率是16.28%;36~48 h新增卵裂胚胎89枚,卵裂率是3.15%。3个时间段的卵裂率差异极显著(P<0.01)。其中快卵裂胚数占总卵裂胚胎数的77.85%(1916/2461)。
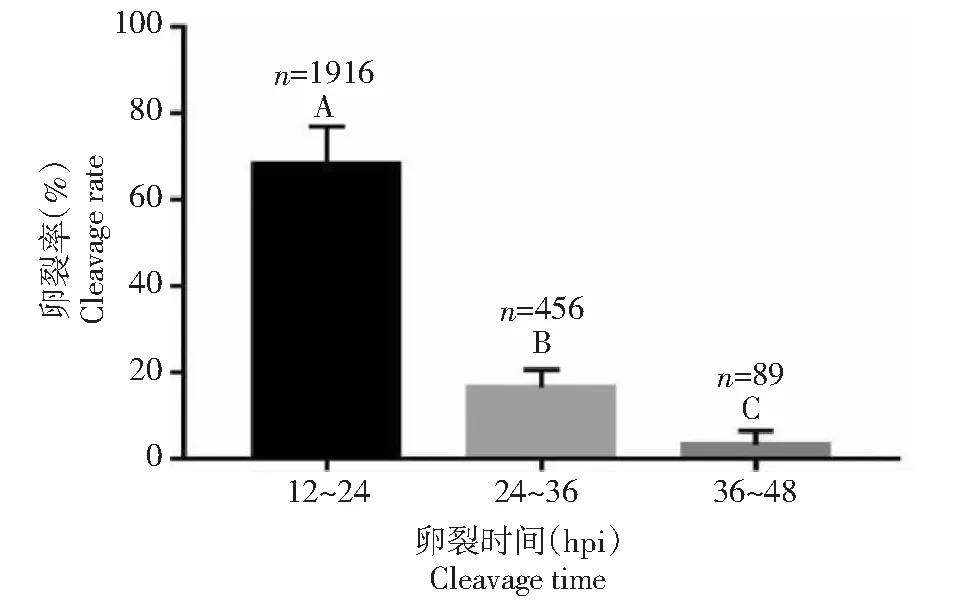
图1 绵羊体外胚胎不同时间段卵裂率Fig.1 Cleavage rate of sheep embryos in vitro at different time
2.2 卵裂快、慢胚胎的发育潜能分析
将不同时间节点卵裂的胚胎分组培养至第7 天,表1显示,受精24 h卵裂的胚胎囊胚率达68.95%,受精24~36 h卵裂的胚胎囊胚率为26.91%,受精36~48 h 卵裂的胚胎囊胚率仅为7.65%;卵裂快的胚胎囊胚率极显著高于卵裂慢的胚胎。
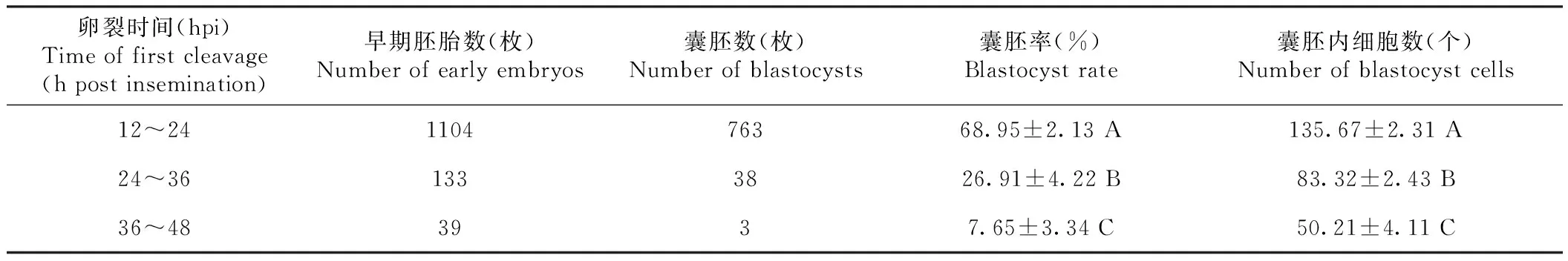
表1 绵羊不同时间卵裂胚胎的发育效率Table 1 Development efficiency of sheep embryos with different cleavage time
卵裂速度不同的胚胎发育成的囊胚细胞数也不同。从不同组囊胚中各取20枚进行细胞核染色并统计细胞数。卵裂快组囊胚细胞数为135.67±2.31,24~36 和36~48 hpi 卵裂慢组的囊胚细胞数分别为 83.3±2.43 和50.21±4.11。卵裂快组与卵裂慢组囊胚的细胞数差异极显著(P<0.01),且卵裂快组胚胎发育成的囊胚内细胞团细胞排布比卵裂慢组更紧密(图2)。
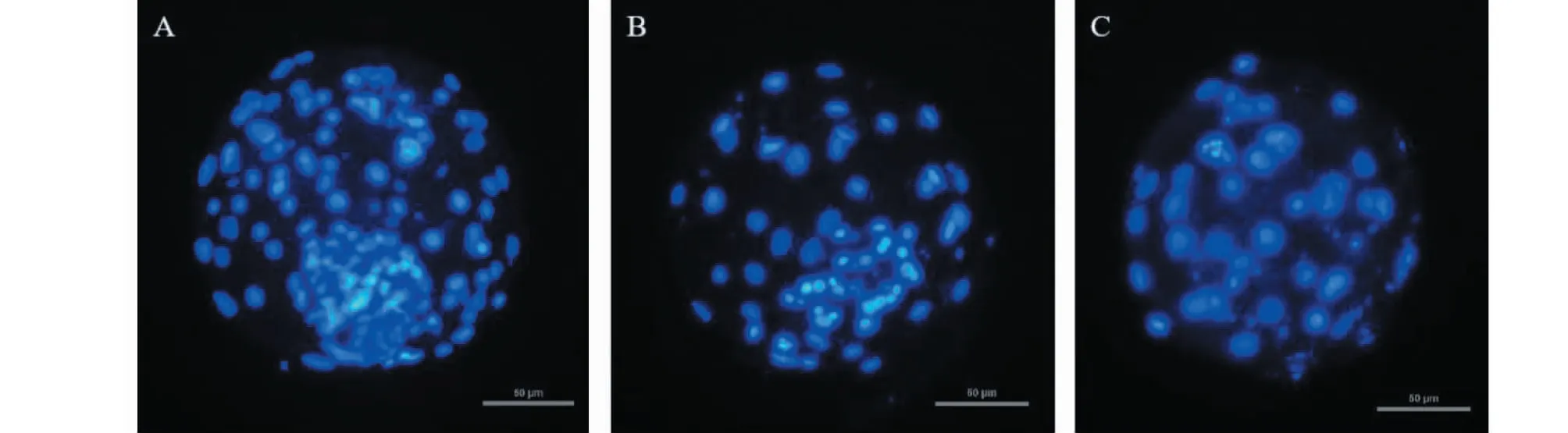
A.12~24 hpi卵裂胚发育的囊胚;B.24~36 hpi卵裂胚发育的囊胚;C.36~48 hpi卵裂胚发育的囊胚。图中比例尺代表50 μmA.Blastocysts developed from 12-24 hpi cleavage embryos; B.Blastocysts developed from 24-36 hpi cleavage embryos; C.Blastocysts developed from 36-48 hpi cleavage embryos; The scale represents 50 μm图2 不同时间卵裂绵羊体外胚胎发育至囊胚的细胞核染色Fig.2 Fluorescent staining of the nuclei of blastocyst development from sheep in vitro embryos cleaved at different times
2.3 卵裂快慢胚胎发育时期及移植数量对怀孕率的影响
如表2所示,卵裂快的早期胚胎单枚移植和双枚移植怀孕率分别是64.05%和65.62%,差异不显著(P>0.05)。卵裂慢的(24~36 h卵裂)早期胚胎双枚移植怀孕率是33.89%,极显著高于单胚移植的11.67%(P<0.01),但仍显著低于卵裂快的胚胎(P<0.01)。
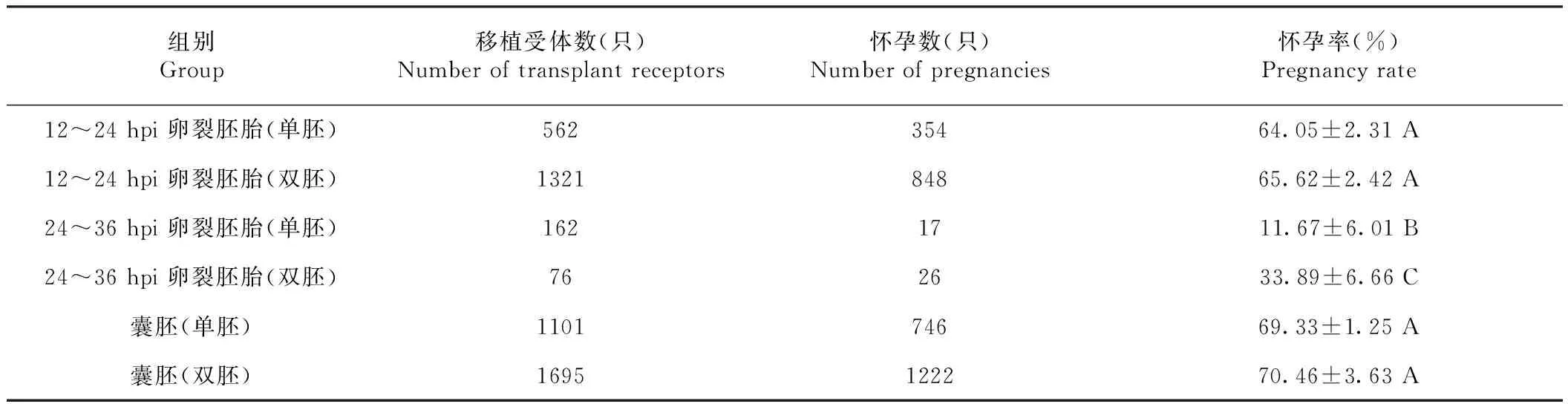
表2 移植不同卵裂时间的体外早期胚胎及胚胎数对怀孕率的影响Table 2 Effects of developmental period and number of transferred embryos with different cleavage time on pregnancy rate
囊胚移植单枚和双枚的怀孕率分别是69.33%和70.46%,差异不显著(P>0.05),与卵裂快的早期胚胎单、双胚移植的怀孕率比较,也无显著差异(P>0.05),但极显著高于卵裂慢的早期胚胎移植组(P<0.01)。
2.4 体外培养早期胚胎移植时间对怀孕率的影响
如表3所示,将受精后24 h卵裂的早期胚胎立即移植,或者继续培养至48 h 再进行移植的怀孕率分别是64.31%和64.05%,两者差异不显著(P>0.05)。

表3 体外培养早期胚胎不同移植时间对怀孕率的影响Table 3 Effect of different transplantation time of early embryo culture in vitro on pregnancy rate
2.5 胚胎形态学分级对怀孕率的影响
如表4所示,移植A级早期胚胎的怀孕率为63.46%,B级为63.07%,稍低于对照组的66.02%,三者统计学差异不显著(P>0.05)。

表4 早期胚胎形态学质量评分对怀孕率的影响Table 4 Effect of early embryo morphology on pregnancy rate
3 讨 论
绵羊体外胚胎生产结合胚胎移植技术,不仅可以将无法排卵的纯种肉羊母羊“废物利用”,还便于胚胎长期保存和运输,高效利用了良种肉羊配子资源,显著提高了繁殖效率[16]。非损伤性高质量胚胎的选择、移植时期及移植数量都可能影响受体的怀孕率,从而影响获得后代的数量和经济效益。哺乳动物合子第一次卵裂时间被认为是胚胎发育潜力的非损伤性标记,在人类辅助生殖中已进行较为深入的研究。目前对绵羊体外胚胎根据卵裂快慢标记进行高效利用的研究尚未见详细报道。本项目以杜泊肉羊为对象,研究胚胎卵裂快慢与其发育潜能的关系以及对移植怀孕率的影响。
人类卵母细胞体外受精首次卵裂时间被认为是胚胎发育潜力的非损伤性标记,用以识别优质胚胎。Edwards等[17]和Van等[18]在人类辅助生殖过程中发现,早(快)卵裂胚胎具有高质量的发育潜能,优先用作辅助生殖移植胚胎。现在人们普遍认为,早卵裂是人类、猪和牛胚胎发育能力的重要标志事件[6,19-22],可用于优质胚胎的选择。
通常在受精后的24、36 和 48 h 3个时间节点段观察卵裂情况,判断首次卵裂时间。不同物种合子卵裂时间范围是有差异的。比如人类合子首次卵裂时间范围在22~30 hpi[23-24],大部分集中在24 hpi[24];牛合子首次卵裂时间范围在22~48 hpi,在36 hpi 时2细胞期胚胎达到高峰[19,25];绵羊胚胎合子卵裂时间在18~36 hpi[9],本研究结果显示,受精24 h即卵裂的胚胎所占比例显著高于24 h以后组。本研究中卵裂快胚胎的囊胚发育率极显著高于卵裂慢胚,与Fryc等[9]认为早卵裂比晚卵裂受精卵更容易发育到囊胚期的研究结论一致;Matsuura等[26]在对牛的体外胚胎研究中发现胚胎内的细胞数与其体外发育能力成正比,本研究也发现卵裂快胚胎发育得到的囊胚内细胞数最多,且内细胞团紧密。
根据胚胎发育的不同时期,在受体生殖道中移植的位置也有所不同。通常2~8细胞胚胎进行输卵管移植,而桑椹胚和囊胚则是子宫角移植。移植人受精2~3 d(卵裂期)的胚胎与4~5 d(桑葚胚/囊胚)的胚胎妊娠率在统计学上并没有显著差异[27-28],但从早期胚胎培养至囊胚,可移植的胚胎数量则显著减少[29]。绵羊每个受体移植3~4枚IVP早期卵裂胚受胎率可达50%~80%[29-30]。郭延华等[31]移植单枚优质早期卵裂胚怀孕率可达43%~58%,双枚优质胚怀孕率为53%。绵羊体内胚胎2细胞、4~8细胞胚胎及囊胚分别移植受体,2细胞胚胎移植怀孕率为42%,而4~8细胞期移植怀孕率高达67%,与囊胚移植受胎率(70%)差异不显著(P>0.05)[30,32]。假定2细胞胚胎和4~8细胞胚胎体内受精时间大致相同,但冲出体外时胚胎发育时期不同,推测2细胞胚胎属于慢卵裂胚,而4~8细胞期胚胎即快卵裂胚,所以2细胞胚胎移植后的怀孕率显著低于4~8细胞期胚胎。这与本研究中绵羊体外胚胎的移植怀孕率结果一致,即移植卵裂快的早期胚胎怀孕率高于卵裂慢的早期胚胎,而同样本研究中囊胚移植怀孕率虽略高于快卵裂胚,但统计学上差异不显著。
本研究发现移植单枚或双枚卵裂快的胚胎怀孕率差异不显著,而移植单枚卵裂慢的胚胎怀孕率显著低于双胚移植。前期本项目组未对胚胎卵裂快慢进行研究,在受精48 h时进行移植,单枚早期胚胎的受胎率显著低于双胚移植,可能与卵裂较慢胚胎占比较高有关[10]。表明移植胚胎的质量是影响怀孕率的主要因素,而移植胚胎的数量只对质量较差的慢卵裂胚的怀孕率产生影响。快卵裂早期胚胎占总卵裂胚胎的比例超过70%,且卵裂的时间较集中,如果遵循越早进入体内越有利于胚胎发育着床的原则,则需要多台手术同时移植,意味着需要更多熟练手术操作的人员投入。因此本研究探究了快卵裂早期胚胎在不同时间移植对怀孕率的影响,发现在24或48 hpi移植,怀孕率结果差异不显著,那么对应受体移植的时间窗口就可以设置在24~48 hpi,增加了移植手术安排和操作的灵活性和方便性。因此,合理地移植早期卵裂胚可显著提高体外胚胎利用效率。
胚胎形态学质量评分也可能影响移植受胎率。有研究发现A级桑葚胚单枚移植怀孕率显著低于双枚移植; B级桑葚胚单枚移植怀孕率低于双枚移植,而且A级胚怀孕率显著高于B级胚[32-33]。本研究对快卵裂胚培养至48 h时进行形态分级并分别移植受体,但怀孕率差异并不显著。这表明快卵裂早期胚胎形态学质量评定对胚胎移植的指导意义不大,无法从形态上准确区分早期胚胎的质量。
囊胚移植具有较高的怀孕率。移植绵羊双枚体内生产的囊胚,怀孕率达70%~90%, 产羔率为59%~67%[34-35]。双枚或多枚体外绵羊囊胚移植怀孕率也有47%~70%[30,36-38]。本研究中体外生产囊胚单、双胚移植的怀孕率为69.33%和70.46%,无显著差异。因此,建议体外生产囊胚多采用单胚移植。另外,体外生产绵羊囊胚与卵裂快早期胚胎的移植怀孕率也无显著差异,均达到65%左右,已知体外胚胎生产中囊胚发育率通常在40%~60%,说明可用于移植的囊胚数量相较于可移植的早期胚胎数量减少了近半数,因此,移植早期快卵裂胚不仅可以将移植时间提前,缩短胚胎移植实验安排的整体时间,提高时效性;还可以增加可用于移植的胚胎数量,提高胚胎利用率。
4 结 论
绵羊体外胚胎生产后,应分别在受精后24和36 h挑选卵裂的早期胚胎并分开培养。受精24 hpi以内卵裂卵裂的胚胎以单枚移植为主,超过24 hpi 卵裂的胚胎以移植双枚为主。并且早期快卵裂胚胎无需对胚胎质量进行鉴定,随机移植即可。囊胚移植应以单枚移植为主。该移植方案能有效提高绵羊体外胚胎的利用率。

