食品胶体研究进展与未来趋势:组分互作、未来食品结构设计及胶体营养学视角
方亚鹏,赵一果,孙翠霞,厉晓杨,鲁 伟
(上海交通大学农业与生物学院,上海 200240)
食品为典型的多分散相复杂体系,普遍含有蛋白质、碳水化合物、脂类等生物大分子及其相互作用所形成的多尺度微纳米结构。如天然牛乳中的酪蛋白胶束及脂肪颗粒、传统食疗汤中的功能性多糖和蛋白颗粒、奶酪中的酪蛋白凝胶等。通常广义地将这些食品生物大分子及其所形成的超分子构造定义为食品胶体,它们不仅提供人体生命活动所必需的营养元素,也是食品结构的骨架。食品胶体分子之间通过共价/非共价键相互作用,形成具有特定三维网络的功能性结构,在食品的增稠与赋型、加工过程稳定性及质构维持方面发挥重要作用。此外,这些食品胶体还可与食品中的矿物离子、风味分子、营养素等小分子物质发生相互作用,继而影响食品营养组分的消化与吸收以及食品的风味与口感。因此,食品胶体在维持食品结构稳态化、食品结构设计及营养特性调控方面扮演着重要角色。
近年来,在全球倡导人口、环境与能源可持续发展的新格局下,如何制造更符合人类营养与健康需求的未来食品仍面临巨大挑战。食品胶体作为食品结构骨架,将如何继续在未来食品结构设计中扮演不可或缺的角色,也值得深入思考。本文将从食品胶体组分互作、未来食品结构设计、食品胶体与细胞互作及体内代谢与安全角度,阐述食品胶体相关最新研究进展,以期为食品胶体与未来食品的创新研究与开发提供新思路。
1 食品胶体组分互作
1.1 蛋白与多糖互作
蛋白质和多糖共同存在于许多食品体系中,这两种食品大分子通过增稠、凝胶化行为及特殊的表面性质,在保持食品的结构、质地和稳定性方面发挥重要作用。深入了解蛋白与多糖的互作机理对于建立食品结构稳态化及提升食品品质调控技术具有重要意义。
蛋白与多糖的混合溶液一般会出现两种现象,即分离型相分离和结合型相分离(图1A)。前者两种大分子各成一相,不发生相互作用,故本文主要讨论后者。蛋白与多糖结合型相分离也称复合凝聚,该过程中多糖与蛋白之间的相互作用力主要表现为静电、氢键及疏水相互作用,其中以静电作用力占主导地位。蛋白与多糖发生静电络合的关键在于两者需带有不同电荷,可通过调节环境的pH值来实现。例如,当环境pH值低于蛋白等电点时,蛋白分子整体呈现正电状态,而多糖一般在较为宽的pH值范围内都呈现负电状态,此时两者可通过静电吸引力发生络合。蛋白与多糖的静电络合方式,在学术界一直存在争议。最早有Kantor于1995年提出的“珍珠项链”模型假说。该假说认为均匀带电的聚两性电解质(聚合物)分子在溶液中会伸展为(珍珠)项链状。当带电不均匀时,则呈现无序项链状结构。在这种“珍珠项链”结构中,链的一部分坍缩成紧凑的珠子,并由柔性链连接起来。将该假说用于解释蛋白与多糖静电络合机理,即具有球形结构的蛋白分子通过静电作用吸附到呈现不规则链状结构的多糖分子上,形成类似“珍珠项链结构”的静电络合物。
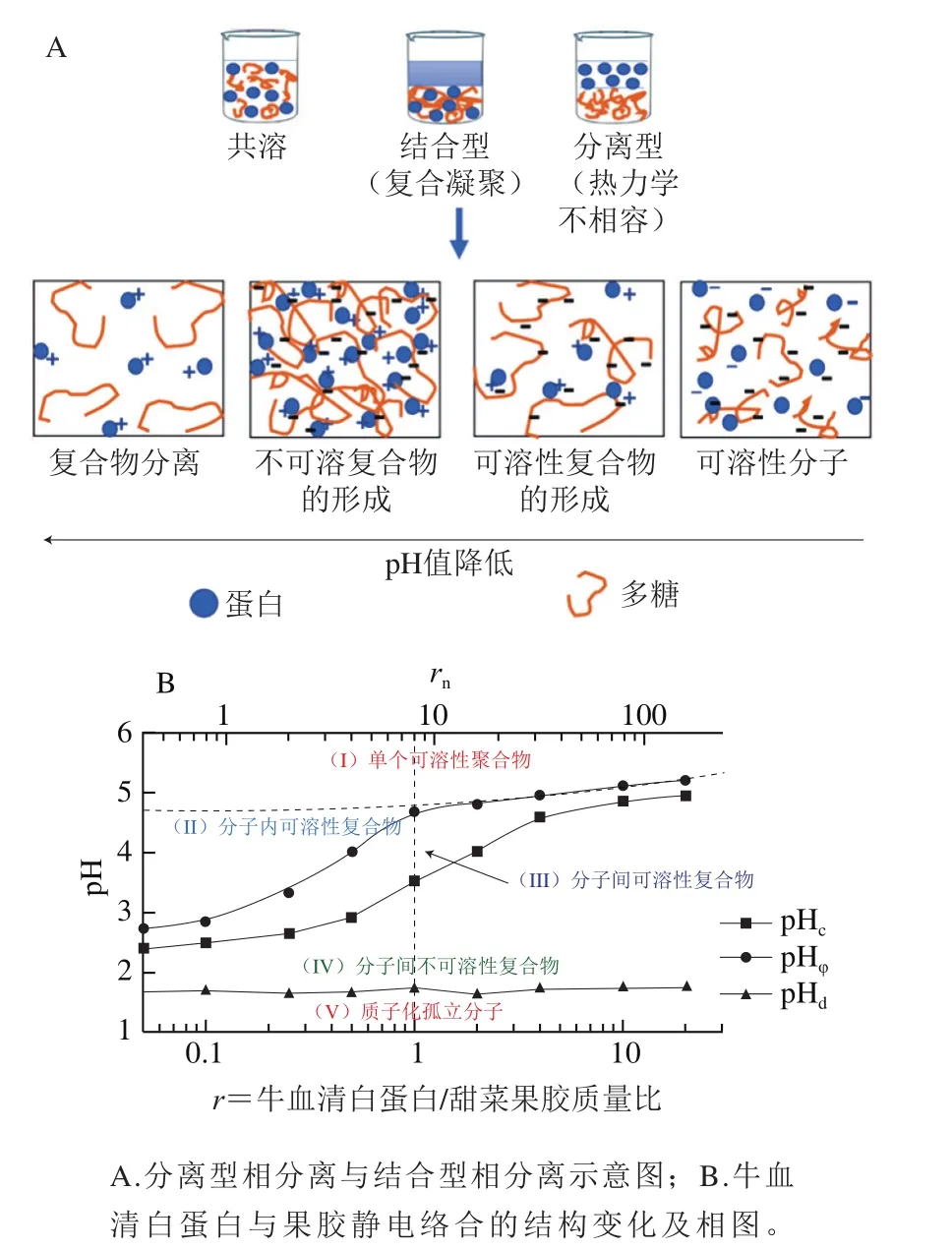
图1 蛋白质与多糖相互作用[8]Fig. 1 Interaction of protein with polysaccharide[8]
在后续开展的针对蛋白与多糖静电络合机理的探究中,研究人员绘制了蛋白与多糖静电络合的完整相图,提出了动态静电络合机理,并确立了蛋白与多糖静电络合的5 个关键相区(图1B),即(I)孤立分子、(II)分子内络合物、(III)分子间络合物、(IV)不溶性络合物、(V)质子化孤立分子。该发现进一步完善了“珍珠项链”模型,使其从单一的静态络合发展为互为关联的动态络合模型,从基础研究角度,加深了对蛋白与多糖络合机理的理解。该研究团队进一步的研究发现,蛋白与多糖静电络合的分子内络合物,与单纯的蛋白或多糖相比,其界面活性大大提升,显示出更强的乳化活性,提示可通过控制蛋白与多糖络合物动态结构,实现蛋白或多糖界面活性的显著提升,以用于稳定食品乳化体系,替代具有潜在健康风险的合成小分子界面活性剂。此外,这类蛋白与多糖复合物还可用于提升不饱和脂肪酸、油脂体、功能性蛋白纳米颗粒、低胆固醇蛋黄酱等不同食品分散体系的稳定性,在维持食品稳态化方面具有巨大潜力。
1.2 蛋白与脂质互作
蛋白与脂质的互作,主要体现在食品脂质分散体系(乳液)的制备及稳定过程。蛋白质为两亲性表面活性分子,分子中的疏水基团(如非极性基团、硫醇基等)可与乳液油相中的脂质分子发生疏水相互作用,快速吸附在油-水-蛋白混合物均质后产生的油滴表面,通过降低界面张力促进液滴进一步破碎,并通过在油滴周围形成保护膜来延缓油滴的聚结,因此常被用作油/水乳液的乳化剂。此外,蛋白质在油滴之间产生排斥作用(如空间位阻、静电作用),并形成抗破裂的界面膜的能力,也在长期贮存中稳定油滴防止絮凝和聚结方面发挥了重要作用。
最早也是最常被用作食品乳化剂的蛋白为牛奶来源的酪蛋白和乳清蛋白(图2A)。两者因来源广泛、营养价值高且兼具很好的界面活性等优点,被广泛用于各类食品乳液体系。此外,也有研究者利用鱼肉蛋白及其水解物稳定乳液。其中最为常见的是用鱼明胶作为稳定剂的油/水乳液。除动物源蛋白,近年来更多植物来源的蛋白也被证实具有很好的界面活性,为纯绿色、天然乳化剂提供了更为丰富的来源。这其中包括豆类蛋白(大豆、豌豆、羽扇豆)、玉米胚蛋白、大米蛋白等。与动物蛋白相比,这些植物蛋白被认为对人体健康更有利,也能更好地满足素食主义者的饮食习惯,正在被广泛用于各类含有食品乳液的食品。除单纯蛋白分子外,蛋白分子自组装形成的纳米颗粒也常被用于稳定皮克林乳液,如乳清蛋白微凝胶颗粒(图2B)、玉米醇溶蛋白颗粒、明胶颗粒、大豆蛋白颗粒等。
基于蛋白与脂质互作形成的乳液结构,往往受环境因素影响较大。因为蛋白分子结构和性质会随着环境的pH值、盐离子浓度、温度等的变化而发生改变,干扰其与油相中脂质分子的疏水相互作用,并最终引起乳液失稳。例如,高温会引起球形蛋白分子变性(空间结构去折叠)并导致疏水基团暴露,引起同一油滴表面或相邻油滴表面蛋白分子聚焦,继而导致乳滴发生絮凝或合并,从而影响乳液稳定性。除高温外,过高或过低的pH值或盐离子环境同样会破坏蛋白乳液的结构与稳定性。
1.3 多糖与矿物离子互作
矿物离子(Ca、Fe、Na、K等)是人体必需的营养元素,也是食品中的重要组分。食品胶体,如海藻酸钠、果胶、卡拉胶等,可与矿物离子发生相互作用从而改变食品体系的黏度、流变特性及质构特性。因此,明确这些以多糖类为代表的食品胶体与金属矿物离子间的互作规律,对于了解食品结构的稳定机制、功能性食品结构设计及食品包装材料开发等具有重要意义。
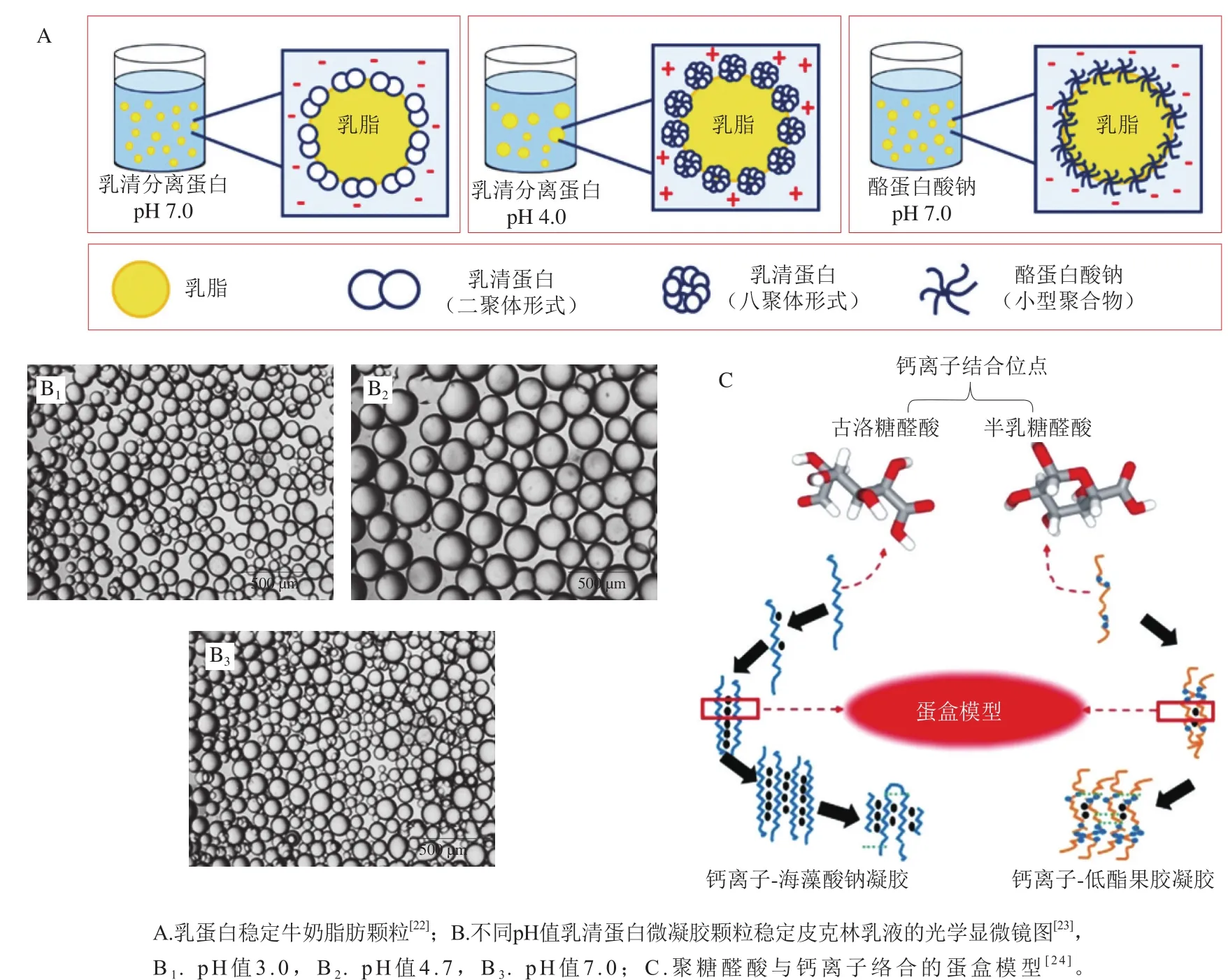
图2 蛋白与脂质相互作用及多糖与离子相互作用示意图Fig. 2 Schematic illustrations of protein-lipid interaction and polysaccharide-ion interaction
食品体系中最具代表性的多糖-离子互作即为海藻酸钠与二价钙离子(Ca)的特异性静电络合,其作用机理为“蛋盒模型”(图2C)。该模型描述了两条反向平行的聚糖醛酸分子链首先与游离Ca络合形成蛋盒状二聚体,该二聚体又在游离Ca作用下进一步横向聚集为多聚体并最终形成凝胶的过程。该模型最早由Grant教授在1973年提出,在这之后的近半个世纪里,“蛋盒模型”历经多次修正与完善,逐步形成了聚糖醛酸类多糖与二价离子络合的经典理论模型。例如,研究人员发现聚糖醛酸类多糖与钙离子络合经历单络合物、二聚体、多聚体3 个连续步骤,且二聚体的形成具有全-无临界协同性,是一个多步骤且存在临界行为的过程。进一步的研究发现,海藻酸钠与Ca的络合呈现“临界拉链生长”模式,而果胶与Ca的络合却表现为“渐进点式生长”模式,从机理上确认了两者的差异。此外,研究人员发现卡拉胶、阿拉伯胶等多糖与三价金属离子(Fe、Al等)的特异性络合机理,除包括与“蛋盒模型”相似的配位作用外,还涉及熵增驱动的离子脱水缩合作用。
1.4 食品胶体与功能物质互作
食品胶体还可与多类食品功能因子发生相互作用,如多酚、黄酮、皂苷、萜烯、不饱和脂肪酸等。这种相互作用可被用于设计多尺度、多功能食品微纳米构造,用于提升食品胶体的功能特性以及功能因子的稳定性和消化吸收特性。例如,蛋白与多酚的相互作用可形成不同性质的纳米复合物,显著提升了蛋白的乳化性、凝胶性、抗氧化性,并同时改善了多酚的化学稳定性和生物可利用率,可被广泛用于改善食品质构与营养特性;多糖也可与多酚之间发生相互作用,而且这种互作可显著影响多糖的营养与功能特性,包括结肠发酵及益生元功能、含有多糖类食品的质构与稳定性、多糖微胶囊包埋效率及所含活性组分的氧化稳定性等;此外,食品胶体还可与食品中的色素、风味物质、维生素、脂肪酸及植物化合物等发生相互作用,继而显著改变食品的感官、功能和营养特性,例如饮料中的阿拉伯胶可破坏偶氮类着色剂稳定性并引起沉淀;与之相反,海藻酸钠和果胶可增强果冻类食品中花色素苷的稳定性;-乳球蛋白和酪蛋白可与疏水性的omega-3多不饱和脂肪酸及VD发生相互作用形成纳米颗粒,可作为天然的脂溶性功能因子纳米载体;利用常见的食品油/水乳液胶体结构,可实现脂溶性风味物质的高效包埋并显著抑制其在空气中的快速挥发。而且通过乳液油相、油/水界面及水相结构设计,可显著改变风味物质的释放规律,从而实现食品风味的长久保持与个性化调控;除此之外,其他食品胶体类生物大分子,也可与食品基质中的单糖、盐离子、草莓香精等风味物质相互作用,并改变其释放规律及最终的食品感官特性。
除小分子物质外,食品胶体还可与益生菌发生相互作用,并被用于提升益生菌的环境(如胃肠道消化环境、贮存环境等)耐受性。这种相互作用主要发生在利用食品胶体实现益生菌微胶囊化包埋的过程中。目前,用于益生菌微胶囊包埋的方法包括喷雾干燥、冷冻干燥、挤压、乳化、凝聚、静电纺丝和静电喷涂等。其中,最为常用的为喷雾干燥法及冷冻干燥法。挤压法、乳化法及复合凝聚法均可实现益生菌的有效包埋,但相关技术大多还处于实验室研究阶段,离工业化尚有一定距离。静电纺丝及静电喷涂法是制备多尺度纤维及颗粒的有效方法,也可用于包埋益生菌,但面临与挤压、乳化及复合凝聚法等同样的问题,生产规模难以放大,工业化前景不明朗。在这些益生菌的微胶囊化技术中,食品胶体分子通常作为微胶囊壁材,如海藻糖、魔芋糖、阿拉伯胶、酪蛋白、乳清蛋白、大豆蛋白等。这些食品胶体可通过防止益生菌膜损伤、保持细胞膜完整性、与膜蛋白互作并形成纽带、在雾化过程中降低益生菌的流动性、促进玻璃态形成、控制水分含量和颗粒大小等机制,保护益生菌免受环境因素损伤。例如,有研究报道,内源乳化/凝胶法制备的海藻酸钠微胶囊,可通过形成多糖-蛋白质-益生菌三元静电复合结构,显著提高乳酸菌在喷雾干燥和贮藏过程中的稳定性,且包埋乳酸菌微胶囊对胃肠道消化酶的耐受性与微胶囊凝胶网络结构的机械强度呈现正相关。
2 食品胶体与未来食品结构设计
2.1 人造肉
随着人口的快速增长,全球肉制品消耗量逐年攀升。到2050年,全球人口数量预计增至90亿,肉类制品总消耗预计超过3 000亿 美元。为满足人类对肉品需求的不断增长并缓解肉品生产对全球生态、环境、气候、能源带来的巨大压力,人造肉制品正成为今后很长一段时期内未来食品发展的引导与驱动。当前人造肉的制造主要有两条技术路线,即细胞培养肉和植物基人造肉。
2.1.1 细胞培育肉
细胞培育肉利用动物细胞组织培养的方法,通过肌肉组织干细胞或肌卫星细胞的增殖、分化、融合形成一整块的人造肉(图3A)。生物支架材料是细胞培育肉的关键组成部分,作为一个完整的支持网络,细胞在其上以锚定依赖的方式扩展和分化。同时,这种具多孔网络结构的支架材料,可允许氧气和营养物质流动和废物清除,以维持细胞代谢功能,避免坏死核心的形成。
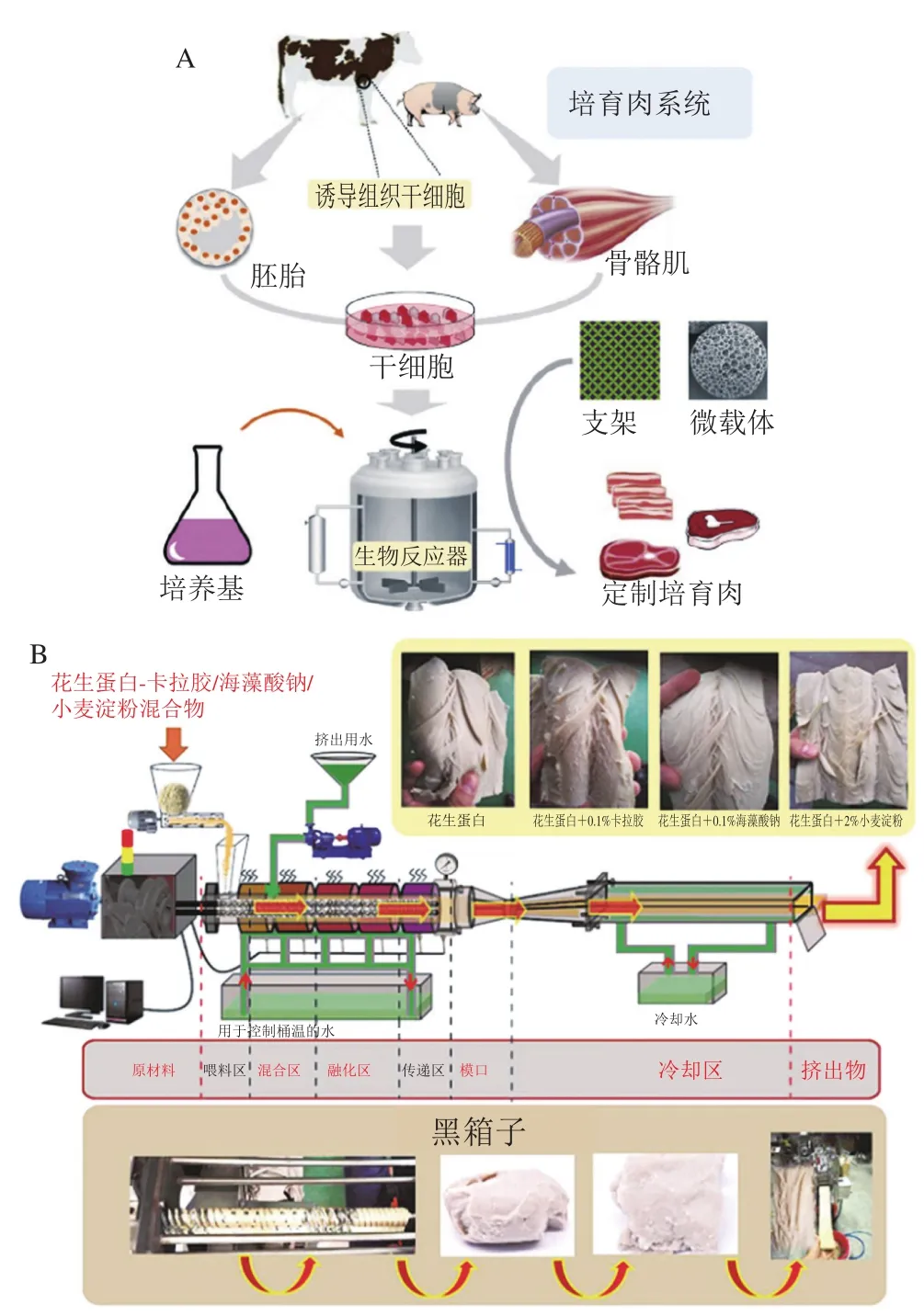
图3 细胞培养法(A)[43]和植物基(花生蛋白)高水分挤出法(B)[44]制备人造肉过程Fig. 3 Preparation of artificial meat by two different methods: tissue culture (A)[43] and high moisture extrusion (B)[44]
作为细胞培育肉的一部分,支架材料的选择通常有特殊的要求,比如它首先必须是安全可食用的(熟的或生的),而且最好食用时具有理想的味道、质构及营养品质。此外,热稳定性也很重要,防止其在烹饪过程结构塌陷。支架材料的来源需广泛、经济、易于大规模生产。基于这些要求,食品胶体在细胞培育肉支架材料方面具有显而易见的优势。基于食品胶体的智能型3D肌肉细胞培育骨架也被广泛研究,包括大豆蛋白、鱼明胶微球、小麦蛋白、豌豆蛋白/大豆蛋白/海藻酸钠等。还有研究人员开发了一款性质可控、多孔结构、高机械强度,且不含酵母的“苏打面包”支架材料(图4A)。该“苏打面包”可与成纤维细胞、成肌细胞和前成骨细胞共培养数周后保持稳定,且3 种细胞都能在“苏打面包”提供的三维支架中增殖、沉积细胞外基质,并同时表现出低应激反应和高生存能力(图4B)。更为重要的是,成肌细胞也能够在该支架上分化为肌管,这是骨骼肌组织培养所需的关键步骤。该技术为低成本、高通量细胞培育肉支架开发提供了全新思路。

图4 基于“苏打面包”的细胞培育肉支架材料[49]Fig. 4 Soda bread-based scaffold materials for cultured meat[49]
虽然,细胞培育肉技术的研究在不断深入和完善,但在迈向工业化的道路上也存在诸多挑战。首先,需突破当前肌肉细胞培养过程大量使用血清培养基的技术瓶颈,实现细胞培育肉制造的低成本、低碳及避免监管障碍(美国和欧洲正在同时建立针对细胞培育肉的监管途径和相关条件)。其次,如何逐步降低消费者对细胞培育肉伦理方面的担忧,提高培育肉在公众中的接受度,也是细胞培育肉面临的挑战之一。此外,在实现支架材料与细胞有机相容、肌肉细胞体外培养与规模化增殖以及培育肉后期人为“训练”使其具有类似真实肌肉质感等过程中所涉及的系列基础科学问题也有待进一步阐明。
2.1.2 高湿挤出植物基人造肉
人造肉制造的另一技术路线为植物基人造肉,主要涉及将植物来源的蛋白、多糖(淀粉)及脂质等食品胶体组分,利用挤出、水凝胶结构设计等技术,加工或搭建在外形、色泽、质构、口感等方面接近动物肉的仿肉制品,是目前人造肉制造最具工业化前景的技术路线。
利用挤出技术制造人造肉虽已被研究多年,但对挤出产品的工艺控制和结构设计仍停留在依靠经验阶段。基于大豆拉丝蛋白及低湿挤出的各类素食产品,可视为第一代植物基人造肉产品。但其组织化度低,整体口感距真实动物肉较远。近年来兴起的高湿挤出技术,可实现挤出物组织化度、机械强度、质构等指标的显著提升,使其更接近真实动物肉,正成为未来植物基人造肉最具竞争力的制造技术之一。然而,以目前的研究水平,高湿挤出过程仍是一个“黑箱”,挤出过程蛋白纤维结构的形成过程及其分子机制尚不明确,难以实现挤出物品质的有效调控,缺乏受消费者欢迎的高质量植物基人造肉产品。针对这一现状,有研究人员以花生拉丝蛋白为原料,通过控制挤出过程温度-物料水分、温度-剪切方式及物料水分-剪切方式构成的能力输入方式及大小,尝试从多个尺度揭示高湿挤出过程蛋白纤维结构的形成及分子机制,并确定关键挤出控制区段(图3B)。结果表明,剪切方式、挤压温度及物料水分可显著影响挤出物的蛋白纤维结构、色度及机械性能(拉伸特性、弹性、硬度)。
研究发现,转谷氨酰胺酶的引入可通过促进蛋白分子链的展开、聚焦和交联等方式,促进花生蛋白纤维的形成;卡拉胶(质量分数0.1%)、海藻酸钠(质量分数0.1%)、小麦淀粉(质量分数0%~8.0%)等食品胶体结构助剂的引入,可显著改变挤出物的组织化度、机械性能与质构;此外,研究人员发现,小麦淀粉(质量分数2%)的添加,可降低花生蛋白在挤压过程中的热转变速率,促进分子内二硫键断裂和蛋白分子聚集,增强疏水相互作用和蛋白-脂质相互作用,稳定新形成的蛋白构象。食品胶体助剂的引入还可促使-螺旋结构发生解螺旋,逐渐转化为-转角结构和无规卷曲结构。在针对花生蛋白、大豆蛋白、谷朊粉复配挤出的实验中,研究人员发现,物料中蛋白类型和比例对单位机械能耗、模块温度、模口压力等响应参数有显著影响。
综上所述,食品胶体的选择对于高湿挤出至关重要。以蛋白为主料,适当添加一定比例的胶体结构助剂,如卡拉胶、淀粉、海藻酸钠等,可提升挤出物的组织化度和整体质构。蛋白主料可以是单一蛋白,也可以使用多种蛋白复配。最为常用的蛋白主料为大豆蛋白、豌豆蛋白。除此之外,作者所在实验室团队正在研究可直接用于高湿挤出的杂豆类植物蛋白及微生物源多糖(可得然胶)(数据未发表)。此外,高湿挤出人造肉过程涉及的分子间互作及其对挤出物品质的影响规律、挤出过程物理化学反应与挤出物结构性质之间的相互关联等重要科学问题,还有待进一步研究。
2.1.3 水凝胶结构设计制备人造肉
除挤出技术以外,静电纺丝、定向冷冻、定向拉伸、双网络凝胶等胶体结构设计技术也可应用于植物基人造肉的制造,通过模拟真实肉的多级各向异性结构特征,提高人造肉的质构仿真度。
北海道大学的龚剑萍教授团队利用定向拉伸结合空气干燥的方法,通过在水凝胶长度方向上建立足够的拉伸力,使聚合物链对齐并自发形成纤维结构,成功制备了具有特定取向、多尺度纤维结构的食品级水凝胶(图5A),可进一步用于人造肉制造。加州大学洛杉矶分校贺曦敏教授团队开发了一种定向冷冻辅助盐析策略,来合成具有多尺度、分级结构的超高强度聚乙烯醇水凝胶(图5B)。所制备的水凝胶具有高度的各向异性,包括微米级的蜂窝状孔壁和相互连接的纳米纤维网络,表现出超强的机械性能(甚至超过天然肌腱)。虽然该水凝胶不是食品级,但其制备方法(定向冷冻辅助盐析)却值得借鉴,有望用于制备机械性能、各向异性取向接近肌肉的食品级水凝胶。

图5 各向异性水凝胶结构制备方法Fig. 5 Fabrication strategies for hydrogels with anisotropic structure
受这些研究思路启发,作者团队研制发明了食品水凝胶拉伸设备,通过调控定向拉伸应力和应变,构建出具有良好机械强度的各向异性食品水凝胶,可用于真实肉制品(如牛肉干)的仿生制造(数据未发表)。该设备还可用于风干牛肉的加工,不仅可大幅缩短风干时间,还能显著改善最终牛肉干的外形和质构,具有较好的市场应用前景。此外,作者团队还将多糖/蛋白双网络凝胶技术引入仿生食品结构模拟,通过调控双网络凝胶中刚性和柔性分子比例及交联密度,实现了凝胶机械强度和质构的明显提升,并成功制备出人造牛蹄筋、人造牛肚等高咀嚼性产品,为仿生食品制造提供崭新思路(数据未发表)。
2.2 基于食品胶体的低盐/低糖/低脂食品设计
随着“2030健康中国”国家战略的实施与推进,国家卫健委于2016年便倡导“三减三健”的健康生活理念,其中的“三减”指的便是减盐、减糖、减脂。虽然,消费者对更为健康的“三减”类食品需求在逐年上升,但“三减”食品制造技术大多还停留在实验室阶段。如何突破这些健康食品制造背后的技术瓶颈,成为食品工业界及学术界的研究热点。
2.2.1 食品胶体减盐技术
世界医学权威杂志《柳叶刀》近期刊文报道,高盐饮食诱发的高血压、中风等疾病引起的死亡人数已超越癌症,成为当今导致我国居民死亡的主要因素。我国人均盐摄入量为10~12 g/d,远高于世界卫生组织(World Health Organization,WHO)推荐的约5 g/d。减盐已成为目前我国食品工业亟待解决的重大问题。当前食品减盐策略主要包括通过设计食物结构优化钠释放、使用咸味促进剂、使用替代盐及体内调控钠排泄与吸收等。这其中,食品胶体扮演着重要角色,基于食品胶体的减盐技术也被广泛研究。
食品胶体减盐技术的关键是如何利用食品胶体进行食品结构设计,控制盐的释放,提高咸味感知以减少盐的摄入,实现食品的“减盐不减咸”。研究人员从调节食品基质结构与组成增强钠释放、控制食品胶体加工性能加快钠传递、加快界面失稳增强咸味感知、多种风味协调增强咸味感知等角度,研究基于食品胶体的减盐技术,并取得了一定进展。例如,通过增加凝胶基质的孔隙率增加浆液释放,使得凝胶变形过程钠释放量增加,从而增强咸味;或者在含有脂肪的凝胶体系中,通过降低脂肪颗粒尺寸,增加钠释放;或通过控制食品凝胶网络结构,形成水相中钠的不均匀分布,从而增强咸味感知等。然而,当前这些基于食品胶体的减盐策略都具有一定的局限性,或受限于某种特定的食品基质,或受限于适用范围(固体或液态食品体系),或引入其他呈味物质破坏食品原有风味等,缺少一种普适性的减盐策略。
作者团队基于天然多糖与矿物离子互作的研究积累,巧妙利用天然海藻多糖卡拉胶与钾离子的特异性结合,成功开发了一种无苦味、低钠、高钾健康固体盐。通过在氯化钠与氯化钾混合体系中引入卡拉胶,成功掩盖了氯化钾的金属苦涩味且不影响整体咸味,突破了氯化钾替代盐苦味难掩盖且替代比例低的技术瓶颈,最高可实现50%减盐效果(图6A)。小鼠喂养实验结果显示,基于该技术制备的低钠盐可显著降低小鼠钠吸收,增加钾吸收,并同时抑制高盐饮食引起的钙流失。此外,该低钠盐还可以显著降低高盐饮食引起的大鼠收缩压及舒张压的升高,降低高血压风险。研究团队发现,该低钠盐在火腿、腌鱼、薯条、奶油蘑菇汤、鸡汤及面条等代表性模型食品中的使用,可显著改善食品质构,降低食品盐含量,且不破坏食品风味,整体接受度高,有望开发为普适性的食品减盐新策略。
2.2.2 食品胶体降糖技术
高糖饮食容易诱发糖尿病等慢性疾病,严重威胁人类健康。饮食治疗是糖尿病主要的辅助治疗手段。在低糖食品开发过程中,血糖生成指数(glycemic index,GI)为重要评判指标。通常GI低于55的食品被称为低GI食品。低GI食品的开发主要有两条技术路线:1)改变食品中碳水化合物的含量;2)控制食品中碳水化合物的分解速度。前者可通过各种不同来源的淀粉或食用胶进行复配来实现,比如在小麦面粉中引入低糖高纤维的苦荞、荞麦、燕麦、魔芋粉等,用于生产低GI面条;对于低GI食品的基础研究主要集中在如何控制食品中碳水化合物的分解速度方面。这其中最具代表性的策略为构建仿生淀粉/蛋白核壳结构,即在淀粉颗粒表面吸附一层疏水蛋白的外衣,使整个淀粉颗粒在经过胃肠道消化时,保持较低的淀粉消化水解速率,从而实现含碳水化合物食品的低GI值。例如,作者团队基于玉米醇溶蛋白难消化的特点,采用玉米醇溶蛋白作为淀粉颗粒的消化屏障,在静电、疏水等非共价相互作用的协同驱动下,构建的仿生蛋白质-淀粉壳核结构(图6B)可显著降低淀粉的体外消化速率,用该核壳结构的淀粉喂食的正常及糖尿病老鼠,其血糖水平显著低于正常淀粉对照组(数据未发表)。该技术有望开发成为新一代的食品降糖技术。
除此之外,通过物理、化学、生物酶等方法,对淀粉或食品原料进行改性,提高低GI的抗性淀粉(resistant starch,RS)和慢消化淀粉(slowly digestible starch,SDS)含量,也是有效控制糖吸收并维持血糖平衡的有效方法。除单一使用物理或化学或酶法改性外,还可两种或两种以上的方法联用,利用不同方法间协调增效的作用,提高RS和SDS的产率。例如,超声波-湿热处理并结合酸水解法制备RS,得率可达40.7%,且所得RS具有含水率低、易贮存、结构致密、热稳定性好等优点。也有研究利用微波协同湿热、微波协同柠檬酸湿热、有机酸与湿热法联用制备玉米SDS和RS,与单一改性法相比,SDS与RS得率显著增加。
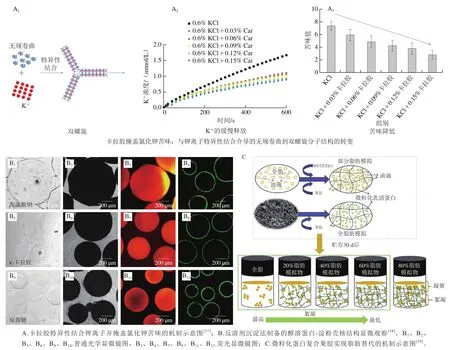
图6 基于食品胶体的减盐、减糖、减脂技术Fig. 6 Food colloids-based technologies for reducing salt, sugar and fat contents in foods
2.2.3 基于食品胶体的脂肪替代
高热量饮食对人体健康有诸多不利影响。除淀粉外,脂肪是另外一种主要的浓缩热量来源,因此如何通过设计食品结构减少脂肪摄入量,成为未来健康食品的重要研究方向之一。20世纪80年代,通过减少某些食品(如牛奶、乳品、肉制品等)中脂肪含量,在一定程度上实现了脂肪摄入量的减少,但对于大多数食品,在减少脂肪含量方面仍面临较大困难。因此,第二代食品减脂技术主要依赖基于脂肪替代物的食品配方设计及加工条件控制。
常见的脂肪替代物为蛋白质与碳水化合物。蛋白常被加工成直径在0.1~2.0 μm的微凝胶颗粒,用作脂肪替代物。这个尺寸范围的蛋白微凝胶不会有颗粒感,且蛋白热可逆凝胶在口腔温度下可快速熔化(例如明胶),产生一种奶油般光滑的口感,在不影响食品整体质构口感的前提下,显著降低了食品中的脂肪含量。除单纯蛋白微凝胶外,蛋白微凝胶与多糖的复合物也可用作脂肪替代。例如,乳清蛋白微凝胶与高酯化果胶复合物可通过抑制油滴絮凝、稳定果胶三维网络等机制,稳定低脂蛋黄酱体系(图6C)。除动物源蛋白外,很多植物蛋白也可用作脂肪替代物,如大豆蛋白。有证据表明大豆蛋白的添加可显著改善低脂猪肉的质构并降低蒸煮损失;大豆蛋白水解物与黄原胶的混合物(soy protein hydrolysates/xanthan gum,SPH/XG)可用于低脂冰淇淋的制备。研究发现使用质量分数50% SPH/XG替代脂肪制备的冰淇淋,具有与全脂冰淇淋相似的外观、味道和质地。然而,使用蛋白作为脂肪替代物也有某些局限性,例如蛋白能与食品体系中的某些风味物质发生相互作用,从而改变食品的整体风味。
碳水化合物是另外一类可用作脂肪替代物的生物大分子。与蛋白相比,可用作脂肪替代的碳水化合物种类要丰富得多,包括各种可消化天然淀粉/改性淀粉、不可消化的树胶/纤维素及其衍生物等,这其中可消化淀粉最为常用。可消化淀粉主要通过两种机制实现脂肪模拟:1)形成高水分含量的三维凝胶网络结构,模拟类似脂肪般的口感;2)在加热和冷却过程中形成与脂肪球大小(2~10 μm)相近的颗粒,提供类似脂肪的润滑口感。基于这两种机制,小麦、绿豆、玉米、红薯等来源的淀粉已被广泛应用于低脂食品制造,包括奶酪、香肠、酸奶、蛋黄酱和冷冻甜点等。该策略的潜在缺点是淀粉含有高能量,过量食用可能导致超重和糖尿病,未来基于RS的脂肪替代物研发有望解决这一问题。
除蛋白和淀粉外,多种不可消化的膳食纤维也可用作脂肪替代物,包括纤维素及其衍生物、菊粉和树胶(黄原胶、卡拉胶、刺槐豆胶、秋葵胶、刺梧桐树胶、果胶、魔芋胶、海藻酸钠等),用于低脂冰激凌、蛋黄酱、香肠、奶酪等产品开发。此外,联合使用多种脂肪替代物可弥补单一脂肪替代带来的不足。不同食品胶体的同时加入,可能会引起分子间的相互作用,产生更理想的功能特性,更好地维持食品原有的口感与质地,例如蛋白-多糖联用、多糖-多糖联用等。然而,在开发各种高效脂肪替代策略的同时,也要考虑两个问题:1)有些脂肪是维持人体生理功能与生长发育的重要物质基础,如胆固醇、不饱和脂肪酸等,是否有必要大幅度降低这些脂类的摄入,还需要进一步的研究;2)用于替代脂肪的某些不可消化食用胶或纤维类,对肠道菌群及人体健康的潜在影响尚未完全明确,还有待进一步验证。
2.3 老年/特殊医学用途配方食品
随着年龄的增长,人体生理上的变化会抑制肌肉和器官活动、唾液分泌以及味觉和香气的敏感性等,继而降低人的饮食能力。食品加工需考虑设计适合老年人的食品配方,特别是针对患有吞咽障碍的老年人,应确保食物的可安全吞咽性,不引起食物误吸(严重者可引起肺炎并致人死亡)。为防止误吸,食物在咽部流动时应以中等速度流动,不能太快也不能太慢,而且最好具有较低的黏附性和较好的润滑性。因此,老年食品的结构设计,应从流变学、胶体、摩擦学等方面综合考虑,使其食用时更为容易和舒适。
利用多糖改变加工食品质构是目前开发老年食品的最主要策略。以日本市场为例,加工类老年食品主要有半凝固(增稠或凝胶化)肠内营养食品、补水果冻、营养补充果冻等。此外,用于糊状食品的粉状速溶胶凝剂和吞咽困难增稠剂以膳食补充的方法,通过少量添加到现有食品中发挥作用。半固化肠内营养成分可降低肠内稀液营养成分经肠内管或经皮内镜下胃造口喂养的并发症风险。通过对多糖的选择和组合,可以改变半固化营养食品的黏度,以实现通过食管的平稳流动和控制喂养速度,以预防腹泻和反流。用于这种肠内半固态营养成分中的多糖主要有琼脂、果胶、卡拉胶和黄原胶等,目前这些多糖在日本的市场份额正在逐步增加。在补水果冻方面,研究人员尝试用多糖构建新的食品质构,不仅模仿真正水果的质构,而且模仿真正水果的外观。作为食物适口性的主要特征之一,外观可以增强人的食欲。有报道称,视觉食物识别对吞咽功能有影响。研究结果显示,当受试者看到具有正常外观的完整食品图片时,唾液分泌量比看到相应的模拟食品图片的分泌量要多。用多糖代替水果的另一个好处在于它可以控制热量和营养。此外,针对改善吞咽困难的食品增稠剂应具有不结块、黏度增加快、贮存后黏度稳定、在弱搅拌条件下适用于各种液体食品的特点。增稠剂还应该对液体食品提供更好的感官特性,包括黏连的质地和无异味。黄原胶满足这些要求,已取代改性淀粉,成为改善老年人吞咽困难的最理想食品质构改良剂。
除老年食品外,食品胶体在特殊医学用途配方食品(简称特医食品)中也有应用。特医食品是一种为了满足进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养素或膳食的特殊需要,专门加工配制而成的配方食品。特医食品适用人群包括婴幼儿、减肥人群、食物组分过敏人群、碳水化合物代谢异常人群(糖尿病患者)、乳糖不耐人群、运动员、老年人等。上文提到的预防老年人吞咽障碍食品即被视为一类特医食品。而食品胶体可通过调控食品的流变学特性,使食品的整体质构与流动性更好地满足吞咽障碍人群的特殊需求,继而在预防吞咽障碍食品开发中扮演重要角色。目前,已被用于吞咽障碍食品配方开发的食用胶体包括黄原胶、麦芽糊精、改性淀粉、改性纤维素、瓜尔豆胶、塔拉胶等。此外,海藻酸钠和卡拉胶被允许用于婴儿配方奶及婴儿或儿童特医食品配方,但对用量及婴儿年龄有限定。例如,海藻酸钠用量一般不超过1 g/L,且只能用于4 个月以上婴儿或更大龄婴幼儿及儿童。卡拉胶一般用于6 个月大及以上婴儿特医食品,用量需少于1 000 mg/L。目前,全球特医食品市场规模为560~640亿 元,2019年中国市场规模约60亿 元,且近年来呈现快速发展态势。因此,我国特医食品未来市场前景巨大。特医食品也是食品领域热门研究方向之一。然而,目前食品胶体在特医食品中应用的相关研究较少,针对食品胶体对特医食品功能特性影响规律的研究亟待深入开展。

表1 3D打印肉制品及其热加工前后外观对比[81]Table 1 3D printed meat products and their appearance before and after hot processing[81]
2.4 3D食品打印
增材制造也被广泛称为3D打印,是20世纪80年代诞生的一项革命性技术。因为具有产品无需组装、成本低、制造周期短和自定义产品形态等诸多优点,已成为制造业研究热点之一。3D打印在食品领域中的应用有许多优点,可更为便捷地创造出在成分、结构、质地和口味上更为多元化的食品,将在未来食品制造中发挥重要作用。
蛋白、淀粉/多糖、脂质等食品胶体是食品3D打印不可或缺的“墨水”原材料,在对挤出、恢复、沉积、后加工等3D打印各个阶段食品物性调控中扮演重要角色,已被用于蔬菜、水果、肉制品、巧克力、烘焙食品、面制品等各类食品的3D打印制造。以肉制品为例,增稠剂(如黄原胶和瓜尔豆胶)和胶凝剂(如谷氨酰胺转胺酶和海藻酸钠)用于在挤压过程中控制水分,并在沉积和后处理后保持形状。增稠剂增强膏体的黏度,便于初始和连续挤压,以及确保印刷结果的一致性。另一方面,胶凝剂有助于形成不同强度的黏弹性体系,有利于形状的保真度和稳定性(表1)。此外,对亲水胶体溶解度、耐热性和稳定性的了解有助于优化配方设计和打印工艺条件,确保3D打印食品具有所需的物理和质构属性。
食品胶体可增加含水量较高的蔬菜类“墨水”的黏稠度,从而赋予其较好的可打印性。同时,食品胶体的引入可稳定并显著改善3D打印蔬菜食品的质构及流变性能,使其适合吞咽困难人群。有研究显示,几乎不含有淀粉且水分质量分数高(约96%)的白菜,需要同时添加黄原胶和刺槐豆胶作为增稠剂。而含有一定量淀粉且水分质量分数略低(90%)的胡萝卜,则只需要添加质量分数0.3%的黄原胶。淀粉含量最高且含水量相对较低(质量分数80%)的豌豆,可在不添加任何食品胶体的条件下表现出良好的可打印性,且打印得到的蔬菜制品析水率最低(图7)。

图7 3D打印的蔬菜食品[82]Fig. 7 3D printed vegetables[82]
3D打印还可用于植物基人造肉的制造(表1)。有研究显示,乙基(羟乙基)纤维素(ethyl hydroxyethyl cellulose,EHEC)、改性淀粉、改性菊粉等多糖类大分子表面活性剂的加入,促进了大豆蛋白各向异性结构的形成,并改善了3D打印人造肉的纤维化程度(组织化度);而且分子链较为刚性的EHEC可降低挤出物与口腔之间的界面接触及摩擦系数,改善润滑性能,从而表现为口腔摩擦学性质的不同。此外,这些多糖通过改变3D打印人造肉的质构,赋予产品良好的动态感官特性,有望替代人造肉中的脂肪,生产基于3D打印的纤维状低脂植物肉。
3 食品胶体与细胞相互作用
很多食品胶体以颗粒形式存在于各种食品体系中,了解这些多尺度食品胶体颗粒(food colloidal particles,FCPs)的细胞吸收机制及胞内生物学效应是明确其安全性及功能性的关键。传统营养学研究认为,FCPs只有被消化降解为小分子物质后(如氨基酸、游离脂肪酸、单糖等),才能被机体吸收利用。然而,越来越多的证据表明,FCPs可潜在“逃脱”胃肠道的消化降解过程,并被肠上皮细胞直接吸收。阐明这些FCPs的细胞吸收机制及进入细胞后的转运代谢行为,对于明确食品纳米颗粒的安全性及生理功能进而在更深层次理解食品与人体的相互作用至关重要。因此,本部分内容将着重总结并讨论FCPs的肠黏层渗透、肠细胞吸收和体内转运代谢行为相关研究进展。同时,探讨天然或工程FCPs在体内的生物分布和安全性问题。旨在通过食品胶体视角来拓展并探索食物与身体之间相互作用,并将这些相关领域的研究定义为“胶体营养科学”,以引起更多研究者的兴趣和关注。
3.1 FCPs的黏膜层渗透
外源纳米颗粒想要靠近肠上皮细胞并被吸收,首先需穿过上皮细胞外面的一层黏液层。黏液层的黏液是一种由水(质量分数>95%)、黏蛋白(质量分数<5%)、无机盐(质量分数1%左右)、碳水化合物和脂质组成的具有黏弹性的黏性凝胶。黏液层可以被认为是胃肠道外部环境与内部环境之间的第一道屏障。
一般认为黏液穿透颗粒通常具备以下几个特点:1)合适的尺寸。颗粒尺寸是决定其扩散速率的重要因素。黏液由于其来源的不同,孔隙大小分布并不均匀。例如,狗胃部黏液平均空隙为4.2 μm,而小肠部黏膜空隙则在2.1~3.3 μm,且均呈现空隙的宽分布(1.0~14.5 μm)。对于大型哺乳动物猪来说,情况正好相反,猪胃部黏液平均空隙为(4.0±2.0)µm,低于猪十二指肠的(5.3±2.9)µm。一般来说,颗粒越小,就越容易穿透黏液。小于100 nm的颗粒可以有效地穿过黏液层,较大的颗粒(空隙>200 nm)则扩散受限。然而,直径为500 nm和200 nm的纳米颗粒如果被聚乙二醇(polyethylene glycol,PEG)包裹,也能有效地穿过黏液,说明颗粒的表面化学结构也显著影响其黏液扩散速率。2)带负电或电中性。黏液由带负电的糖蛋白组成,它可以与带正电的纳米颗粒相互作用,降低它们在黏液中的扩散速度。因此,带负电荷或中性电荷的粒子在黏液中的扩散系数明显高于带正电荷的粒子。3)亲水性。黏液可通过疏水相互作用与纳米颗粒发生相互作用,导致其黏液扩散系数低。因此,亲水表面是颗粒实现黏液层穿透的重要条件之一。4)较低的黏蛋白纤维黏附性。颗粒表面伸展的链状结构可与黏蛋白纤维互穿,从而阻碍了颗粒在黏液中的运动。与表面结构较为伸展的颗粒相比,具有收缩表面结构的颗粒更容易扩散通过黏液层。
FCPs与黏液层的相互作用已有报道。FCPs在颗粒尺寸、表面化学、亲/疏水性等方面存在多样性,因此其黏液扩散行为呈现不同的规律。壳聚糖包裹的脂质纳米颗粒,由于表面带正电,与带负电的黏液层发生静电吸引相互作用,继而呈现较强的黏膜层吸附特性,容易被“困在”黏液层而无法穿透。有研究发现,小麦醇溶蛋白多肽自组装形成的负电性纳米颗粒(undigestible gliadin peptide nanoparticles,UGPNs)(纳米颗粒直径()=(128.6±0.6)nm)可有效穿透由Caco-2/HT29-MTX单层细胞共培养分泌的黏液层,渗透指数()为5.7×10cm/s,显著高于已有报道的壳聚糖/海藻酸钠颗粒(<3.0×10cm/s),与-乳球蛋白多肽纳米球接近(为6.0×10cm/s)(图8A~C)。


图8 小麦醇溶蛋白肽自组装纳米颗粒和溶菌酶/淀粉微凝胶纳米颗粒的黏膜穿透[92-93]Fig. 8 Mucus layer penetration of wheat gliadin peptide nanoparticles and lysozyme/starch microgel nanoparticles[92-93]
此外,研究人员还发现UGPNs可显著抑制黏蛋白分泌继而降低黏液层厚度,提示纳米颗粒可潜在通过影响黏液层结构继而影响肠屏障功能。另外一项针对溶菌酶颗粒的间接体内和体内实验发现,荷载有槲皮素的溶菌酶纳米颗粒可穿透大鼠肠黏液层(图8D~F)。如果在该颗粒表面裹上一层氧化淀粉的微凝胶层则可显著提升复合颗粒的黏液层吸附能力及延长黏液层停留时间,使复合颗粒更耐受胃部酸性环境并顺利到达肠道,并在肠道缓慢释放含有槲皮素的溶菌酶颗粒,最终达到缓释的靶向递送效果。
有研究发现,衣壳病毒可快速穿透黏液层,原因是病毒颗粒表面的衣壳呈现电中性,且基本没有疏水区域,因此不容易通过静电吸引或疏水相互作用被吸附在黏液层。受该病毒衣壳结构启发,结合上面总结的黏液层穿透型颗粒所具备的性质,研究人员开发了多种表面修饰的黏液层穿透纳米颗粒,其中最具代表性的为PEG表面涂层。有研究显示,经PEG涂层后纳米颗粒的黏液扩散能力显著提升,与颗粒在水中的扩散速率相比只有小幅度下降。然而,目前PEG涂层技术的应用对象主要为合成高分子纳米颗粒或纳米颗粒药物载体,用于FCPs的极为有限。而且,PEG的体内安全性尚不明确。此外,研究人员还开发了其他颗粒表面修饰策略用于提升颗粒的黏液层穿透能力,比如海藻酸钠壳核结构、羧酸盐/硫酸盐表面修饰、表面活性剂等。
3.2 FCPs的肠细胞吸收
3.2.1 外源纳米颗粒的细胞吸收
外源纳米颗粒扩散穿过黏液层后,靠近上皮细胞层,可通过两种主要途径(图9A)从肠管侧经单层肠上皮细胞吸收至机体内进入循环系统:1)通过相邻上皮细胞之间紧密连接的细胞旁路途径;2)通过肠上皮细胞或微褶细胞(M细胞)的跨细胞途径。其中,经肠上皮细胞的跨细胞途径是外源纳米颗粒吸收的主要途径。除肠上皮细胞外,肠上皮细胞层还含有另外一种可从肠管中吸收转运外源纳米颗粒的细胞,即M细胞。M细胞可看作肠组织特异性免疫细胞,负责肠屏障的部分免疫功能。因此,通过M细胞介导的跨细胞途径吸收的颗粒可以被巨噬细胞和树突状细胞捕获,然后传递到淋巴系统。目前,普遍认为占据绝对数量优势的肠上皮细胞是吸收外源纳米颗粒的最主要跨细胞途径。而M细胞只占上皮细胞层的1%左右,整体吸收能力有限。
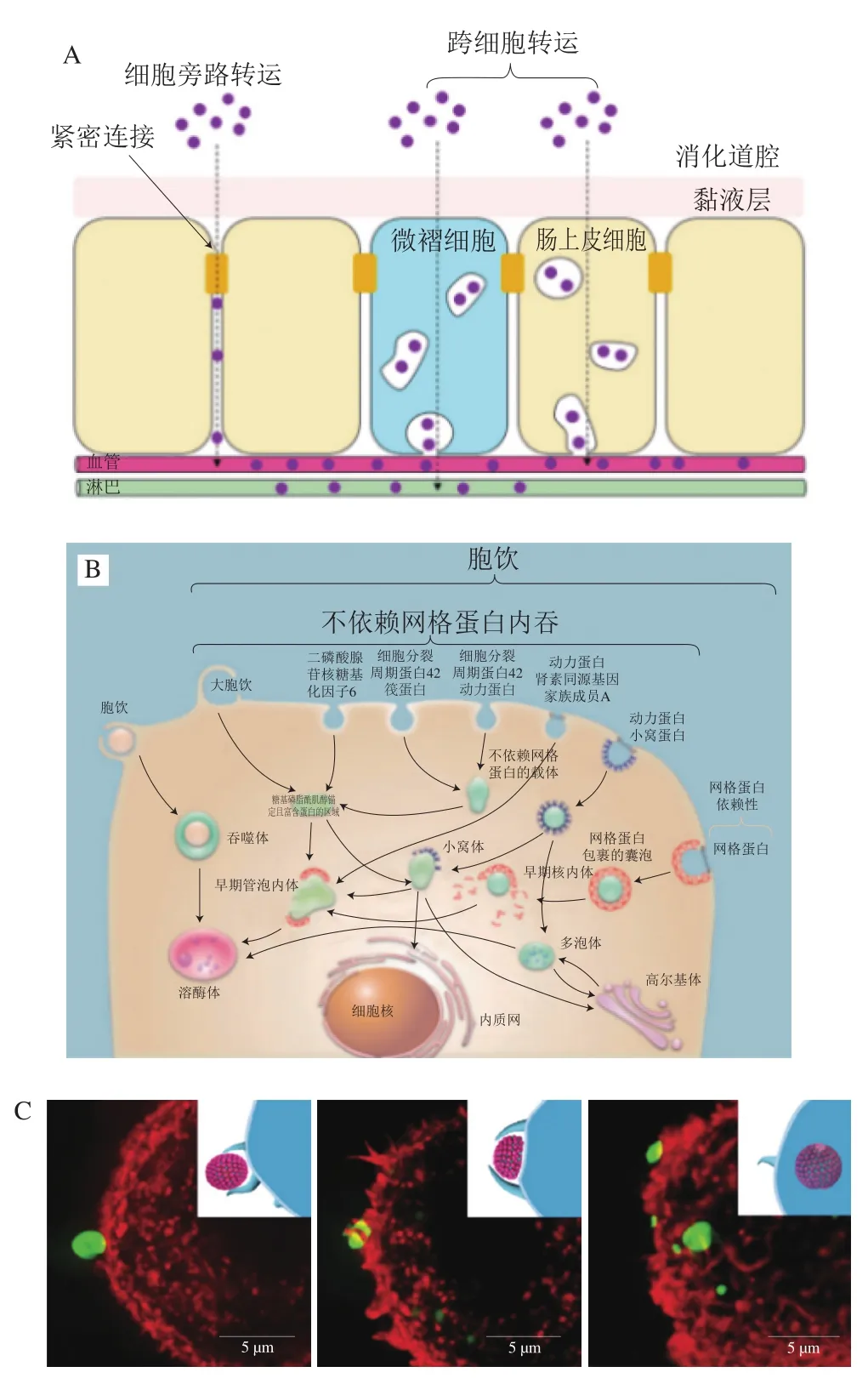
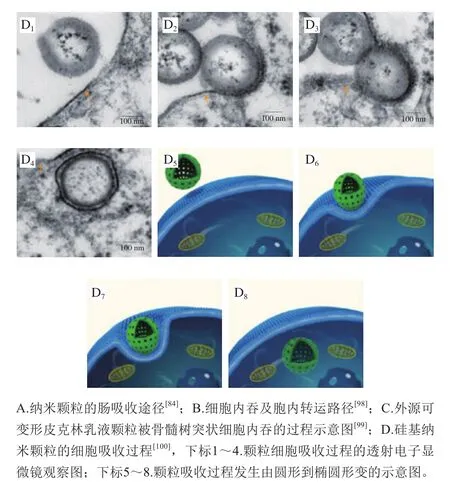
图9 外源纳米颗粒的细胞吸收过程Fig. 9 Cellular uptake of external nanoparticles
外源纳米颗粒的跨细胞途径吸收主要依赖内吞作用,可分为吞噬和胞饮两大类。吞噬作用负责摄取大颗粒(20 μm左右),通常发生在特定的细胞类型中,如巨噬细胞、中性粒细胞、单核细胞及树突细胞等;而胞饮作用则几乎存在于各种细胞类型中,又根据细胞种类及外源颗粒的性质,细分为网格蛋白、小窝蛋白、大胞饮和网格蛋白/小窝蛋白非依赖型胞饮(图9B)。内吞过程包括几个步骤,首先是颗粒与细胞膜接触,并沉积在膜的表面。然后,这些颗粒被膜内陷包裹,膜内陷被夹断,形成膜结合的小泡,也称为核内体(或吞噬作用下的吞噬小体)。最后,核内体将颗粒运送到不同的亚细胞结构,从而实现颗粒的胞内分拣及后续的个性化代谢。纳米颗粒与细胞膜相互作用的动力学、能量学及力学特性对颗粒的后续胞吞过程很重要,因为它们可以显著影响颗粒内吞的途径/机制、速率和量。这些动力学和能量学参数取决于纳米颗粒的尺寸、形状、变形能力、细胞膜性质以及细胞周围的局部环境。
有研究人员利用超高分辨结构照明显微成像,捕捉到了皮克林乳液颗粒被骨髓树突状细胞内吞的过程(图9C)。乳滴首先通过细胞包裹的方式沉积在细胞膜上并发生从圆形到椭圆形的变形,以增加乳化液滴与细胞膜的接触面积。在液滴与细胞膜的结合区,液滴内的抗原在液滴表面侧流引发多价相互作用,最终诱导液滴吞噬。而不具备这种变形能力的硬质固体脂质颗粒的细胞吸收率显著降低。另外一项针对硅基纳米胶囊细胞吸收的研究也发现同样规律,空心硅纳米颗粒在进入细胞的过程中发生从圆形到椭圆形的变形(图9D),而且这种变形能力可以显著促进它们的细胞吸收。这些结果表明,颗粒的可变形度(硬度)对其细胞吸收过程至关重要。
当外源纳米颗粒通过内吞作用进入细胞后,一般有以下几种转运路径:1)被分泌回细胞外环境;2)残留在细胞内并积累;3)在细胞内降解;4)进入体循环。细胞内存在特定的分选机制来决定这些进入胞内外源颗粒的最终“归宿”。这个分选机制主要是由细胞内核小体联合高尔基体、内质网和溶酶体等共同组成的细胞器网络所介导的(图9B)。纳米颗粒通常首先被转运到早期核内体,这是经内吞作用进入胞内颗粒的主要“分选站”。在早期核内体中,一些颗粒与受体一起被转运到循环核内体,然后排至胞外;未被排出细胞的其他核内体进一步成熟并分化成晚期核内体,它可以与质膜融合从而以外泌体的形式释放其内容物到胞外。晚期核内体也可以与溶酶体融合形成内吞溶酶体,溶酶体中含有的多种水解酶可引起纳米颗粒的降解。内吞进入细胞的纳米颗粒也可能“逃脱”上述分选路径。例如,当“逃脱”发生在与溶酶体发生融合前,则该颗粒将不会进入内吞溶酶体降解路径,并以完整颗粒的形式停留在细胞质或其他细胞器中。
被吸收的纳米颗粒在细胞内的生物命运与其内吞途径密切相关。通过网格蛋白介导的内吞作用吸收的颗粒首先进入具有低pH值环境的早期核内体,然后进入溶酶体并进一步代谢;通过小窝蛋白内吞途径进入细胞的纳米颗粒一般与具有中性pH值环境的小窝体或多泡体融合。该途径比网格蛋白内吞过程要慢,但在某些条件下可绕开溶酶体融合步骤,有时有利于某些需要逃脱溶酶体降解过程的蛋白质或功能成分的有效递送。进入小窝体的纳米颗粒大多最终被输送到内质网或高尔基体。
综上所述,外源纳米颗粒的性质(如大小、形状或变形能力)决定了其内吞途径,进而影响其随后的胞内运输和最终胞内定位。如果该外源颗粒被设计为生物活性化合物的载体,那么这些封装的生物活性化合物的功能也将被改变。
3.2.2 FCPs的细胞吸收
本部分总结的FCPs主要包括食源蛋白、多糖及脂质形成的多尺度微纳米颗粒。一般认为,这些FCPs很容易被胃肠道的各种消化酶降解,且跨膜能力较差,较难以完整颗粒形式被肠细胞直接吸收。然而,有研究表明,食品中的少量FCPs能够逃脱消化酶的降解并通过肠上皮细胞层的M细胞途径,以转胞吞的形式,跨过肠上皮细胞层,进入机体循环系统。例如,早在20世纪80年代,研究人员在探索为何一些膳食蛋白质在通过胃肠道消化后仍能引起过敏的原因时得出结论,从免疫学角度来说,肯定有大量的完整蛋白质被机体所吸收。此外,最早的关于完整纳米颗粒吸收的证据也来自对食品颗粒的研究。研究人员发现,经大鼠口服喂食的完整粗淀粉颗粒可跨越肠黏膜层被机体直接吸收。这些证据都直接证实了完整FCPs被细胞/机体直接吸收的可能性。目前,已有诸多体外/体内研究证实,许多蛋白、多糖或脂质FCPs能够以完整颗粒形式被细胞直接吸收(表2)。
然而,也有研究对FCPs的细胞吸收提出质疑。一项涉及酪蛋白酸钠胶体颗粒的大鼠体内吸收实验结果显示,直径为138 nm的酪蛋白酸钠颗粒经口摄入2 h后,仍大量滞留大鼠胃部;24 h后,消化道末端仍然可以检测到颗粒的存在;摄入48 h后,颗粒被排出体外,提示酪蛋白酸钠胶体颗粒未被吸收,留在大鼠消化道内,直至排出体外。不过,该研究在考察颗粒分布、吸收及排出时,使用的荧光和放射性标记实验缺乏定量分析,而且也没有给出大鼠粪便中完整的酪蛋白纳米颗粒的准确定量数据。因此,很难排除这些酪蛋白纳米颗粒部分被吸收的可能性。另外一项针对吐温-80稳定的固体脂质纳米颗粒(solid lipid nanoparticles,SLNs)的研究表明,这些SLNs可迅速在小鼠肠道中被消化,未发现SLNs以完整颗粒形式转运至别的组织或器官。原位灌注实验显示SLNs可黏附在肠黏液上,但却不能穿透黏液层。体外实验进一步证明,SLNs可以被Caco-2细胞吸收,但不能穿透细胞单层,主要位于细胞单层表面,很难通过细胞旁途径被吸收。这些证据与先期SLNs能够以完整颗粒形式被机体所吸收的研究结论(表2)截然相反。因此,需寻找更有说服力的证据,进一步确认食品脂质纳米颗粒是否能够以完整颗粒形式从肠管中被吸收。
除上述蛋白、脂质或多糖纳米颗粒外,我国传统加工食品及食品烹饪过程也会产生许多功能性纳米颗粒。例如有研究人员发现诸多食疗汤的烹饪制备过程也是各种生物大分子及小分子自组装形成各式结构并兼具特定功能FCPs的过程。结果显示,我国消费者钟爱的猪骨汤中由脂质、蛋白和碳水化合物组装成的FCPs(=(275±2)nm)可经内吞方式被体外培养的小鼠腹腔巨噬细胞直接吸收,且该过程对正常细胞无明显影响,但能防止过氧自由基诱导的膜超极化、线粒体功能障碍和吞噬作用抑制等。
3.3 FCPs的体内转运与生物分布
经肠上皮细胞吸收后的纳米颗粒,可进入机体循环系统,并根据其基本理化性质,被运送到不同的组织或器官,包括心脏、肺、脾脏、肾脏、肝脏等。目前针对FCPs体内分布的研究主要集中于加工食品,对天然食品中的FCPs的研究几乎为空白。Li Shen等率先报道了可乐中含有荧光纳米颗粒,这些荧光纳米颗粒主要在小鼠的小肠和结肠部位被吸收,进入体内后主要分布在心脏和大脑,说明它们可以穿过血脑屏障;Cong Shuang等发现匹萨烧焦部分含有一类水溶性荧光纳米颗粒,该颗粒可进入线虫的组织和器官,并被发现在小鼠的肝脏、肺及肾脏中富集。这些荧光纳米颗粒的具体来源尚不清楚,可能是匹萨原料中的蛋白、脂质及碳水化合物等在高温烘焙过程中所发生的复杂物理化学反应所生成。在该团队的另一项研究中,研究人员发现,烤三文鱼也含有不同尺寸、表面化学基团和荧光性质的碳量子点纳米颗粒(carbon quantum dots,CQDs)。这些CQDs可在小鼠小肠部位被吸收并在小鼠大脑中累积,说明该颗粒也可穿过血脑屏障。
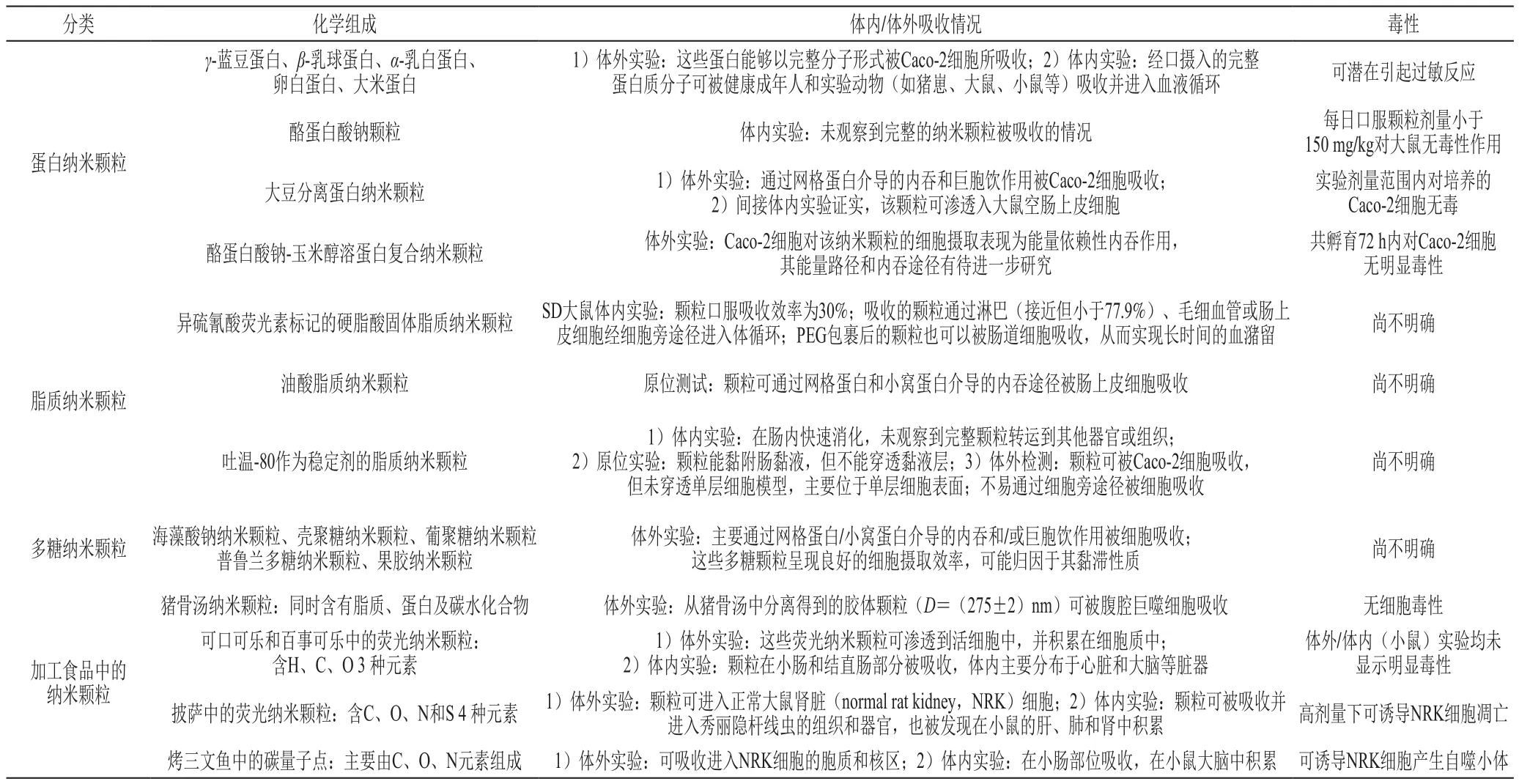
表2 天然或加工食品中蛋白、脂质、多糖等纳米颗粒的细胞吸收[84]Table 2 Cellular uptake of protein, lipid, and polysaccharide nanoparticles in natural and processed foods[84]
纳米化的食品添加剂是一类常见的FCPs。纳米食品添加剂已广泛应用于食品行业,以改善食品的口感、色泽、质地、加工适应性、营养价值和保质期。这些食品添加剂颗粒与食物基质一起被人体摄入。因此,明确它们的吸收和运输过程对于全面评估其体内安全性至关重要。纳米二氧化硅颗粒是目前应用最广泛的食品添加剂颗粒之一。经口摄入后,纳米二氧化硅颗粒可在肾、肝、肺、脑和脾中积累,其体内的脏器分布取决于颗粒的形状、介孔或表面化学性质。有研究发现,随着观察时间的延长,二氧化硅颗粒在大鼠体内的器官分布可发生显著变化,但却没有明确的器官靶向性。还有研究表明,大部分经口摄入的二氧化硅颗粒会经大鼠粪便(75%~80%)或尿液(7%~8%)排出体外,只有少部分被吸收进入体内,而且颗粒在大鼠肝、肾的滞留时间较肺、脾长。除二氧化硅以外,纳米化碳酸钙颗粒为另一种常用食品添加剂。有研究表明,每天口服给予大鼠碳酸钙纳米颗粒14 d后,碳酸钙颗粒可大量富集于大鼠肺组织中,其次是血液、脑、肝、脾、肾;在雌性大鼠卵巢中也发现有大量的碳酸钙颗粒。此外,大鼠脾脏总钙浓度显著增加,其他器官未见明显钙积累。
综上所述,大量的体内实验证实了食品加工过程中引入或产生的纳米颗粒可通过被吸收进入人体循环系统并在特定组织或器官中富集,而且这些纳米颗粒的化学组成、大小、形状、内核组成、表面化学性质、弹性等性质可显著影响其在血液中的停留时间和特异性器官分布。然而,这些食源纳米颗粒是否对人类健康有影响还不清楚。因此,需要进行严格的体内实验来进一步确认其潜在的健康或毒性作用。
4 食品胶体颗粒的安全性与功能性
4.1 安全性
如上所述,食品中含有的各类天然或人工FCPs,由于其特殊的纳米尺寸效应,可进入动物细胞并在特定的组织或器官中累积。因此其安全性正受到消费者和学术界的高度关注。按照化学成分,FCPs可被分为无机颗粒和有机颗粒两大类。前者主要由无机材料组成,如银、氧化铁、二氧化钛、二氧化硅、氧化锌等;后者则由天然或人工生物大分子组成,如蛋白、脂质、碳水化合物等。
对无机FCPs来说,它们被发现可在各自器官中富集,包括肝脏、肾脏、胃、肠道、脾脏、肺及心脏。如果摄入量过高,无机FCPs可引起多种组织或脏器毒性,例如肠道紊乱、肝损伤、肾毒性、心肌损伤等。无机FCPs引起这些不利健康效应的主要作用机制是产生活性氧(reactive oxide species,ROS)。胞内ROS水平的升高可上调细胞氧化应激,损伤细胞膜、细胞器和细胞核,并最终导致细胞、组织或器官功能紊乱。无机FCPs还被发现可干扰正常胃肠道功能及肠道菌群。
对有机FCPs负面安全性的相关报道较少,而且研究人员一般认为它们比无机FCPs更安全且潜在毒性低,原因是它们通常在胃肠道中被完全消化。然而,如本文3.1节至3.3节所述,完整的FCPs可被直接吸收进入体内。这些进入细胞或体内的FCPs的安全性尚不明确,需进一步研究,在此不作赘述。也有一些情况,FCPs会产生一定的毒性。有些蛋白或多糖颗粒,当它们以完整颗粒形式被吸收后,会引起机体过敏反应,比如卵清蛋白。此外,这些颗粒还能够与肠道菌群发生相互作用,导致一些不可预见的健康效应,值得深入研究。另外,有机FCPs可引起潜在毒性的原因之一是其作为功能组分包埋递送载体,可能会改变功能性物质的消化和释放部位,或导致这些化合物的过度释放和吸收,从而对人体健康产生不利影响。例如,使用多层界面乳液颗粒作为递送载体时,这些乳滴表面的多层生物大分子涂层,可显著抑制油滴的消化速度和程度,从而导致诸多未消化的脂质到达结肠部位,继而被结肠细菌发酵,产生一些有害代谢产物从而导致胃肠道功能紊乱。此外,将生物活性营养素装入有机FCPs以提高其生物利用度有时会成为一个安全问题,因为这些化合物的高水平接触可能会对健康产生不利影响。即使它们在适当水平上对健康是有益,但摄入量过高,也可能是有毒的。
由于纳米材料在食品中的广泛应用,世界各地的监管机构已意识到其所带来的安全风险。英国、美国、欧盟等相继出台相关文件,管控纳米颗粒在食品中的使用。同时明确,纳米颗粒在食品中的应用需重新经过严格的安全及毒性评估。然而,大多数国家对使用纳米材料工业产品的销售和使用并没有明确规定。虽然,欧盟议会在2009年要求所有欧盟国家检查纳米材料相关立法,确保对工人、消费者及环境所能接触到的纳米材料实施全覆盖。然而,只有少数几个较为具体且有针对性的调控法规,缺乏针对所有食品类别的具体法规,食品行业和私营企业很难获取监管框架范围内的明确法规指导。
在过去的几年中,人们对食品级纳米颗粒的安全问题越来越关注。相关研究对可能导致不良健康影响的颗粒类型以及可能的毒性机制有一些了解。然而,在这一领域仍有许多矛盾的结果和未解的问题。例如,一些研究表明纳米二氧化钛在食物中不产生毒性,而其他的研究表明它们是有毒性的。此外,目前对大多数食品级纳米颗粒在胃肠道中的消化行为、生物学命运及潜在毒性了解甚少,需要对不同类型食品纳米颗粒的安全性及毒性机制进行更多的研究。
4.2 功能性
除安全性以外,FCPs的功能性及潜在健康功效也不可忽视。一项针对食品来源微纳米颗粒对肠细胞代谢影响的文献综述报道,食品来源的胞外囊泡(外泌体、微泡等)因含有蛋白、脂质、miRNA等功能性大分子,在细胞间通讯及功能调控方面扮演重要角色(图10)。例如,牛奶中的外泌体可降低细胞自由基水平。它们还可以抑制炎症因子表达,调节免疫细胞功能,同时重塑肠道菌群,调节肠道免疫稳态,从而缓解结肠炎。人乳中的胞外囊泡类纳米颗粒也被发现可促进肠上皮细胞生长,保护细胞免受氧化应激,维持肠稳态。此外,上文3.3节提及的食品烹饪过程产生的各类FCPs及加工过程引入的纳米化添加剂颗粒被吸收进入机体后的潜在毒性或功能尚不明确,亟待深入研究。
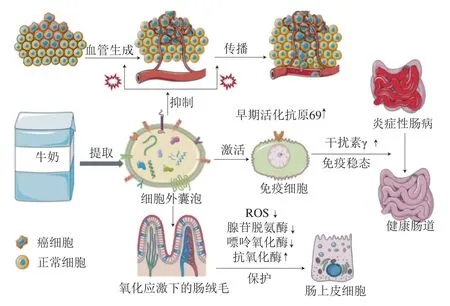
图10 乳源性细胞外囊泡对肠道细胞代谢的影响Fig. 10 Effects of milk-derived extracellular vesicles on intestinal cell metabolism
5 结 语
食品胶体作为食品结构的骨架,承载着食品的加工、风味、质构、营养及健康属性。随着食品科技的日新月异,食品胶体在新兴的植物基人造肉、低盐/低糖/低脂食品、老年食品、3D打印、精准营养等未来食品新方向更是发挥着不可替代的重要作用。此外,食品胶体形成的多尺度微纳米颗粒在与生物系统(细胞)相互作用过程中带来的安全性问题也备受关注,例如这些食品胶体颗粒是否可随意进入各类细胞,进入细胞的方式与途径,进入细胞后的转运代谢行为及生物学效应等系列科学问题,都还有待进一步阐明。除安全性外,也需同时关注这些食品级纳米颗粒进入细胞后的潜在生物学功能,以期寻找其参与细胞生命活动的证据,尤其是在参与细胞基础营养代谢、胞内细胞器互作及细胞骨架与代谢网络调控等方面的作用。
过去的5 年间,食品胶体科学研究发展迅速。研究队伍不断壮大,研究成果数量,更是连年攀升。我们相信,通过与生命科学、材料科学及医学等相关学科的交叉融合,利用食品胶体在未来食品结构设计、精准营养与人体健康方面所扮演的重要角色,创新研究思路,深度挖掘食品胶体在大生命、大健康领域的前沿方向,“食品胶体人”必将食品胶体科学的研究推向新高度。

