1D/2D Cl-TCN/Ti3 C2 的制备及光催化性能研究实验设计
刘 芳,赵小萱,王雪尧,由雪慧,赵朝成,王永强
(中国石油大学(华东)化学工程学院,山东青岛 266580)
0 引言
工业化的快速发展,人口的急剧增长,大量的化石燃料被过度消耗,导致大量的工业和生活废物被排入环境,带来了诸多的环境问题,如有机污染物引起的水体污染等[1-2]。4-硝基苯酚(p-NP)是废水中不可生物降解的一种典型的持久性有机污染物,即使浓度极低也会对环境带来严重的危害。凭借具有非选择性的氧化性能和逐步完全降解废水中有机污染物的能力,光催化技术引起了人们的关注,光催化技术以半导体为催化剂,仅靠阳光即可激发活性氧物质(ROS,如,·OH等),被誉为一种高效、安全的环境友好型环境净化技术。
石墨相氮化碳(g-C3N4)是一种无金属的有机聚合物半导体,由于具备特殊的sp2 杂化形成的大π 键分子结构,使其具有出色的化学稳定性[3]。g-C3N4可以响应波长小于460 nm的可见光,因此可被用于可见光下光催化降解有机污染物[4]。研究表明,Cl 掺杂可以通过层间嵌套改变能带结构,调整氮化碳的导带位置,同时由于Cl 具有较高的电负性,可以捕获带正电的空穴,从而促进光生电子空穴对的分离[5]。此外,Ti3C2作为一种新兴的二维过渡金属碳化物,具有高导电性、亲水性和多孔性的优异性能,是优异的助催化剂,可以与g-C3N4形成异质结从而提升光催化性能。
除有机污染物外,由硝酸盐引起的水污染也成为全世界一个普遍存在的环境问题。近年来,通过光催化技术实现硝酸根向N2的转换引起了人们的关注,但目前的研究往往需要高压汞灯和贵金属的辅助。通过合理设计氮化碳的结构,使其既可以满足对有机污染物的降解,又可以实现在可见光下对硝酸根的还原,这将对光催化技术在水处理中的应用起到一定的推动作用。
本文采用水热-煅烧结合法构建了1D/2D Cl掺杂氮化碳纳米管/层状碳化钛(Cl-TCN/Ti3C2)光催化复合材料,并用于光催化降解4-硝基苯酚(p-NP)和硝酸根,对催化剂进行表征分析,并研究光催化降解的影响因素及降解机制。本实验设计涵盖了光催化剂设计中元素掺杂、形貌调控及异质结构建的相关内容,结合性能测试及数据分析,是一套完整的实验教学体系,为科创训练和创新培养体系的构建提供了一定的指导。
1 实验材料与方法
1.1 试剂和仪器
试剂:三聚氰胺、三聚氰酸、盐酸、碳化钛(Ti3C2),以上均为分析纯,国药集团化学试剂有限公司购置。
仪器:管式炉,分析天平,超声清洗器,pH计。
1.2 1D/2D Cl-TCN/Ti3C2 的制备
取1.29 g 三聚氰胺和1.26 g 三聚氰酸先后溶解至60 mL去离子水中(50 °C),利用注射器将溶解后的三聚氰酸溶液逐滴加入三聚氰酸溶液中均匀混合,所得产物转移至100 mL特氟隆衬里高压反应釜中,并向内加入3 mmol HCl,180 °C 反应8 h 后将产物分离并在N2氛围下520 °C 煅烧4 h(升温速率2°C/min)得到Cl掺杂氮化碳纳米管(Cl-TCN)。取0.1 g Cl-TCN加入30 mL去离子水中,超声处理30 min后向内逐滴加入含有7.5 mg Ti3C2的30 mL 去离子水,继续超声处理2 h。离心收集所得产物,300 °C 煅烧1 h 得到1D/2D Cl-TCN/Ti3C2。制备流程见图1。

图1 1D/2D Cl-TCN/Ti3C2 的制备流程图
1.3 光催化降解废水性能测试
将50 mg 光催化剂添加到100 mL 不同废水(10 mg/L p-NP、生活污水或油田采出水)溶液中,光源使用具有420 nm截止滤光片的300 W氙灯,实验均在配有夹套冷却器的反应器中进行,以保持25 ℃的反应温度,光源距反应器的距离为10 cm。在光照开启之前,将反应溶液在黑暗中机械搅拌60 min,以达到吸附-解析平衡。氙灯打开后,每隔20 min 取3 mL 反应溶液分析污染物浓度变化,使用液相色谱-质谱法(LC-MS)监测中间产物信息,分析污染物的转化途径。
1.4 光催化降解NO3-性能测试
将50 mg 光催化剂添加到100 mL 0.8 mmol/L的NaNO3(NO3-浓度为50 mg/L)溶液中,光源使用具有420 nm 截止滤光片的300 W氙灯。反应前将溶液在黑暗中机械搅拌60 min,并向反应器内通入氩气去除反应中的溶解氧。反应期间每隔20 min取3 mL反应溶液,用离子色谱法监测溶液中NO3-和NO2-浓度的变化,用纳氏试剂法监测溶液中NH4+浓度的变化。氮气选择性,

式中:S为N2选择性(%);c0为物质的初始摩尔浓度(mmol/L);ct为物质在t时刻的摩尔浓度(mmol/L)。
2 实验结果与讨论
2.1 催化剂表征
图2 展示了所制备催化剂的微观形貌结构。可以明显看出Cl-TCN 呈管状结构,管径58~67 nm,小的管径往往可以带来更高的电子传输速率,从而提升光催化效率。Ti3C2呈现出典型的二维片层结构,边缘有轻微褶皱,表明Ti3C2是由平行堆叠的薄纳米片组成。从Cl-TCN/Ti3C2的微观形貌照片可以看出Cl-TCN的管状结构在Ti3C2的片层上完成负载。

图2 所制备催化剂的微观形貌照片
采用X射线衍射(XRD)研究所制备催化剂的晶体结构。如图3(a)所示,Ti3C2在8.7°、18.5°和60.9°出现的峰分别对应于(002)、(004)和(110)晶面。Cl-TCN在13.0°和27.6°处出现衍射峰,与三均三嗪环的重复堆积和类石墨材料的层间堆积有关,对应石墨相氮化碳的(100)和(002)晶面[6]。Cl-TCN/Ti3C2的XRD图谱在8.7°和60.8°出现了Ti3C2的衍射峰,峰强度较低是由于Ti3C2含量较低引起的。在27.2°处出现了Cl-TCN的(002)晶面衍射峰,但角度发生了偏移,这是由于Ti3C2破坏了Cl-TCN中类石墨结构的堆叠方式引起的。图3(b)展示了所制备催化剂的傅里叶变换红外光谱(FT-IR),Ti3C2在520~640 cm-1处出现的峰归因于Ti-C 和Ti-O 键。Cl-TCN 在1 200~1 700 cm-1处出现的众多吸收峰是由C—N 和CN杂环的拉伸模式引起的,在812 cm-1处出现的尖峰是由三均三嗪环单元的呼吸模式引起的[7]。Cl-TCN/Ti3C2保留了Cl-TCN的全部吸收峰,在520~640 cm-1处出现多处杂乱的小峰,表明Cl-TCN/Ti3C2复合材料制备成功。
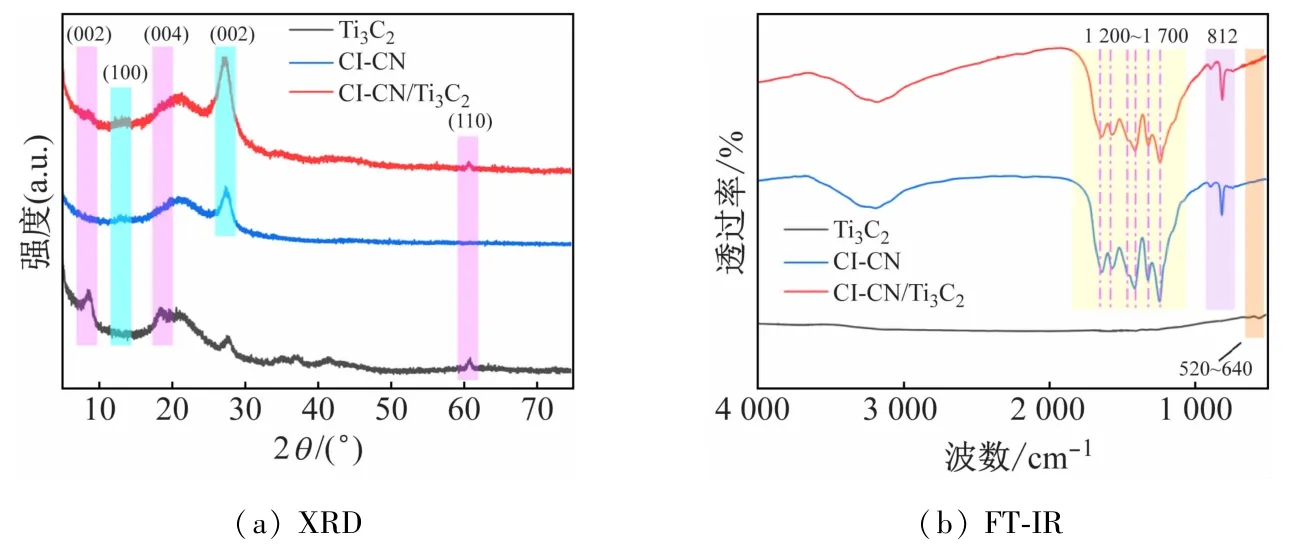
图3 所制备催化剂的XRD和FT-IR光谱图
为确定Cl-TCN/Ti3C2的化学组成和价态,对其进行了X射线光电子能谱(XPS)测试。图4(a)展示了Cl-TCN/Ti3C2的XPS总谱,可以看出其主要包含了C、N、O、Cl和Ti 5 种元素。图4(b)展示了C 1 s的高分辨率轨道结合能,通过分峰拟合得到了288.4、286.0和288.2 eV 3 个峰,分别对应于石墨碳(C—C或CC)、C—O 和三均三嗪环单元中的C 原子(N—C—N)[8]。N 1 s 的XPS 图谱(图4(c))可以被分为398.5、399.4 和400.9 eV 3 个峰,分别对应于三均三嗪环单元中的N 原子(CN—C)、叔N 原子(N-(C)3)和氨基N 原子(C—N—H)[9]。此外,在404.5 eV处出现的峰于片层间π—π*电子激发有关。图4(d)展示了O 1 s的XPS光谱,其中531.9 和533.2 eV分别对应于CO 和C—O,O 元素的出现主要是由三聚氰酸在反应过程中提供的,O 元素的引入可以调控Cl-TCN的能带结构,从而提高光催化性能。199.5 eV出现的峰对应于C—Cl共价键(图4(e)),表明Cl-TCN中Cl的成功掺杂。图4(f)展示了Ti 2p 的XPS光谱,其中455.2、458.7 和462.3 eV分别对应于Ti—C(2p3/2)、Ti—O 和Ti—C(2p1/2)[10]。以上元素的出现表明Cl-TCN/Ti3C2制备成功。
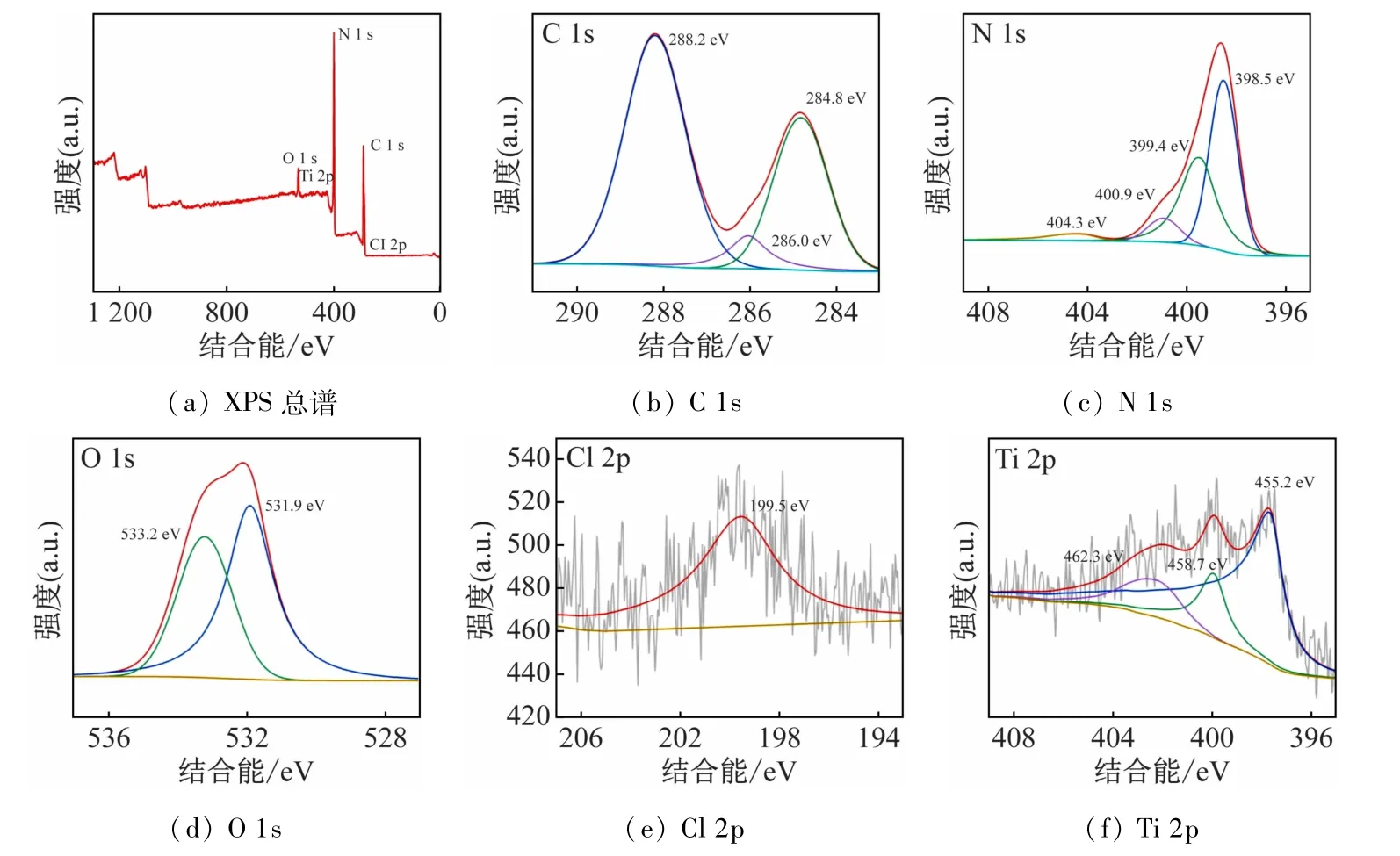
图4 Cl-TCN/Ti3C2 的XPS光谱图
通过紫外-可见漫反射(UV-vis)可以研究所制备催化剂对光的吸收。如图5(a)所示,Cl-TCN 的吸收带边为498 nm,优于文献中直接煅烧三聚氰胺所得到的g-C3N4[11]。通过转换的Kubelka-Munk函数作图可以计算Cl-TCN的禁带宽度[12]:

式中:α 是吸光指数;hv是光子能量(hv=1 240/λ,λ为入射波长);Eg为半导体禁带宽度。由于氮化碳为间接带隙半导体,因此n=2。以能量为横坐标,ahv为纵坐标作图,通过切线与横坐标的交点得出Cl-TCN的禁带宽度为2.55 eV(图5(b)),通过XPS 测量Cl-TCN的价带位置为1.39 eV,则其相应的导带位置为-1.16 eV。由于Ti3C2为纯黑色固体,因此在全光谱范围内都表现出了光吸收。相较于Ti3C2,Cl-TCN/Ti3C2表现出了更强的光吸收强度,一方面Ti3C2的引入使复合催化剂颜色加深从而对光的吸收增强;另一方面由于Cl-TCN与Ti3C2形成了异质结,加速了光生电子与空穴的分离,从而增强了对光的吸收。光致发光光谱(PL)可以帮助研究催化剂中载流子的转移行为,PL光谱中更强的发射强度代表着更高的光生电子-空穴复合率[13],Cl-TCN/Ti3C2的PL 光谱强度明显低于Cl-TCN(图5(c)),证实Ti3C2助催化剂可以显著促进Cl-TCN表面的光生电子-空穴对的分离。
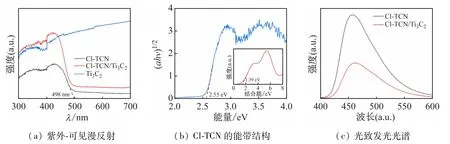
图5 所制备催化剂的UV-vis和PL图谱
2.2 Cl-TCN/Ti3C2 光催化降解p-NP模拟废水
在模拟可见光(>420 nm)下考察所制备催化剂对有机污染物的光催化降解性能。图6(a)展示了不同催化剂在pH =3 条件下对p-NP的降解图。可以看出,120 min 内g-C3N4(550 ℃直接煅烧三聚氰胺所得)对p-NP 的降解率仅有4.1%,而Cl-TCN 对p-NP的降解率为52.5%,表明管状结构和Cl掺杂加速了氮化碳对p-NP的降解。这一方面由于管状结构拥有更好的电子转移能力以及更多孔结构可以促进入射光的多次反射,从而提高Cl-TCN对光的利用率;另一方面,Cl原子的掺杂可以在氮化碳价带和导带附近形成施主能级和受主能级,这些杂质能级在光催化过程中充当了光生电子的跳跃台阶,降低光激发所需的能量,从而提高了光催化性能[14]。Cl-TCN/Ti3C2对p-NP 在120 min 的降解率为71.2%,表明助催化剂Ti3C2与Cl-TCN形成的异质结通过降低光生电子-空穴复合率增强了Cl-TCN/Ti3C2的光催化性能。Cl-TCN 和Cl-TCN/Ti3C2的光催化降解速率常数k分别为0.006 1和0.010 0 min-1,相较于g-C3N4分别提高了15 和25 倍。
pH的改变往往会影响光催化剂的光催化性能,由图6(b)可看出,随着pH 的上升,Cl-TCN/Ti3C2对p-NP的降解性能逐渐下降,当pH =5 和pH =7 时,反应120 min后相应的降解率分别下降至60.4%和52.4%,光催化降解速率常数k分别下降至0.006 9和0.005 5 min-1,表明H+的存在会增强Cl-TCN/Ti3C2对p-NP的降解。

图6 所制备催化剂对p-NP的降解性能图
为探索H+对Cl-TCN/Ti3C2光催化降解性能影响的机制,以DMPO 为自由基捕获剂,对反应体系进行液相电子顺磁共振(ESR)测试(图7(a)),考察Cl-TCN/Ti3C2在光催化过程中产生的活性自由基种类。经可见光照射后,的信号强度明显强于·OH的信号强度,表明在反应过程中可能起主导作用。以三乙醇胺(TEOA,0.01 mol/L)作为空穴(h+)清除剂,以异丙醇(IPA,0.02 mol/L)作为·OH 清除剂,以对苯醌(BQ,0.01 mol/L)作为清除剂,采用淬灭实验考察不同活性物质对光催化降解性能的影响。由图7(b)可以看出,随着BQ、TEOA 和IPA 的加入,Cl-TCN/Ti3C2对p-NP 的降解率分别下降至20.9%、33.3%和57.7%,证实了在光催化反应中提供了最高的贡献度。在光催化反应中,当能量大于带隙的可见光照射到Cl-TCN/Ti3C2表面后会产生空穴和电子(方程(3)),由于Cl-TCN/Ti3C2(-1.16 eV)的导带位置比O2(-0.33 eV)的氧化还原电位更负,因此导带的e-可以与O2反应生成·(式(4))。由于Cl-TCN/Ti3C2(1.39 eV)的价带位置比·OH/OH-(1.99 eV)的氧化还原电位更负,因此价带的h+无法直接与H2O 或OH-反应生成·OH。然而,在酸性条件下,反应过程中的可以转化为·OH(式(5~7)),由于·OH的氧化性能优于,因此H+的存在可以增强Cl-TCN/Ti3C2的光催化降解性能。

图7 Cl-TCN/Ti3C2 的ESR测试及淬灭实验

使用液相色谱质谱联用(LC-MS)技术对Cl-TCN/Ti3C2光催化降解p-NP 的中间产物进行分析(图8(a)),分别在质子数/电荷数(m/z)=123、116、110、108、94、74 和60 处检测到中间产物,结合活性自由基信息,相应的降解途径见图8(b)。

图8 Cl-TCN/Ti3C2 光催化降解p-NP的中间产物及降解途径图
2.3 Cl-TCN/Ti3C2 光催化降解实际废水
利用三维荧光光谱研究了Cl-TCN/Ti3C2对生活污水及油田采出水的降解性能(见图9),表1 列出了两种废水的水质状况,所有图像均进行了瑞利散射和拉曼散射的消除[15]。图9(a)表明生活污水主要含有A(λex/em=250/370,芳香族蛋白质)、B(λex/em=250/455,黄腐酸和类黄腐酸)、C(λex/em=275/330,色氨酸与类蛋白质)和D(λex/em=300/455,腐殖酸聚合物)4种组分,Cl-TCN/Ti3C2降解生活污水的前40 min组分A的荧光峰出现了上升,而组分B 和组分D的荧光峰大幅下降,这是由于大分子的组分B和组分D在降解过程中被分解为小分子导致的。反应120 min后A、B、C、D 4 个组分的荧光强度分别下降了52.3%、97.9%、97.5%和96.2%,表明Cl-TCN/Ti3C2对生活污水整体有优异的降解效果,由于A 组分相对分子质量较小,键能较强,因此降解率较低。图9(b)展示了油田采出水的三维荧光光谱,与生活污水不同,油田采出水主要由A′组分(λex/em=240/360,芳香族蛋白质)和C′组分(λex/em=280/340,色氨酸和类蛋白质)组成,反应120 min 后Cl-TCN/Ti3C2可使油田采出水A′和C′组分的荧光强度分别下降62.5%和78.1%。此外,反应120 min后Cl-TCN/Ti3C2还可使生活污水和油田采出水的COD分别下降54.2%和64.8%(见图10)。

图9 Cl-TCN/Ti3C2 光催化降解生活污水及油田采出水的三维荧光光谱图

表1 生活污水及油田采出水的水质分析表 mg/L

图10 Cl-TCN/Ti3C2 对生活污水及油田采出水的COD光催化降解曲线
2.4 Cl-TCN/Ti3C2 光催化降解NO3-模拟废水
图11(a)展示了g-C3N4、Cl-TCN和Cl-TCN/Ti3C2对的光催化降解性能,可以看出g-C3N4仅可以还原2.6%的,这与g-C3N4本身光响应能力较差有关,因此降解率较低。Cl-TCN 和Cl-TCN/Ti3C2在120 min 反应后对的降解率也分别提升至14.8%和25.5%,降解速率常数相较于g-C3N4分别提高了7 倍和12 倍。甲酸的加入可以显著提高Cl-TCN/Ti3C2对的还原,一方面甲酸与空穴发生反应生成的·可以在光催化还原过程中起作用(方程(8)~(10);另一方面甲酸的加入可以减少空穴对和的氧化。随着甲酸浓度的增大,Cl-TCN/Ti3C2对的降解率逐步提升,当甲酸浓度达到0.2 mmol/L 时,Cl-TCN/Ti3C2对的降解率可达65.8%(图11(b))。此后继续增大甲酸浓度,Cl-TCN/Ti3C2对的降解率提升不明显,这是由于此时甲酸浓度已达到空穴能反应的上限。当甲酸浓度为0.2 mmol/L时,Cl-TCN/Ti3C2光催化降解的N2选择性可达92.5%(图11(c)),副产物生成量较少。
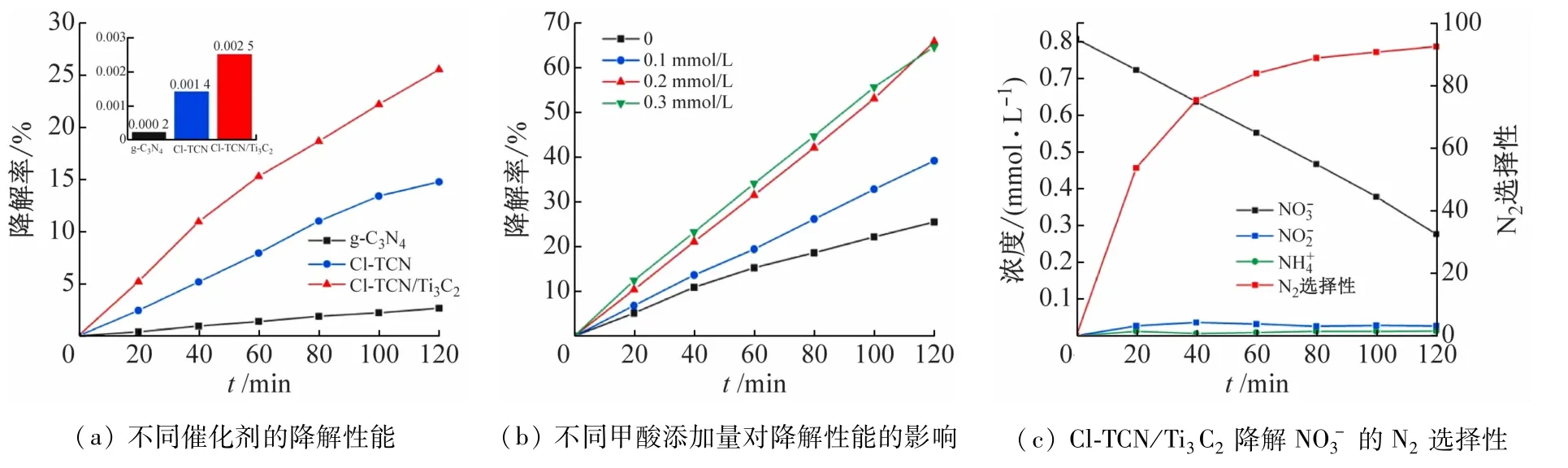
图11 所制备催化剂对的降解性能图
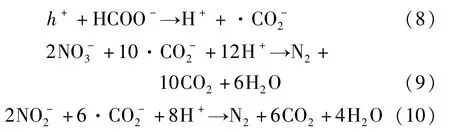
基于以上结论,图12 展示了Cl-TCN/Ti3C2在可见光下光催化降解有机污染物和的机理。

图12 Cl-TCN/Ti3C2 光催化降解p-NP的机理图
3 实践教学
作为高级氧化技术中的一种,光催化技术在环境修复方向,尤其是水环境修复方向展现出了巨大的潜力。作为一种新兴技术,光催化在目前的实践教学中还少有涉及,然而,光催化技术的探究与应用已经逐渐出现在本科生创新工程项目、毕业论文选题以及研究生的科研中,因此有必要设计一套完善的光催化教学体系。
本实验设计的1D/2D Cl-TCN/Ti3C2的制备及光催化性能研究,广泛涉及了环境光催化原理、半导体调控、水环境污染物的降解及迁移等基础理论知识及学科前沿的新理论和新知识,包含了半导体光催化剂的制备、形貌调控、元素掺杂、异质结构建、材料表征、性能测试及数据分析等多个方面,几乎涉及了光催化在水体有机物降解的全部知识点。此外,本实验设计教学还可以培养学生对实验方案的涉及、大型表征及分析仪器的使用等内容。根据实验教学条件的不同,还可拓展学生思维,让学生自主对实验方案设计进行补充及拓展,以求提高学生的求知欲和创新能力。
4 结语
该实验设计采用水热-煅烧结合法制备了1D/2D Cl-TCN/Ti3C2复合光催化材料,通过表征分析了催化剂的形貌结构、晶相组成及光学性质。Cl-TCN/Ti3C2对p-NP、生活污水、油田采出水和表现出了优异的光催化降解效果,pH的降低有助于·OH的产生从而增强光催化性能,通过LC-MS 技术揭示了Cl-TCN/Ti3C2对p-NP的光催化降解途径。对于生活污水和油田采出水中的污染物,Cl-TCN/Ti3C2也有着优秀的降解效率。在实验过程中,学生由查阅文献开始,而后进行方案设计、方案实施、数据记录与处理、测试仪器分析与学习、实验结果分析及报告撰写等,最终达到体验一次完整光催化科研实验的目的。在此过程中,科研训练课程中最重要的实验实践环节得以实现,不仅锻炼了学生的中英文文献阅读能力、独立思考能力、动手能力、数据及仪器测试分析等能力,还锻炼了学生在将理论与实践相结合的过程中,发现并解决问题的能力,为丰富科研训练课程内容、完善课程体系以及全能型人才的培养提供了一定的指导。

