胶囊剂型保健食品生产过程微生物分布和溯源分析
张依钰,陈玲,郑钰清,刘婷婷,周锦祯,陆永成,陈鉴宇,姚非,郭伟鹏
(广东省科学院微生物研究所,广东省微生物分析检测中心,华南应用微生物国家重点实验室,广东省微生物安全与健康重点实验室,农业农村部农业微生物组学与精准应用重点实验室,广东广州 510070)
随着中国经济的快速发展和人们对健康的迫切需求,我国大力推进健康中国建设,保健食品产业将迎来新的发展高潮,与此同时保健食品的安全问题也越来越受到社会关注。微生物是影响保健食品安全质量的主要因素之一,具有易繁殖、危害多、范围广等特点,成为了贯穿食品安全环节的首要风险因子。食品加工过程的微生物监控主要包括环境微生物和过程产品的微生物监控,环境微生物监控通过检测环境中的指示微生物,如菌落总数、大肠杆菌、酵母菌或其他指示菌以及其他致病菌,来评判加工过程的卫生控制状况和追溯可能存在的污染源[1]。除了定期监测生产过程中关键环节的微生物限度外,采用快速、可靠的微生物鉴定技术对污染微生物进行溯源,有助于企业锁定微生物关键控制点,加强卫生管理与操作规范,从而使产品安全管理从末端控制向防患于未然的风险控制转变。
目前,微生物溯源方法已从传统表型鉴定转向基因序列分析、蛋白差异分析等多项手段,其中基因序列分析方法具有简便、灵敏度高的特点,但对操作人员技术要求较高;基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF MS)是近年被广泛用于临床、食品、环境微生物鉴定的新技术,它是基于微生物特征蛋白指纹图谱比对进行菌种快速鉴别的新技术[2-4],速度快、样品需求量少且操作简单[5],对于大量微生物的同时快速鉴定更具优势[6,7],非常适合用于环境微生物检测。
本研究通过监测车间操作人员手部和设备表面的微生物污染状况,初步掌握车间与产品密切接触表面的微生物负载情况,为胶囊剂型保健食品生产过程中的微生物污染控制及风险评估提供数据支持。此外,比较了16S rRNA基因测序和MALDI-TOF MS方法对类芽胞杆菌属的鉴别和分型能力,旨在为高效快速准确地溯源和分析生产中常见微生物提供科学依据。
1 材料与方法
1.1 材料
1.1.1 样本来源
根据GB 15979-2002《一次性使用卫生用品卫生标准》附录E进行采样[8]。于2018年4月、11月、2019年1月、5月采集生产同一胶囊剂型保健食品的车间中人员手部和设备表面的涂抹样本共166份,具体采集数量见表1。

表1 涂抹样本采集数量 Table 1 Quantity of smear samples collected
主要生产工艺:
原料、半成品→称重→调配→总混→充填→内包→外包
1.1.2 主要试剂与仪器
微生物培养所用的培养基、细菌生化鉴定管均购自广东环凯微生物科技有限公司,乙腈(色谱纯)、甲酸(色谱纯)购自上海安谱实验科技股份有限公司,α-氰基-4-羟基肉桂酸(HCCA)购自布鲁克(北京)科技有限公司广州分公司,细菌基因组提取试剂盒及PCR扩增试剂购自广州东盛生物科技有限公司,真菌基因组提取试剂盒购自北京六合华大基因科技有限公司广州分公司,PCR引物由北京六合华大基因科技有限公司广州分公司合成。
CX21FS1C型生物显微镜,奥林巴斯(广州)工业有限公司;Biometra Tadvanced Twin 48G型耶拿双槽基因扩增仪,德国耶拿分析仪器股份公司;Bruker IVD-MBT Smart system GP型基质辅助激光解吸电离飞行时间质谱仪(MBTTMsmart),布鲁克(北京)科技有限公司。
1.2 方法
1.2.1 检测方法
对生产过程中人员手部和设备表面微生物采样和测试方法均参照GB 15979-2002《一次性使用卫生用品卫生标准》附录E[8],对样本进行菌落总数、大肠菌群和金黄色葡萄球菌的检测。
1.2.2.1 形态学鉴定
观察菌株在适宜培养基上纯培养的菌落形态,分别利用革兰氏染色法和乳酸酚棉蓝染色法处理细菌和真菌,在光学显微镜下观察其微观特征。
1.2.2.2 基因型鉴定
(1)基因组DNA提取:根据商品化细菌或真菌DNA提取试剂盒说明书进行DNA的提取。
(2)细菌鉴定方法
采用PCR方法扩增细菌的16S rRNA基因,引物:27 F (5"-AGA GTT TGA TCC TGG CTC AG-3"),1492 R (5"-TAC GGC TAC CTT GTT ACG ACT T-3");PCR扩增条件:94 ℃预变性,5 min;94 ℃变性,1 min;56 ℃退火,1 min;72 ℃延伸,2 min;共进行30循环;最后72 ℃终延伸,7 min。
(3)真菌鉴定方法
采用PCR方法扩增霉菌的ITS基因,引物:ITS1 (5"-TCC GTA GGT GAA CCT GCG G-3"),ITS4 (5"-TCC TCC GCT TAT TGA TAT GC-3");PCR扩增条件:94 ℃预变性,5 min;94 ℃变性,40 sec;53 ℃退火,45 sec;72 ℃延伸,45 sec;共进行30循环;最后72 ℃终延伸,5 min。
采用PCR方法扩增酵母菌的26S rDNA基因,引物:NL1 (5"-GCA TAT CAA TAA GCG GAG GAA AAG-3"),NL4 (5"-GGT CCG TGT TTC AAG ACG G-3");PCR扩增条件:94 ℃预变性,5 min;94 ℃变性,40 sec;53 ℃退火,45 sec;72 ℃延伸,45 s;共进行30循环;最后72 ℃终延伸,5 min。
(4)测序与分析:扩增产物交付北京六合华大基因科技有限公司广州分公司进行测序。最后将所得测序结果提交到GENBANK(http://www.ncbi.nlm.nih. gov/blast)进行比对,分析其与经验证过的标准菌株或模式菌株序列的相似性,选取最高得分作为鉴定结果。
1.2.2.3 细菌MALDI-TOF MS鉴定
(1)菌株前处理:待测菌株划线接种于营养琼脂平板,置36 ℃培养24 h后,挑取新鲜菌落点样至靶板上并记录样品的靶板编号,取1 µL 70%甲酸覆盖在每个样点上,室温晾干;再取1 µL HCCA基质液覆盖在每个样点上,室温晾干。
(2)MALDI-TOF MS质谱仪鉴定:将晾干后的靶板放入MALDI-TOF MS质谱仪中进行检测。仪器参数设置:选择MBT_FC. par方法(线性操作模式,正离子模式;检测范围:2000 u~20000 u)。数据库选用MALDI BIOTYPER,进行质谱数据采集并保存,通过MBT Compass软件进行分析鉴定。结果判读:分值范围2.300~3.000,表示完全可靠地鉴定到种的水平;分值范围2.000~2.299,表示鉴定到种的水平;分值范围1.700~1.999,表示鉴定到属的水平;0.000~1.699,表示无可信的鉴定结果。一致性分类结果的含义:A表示种水平的一致性;B表示属水平的一致性;C表示无一致性。
1.2.3 数据分析
将基因测序获得的序列运用MEGA 7.0软件构建邻接法系统发育进化树。MALDI-TOF MS方法得到的质谱图运用MALDI-Biotyper软件进行聚类分析和主成分分析(principle component analysis,PCA)。
2 结果与讨论
2.1 生产过程中微生物检测
采集的166份涂抹样本的大肠菌群和金黄色葡萄球菌均未检出,菌落总数结果见表2和表3,其中,人员手部涂抹样本的菌落总数介于10~107CFU/手,检出阳性的人员主要分布在总混、充填和内包生产环节;设备表面涂抹样本菌落总数介于10~104CFU/cm2,其中内包车间设备表面涂抹样本的菌落总数均为<10 CFU/cm2;位于总混车间的“容器”菌落总数检出频次较高,且消毒后仍负载微生物。

表2 人员手部涂抹样本菌落总数结果 Table 2 Results of total colony count of hands smeared samples

表3 设备表面涂抹样本菌落总数结果 Table 3 Results of total colony count of equipment face smeared samples
2.2 微生物鉴定
从42份菌落总数阳性样本中共分离纯化46株菌株,经基因测序鉴定为44株细菌(见图1),1株霉菌(Aureobasidium melanogenum)和1株胶红酵母(Rhodotorula mucilaginosa);其中52.17%的菌株来自人员手部,47.83%分离自设备表面。44株细菌分为16个属,24个种,有4株细菌未鉴定到种;从属的水平分析,分离的细菌主要由类芽胞杆菌属(60.87%)、不动杆菌属(4.35%)、芽胞杆菌属(4.35%)、短杆菌属(4.35%),以及其他种属占小部分组成;其中占比最高的类芽胞杆菌属包括16株腐殖质类芽胞杆菌、10株台中类芽胞杆菌和2株解葡聚糖类芽胞杆菌,这三种类芽胞杆菌在人员手部及设备表面(容器)中同时存在,存在交叉污染;作为优势菌的类芽胞杆菌是芽胞杆菌属分类上的新发现[9],常分离自土壤,为革兰氏阳性、阴性或可变杆菌,可产生芽胞,抗热和耐热,不易被杀灭[10]。不动杆菌属是一类条件致病菌,当人体抵抗力降低时可引起感染,如呼吸道感染、脑膜炎、心内膜炎 、泌尿系统感染及败血症等[11,12],其对于特定群体而言具有更大的感染风险,如婴幼儿、孕妇和老人等,而这些人群恰恰是食用保健食品的主要对象。2株芽胞杆菌分别为蜡样芽胞杆菌和尼氏芽胞杆菌,蜡样芽胞杆菌是食品中常见污染菌和食源性致病菌,因产肠毒素而致呕吐型或腹泻型综合症[13,14]。
2.3 溯源分析
将所有细菌测序序列和标准菌株或模式菌株的序列一起构建系统进化树获得其在分子水平的亲缘关系和位置。图1显示同种微生物均具有高度的同源性,提示同种微生物的来源相同;类芽胞杆菌作为优势菌,分为两个分支;其中16株腐殖质类芽胞杆菌均归为一支,来源多样;10株台中类芽胞杆菌则集中分布在总混车间的人员手部表面和设备表面;推测人员与设备存在交叉污染。数据显示设备表面微生物检出主要分布在总混环节;可能原因是此环节涉及多种物料、车间人员、设备和空气等的频繁接触。从容器1和容器2表面分离的微生物占总混环节设备表面的46.67%,且在不同时期消毒前后均可在其表面分离到腐殖质类芽胞杆菌和台中类芽胞杆菌,提示同种微生物的持续性污染,可能与容器的清洗消毒不彻底、空气或物料长期存在该种菌株有关。此外,人员手部样本分离株中占优势的类芽胞杆菌与来源于容器的相同菌株亲缘关系非常相近,推测容器是微生物污染源,通过接触人员手部进行传播。袁先铃等[15]对富顺香辣酱生产环境的致病菌进行溯源分析,发现从生产人员手上分离出的3株不动杆菌与原辅料分离的不动杆菌有很高的同源性,原辅料是污染源,人员流动易造成交叉污染。喻世哲等[16]除了对低盐腐乳生产车间主要接触面进行微生物检测外,还研究了车间空气、生产过程中的原辅料、半成品和成品中微生物负载情况,结果显示接触面和操作人员手部容易带入微生物。针对生产接触面,企业应适当增加消毒频率和定期更换消毒剂,同时对于污染严重及关键控制点应用强效消毒剂,并对清洗消毒规程进行消毒效果验证;同时,严格规范进入生产车间人员的清洁消毒程序。
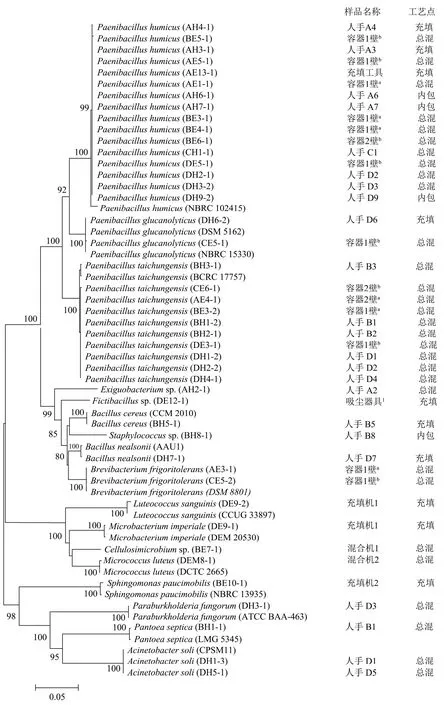
图1 16S rRNA基因序列系统发育树 Fig.1 Phylogenic tree of 16S rRNA sequence

表5 类芽胞杆菌的两种鉴定方法结果比较 Table 5 Comparison of the results of two identification methods for Paenibacillus sp.
2.4 16S rDNA与MALDI-TOF MS方法对类芽胞杆菌鉴定比较分析
类芽胞杆菌在分离株中数量最多,分布最广,采用MALDI-TOF MS方法对其进行鉴定及分析,该法对16株腐殖质类芽胞杆菌和2株解葡聚糖类芽胞杆菌可鉴定至种水平,分值均>2.00,与16S rDNA鉴定结果一致,但对10株台中类芽胞杆菌则鉴定为饲料类芽胞杆菌(Paenibacillus pabuli),分值在1.85~1.99,只可作为属水平报告,造成这一结果主要是因为MALDI-TOF MS数据库中无台中类芽胞杆菌的质谱信息。为了满足更多菌株的鉴定需求,可通过拓展数据库来提高MALDI-TOF MS方法对生产常见微生物的菌种鉴定能力[17-19]。
基于28株类芽胞杆菌的蛋白指纹特征质谱图将进行聚类分析(图2)和PCA分析(图3),发现28株类芽胞杆菌(包括2株解葡聚糖类芽胞杆菌、10株台中类芽胞杆菌和16株腐殖质类芽胞杆菌)被分成了5个聚类;PCA分析中10株台中类芽胞杆菌中有3株(CE6-1、DH2-2和BH3-1)与其它7株有区别,这与聚类分析的结果一致;16株腐殖质类芽胞杆菌中有2株与其他14株可以区分,但这16株菌株的PC1、PC2、PC3均集中靠拢。对比分子系统发育树,通过蛋白质特征图谱在一定程度上能更好地区分亲缘关系相近的类芽胞杆菌。

图2 类芽胞杆菌聚类分析结果 Fig.2 Dendrogram results of Paenibacillus sp.
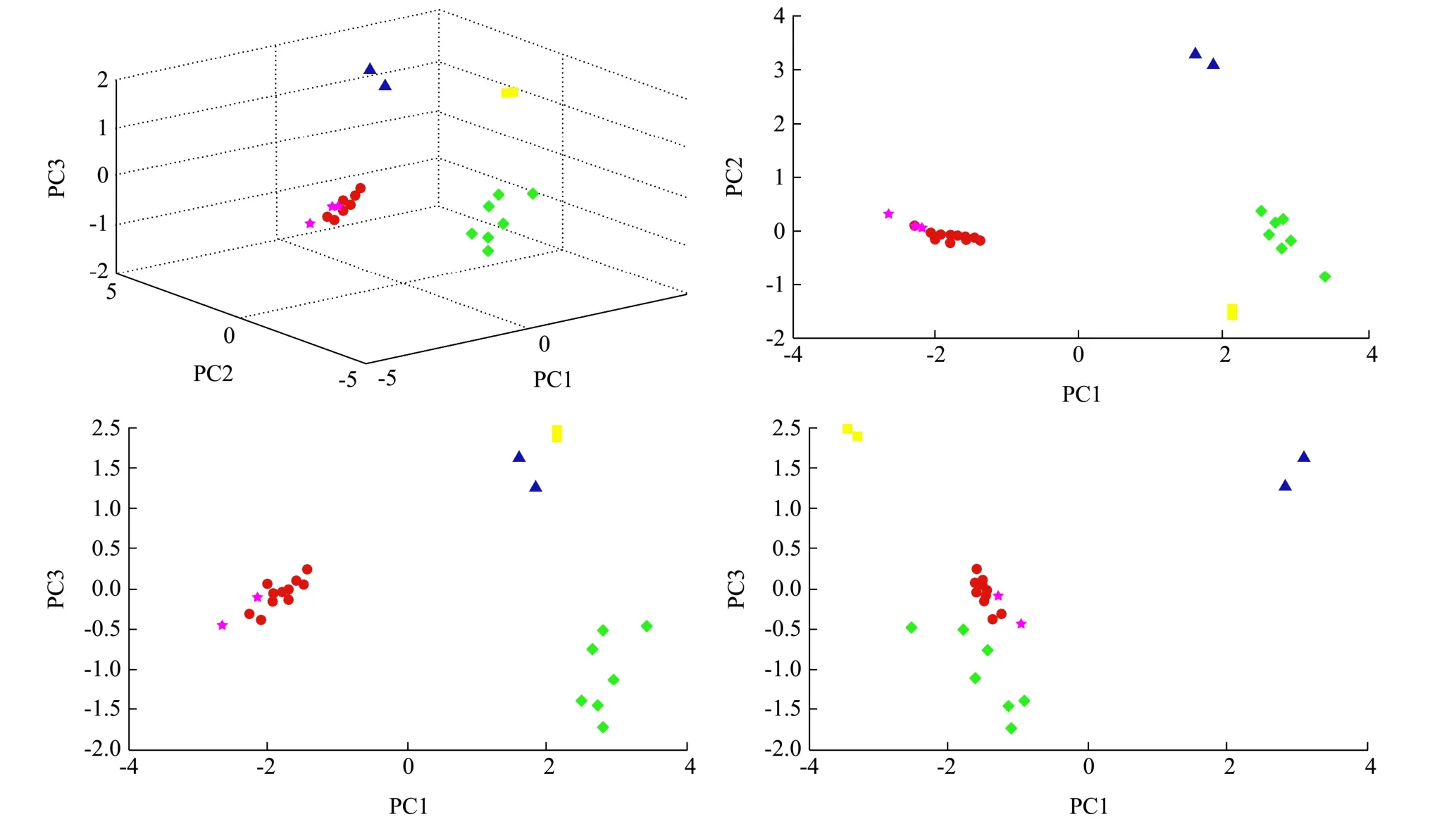
图3 类芽胞杆菌PCA结果 Fig.3 PCA results of Paenibacillus sp.
3 结论
3.1 对生产过程中车间人员手部和生产设备表面进行微生物污染调查,结果显示样本均未检出大肠杆菌和金黄色葡萄球菌,说明车间人员手部和生产设备表面食源性致病菌污染控制良好;人员手部涂抹样本菌落总数介于10~107CFU/手,设备表面涂抹样本菌落总数介于10~104CFU/cm2。从样本中共分离出46株菌,其中类芽胞杆菌占60.87%;通过构建系统发育树,发现同种微生物高度相关,推测人员手部与设备表面存在微生物交叉污染。此外,作为产品生产过程中物料周转使用的容器可多次分离出类芽胞杆菌,提示容器是生产过程的污染源,建议增加容器消毒频率,必要时验证现有卫生消毒措施是否满足质量控制要求,同时需加强监督生产车间人员落实清洁消毒操作规范。
3.2 采用MALDI-TOF MS方法对腐殖质类芽胞杆菌和解葡聚糖类芽胞杆菌可鉴定至种水平,对台中类芽胞杆菌则鉴定仅鉴定到属水平,后续可通过自建库扩大该法的微生物鉴定范围;基于基因序列和蛋白指纹图谱的微生物溯源分析结果基本一致,采用MALDI -TOF MS方法鉴定微生物操作更为简单,适于高通量检测,该技术可作为胶囊剂型保健食品生产环境的微生物快速鉴定和溯源分析的一种手段。

