牦牛乳硬质干酪苦味肽RK7的抗氧化活性及其机制
杨保军,梁 琪*,宋雪梅
(1 甘肃农业大学食品科学与工程学院 兰州 730070 2 甘肃省功能乳品工程实验室 兰州 730070)
干酪成熟过程中酪蛋白发生降解,肽是酪蛋白降解后暂存的中间产物。Huma 等[1]研究发现水牛乳和普通牛乳Cheddar 干酪水溶性多肽均对结肠癌细胞产生的自由基具有抑制作用。自由基是人体内细胞代谢产生的中间产物,体内过量产生自由基会使细胞内多种物质(DNA、蛋白质和脂质等)发生氧化应激反应,致机体代谢紊乱。预防体内自由基过量产生(即抗氧化)对维持人体健康具有重要意义。
国内外研究表明,对抗氧化至关重要的信号通路由长寿酶家族sirtuins(SIRT1-7)和单磷酸腺苷激活的蛋白激酶(AMPK)介导[3]。机体中的组蛋白虽可参与到调节蛋白分子活性、稳定性以及相关激活因子和相关转录因子之中实现抗氧化,但前提是让SIRT1-7 作为乙酰化酶催化组蛋白发生乙酰化反应[2]。烟酰胺腺嘌呤二核苷酸(NAD+)具有承载和转移氢原子的作用,是SIRT1-7 介导的信号通路发生乙酰化不可缺少的辅助因子,NAD+含量与抑制机体氧化反应发生程度成正比,NAD+含量的调节可通过控制NAD+合成酶或NAD+降解酶活性来进行[3]。体内细胞氧化应激反应、细胞以及整个机体能量代谢、细胞自噬降解以及应激耐受等过程同样受AMPK 介导的信号通路的调控[4]。调控因子Keap1 和转录因子Nrf2 是AMPK 信号通路下重要抗氧化调控途径Keap1-Nrf2 中的两个关键性蛋白分子,体内抗氧化应激反应可以被Nrf2 激活,自然条件下Nrf2 与Keap1 的特定区域结合,促进Nrf2 降解[3]。生物活性肽的抗氧化作用主要归因于Keap1-Nrf2 信号通路的激活[5]。Tonolo等[6]研究表明牛乳来源的生物活性肽KVLPVPEK能够阻碍Nrf2 与Keap1 的相互作用,上调相关抗氧化酶的表达。通过提供小分子抗氧化物质阻止Nrf2 与Keap1 蛋白结合位点的结合来维持高Nrf2水平,可增强机体抗氧化效果。
牦牛乳硬质干酪营养丰富,成熟期长,且原料乳中有较高含量的酪蛋白 (约占总蛋白含量的80%,且以α-酪蛋白和β-酪蛋白为主)。宋雪梅等[7]研究表明15 ℃成熟4 个月的牦牛乳硬质干酪中水溶性多肽对1,1-二苯基-2-三硝基苯 (1,1-Diphenyl-2-picrylhydrazyl,DPPH)自由基清除率最高(30.20%)。豆佳毓等[8]研究表明脱脂牦牛乳硬质干酪4 ℃成熟4 个月时水溶性多肽的DPPH 自由基清除率、超氧阴离子自由基(O2-·)清除率和羟自由基 (·OH) 清除率分别为52.39%,63.27%和49.54%。乳源活性肽主要源自αS1-酪蛋白,其次为β-酪蛋白和αS2-酪蛋白,少部分来自κ-酪蛋白,一般由2~20 个氨基酸发生缩合反应形成肽链,且分子质量小于6 000 u[9]。宋雪梅等[10]经葡聚糖凝胶(Sephadex G-25) 色谱和液相色谱-串联质谱(LC-MS/MS)从牦牛乳硬质干酪中鉴定出14 种苦味肽,其中RPKHPIK(RK7)来源于αS1-酪蛋白,分子质量为875.09 u,疏水性平均值(Q)为7 415.18 J/mol。Timon 等[11]指出不同凝乳酶干酪中分子质量小于3 000 u 的多肽都具有抗氧化作用,且主要源自αS1-酪蛋白。BIOPEP 数据库是目前最全面的生物活性肽数据库[12],截止2021年4月共记录689种序列已知的抗氧化肽,将RK7 与该数据库中抗氧化活性已知的肽序列比对后发现:其最高相似度为0,RK7 极有可能是一种新型天然抗氧化肽。分子对接已被用于寻找能与靶蛋白相互作用的多肽并说明其生物学机制。目前对牦牛乳硬质干酪中苦味肽的抗氧化机制尚无报道。本试验中主要研究体外合成牦牛乳硬质干酪苦味肽RK7 的抗氧化活性,然后利用分子对接软件研究其在SIRT1-7 和AMPK 信号通路介导下的抗氧化机制,为从分子水平分析和解释苦味肽的抗氧化性提供基础数据。
1 材料和方法
1.1 试验工具和材料
1.1.1 试验工具 Discovery Studio Client v16.1.0
(DS)软件,主要用于蛋白质结构功能研究和药物设计[13]。
1.1.2 试验材料 本试验以项目组前期从牦牛乳硬质干酪中鉴定出的苦味肽RPKHPIK (RK7)为研究对象【注:R-精氨酸(Arg),P-脯氨酸(Pro),K-赖氨酸 (Lys),H-组氨酸 (His),I-异亮氨酸(Ile)】,RK7 由生工生物工程(上海)股份有限公司合成,为后续的研究提供材料和基础。
1.1.3 试剂与设备 无水乙醇,天津市光复科技有限公司;DPPH、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸 (ABTS)、L-氧化型谷胱甘肽(GSSH),上海源叶生物科技有限公司;过硫酸钾(K2S2O8),天津市化学试剂三厂;以上试剂均为分析纯级。酶标仪(VersaMax),上海光谱仪器有限公司。
1.2 试验方法
1.2.1 RK7 分子特性预测 https://pepcalc.com用于计算肽的等电点和净电荷[14];https://web.expasy.org/protparam/用于计算肽的不稳定性指数(不稳定性指数低于40 预示该肽可能是稳定的,不稳定性指数高于40 则预示蛋白质或肽可能不稳定)[14];https://www.peptide2.com 用于计算肽的疏水性氨基酸比例[14];http://bioware.ucd.ie /~compass/biowareweb/用于预测肽的潜在生物学活性[15];http://www.innovagen.com/proteomics-tools 用 于 预测肽的溶解度[15];http://lmmd.ecust.edu.cn/admetsar1 /predict/?smiles=RPKHPIK& action=A 用于计算肽的ADMET 性质(包括人体肠道吸收能力、血脑屏障穿透能力、急性口腔毒性等)[15]。
1.2.2 RK7 抗氧化活性测定
1.2.2.1 DPPH 自由基清除活性 参考Sharma等[16]的方法并略作改动。DPPH 自由基清除率公式为:
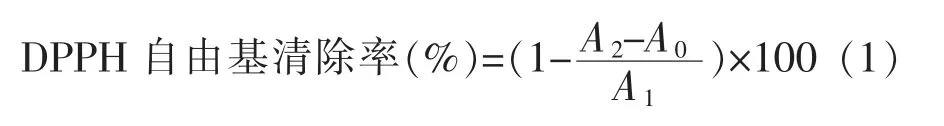
式中,A0——样品对照 (蒸馏水与乙醇混匀)的OD 值;A1——空白 (蒸馏水代替样品) 的OD值;A2——待测样液 (样品与DPPH 反应液混匀)的OD 值。
1.2.2.2 ABTS 自由基清除活性 参考张雪娇等[17]的方法并略作改动。ABTS 自由基清除率公式为:
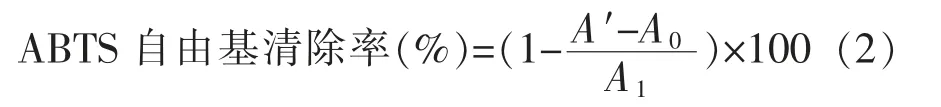
式中,A0——样品对照 (蒸馏水与乙醇混匀)的OD 值;A1——空白 (蒸馏水代替样品) 的OD值;A'——待测样液(样品与ABTS+·工作液混匀)的OD 值。
1.2.3 RK7 抗氧化机制研究
1.2.3.1 结构优化 考虑到RK7 极有可能是一种新型抗氧化肽,为了提供足够的理论依据,抗氧化机制研究中也以GSSH 作为阳性对照。RK7 和GSSH 的分子结构式如图1所示。在DS 软件的Macromolecules 模块中构建肽的三维结构,在Small molecules 模块、CHARMm 力场下对其进行能量最小化处理,以便后续的分子对接,其它参数均为默认。
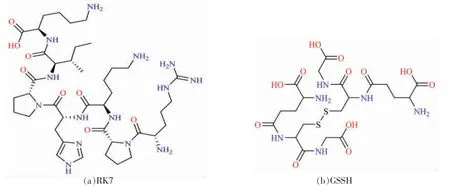
图1 RK7 和GSSH 的分子结构Fig.1 Molecular structure of RK7 and GSSH
1.2.3.2 准备受体蛋白 参考杨小翠[3]的方法,从Protein Data Bank 数据库(www.rcsb.org)中下载受体分子CD38 (NAD+降解酶,PDB ID:3DZK)和Keap1(胞质接头蛋白,PDB ID:2FLU)蛋白晶体的X 射线衍射三维结构并作进一步处理,具体处理方法参考文献[18]1.2.3 节所述内容。
1.2.3.3 分子对接 DS 软件中的分子对接工具LibDock 适用于对功能肽快速精确的虚拟筛选[13],因此本试验采用该方法,详细步骤参考文献[19]1.2.4 节所述内容。
2 结果分析
2.1 RK7 体外合成与分析
采用固相合成技术合成牦牛乳硬质干酪中的苦味肽RK7,经质谱检测和HPLC 分析可知RK7的合成纯度为99.579%,相对分子质量理论值为:875.063 u,实际值为:875.25 u,分子质量与理论值基本一致,达到了预期标准。预测计算RK7 的理化特性可知其等电点为11.57,净电荷为3.1,不稳定性指数为19.84(不稳定性指数小于40,预示该肽可能是稳定的),疏水性为42.86%,生物活性评分为0.404,显示出良好的水溶性。口服小分子生物活性肽主要通过肠道吸收且生理屏障限制了大多数化合物,通过预测RK7 的ADMET 性质发现其小肠吸收能力 (HIA) 为0.9072+(吸收率>30%),血脑屏障穿透能力(BBB)为0.9701-(透过性<30%),急性口腔毒性为0.6259(无毒)。因此可将其用于抗氧化活性测定试验。
图2 合成肽RK7 基峰离子流色谱图Fig.2 Base peak ion chromatogram of synthetic peptide RK7
2.2 RK7 抗氧化活性
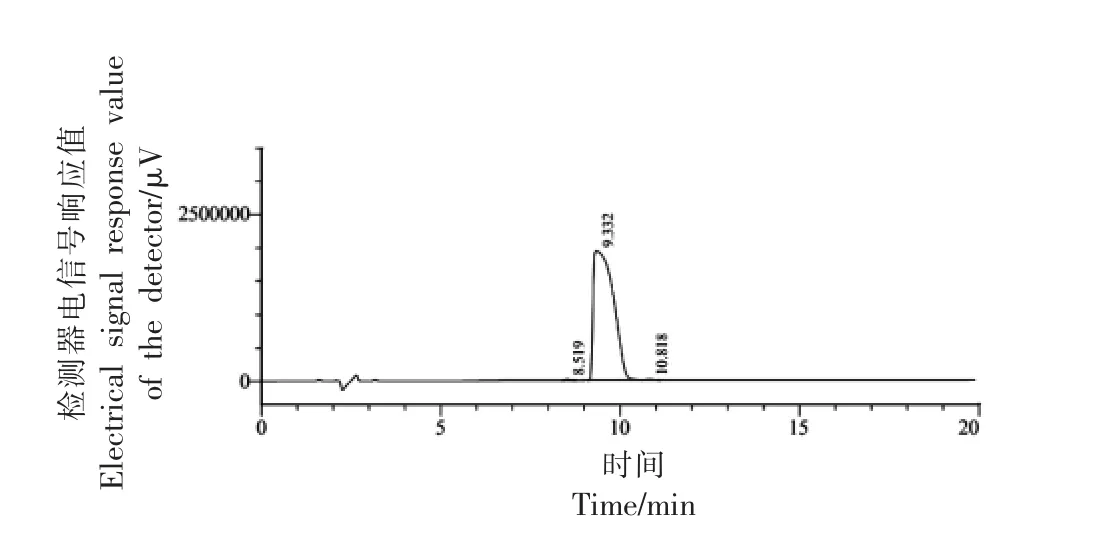
图3 合成肽RK7 高效液相色谱图Fig.3 High performance liquid chromatogram for synthetic peptide RK7
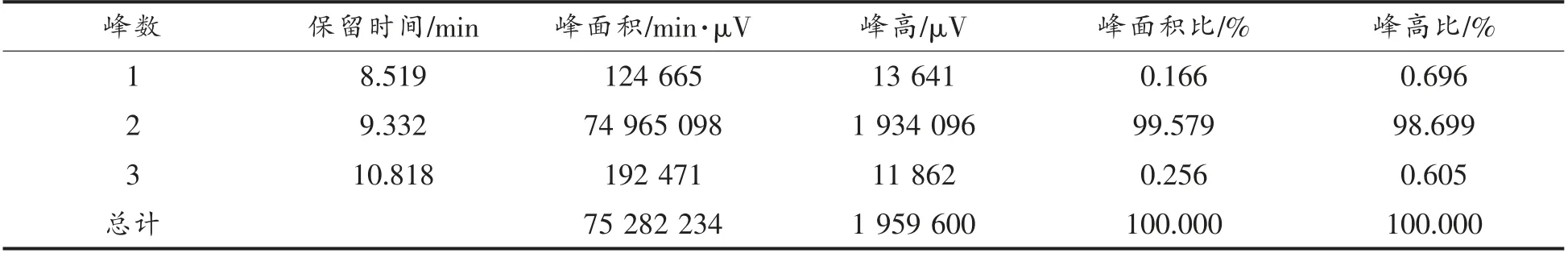
表1 RK7 的HPLC 结果积分表Table 1 Score table for HPLC results about RK7
2.2.1 DPPH 自由基清除能力 苦味肽RK7 的DPPH 自由基清除率曲线为y=-40.49x2+99.39x-5.36 (R2=0.9957),GSSH 的DPPH 自由基清除率曲线为y =-54.06x2+ 117.95x-4.05 (R2=0.9946),RK7 和GSSH 的DPPH 自由基清除率IC50分别为0.85 mg/mL 和0.65 mg/mL。肽质量浓度在0.2~1.0 mg/mL 范围内变化时,RK7 的DPPH自由基清除率范围为12.26%~53.78%,GSSH 的DPPH 自由基清除率范围为16.54%~60.58%。苦味肽RK7 具有很好的DPPH 自由基清除能力,且DPPH 自由基清除能力随着肽质量浓度的增加而增强。
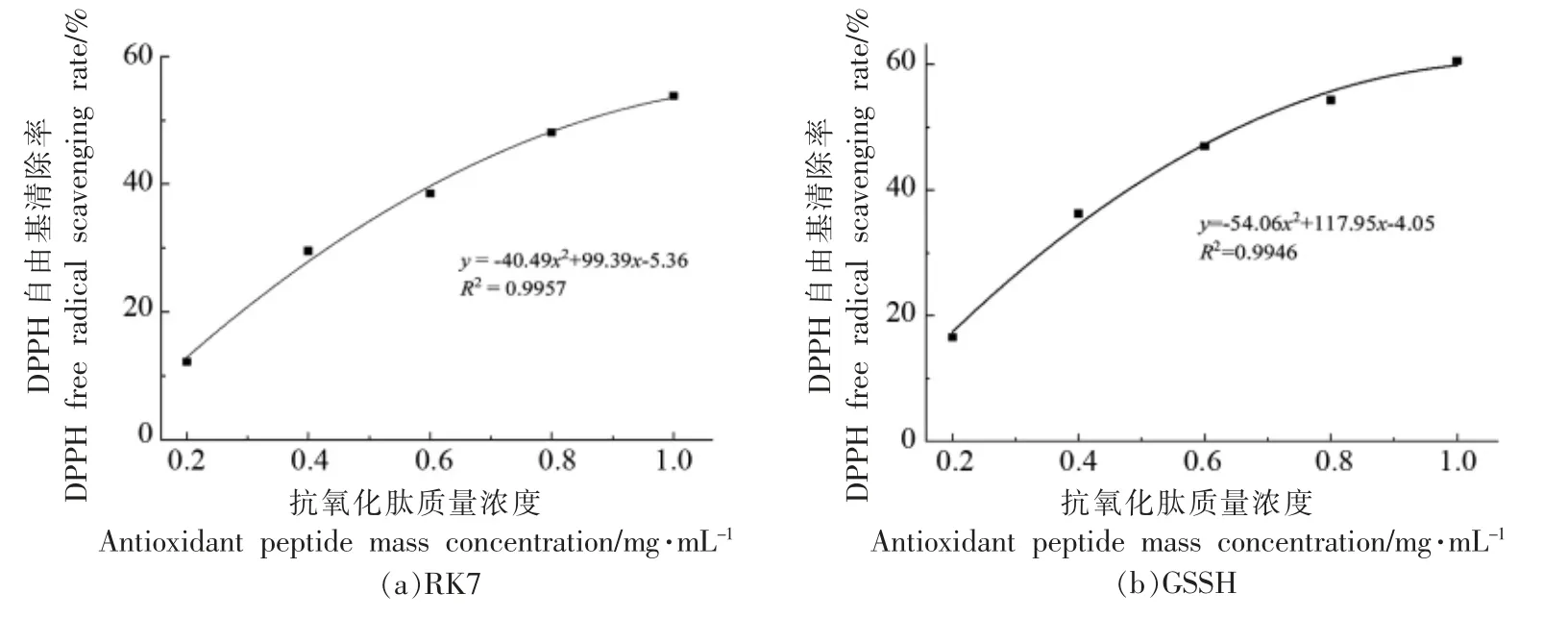
图4 肽质量浓度对DPPH 自由基清除率的影响Fig.4 The effect of peptide mass concentration on the scavenging rate of DPPH free radicals
2.2.2 ABTS 自由基清除能力 苦味肽RK7 的ABTS 自由基清除率曲线为y=-6.98x2+16.71x+78.02(R2=0.9826),GSSH 的ABTS 自由基清除率曲线为y =-11.76x2+ 29.96x + 78.81 (R2=0.9975)。肽质量浓度在0.2~1.0 mg/mL 范围内变化时,RK7 的ABTS 自由基清除率范围为80.86%~87.86%,GSSH 的ABTS 自由基清除率范围为84.16%~97.12%,这说明苦味肽RK7 具有很强的ABTS 自由基清除能力,且ABTS 自由基清除能力随着肽质量浓度的增加而增强。
2.3 RK7 抗氧化机制
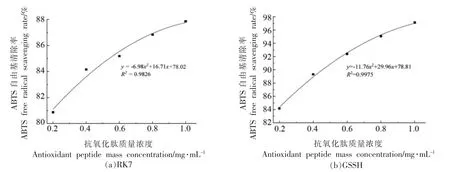
图5 肽质量浓度对ABTS 自由基清除率的影响Fig.5 The effect of peptide mass concentration on the scavenging rate of ABTS free radicals
2.3.1 寻找受体结合区 借助DS 软件中的Define and Edit Binding Site 工具寻找受体中的空腔,以此来寻找受体中可能的结合部位。图6a 为3DZK 的三维构象,图6b 为2FLU 的三维构象,经过处理后系统视图中均自动添加5 个结合位点(Site 1~5),即找到了5 个可能的结合区域。
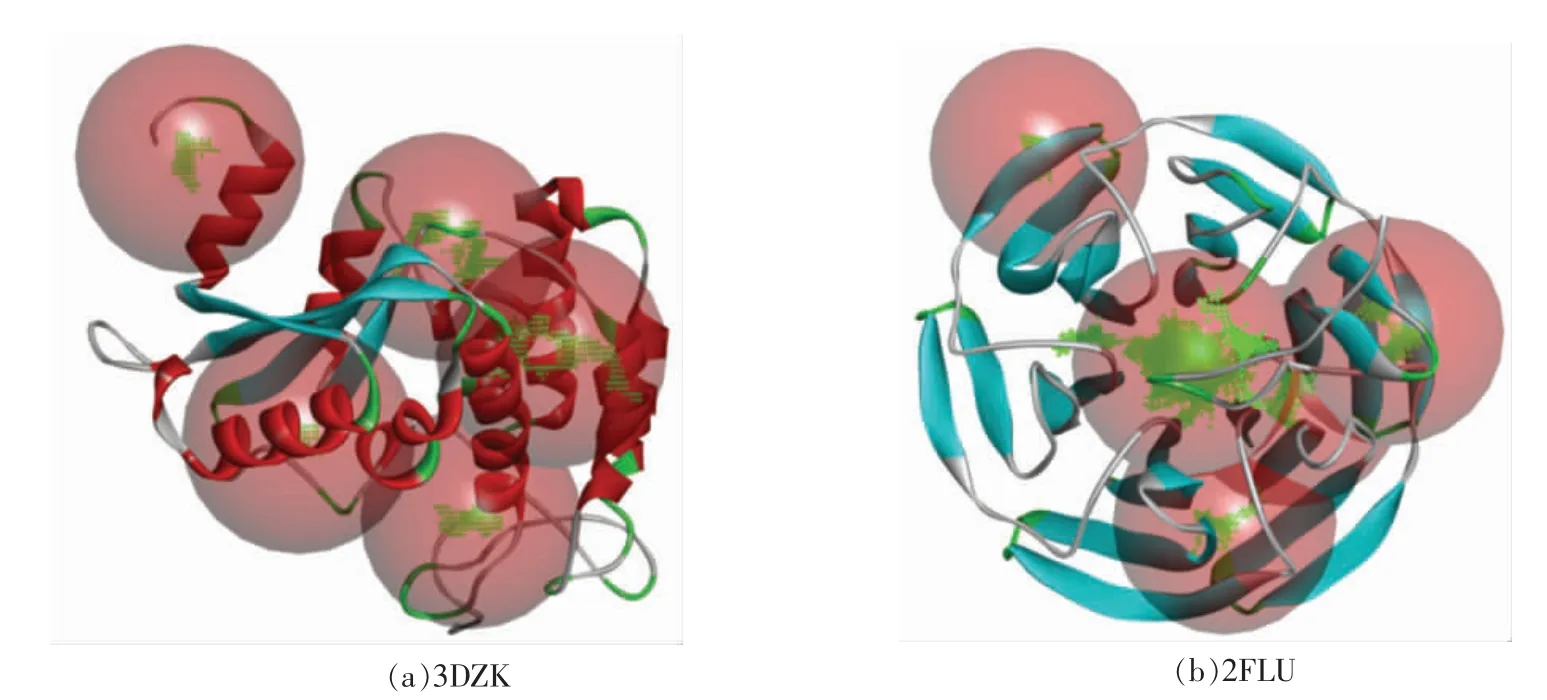
图6 受体结合区域图Fig.6 Receptor binding region map
2.3.2 抗氧化肽分子对接的可视化分析
2.3.2.1 抗氧化肽抑制CD38 活性分析 RK7 与3DZK 对接后得到3 个对接构象,其中Site 1 区域包含2 个对接构象,Site 5 区域包含1 个对接构象,最佳对接构象位于Site 1 区域(X:-11.93,Y:-1.30,Z:0.38,R:10 Å),对接得分为166.69,结合能为20.88 kJ/mol,最佳对接构象如图7所示。
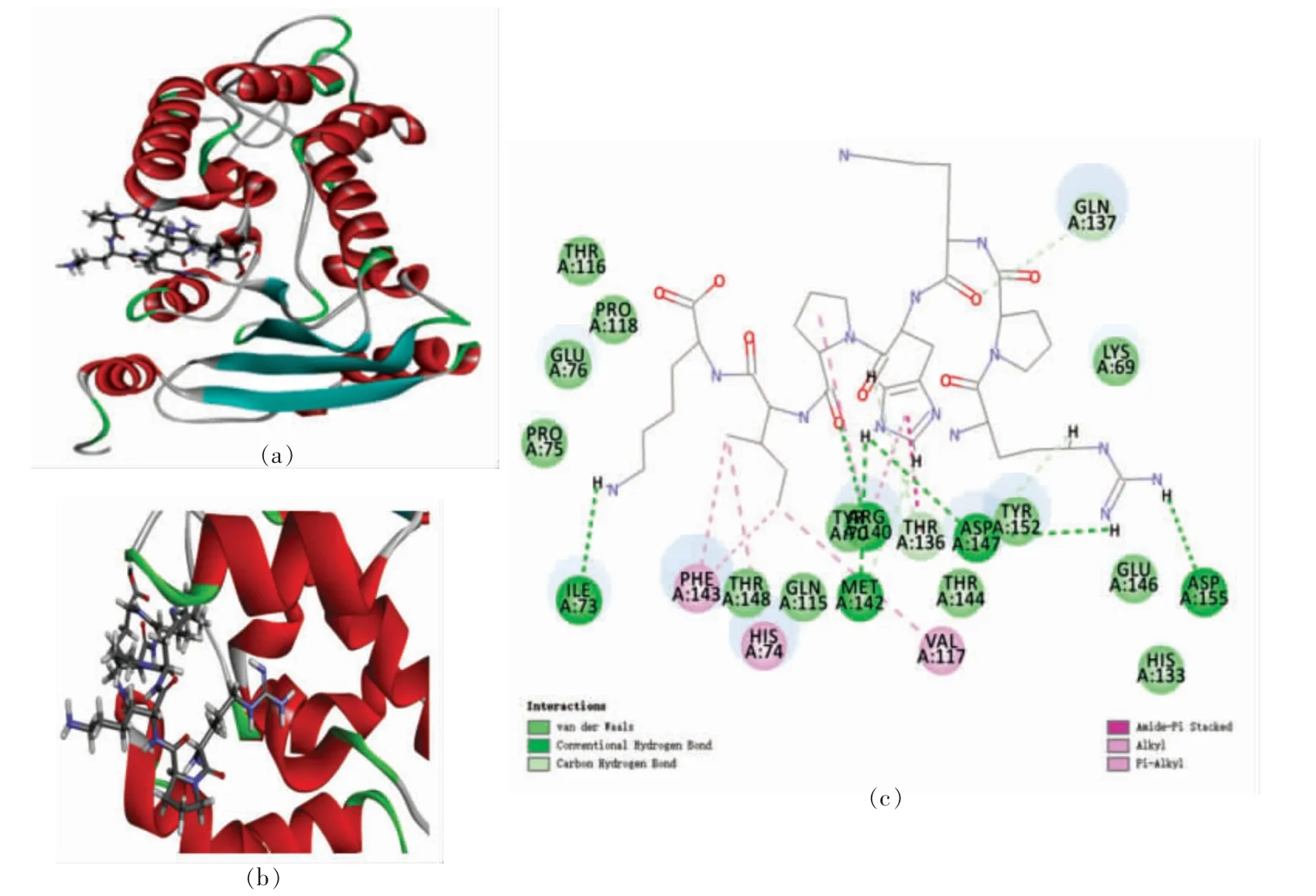
图7 RK7 与3DZK 之间的相互作用图Fig.7 Interaction map between RK7 and 3DZK
由图可知,RK7 与3DZK 的氨基酸残基Ile73(5.22 Å)、Arg140(4.14 Å)、Met142(6.93 Å)、Asp147(4.21 Å/3.92 Å)和Asp155(4.47 Å)之间形成了6个不同距离的氢键,其中RK7 和Asp147 氨基酸残基之间含有2 个氢键;RK7 与氨基酸残基Thr136(3.72 Å)、Gln137(3.49 Å)、Met142(6.95 Å)和Asp147(4.03 Å)形成范德华力或碳氢键,与氨基酸残基Thr136(5.02 Å)形成Amide-Pi Stacked相互作用,与氨基酸残基Val117 (5.09 Å)和Arg140(4.11 Å)形成Alkyl 相互作用,与氨基酸残基His74(6.12 Å)、Arg140(4.98 Å)和Phe143(4.84 Å/5.00 Å)形成Pi-Alkyl 相互作用。
GSSH 与3DZK 对接后得到34 个对接构象,其中Site 1 区域包含10 个对接构象,Site 2 区域包含10 个对接构象,Site 3 区域包含10 个对接构象,Site 4 区域包含1 个对接构象,Site 5 区域包含3 个对接构象,最佳对接构象位于Site 1 区域(X:-11.93,Y:-1.30,Z:0.38,R:10 Å),对接得分为158.35,结合能为2.93 kJ/mol,最佳对接构象如图8所示。
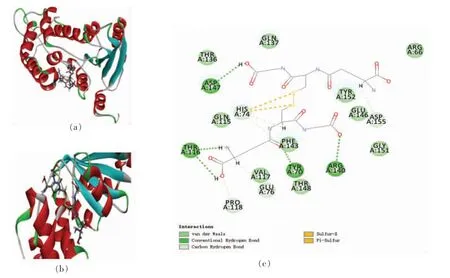
图8 GSSH 与3DZK 之间的相互作用图Fig.8 Interaction map between GSSH and 3DZK
由图可知,GSSH 与3DZK 的氨基酸残基Tyr70(6.14 Å)、Thr116(3.90 Å/4.06 Å)、Arg140(3.56 Å)和Asp147(4.62 Å)之间形成了5 个不同距离的氢键,其中GSSH 和Thr116 氨基酸残基之间含有2 个氢键,与Arg140 之间形成的氢键最短,结合最紧密;GSSH 与氨基酸残基His74(4.67 Å/4.77 Å)、Glu76 (5.28 Å)、Pro118 (4.26 Å) 和Asp155(3.39 Å)形成范德华力或碳氢键,与氨基酸残基His74(5.73 Å/6.42 Å)形成Sulfur 相互作用。
2.3.2.2 抗氧化肽抑制Keap1 活性分析 RK7 与2FLU 对接后得到1 个对接构象,该构象位于Site 2 区域(X:8.33,Y:13.99,Z:20.41,R:9 Å),对接得分为108.15,结合能为20.88 kJ/mol,对接构象如图9所示。
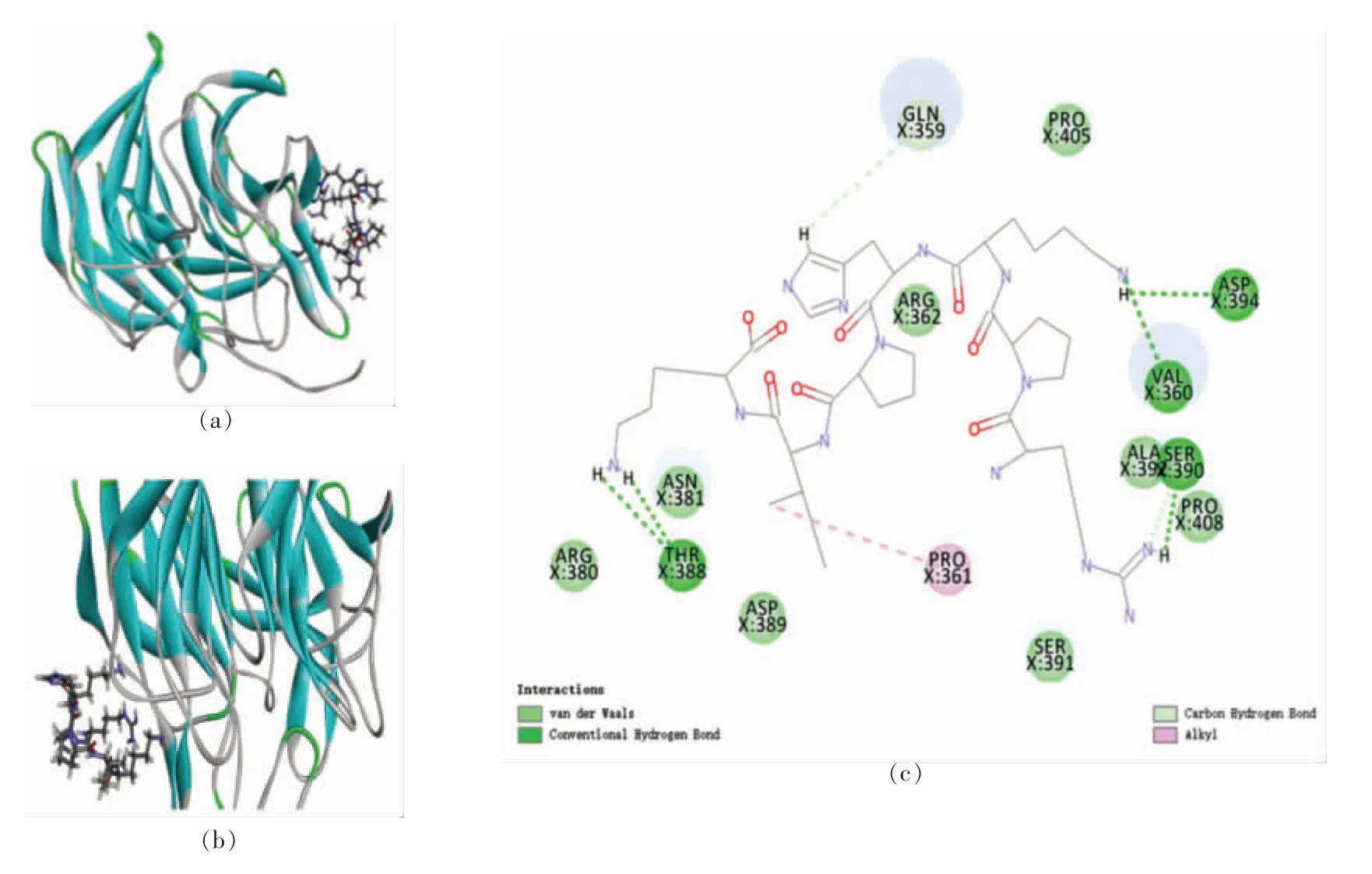
图9 RK7 与2FLU 之间的相互作用图Fig.9 Interaction map between RK7 and 2FLU
由图可知,RK7 与2FLU 的氨基酸残基Val360 (3.80 Å)、Thr388 (4.51 Å/4.12 Å)、Ser390(3.88 Å)和Asp394(4.99 Å)形成5 个不同距离的氢键,其中RK7 和Thr388 氨基酸残基之间含有2个氢键,与Val360 之间形成的氢键最短,结合最紧密;RK7 与氨基酸残基Gln359 (3.43 Å)和Ser390(3.73 Å)形成范德华力或碳氢键,与氨基酸残基Pro361(4.21 Å)形成Alkyl 相互作用。
GSSH 与2FLU 对接后得到16 个对接构象,其中Site 2 区域包含6 个对接构象,Site 5 区域包含10 个对接构象,最佳对接构象位于Site 2 区域(X:8.33,Y:13.99,Z:20.41,R:9 Å),对接得分为140.90,结合能为2.93 kJ/mol,最佳对接构象如图10所示。
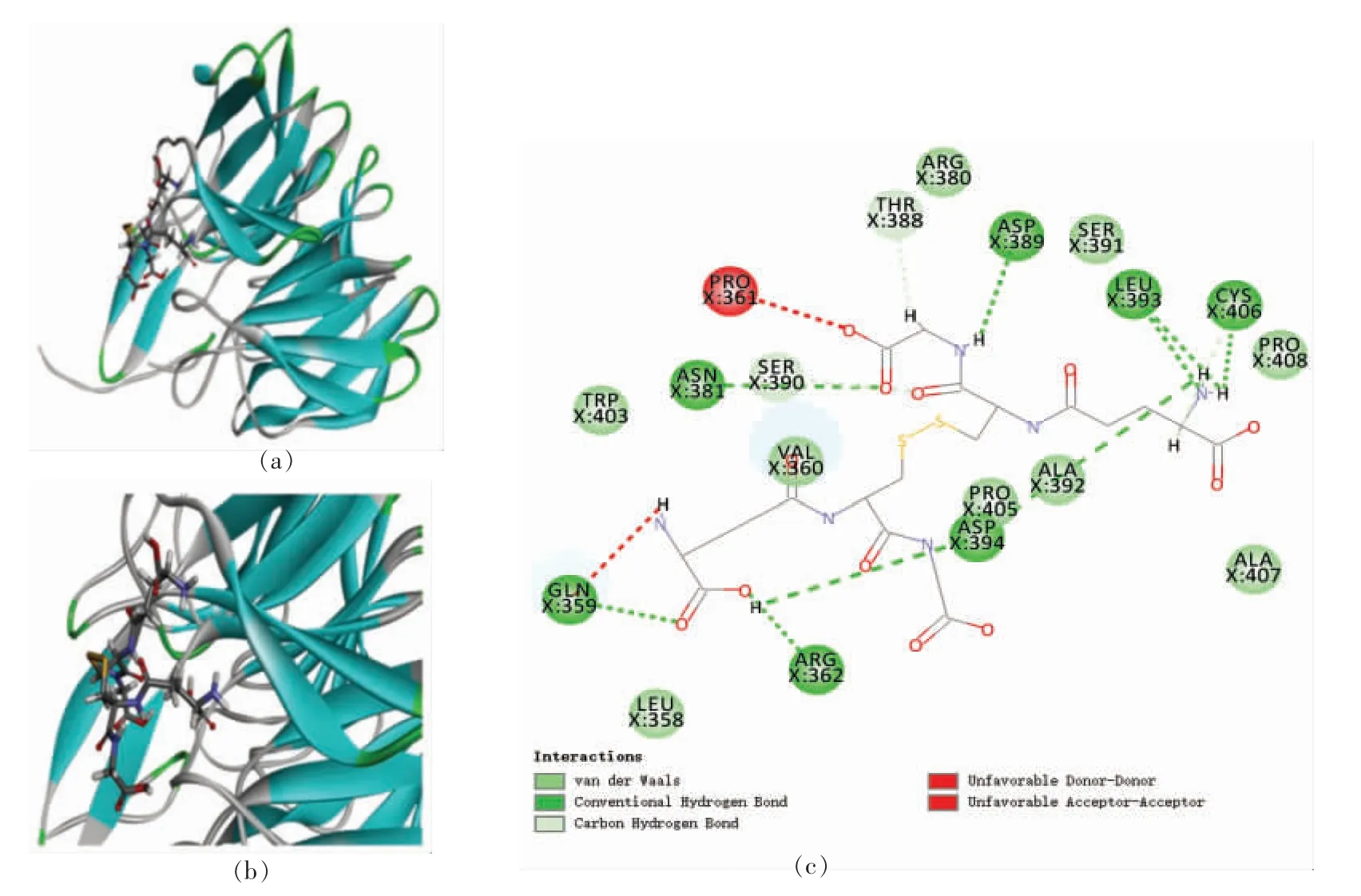
图10 GSSH 与2FLU 之间的相互作用图Fig.10 Interaction map between GSSH and 2FLU
由图可知,GSSH 与2FLU 的氨基酸残基Gln359 (4.31 Å)、Arg362 (4.66 Å)、Asn381(3.28 Å)、Asp389 (5.69 Å)、Leu393 (4.98 Å/5.22 Å)、Asp394(4.30 Å/4.67 Å)和Cys406(3.57 Å)形成9 个不同距离的氢键,其中GSSH 与Leu393 和Asp394氨基酸残基分别形成2 个氢键,与Asn381 之间形成的氢键最短,结合最紧密;GSSH 与氨基酸残基Arg362(4.66 Å)、Thr388(3.53 Å)、Ser390(4.07 Å)和Cys406(4.87 Å)形成范德华力或碳氢键。
3 讨论
肽的抗氧化性主要与其组成、结构(氨基酸残基结构)和疏水性有关[20]。王波[21]利用Caco-2 细胞模型研究了肽组分的分子质量大小、电荷性、疏水性对肽在小肠上皮细胞吸收转运以及生物利用度的影响,发现当肽组分分子质量<1 000 u、带有负电荷且是弱疏水性时,它的吸收率和抗氧化性保留率值高,而且生物利用度显著。陈冠群[22]利用氧化还原滴定法(微量高锰酸钾法、微量碘量法)和总抗氧化能力 (Total antioxidant capacity,TAOC)检测试剂盒法测定了22 种氨基酸(包括胱氨酸和羟脯氨酸)的抗氧化活性,结果发现色氨酸(Trp)、甲硫氨酸(Met)、酪氨酸(Tyr)、组氨酸(His)、赖氨酸(Lys)、半胱氨酸(Cys)6 种氨基酸具有较强的抗氧化活性。此外,组氨酸(His)的咪唑基可以提供孤对电子给亲电试剂(自由基),从而中和自由基,起到抗氧化作用[23]。精氨酸(Arg)能有效地提高机体总抗氧化能力,降低体内自由基含量,抑制活性氧(ROS)的生成与积累,增强内源性抗氧化酶【过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)等】活性,抑制氧化应激的产生[24]。本试验RK7 的分子质量为875.25 u,疏水性为42.86%,且表现出较好的生物学特性,RK7 序列中含有精氨酸 (Arg)、脯氨酸(Pro)、赖氨酸(Lys)、组氨酸(His)、异亮氨酸(Ile),个别氨基酸的抗氧化活性为RK7 具有抗氧化活性奠定了基础。
本研究以GSSH 为阳性对照,通过体外抗氧化活性测定试验发现RK7 具有较好的DPPH 和ABTS 自由基清除能力,其中RK7 的ABTS 自由基清除能力与Tonolo 等[6]研究的4 种合成肽ARHPHPHLSFM、AVPYPQR、NPYVPR 和KVLPVPEK 的ABTS 自由基清除能力基本一致。DPPH 和ABTS 自由基清除能力的不同趋势可能归因于两种测定方法的不同作用机制和DPPH、ABTS 自由基特性差异,ABTS 法可用于亲水性和亲脂性抗氧化体系的评价,DPPH 法仅适用于疏水性多肽[14,25]。有研究表,明ABTS 自由基清除能力与抗氧化活性之间有直接联系,半胱氨酸(Cys)、赖氨酸(Lys)、酪氨酸(Tyr)、甲硫氨酸(Met)、精氨酸(Arg)、苯丙氨酸(Phe)、组氨酸(His)、缬氨酸(Val)、色氨酸(Trp)具有ABTS 自由基清除能力[26]。
某些特定氨基酸有可能成为抗氧化肽的活性位点,包括亲核性的含硫氨基酸半胱氨酸(Cys)和甲硫氨酸(Met),芳香族氨基酸色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe),以及含咪唑基的氨基酸组氨酸(His)等[27]。分子对接可虚拟模拟分子间的相互作用,本试验通过分子对接研究发现,RK7能与3DZK 的氨基酸残基Met142 形成氢键、碳氢键或范德华力,与His74 和Phe143 形成Pi-Alkyl相互作用;GSSH 能与3DZK 的氨基酸残基Tyr70形成氢键,与His74 形成范德华力、碳氢键或Sulfur 相互作用;GSSH 能与2FLU 的氨基酸残基Cys406 形成氢键、碳氢键或范德华力。氢键相互作用对稳定对接络合物和酶催化反应起着最重要的作用[28]。3DZK 与RK7 和GSSH 分别形成6 个和5个氢键,其中3DZK 的氨基酸残基Arg140 和Asp147 是RK7 和GSSH 与3DZK 形成氢键的共同结合位点,RK7 与GSSH 表现出相同的作用机制,共同结合于3DZK 的Site 1 区域;2FLU 与RK7 和GSSH 分别形成5 个和9 个氢键,其中2FLU 的氨基酸残基Asp394 是RK7 和GSSH 与2FLU 形成氢键的共同结合位点,Ser390 是RK7和GSSH 与2FLU 形成范德华力或碳氢键的共同结合位点,RK7 与GSSH 表现出相同的作用机制,共同结合于2FLU 的Site 2 区域。综上可以确定RK7 主要通过调节SIRT1-7 和AMPK 信号通路发挥抗氧化作用。
4 结论
本试验以牦牛乳硬质干酪苦味肽RK7 为研究对象,经BIOPEP 数据库比对发现RK7 与数据库中抗氧化活性已知肽序列的最高相似度为0,所以推测RK7 为新型抗氧化肽;通过生物信息学网址提供的软件计算和预测发现RK7 表现出较好的生物学特性,经体外人工合成后测定其抗氧化活性,结果显示RK7 具有较强的DPPH 和ABTS 自由基清除能力;而后基于分子对接技术研究RK7 在SIRT1-7 和AMPK 信号通路介导下的抗氧化机制,结果表明RK7 均能和3DZK、2FLU形成稳定的配体-受体复合物构象,RK7 与GSSH表现出相似的作用机制,均结合于3DZK 和2FLU的活性空腔内。本试验仅局限于体外模拟,为更全面体现RK7 的抗氧化活性,下一步可将纯化肽进行动物体内模拟实验,为RK7 的深入应用提供科学依据。
——以高中化学“氢键”的教学为例

