急性捕食者气味暴露对丘脑室旁核-中央杏仁核通路活动影响研究
刘程煜,赵娟娟,王亚玲,李思雨,徐 衎,任栓成,高 东,唐 玲
400050 重庆,重庆医科大学附属康复医院1;401331 重庆,重庆医科大学附属大学城医院神经科2;400038 重庆,陆军军医大学(第三军医大学)基础医学院生理学教研室3;400042 重庆,陆军特色医学中心医学心理科4
应激是机体处于各种不利情况下所表现出的一种状态,这种状态有助于机体在短时间内处理各种突发事件。应激涉及自主行为变化和神经内分泌(即下丘脑-垂体-肾上腺轴)系统的激活。在急性暴露于应激事件中,个体除了表现出焦虑、恐惧等特定的行为变化外,其正常的睡眠觉醒行为受到明显影响,包括入睡困难、早醒、睡眠片段化等睡眠障碍,从而增加失眠的风险。觉醒系统过度激活与应激所致的睡眠障碍疾病密切相关。既往研究表明,下丘脑室旁核促肾上腺皮质激素释放激素神经元、外侧下丘脑神经降压素神经元促食欲素神经元等觉醒系统神经元在应激状态下被激活,参与应激条件下的觉醒调节。因此,研究急性应激下涉及的大脑相关觉醒系统活动的改变,有助于更好地阐明应激导致的睡眠觉醒异常的神经机制。
丘脑中线核团是觉醒上行网状激活系统的重要组成部分,包括丘脑室旁核(paraventricular thalamic nucleus,PVT)、中央内侧核(central medial thalamic nucleus,CM)、连接核(reuniens thalamic nucleus,Re)及菱形核(rhomboid thalamic nucleus,Rh)等。其中PVT位于丘脑中线核团的背侧,是控制觉醒的关键丘脑区域。激活PVT谷氨酸能神经元可诱导从睡眠到觉醒的快速转换,而抑制PVT可导致觉醒水平降低。PVT被认为是整合应激相关信号的重要节点,受各种应激源强烈激活从而引起适应性行为反应。PVT向大脑多个区域发出广泛投射,包括伏隔核、杏仁核、终纹床核和前额叶皮层等。值得注意的是,中央杏仁核(central amygdala,CeA)作为杏仁核信号的输出核团,在应激、先天性恐惧和焦虑行为中发挥重要作用。然而,PVT-CeA通路在应激过程中如何变化仍不清楚。
因此,本研究将野生型小鼠暴露于捕食者气味——2,4,5-三甲基噻唑(2,4,5-trimethylthiazole,TMT)中,建立急性应激模型,以揭示中线丘脑中参与急性应激反应的核团及其与CeA的神经通路。首先,我们在CeA注射逆行示踪染料揭示中线丘脑对CeA的神经投射特点。随后通过c-Fos表达作为神经元激活的标志物,对中线丘脑相关核团和杏仁核激活水平进行量化。最后采用染料逆行标记结合c-Fos染色及神经通路特异性的光纤钙信号记录研究CeA投射-PVT神经元在TMT刺激下的c-Fos表达模式和钙活动变化。本研究试图明确PVT对CeA的投射是否构成应激反应的神经通路,从而有助于理解应激源暴露时PVT涉及的神经通路改变。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级健康雄性C57BL/6J野生型小鼠(8~12周龄,体质量25~30 g)购自陆军军医大学实验动物中心。购买后小鼠适应性喂养1周,饲养环境符合标准实验室条件,水和食物自由获得。整个实验过程保持12 h光/暗循环。实验过程符合国家和有关单位实验动物管理和使用的规定,尽可能降低小鼠的痛苦和数量。
1.1.2 主要试剂 兔多克隆抗c-Fos抗体(ab190289,1∶1 000,美国Abcam)、驴抗兔488荧光二抗(A-21206,1∶800,美国Invitrogen)、免疫染色封闭液(P0102,上海碧云天)、免疫染色一抗稀释液(P0103,上海碧云天)、免疫染色二抗稀释液(P0265,上海碧云天)、2,4,5-三甲基噻唑(T1068,上海化成工业)、AAV-EF1α-DIO-GCaMp7b(PT-1423,武汉枢密)、AAV/retro-Syn-Cre(PT-0136,武汉枢密)、CTB555(C34776,1mg/μL,美国Lumaflouor)、RetroBeads(R180-1000,美国Lumaflouor)、核染料4,6-二脒基-2-苯基吲哚(Nuclear dye 4,6-Diamidino-2-phenylindole,DAPI,F6057,美国Sigma-Aldrich)。
1.2 方法
1.2.1 动物手术 野生型小鼠经异氟烷充分麻醉后,将其头部固定于脑立体定位仪上。剪去小鼠头颈部毛发,消毒手术区,沿中线剪开头皮,范围以充分暴露颅骨前囟和后囟为宜。清理颅骨表面结缔组织后,在手术显微镜下通过调整脑立体定位仪的双侧耳杆和鼻夹,使小鼠颅骨表面处于同一平面。参考第8版小鼠脑图谱,确定注射坐标PVT脑区(Bregma,AP=-1.20 mm;ML=0 mm;DV=-2.52 mm)、CeA脑区(Bregma,AP=-1.20 mm;ML=±2.80 mm;DV=-4.00 mm)。用颅骨钻在小鼠目标脑区上方钻1个直径约为1 mm的小孔。手术显微镜下看到脑组织表面后,清理周围碎骨,挑开硬脑膜。用开口直径约为20 μm的玻璃微电极将病毒或染料缓慢推进至目标脑区。停留5 min后开始注射,注射速度为30 nL/min。为了防止液体回吸,注射完成后将玻璃微电极留置10 min后再缓慢退出。消毒缝合创口,待小鼠复苏后,单笼饲养。
对于光纤钙信号记录,小鼠注射病毒3周后进行PVT光纤埋置,PVT 坐标同病毒注射。当光纤的尖端置于脑组织表面时,开始探测钙信号。缓慢植入光纤,实时观察钙信号变化。下降深度约为2.80~2.90 mm,待钙信号稳定且信噪比大于5%后停止下降光纤。清除颅骨表面血液,用紫外固化牙科水泥在光纤周围及颅骨表面均匀涂抹。待牙科水泥完全固定后, 消毒缝合创口。注射CTB555或RetroBeads逆行示踪剂后,需让其充分逆行标记3~5 d后才进行相应的实验。对于注射位点不准确的小鼠,不纳入统计分析。
1.2.2 行为学实验 对于免疫荧光染色实验,将10 μL的TMT滴加到2 cm×2 cm滤纸上,随后放入到实验小鼠的家笼里。对照组则是在相同大小的滤纸上将滴入等体积生理盐水。1.5 h后灌注取脑,进行免疫荧光染色;对于光纤钙信号记录,先将小鼠放到旷场里,适应周围环境3 min后,将滴有10 μL TMT的棉签放在小鼠鼻子前面3 s,每只小鼠连续重复至少3次,记录期间的钙信号变化,并由顶端的红外摄像头所记录。
在进行行为学实验前3 d,每天将小鼠移至行为实验室,并对小鼠进行10 min适应性抚摸、提尾等操作。为了避免昼夜节律带来的影响,所有行为学实验都在同一时间段进行。
1.2.3 免疫组织化学 c-Fos是一种即时早期基因,其产物c-Fos蛋白在各种因素刺激下常常表达增加,可作为神经元激活的分子标志物。对于c-Fos免疫荧光染色实验,在行为学实验结束后,小鼠经异氟烷充分麻醉,用50ml磷酸盐缓冲溶液(phosphate buffered solution,PBS)和50 mL 4%多聚甲醛溶液(paraformaldehyde,PFA)对小鼠进行心脏灌注。取下大脑,放置于4%PFA中后固定6 h,随后浸泡在30%蔗糖溶液中直至沉底。用冰冻切片机连续切片,厚度为30 μm。取每只小鼠相同层面的脑切片,先用PBS漂洗10 min×3次,随后加入封闭液在室温下封闭30 min,封闭完成后在一抗稀释液中,按1∶1 000加入兔多克隆抗c-Fos抗体。4 ℃过夜,第2天用PBS漂洗10 min×3次,随后加入驴抗兔488荧光二抗,室温下孵育2 h,孵育结束后,用PBS漂洗10 min×3次,DAPI染色封片。GCaMp7b通过自身荧光识别,无需抗体标记。用蔡司荧光显微镜拍摄目标脑区,高分辨率图像应用 Zeiss LSM800 共聚焦显微镜拍摄。每只小鼠脑区取6张脑片进行统计。
1.2.4 光纤钙信号数据分析 使用Inper Technology提供的脚本以40 Hz记录光纤钙信号。光纤钙信号的变化由ΔF/F=(F-F0)/F0公式计算。对原始数据采用基线矫正、噪声扣除和滤波处理。使用最小二乘回归法从488 nm信号中扣除410 nm信号。使用多项式拟合校正来减小长期记录造成的漂白效应。
1.3 统计学分析
所有数据均以表示。使用GraphPad Prism 8.0.1软件进行统计分析。两组间比较采用独立样本t
检验、配对t
检验。如果数据未通过Shapiro-Wilk正态性检验,则采用非参数检验。P
<0.05为差异具有统计学意义。2 结果
2.1 逆行染料示踪显示中线丘脑核团中投射到中央杏仁核的神经元
为研究丘脑中线核团与CeA可能存在的神经连接,利用逆行染料示踪技术,在野生型小鼠CeA中注射CTB555,从而特异性追踪投射到CeA的丘脑中线核团。经过3~5 d的表达后,对丘脑中线核团的胞体及CeA的注射位点进行检验。
结果显示,CTB555注射在CeA中且丘脑中线核团的神经元被CTB55标记,这些被标记的神经元主要集中在第三脑室下方的PVT脑区,且沿PVT脑区前中后轴都有分布。此外,少数丘脑中线核团投射到CeA的神经元分布在CM、Rh/Re脑区中部(图1)。这一结果表明存在丘脑中线核团到CeA的投射,且主要为PVT投射到CeA。
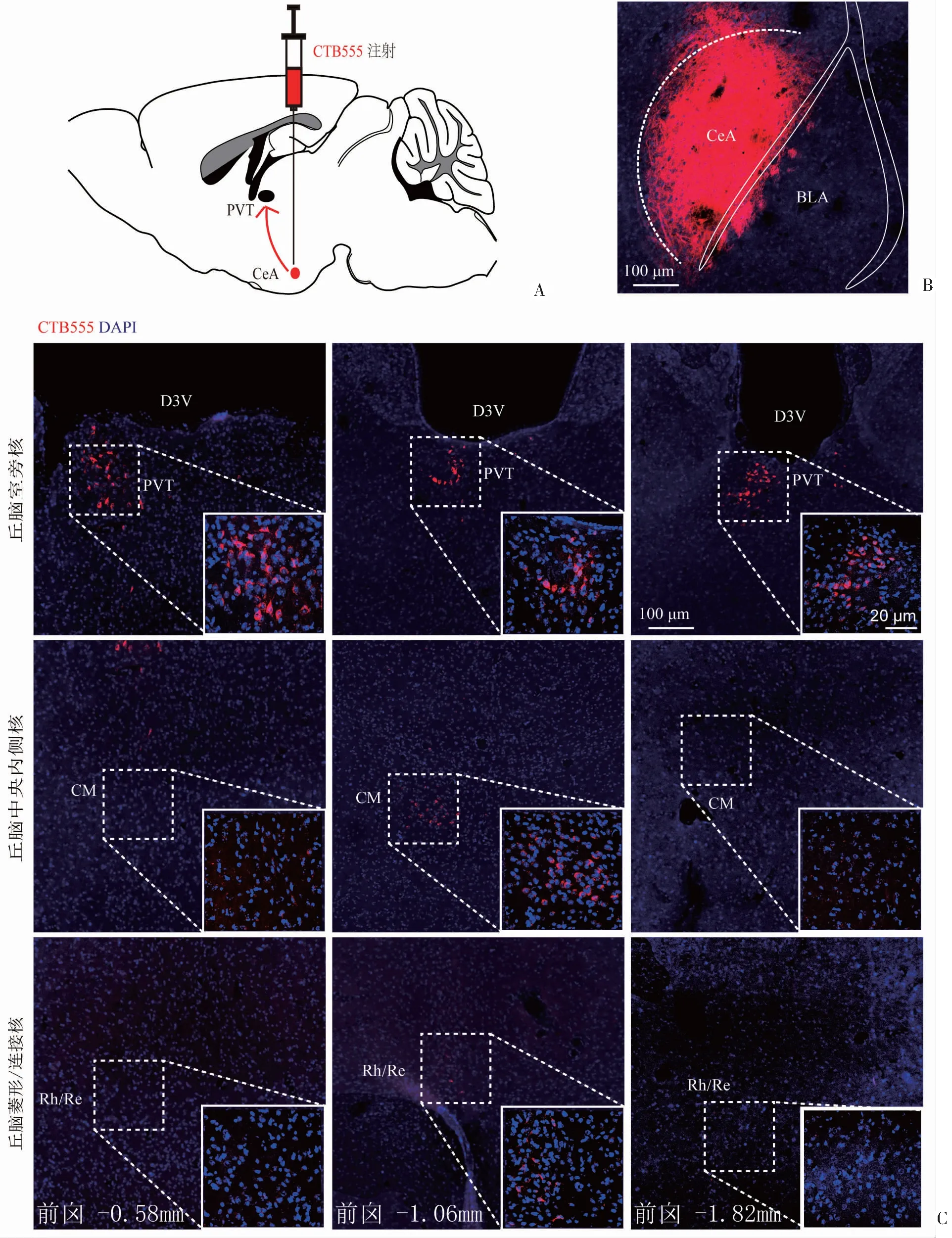
A:CTB555注射示意图;B:CTB555注射到CeA典型图;C:小鼠CeA注射CTB555后逆追到丘脑中线核团中神经元(红色)和DAPI(蓝色)的代表性图像,PVT、CM、Rh/Re区域,比例尺为100μm;右下:对PVT、CM、Rh/Re区域标记到的神经元进行放大,比例尺为20μm
2.2 急性应激对小鼠丘脑中线核团及杏仁核的c-Fos表达影响
为研究丘脑中线核团及杏仁核在急性应激下的神经元活动模式,通过免疫荧光染色方法来构建上述核团在急性应激下的c-Fos表达图谱。急性TMT暴露90 min后,免疫荧光结果显示:与生理盐水组相比,小鼠急性暴露于TMT应激下的丘脑中线核团及杏仁核的c-Fos表达明显增加(表1)。进一步对中线丘脑核团进行分区发现,急性暴露于TMT应激下,PVT脑区的c-Fos表达显著增加(P
<0.01);CM、Rh/Re脑区的c-Fos表达水平有增加的趋势,但差异无统计学意义(图2)。对杏仁核亚群进行区分发现,急性暴露于TMT应激下,CeA神经元的c-Fos表达显著增加(P
<0.05),而相邻的基底外侧杏仁核(basolateral amygdala,BLA)神经元c-Fos表达无明显变化(图1)。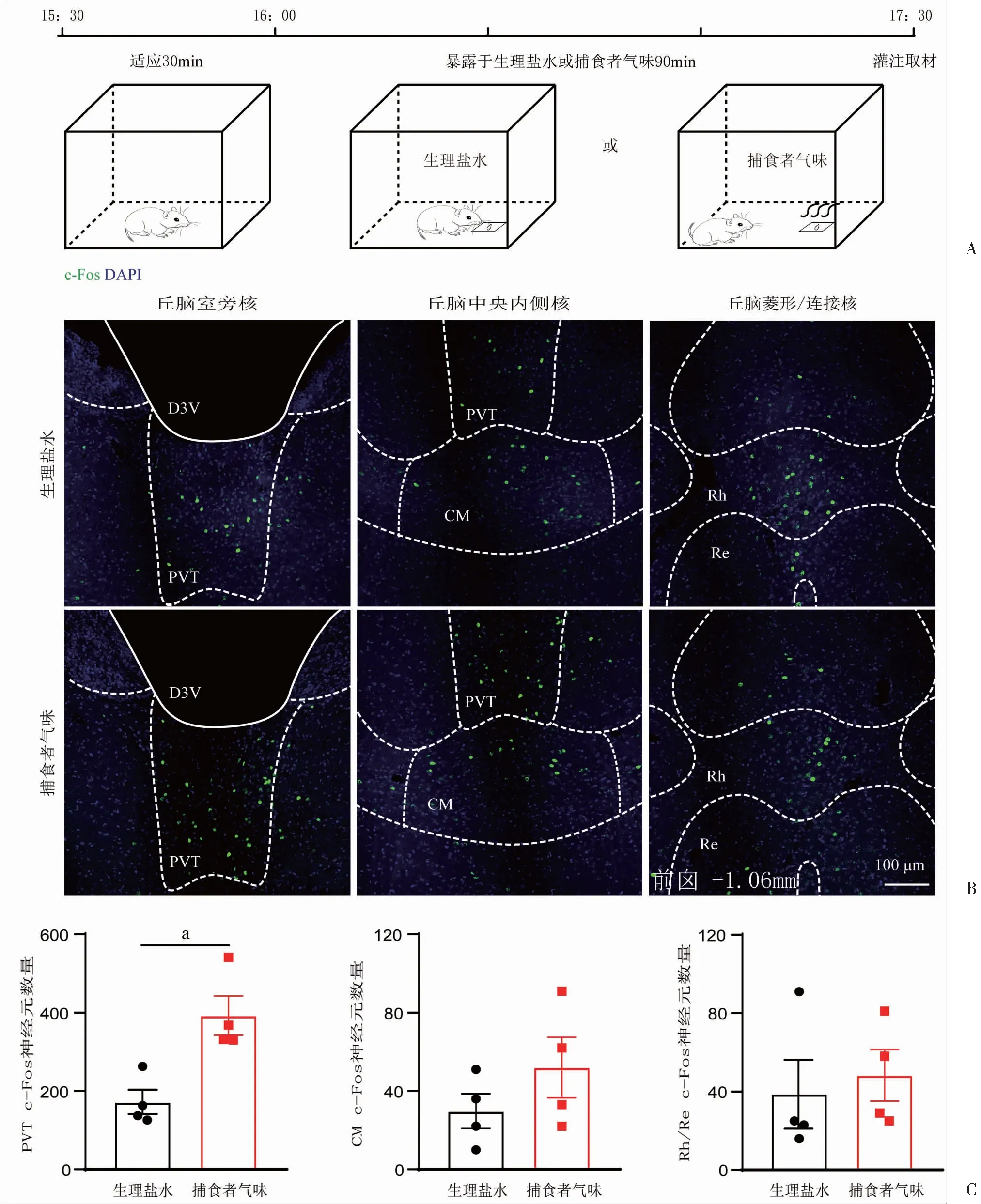
A:急性暴露于捕食者气味应激示意图:B:小鼠急性暴露于生理盐水和捕食者气味后的c-Fos(绿色)和DAPI(蓝色)免疫荧光染色的代表性图像,标记了PVT、CM、Rh/Re区域;C:根据第8版小鼠脑图谱进行c-Fos量化,在急性暴露于生理盐水(黑色)和捕食者气味(红色)后,PVT、CM、Rh/Re中的c-Fos表达数量 a: P<0.01,与生理盐水组比较
表1 急性暴露于捕食者气味后小鼠丘脑中线核团及杏仁核c-Fos表达
中线丘脑杏仁核组别nPVTCMRh/ ReBLACeA生理盐水组4172.30±31.2329.75±8.85438.75±17.5271.00±33.1922.5±5.172捕食者气味组4392.50±50.2852.00±15.5048.25±13.1679.25±12.4595.25±23.35统计值t(6)=3.721t(6)=1.247t(6)=0.1242t(6)=0.2328t(3.294)=3.042P值0.0098b0.25900.90520.82370.0494a
a: <0.05,b:<0.01,与生理盐水组比较
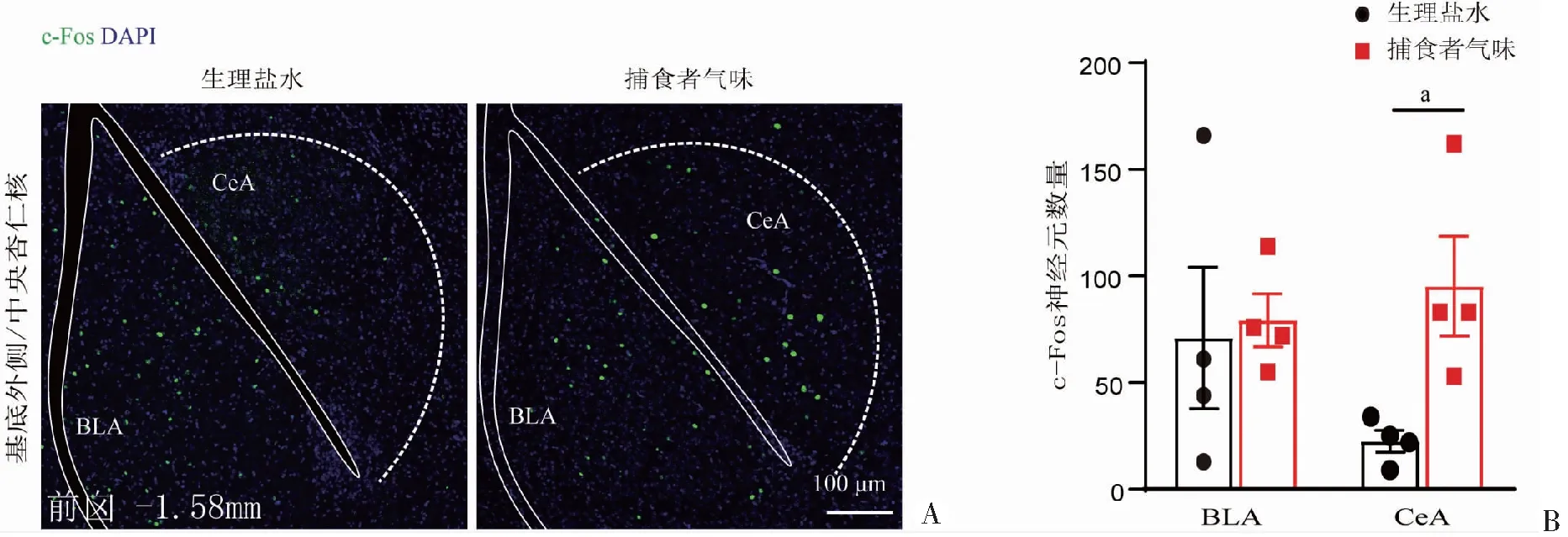
A:小鼠急性暴露于生理盐水和捕食者气味后的c-Fos(绿色)和DAPI(蓝色)免疫荧光染色的代表性图像,标记了BLA和CeA区域;B:根据第8版小鼠脑图谱进行c-Fos量化,在急性暴露于生理盐水(黑色)和捕食者气味(红色)后,BLA和CeA中的c-Fos表达数量 a: P<0.05,与生理盐水组比较
2.3 急性应激对CeA投射-PVT神经元c-Fos表达的影响
鉴于PVT与CeA的解剖连接和功能上的相关性,推测PVT-CeA通路可能在调节急性应激过程中发挥重要作用。目前PVT-CeA通路是否参与急性应激过程中尚未明确,因此本研究通过c-Fos免疫荧光染色方法结合逆行示踪技术检测PVT-CeA通路在急性应激刺激下的激活程度。
在CeA脑区注射逆行示踪剂RetroBeads,3~5 d后,将小鼠暴露于TMT应激模式下,随后对PVT脑区进行c-Fos免疫荧光染色。对于注射位置准确的小鼠,分别统计RetroBeads+神经元的数量和c-Fos+/RetroBeads+神经元的共标百分比(图4)。结果显示,PVT-CeA通路中RetroBeads+神经元在暴露于TMT气味后被激活的比例显著高于生理盐水组(P
<0.05),表明CeA投射-PVT神经元能被急性暴露于TMT刺激所激活。2.4 急性应激对CeA投射-PVT神经元钙活动的影响
光纤钙信号记录技术可以瞬时反应自由活动小鼠脑区群体神经元的钙信号变化,因此我们通过检测钙信号的变化来表征神经元的活动,进而实时研究神经元活动与动物行为的相关性。
进一步采用光纤钙信号记录的方法研究在体条件下,CeA投射-PVT神经元集群的钙信号在急性应激状态下的活动模式。利用脑立体定位注射技术在野生型小鼠的PVT注射AAV-EF1α-DIO-GCaMp7b病毒,在双侧CeA注射AAV/retro-Syn-Cre病毒,从而特异性感染CeA投射-PVT神经元。病毒表达3周后,在小鼠PVT上方埋置光纤,手术恢复1周后,进行行为学实验。结果表明,CeA投射-PVT神经元被病毒感染并在胞体表达。小鼠暴露于生理盐水前后,GCaMp7b荧光变化差异无统计学意义;而小鼠暴露于TMT前后,GCaMp7b荧光在基础波动范围内显著增加(P
<0.01,图5)。进一步对比两种刺激的ΔF/F值发现,急性暴露于TMT刺激的ΔF/F显著高于暴露于生理盐水的ΔF/F值(P
<0.01),表明急性暴露于TMT下,显著激活了CeA投射-PVT神经元。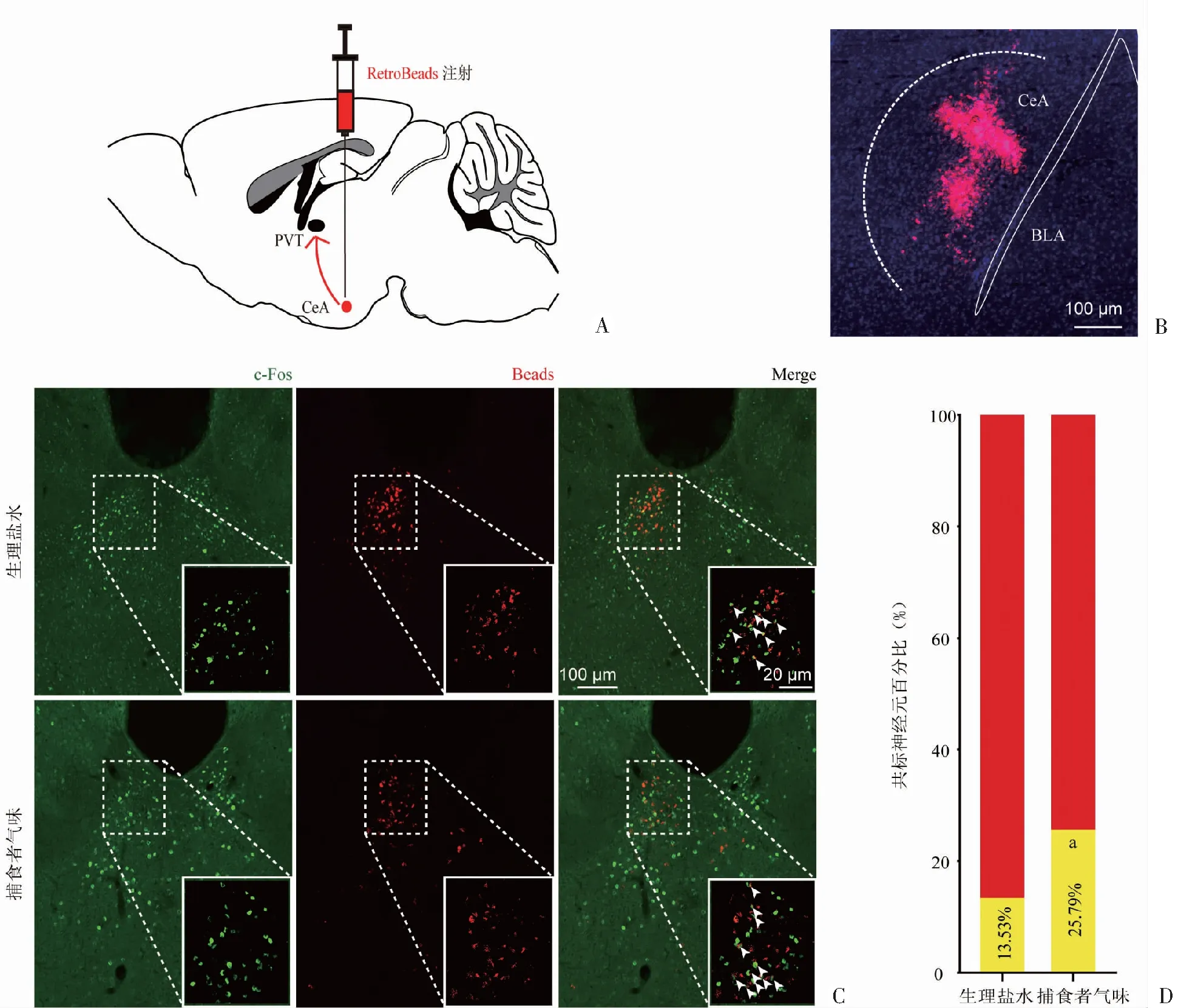
A:RetroBeads注射示意图; B:RetroBeads注射到CeA典型图;C:小鼠c-Fos(绿色)和CeA投射-PVT神经元(红色)的代表性图像,PVT区域;右下:对PVT区域共标的神经元进行放大;D:根据第8版小鼠脑图谱进行c-Fos量化,在急性暴露于生理盐水和捕食者气味后,PVT-CeA神经元(红色)中的c-Fos表达百分比(黄色)。 a: P<0.05,与生理盐水组比较
3 讨论
应激神经通路的激活有助于动物在不利的环境条件下启动生理和防御行为反应。然而参与应激的神经通路长期处于激活状态对机体是有害的,能引起一系列神经精神疾病,包括创伤后应激障碍、病理性焦虑、失眠等。因此,理解参与应激的神经网络,不仅可以促进研究者对应激状态下内部神经通路调节的认识,还有助于开发神经精神疾病治疗的新策略。PVT作为应激反应中觉醒调节的整合点,接受如下丘脑室旁核、脑干蓝斑等在调控觉醒和应激方面都至关重要脑区的大量投射。PVT的不同下游纤维投射对觉醒调控有着不同的作用,其中PVT-终纹床核通路参与调节饥饿应激下的觉醒水平。值得注意的是,杏仁核是调控情感行为的重要枢纽,CeA作为杏仁核的主要输出部位,整合应激相关信息后输出至下丘脑、脑干等脑区调控应激反应。PVT向CeA发出大量投射,目前大部分的PVT-CeA通路的研究集中在焦虑和恐惧行为上,PVT与 CeA的神经结构连接与急性应激的关联仍不清楚。因此,对PVT-CeA通路在急性应激下的激活情况研究仍较少。
大多数啮齿类动物应激模型都通过暴露于单一的应激源来建立。TMT是一种模拟狐狸尿气味的化合物,被广泛用于啮齿类动物应激模型的建立。啮齿类动物接触TMT时,能引起焦虑和恐惧情绪的改变并触发防御行为,因此捕食者气味暴露是诱发啮齿类
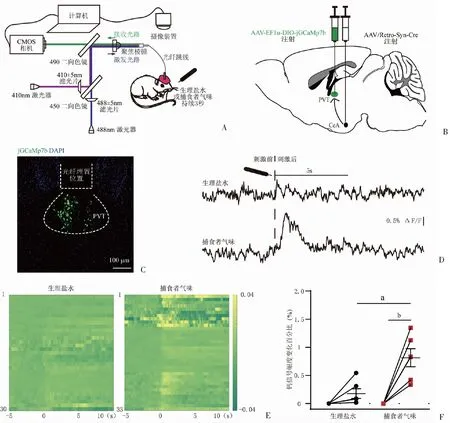
A:急性暴露于捕食者气味同步光纤钙信号记录工作原理示意图;B:AAV-EF1α-DIO-jGCaMp7b、AAV/retro-Syn-Cre病毒注射示意图;C:jGCaMp7b-表达CeA投射-PVT神经元及光纤埋置位置典型图;D:急性暴露于捕食者气味前后CeA投射-PVT神经元钙信号波形示意图;E.急性暴露于捕食者气味前后CeA投射-PVT神经元钙信号热图;F:定量分析急性暴露于捕食者气味前后CeA投射-PVT神经元集群钙信号幅度变化百分比。a: P<0.01,与生理盐水组比较;b:P<0.01,与暴露于TMT前比较
动物应激有效的方式之一。本研究将小鼠急性暴露于TMT中作为一种强烈的应激范式。一些研究表明,TMT作为一种厌恶性刺激,而不是恐惧性刺激。事实上,与厌恶性气味相比,TMT确实会引发防御行为,比如回避,防御性掩埋等。然而TMT作为单一的气味分子可能不会引起与自然捕食者气味相同的行为和神经生物学反应。因此,TMT暴露适合作为一个在啮齿类动物中诱发不可控应激的模型。
本研究发现小鼠急性暴露于TMT应激下,丘脑中线核团中PVT脑区的c-Fos表达显著增加;而在杏仁核中,CeA神经元的c-Fos表达显著增加,而BLA神经元c-Fos表达无明显变化。PVT作为丘脑中线核团的一部分,在调节觉醒功能和应激行为反应方面发挥着重要作用。既往研究证明,啮齿动物PVT在不同类型的应激条件下都能显著激活。杏仁核作为边缘系统一部分,与机体面对应激反应时产生的恐惧、焦虑情绪和防御反应相关行为有关。研究表明,应激情况下会引起特定杏仁核亚群长期形态和功能的改变。然而,在SOTNIKOV等研究中发现小鼠暴露于TMT中主要在BLA中c-Fos表达增加,而对CeA中的c-Fos表达无明显影响。本研究结果与上述研究之间的差异可能是由于小鼠品系不同,应激源暴露和组织取材的时间不同造成的差异。首先,不同品系的小鼠对同一应激源可导致不同的内分泌和行为反应;此外,本研究将小鼠急性暴露于TMT中60 min后立刻取材,尽管c-Fos蛋白染色常用于作为一种标记神经元激活的方法,但该技术存在一定的时间局限性。c-Fos蛋白从开始表达到表达高峰需要一定的时间。一方面,尽管c-Fos水平越高表明激活程度越高,但某些神经元中c-Fos的表达缺失并不一定意味着激活的缺失。另一方面,无法确定在c-Fos诱导之前及诱导期间,一些其他行为或内在状态对c-Fos表达带来的偏倚。这些实验方法的不同可以解释本研究结果与其他研究结果之间的差异。值得注意的是,本研究结果与其他一些研究一致,JANITZKY等研究发现,野生性C57小鼠急性暴露于TMT应激下,CeA脑区c-Fos表达显著增加。而在YANG等研究中发现TMT暴露可特异性诱导小鼠PVT、CeA脑区大量c-Fos表达,而对BLA无明显影响。此外,本研究采用时间分辨率更高的光纤钙信号记录技术来研究CeA投射-PVT神经元对急性暴露于TMT的激活情况,且研究结果与上述等人c-Fos实验结果一致,进一步表明丘脑室旁核、中央杏仁核过度活跃与急性暴露于TMT应激有关。
本研究表明,丘脑中线核团中大量PVT神经元投射到CeA。一些研究发现,与BLA相比,PVT神经元主要投射到CeA,且PVT可调节CeA神经元的兴奋性从而影响恐惧抑郁样行为。本研究中,急性暴露于TMT下引起PVT、CeA明显的c-Fos激活,提示该应激下可能通过激活PVT神经元及其投射到CeA的神经末梢,从而直接激活CeA的神经元起作用。鉴于PVT-CeA通路的解剖基础,且CeA和PVT在功能上的相关性,PVT与CeA的神经通路活动变化在急性TMT应激状态下仍不清楚。本研究利用免疫荧光染色和光纤钙信号记录实验,研究PVT-CeA通路在急性TMT应激状态下的激活程度。结果表明,CeA投射-PVT神经元能被急性暴露于TMT刺激激活,钙信号记录实验也证实了这一点,提示该通路密切参与急性TMT应激过程。
值得注意的是,本研究工作仍存在一定的局限性。CeA中主要由γ-氨基丁酸(γ-aminobutyric acid,GABA)能神经元组成,这些GABA能神经元表达多种肽类物质。如促肾上腺皮质激素释放激素(corticotropin-releasing factor,CRF)、蛋白激酶C-δ、生长抑素(somatostatin,SOM)或神经降压素等。已知PVT与CeA-SOM和CeA-CRF神经元形成突触联系,但在急性暴露于TMT应激研究中本研究未对PVT-CeA通路中具体的分子标志物进行验证,这需要我们进一步的研究。其次,本研究主要在雄性小鼠上进行研究,没有验证雌性小鼠急性暴露于TMT应激时对PVT-CeA通路的影响。应激反应具有性别二态性,提示雌性小鼠在未来相关工作中的重要性。此外,本研究未使用光遗传学、化学遗传学等技术手段来验证PVT-CeA通路的功能充分性和必要性。
综上所述,本研究结果表明PVT-CeA通路在急性暴露于TMT应激反应中被激活,PVT到CeA神经通路的详细解析将为压力应激相关疾病的发生发展提供理论依据和新的治疗策略。