新型磷酸二酯酶5抑制剂CPD1对异丙肾上腺素诱导心肌肥厚大鼠心脏的保护作用
刘晓晴,杨建钦,王栩林,李 斌,封文斌,高 洁,赵子建,穆云萍,李芳红
(1.广东工业大学生物医药学院,广东 广州 510006;2.南方医科大学第二临床医学院,广东省人民医院,广东 广州 510080)
心血管疾病依然是世界范围内导致死亡的首要原因,2019年,柳叶刀发表的前瞻性城乡流行病学研究结果显示心血管疾病死因占比达40%,且不同收入水平国家心血管疾病死亡占比存在显著差异,收入水平越低,心血管疾病发病率和死亡率越高[1]。冠状动脉粥样硬化、心肌梗塞、高血压、慢性肾功能衰竭、糖尿病和肥胖等都是常见的引起心血管疾病的危险因素,尽管病因不同,但常见的最后阶段都是心力衰竭综合征。值得注意的是,病理性心肌肥厚发展为心力衰竭越来越成为心血管疾病的重要病因[2-3],能够引起心肌缺血和心肌病的发生,减少心脏容量,降低心脏射血分数。因此,临床上通过抑制左心肥大,保护心脏功能作为治疗心力衰竭的重要策略。目前临床上用于治疗心衰患者的一线药物有β受体阻滞剂、血管紧张素转换酶抑制剂、血管紧张素受体阻断剂和利尿剂,虽然很大程度上能减缓疾病的进展,但死亡率仍然很高。虽然这些药物通常耐受性良好,但患者出现头晕、咳嗽、心动过缓、高钾血症等不良副作用的情况并不少见[4]。因此,开发一种安全有效治疗心肌肥厚的药物对于预防严重心血管疾病的发生意义重大。
磷酸二酯酶(phosphodiesterase,PDEs)抑制剂是一类能够抑制PDEs活性的药物,在急性难治性心力衰竭、肺动脉高压、勃起功能障碍等多种疾病中被广泛应用。PDE3抑制剂氨力农和米力农具有正性肌力作用和血管扩张作用,可加强心肌收缩力,改善左室功能[5],但因长期口服副作用大,尤其米力农有增加死亡率的风险,目前只限用于顽固性心力衰竭的短期静脉用药。心脏中存在一个与cGMP耦合的内在信号系统,可以抑制心肌增殖反应。cGMP由磷酸二酯酶超家族特定成员分解代谢,研究最广泛的cGMP酯酶是PDE5,PDE5能够选择性水解细胞内cGMP,生理条件下PDE5在心脏中的表达较低,而在心力衰竭患者心肌中表达上调[6],抑制PDE5可显著改善缺血性心肌病、阿霉素诱导的心肌病,以及压力超负荷诱导的心肌肥厚[7-8]。PDE5抑制剂具有治疗方法简单、临床经验丰富和安全性强的特点,表明这可能是治疗人类肥厚性心脏病的重要方法。目前,已被批准上市的PDE5抑制剂西地那非和他达拉非等表现出的副作用仍未解决,中国专利(CN102020645A)公开了一种西地那非类似物(WYQ)制备方法,不仅降低了药物副作用,且对PDE5的特异性显著提升(IC50=0.001 4±0.000 1 μmol·L-1)。但WYQ的水溶性依然很差(室温下<2 g·L-1),影响了药物的生物利用度,因此,团队对其进行成盐和共晶筛选,评估发现的晶型或盐型理化性质,最终选出水溶性高(室温下>13 g·L-1)、理化性质稳定的优良晶型CPD1(中国专利申请号:201910505948.5),以满足临床用药对活性成分纯度、水溶性、吸湿性、热稳定性等理化性质的严格要求。我们前期研究结果发现,CPD1干预能够通过抑制肺动脉平滑肌细胞中非电压依赖性钙通道功能,降低肺血管收缩力,减轻肺血管重塑,发挥防治肺动脉高压的作用[9]。但CPD1对心肌肥厚大鼠心功能的保护作用有待进一步研究。
因此,本研究使用异丙肾上腺素(isoprenaline)持续腹腔注射诱导的心肌肥厚大鼠模型,应用血流动力学检测、心脏病理学分析及分子生物学技术,观察CPD1干预对心肌肥厚大鼠左心室内压、心脏功能、心肌细胞结构及肥大标志基因表达量的影响,进一步探讨新型PDE5抑制剂CPD1在心肌肥厚发病过程中的防治作用。
1 材料与方法
1.1 实验材料
1.1.1实验动物 SPF级雄性SD大鼠,体质量(250~280) g,购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2016-0002]。本研究所需大鼠饲养于华南理工大学实验动物中心[SYXK(粤)2017-0178],实验方案获得华南理工大学实验动物伦理委员会批准(No 2018-042)。
1.1.2试剂与仪器 异丙肾上腺素(I5627)购自美国Sigma公司,依那普利(enalapril,A45103)购自3A Chemicals 艾览(上海)化工科技有限公司,苏木素伊红染色试剂盒(C0105)购自上海碧云天生物技术有限公司。西地那非(139755-83-2)、CPD1(ET32637-37-P1)购自和委托天津药明康德新药开发有限公司合成,经COA分析测定CPD1纯度为99%。药物配制:异丙肾上腺素:用生理盐水配成4 g·L-1药液;CPD1:生理盐水配成1.25 g·L-1的药液;西地那非:用0.5%的羧甲基纤维素钠配成5 g·L-1的药液;依那普利:生理盐水配成2.5 g·L-1的药液;所有药物均现配现用。TRIzol reagent RNA提取试剂盒(美国Invitrogen公司)、PrimeScript® RT reagent Kit(日本TaKaRa),引物由上海生工生物有限公司合成。其他试剂均为国产分析纯。多道生理信号采集处理系统(RM6240BDJ)、压力换能器(YPJ01)购自成都仪器厂;石蜡包埋机(MPS/P1,德国SLEE);石蜡切片机(美国Thermo);冷冻台(中威电子仪器有限公司);自动染色机:LEICA Autostainer ST5020;切片扫描仪:Pannoramic DESK,P-MIDI,P250(匈牙利);-80 ℃冰箱(中国美菱);烘箱(DH6-9143B5-Ⅲ,上海新苗)。
1.2 实验方法
1.2.1异丙肾上腺素致心肌肥厚大鼠模型的建立和分组 持续腹腔注射异丙肾上腺素诱导成年大鼠心脏左心重和室壁厚度增加[10],是最早报道的心肌肥厚动物模型。大鼠随机分为正常对照组(Con,8只)、异丙肾上腺素模型组(Iso,12只)、CPD1治疗组(CPD1,10只)、西地那非治疗组(Sif,10只)、阳性药依那普利治疗组(En,10只)。Iso组和各治疗组大鼠,以5 mg·kg-1的剂量每天一次腹腔注射异丙肾上腺素,正常对照组则采用相同方法注射生理盐水,2 h后治疗组分别给予CPD1(5 mg·kg-1·d-1)、西地那非(20 mg·kg-1·d-1)、依那普利(10 mg·kg-1·d-1)灌胃治疗,持续7 d,正常饮食饮水。
1.2.2大鼠心功能检测 RM6240生理信号采集处理系统可检测大鼠的左心室收缩压(left ventricular systolic pressure,LVSP)和心室压力变化速率(dp/dt),进而反映心脏的舒缩功能。实验启动前,需选择血压测量项目,调节参数,定标压力换能器。腹腔注射20%乌拉坦按照0.5 g·kg-1剂量麻醉大鼠,腹腔肝素化(500 IU·kg-1)处理,经右颈总动脉行左心室插管术,记录各组大鼠的心率、LVSP、dp/dt,待曲线稳定后持续记录10 min。
1.2.3心脏质量指数和左心室质量指数测量 完成心功能检测后,严格按照华南理工大学实验动物伦理委员会的要求对大鼠实施安乐死,迅速取出大鼠心脏,滤纸吸干血液和水分,拍照后称重,分离左心室并称重记录。分离大鼠胫骨并测量其长度,心脏质量指数和左心室质量指数分别用心脏-胫骨长度比(HW/Tibial)以及左心室-胫骨长度比(LV/Tibial)表示。
1.2.4大鼠心脏组织形态学检测 心脏取出后置于10%甲醛溶液中固定24 h,常规脱水、包埋后最大横切面连续切片(3 μm),行苏木精-伊红染色。利用切片数字扫描系统(Pannoramic Scanner)和浏览软件(CaseViewer)对心脏组织切片进行全自动玻片扫描和分析,使用ImageJ软件对每组大鼠心肌细胞横截面积进行计算。设定Con组左心室心肌细胞横截面积为1,模型和治疗组以Con组数据为参照,计算各组心肌细胞的相对横截面积。
1.2.5心脏组织肥大因子mRNA检测 利用TRIzol reagent RNA试剂盒提取各组大鼠左心组织总RNA,测定浓度后,逆转录为cDNA并对目的基因进行RT-PCR。ANP上下游引物序列分别为:5′-CTGGGGAAGTCAACCCGTCT-3′,5′-TCTGGGCTCCAATCCTGTCA-3′;BNP上下游引物序列为:5′-AGCCAGTCTCCAGAACAATCCA-3′,5′-TGTGCCATCTTGGAATTTCGA-3′;大鼠ACTB内参上下游引物序列分别为:5′- TGTCACCAACTGGGACGATA-3′,5′- GGGGTGTTGAAGGTCTCAAA-3′。

2 结果
2.1 CPD1对异丙肾上腺素诱导的心肌肥厚大鼠心功能的影响通过左心室插管,记录各组大鼠的左心室收缩压和dp/dt,观察CPD1治疗对心肌肥厚大鼠左心室收缩压、心率及心脏舒缩功能的影响。结果显示:与正常对照组(Con)相比,Iso组大鼠的LVSP明显降低(Con:142.3±5.1 mmHg,n=8;Iso:107.7±9.9 mmHg,n=9,P<0.01),心率明显降低(Con:409.9±37.5 beats·min-1;Iso:359.4±59.5 beats·min-1,P<0.01),Max dp/dt(Con:9 473.7±721.7 mmHg·s-1;Iso:5 968.7±1 330.1 mmHg·s-1,P<0.01)和Min dp/dt(Con:-6 787.2±840.9 mmHg·s-1;Iso:-3 697.2±826.1 mmHg·s-1,P<0.01)绝对值均明显降低,表明持续异丙肾上腺素腹腔注射可致大鼠心率降低,心脏收缩和舒张功能受损。CPD1治疗后可明显升高大鼠的LVSP(136.8±8.3 mmHg,n=9,P<0.01)、心率(414.1±52.9 beats·min-1,P<0.01)以及Max dp/dt(8 724.3±1 063.7 mmHg·s-1,P<0.01)和Min dp/dt(-5 856.9±1 143.1 mmHg·s-1,P<0.01)绝对值,且CPD1治疗效果明显优于传统PDE5抑制剂西地那非和阳性对照药依那普利,表明CPD1干预能够有效恢复由异丙肾上腺素诱导的心肌肥厚大鼠心功能的损伤(Fig 1A-I)。

Fig 1 Effect of CPD1 on cardiac function in hypertrophy rats after 7 d on isoprenaline intraperitoneal n=9)
2.2 CPD1对异丙肾上腺素诱导的心肌肥厚大鼠心脏质量指数的影响与Con相比,Iso组大鼠的心脏-胫骨长度比(HW/Tibial)(Con:23.4±2.6 mg·mm-1,n=8;Iso:31.4±3.1 mg·mm-1,n=9,P<0.01)和左心室-胫骨长度比(LV/Tibial)(Con:14.1±1.7 mg·mm-1,n=8;Iso:18.8±1.6 mg·mm-1,n=9,P<0.01)均明显增高,表明持续异丙肾上腺素腹腔注射可诱导大鼠发生全心肥大,左心肥大更为明显。CPD1干预后,大鼠的HW/Tibial(26.4±2.1%,P<0.01)和LV/Tibial(15.5±1.5 mg·mm-1,P<0.01)均明显降低,抑制效果不低于西地那非和依那普利,表明CPD1能减轻异丙肾上腺素诱导的大鼠心肌肥厚(Fig 2A-C)。

Fig 2 Effect of CPD1 on cardiac hypertrophy index in
2.3 CPD1对异丙肾上腺素诱导的心肌肥厚大鼠心肌细胞横截面积的影响与Con相比,Iso组大鼠心脏左心室心肌组织形态发生改变,出现明显炎性细胞浸润,左心室心肌细胞的横截面积也明显增大(Con:1.0±0.2,n=50;Iso:5.0±0.7,n=54,P<0.01),表明持续异丙肾上腺素腹腔注射可诱导大鼠心肌细胞发生肥大。CPD1可明显减小大鼠的心肌细胞横截面积(1.3±0.2,n=60,P<0.01),同样,治疗效果优于西地那非和依那普利,表明在细胞层面上CPD1干预可抑制异丙肾上腺素引起的心肌肥大(Fig 3A-C)。

Fig 3 Effect of CPD1 on cardiac structure in hypertrophy rats
2.4 CPD1对异丙肾上腺素诱导的心肌肥厚大鼠左心组织中肥大因子表达的影响心脏组织中肥大因子心房钠尿肽(atrial netriuretic peptide,ANP)和脑钠肽(brain natriuretic peptide,BNP)的表达量可作为衡量心肌肥厚的标志,本研究通过实时定量PCR检测,观察各组大鼠左心室组织中ANP和BNP mRNA表达量的变化。结果显示:与Con相比,Iso组大鼠左心室中ANP mRNA(Con:1.0±0.1,n=3;Iso:17.3±3.6,n=3,P<0.01)和BNP mRNA(Con:1.0±0.1,n=3;Iso:2.1±0.7,n=3,P<0.01)含量均明显增加,表明持续异丙肾上腺素腹腔注射成功诱导大鼠发生心肌肥厚。同样,CPD1治疗明显降低ANP mRNA(6.7±0.8,n=3,P<0.01)和BNP mRNA,0.6±0.1,P<0.01)含量,治疗效果优于西地那非,表明CPD1干预对异丙肾上腺素引起的心肌肥厚有明显保护作用(Fig 4A-B)。
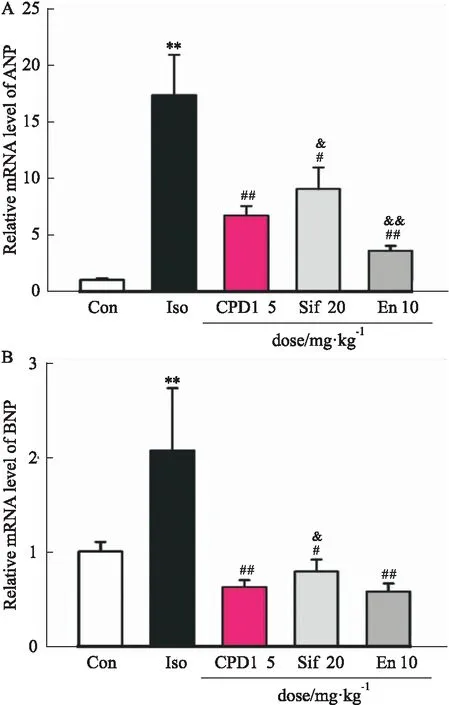
Fig 4 Effect of CPD1 on markers of hypertrophy rats after 7d
3 讨论
心血管疾病目前仍是最常见的住院原因和死因,且发病率在低收入和中等收入国家远高于高收入国家[1],尽管诊断技术和治疗策略已取得重大进展,死亡率降低了50%以上,但长期预后依然很差,随着人口老龄化,负担日益加重,患者医疗需求很难得到满足,已成为重大公共卫生问题。2019年柳叶刀在线发表的PURE研究评估了多种危险因素与心血管疾病和死亡率的相关性,发现高血压是心血管疾病最大的危险因素,吸烟和糖尿病与死亡相关性最强[3]。心脏暴露于持续压力超负荷中,多种细胞因子信号和转录途径被激活,诱导心肌肥大性重塑,最终导致进行性心功能不全和心力衰竭。病理性心肌肥厚成因复杂,受多个调控因素影响,临床上尚缺乏有效防治药物,有研究表明,控制氧化和内质网应激,调节细胞内钙离子信号,减少心律失常和心肌细胞凋亡的风险,抑制心肌细胞肥大的驱动因素,同时
结合营养、饮食和生活方式的选择,可有利于心肌肥厚和心衰的防治[2]。
PDEs可特异性清除cAMP和cGMP的3′,5′-环磷酸酯部分,经典的PDE3抑制剂氯力农、米力农通过调节细胞内外钙平衡,增加心肌组织中cAMP水平,降低全身血管阻力和左心室充盈压,改善心脏功能,但对心率和平均动脉压没有影响[5]。cGMP参与心脏组织中细胞生长和凋亡等多项生理过程,一氧化氮(NO)途径是心血管系统的关键调节因子,可调节血管张力和心肌功能[11]。内皮功能障碍引起的NO-sGC-cGMP信号轴的破坏和cGMP合成受损导致血管紧张素失调、血管和心室硬化、心肌纤维化和肥大,引起心脏和肾功能的下降[12-14]。因此,靶向NO-sGC-cGMP信号通路,减少cGMP的分解代谢,一直是抗心肌肥厚和治疗心衰的有利途径[15]。西地那非和其他选择性药物对PDE5的抑制作用在临床上被广泛用于增强勃起功能和治疗肺动脉高压[16]。PDE5在心肌中也有表达,并具有活性[17],西地那非抑制PDE5对静息状态下心功能影响不大,但对暴露于持续压力负荷中的心功能作用重大,能够阻止和逆转由压力超负荷引起的心室肌细胞和分子重构,改善心功能,甚至在超负荷持续存在的情况下,依然可以逆转已经发生肥大的心室肌功能[8],证明抑制PDE5是一种安全简单、临床经验丰富的治疗肥厚性心脏病的重要方法。
现有PDE5抑制剂药物副作用大且价格昂贵,给病人和社会带来巨大身心和经济负担,中国专利文献CN102020645A公开的WYQ,是一种吡唑并嘧啶酮衍生物,它克服了原有药物的缺点,对PDE5特异性更强,具有低剂量高药效的特点[18],但其水溶性较差。为了改善药物的水溶性,我们对WYQ进行了成盐和共晶筛选,最终选择了水溶性及肠溶性好、理化性质稳定、安全性高(半数致死量LD50=1 120.650 mg·kg-1,LD50的95%可信限=(868.184~1 446.531) mg·kg-1的钾盐晶型CPD1。我们前期研究已经证实其能特异性抑制PDE5,能有效防治肺动脉高压[9]。本研究利用异丙肾上腺素持续腹腔注射7 d制备心肌肥厚大鼠模型,观察CPD1对心肌肥厚大鼠心脏的保护作用,以及对肥大标志基因表达的影响。结果显示CPD1治疗后,显著升高心肌肥厚大鼠的左心室压力和压力变化速率,且无论是治疗剂量还是药效均明显优于西地那非和依那普利,说明CPD1干预通过改善心脏的收缩和舒张功能,恢复心肌肥厚大鼠的心脏功能。ANP含量增加是早期心功能异常的表现,BNP更是公认的心力衰竭生物标志物,CPD1显著降低左心室组织中ANP和BNP基因的表达,表明CPD1治疗在动物水平可改善异丙肾上腺素诱导的心肌肥厚。
病理性心肌肥厚是诱发多种重大心血管疾病的重要病因,心肌细胞增大的过程中伴随心肌细胞间质的增加,因超过毛细血管的供应能力,会引起心肌缺氧和心脏重构,如果不及时干预,心脏会进一步发展为不可逆的失代偿期,并伴有心功能障碍,最终引起心力衰竭甚至死亡。但临床上缺乏治疗心肌肥厚的药物,只能针对诱发因素,采取一定的治疗策略。本研究中,给予CPD1治疗后,显著降低心肌肥厚大鼠的心脏质量指数和左心室质量指数,同时减小左心室心肌细胞的横截面积,表明与PDE5、cGMP和/或PKG调节相关的潜在机制对抑制肥大是有效的,并且可能干扰多种信号途径,改善异丙肾上腺素诱导的心肌肥厚,保护心脏,具有药物开发潜在价值。
综上所述,本研究从心脏功能、心脏质量指数和心肌细胞横截面积、肥大标志因子表达水平说明了新型PDE5抑制剂CPD1对心肌肥厚的防治作用,但因心肌肥厚病因和发病机制复杂,其具体作用机制尚待进一步研究。