金纳米团簇在生物成像中的应用研究*
罗 杰,赵灵芝,杨 曦,杨改玲,高 瑞,胡毓琛
(西安医学院药学院,陕西 西安 710021)
金(Au)是一种贵金属,在自然界中常以单质存在,具有化学性质稳定、易于处理和制造、极高的抗腐蚀性等特点。当其直径降低到2 nm 时,被称为金纳米团簇(Au nanoclusters,Au NCs),简称金簇。金簇是一种由几个到几十个金原子组成的纳米材料,由于其直径接近电子的费米波长,具有独特的光学、电学和化学性质,如:斯托克位移大、光稳定性好、和较长的荧光寿命等。此外,金簇低毒性、生物相容性好,从而使其在生物成像和生物传感领域具有明显优势[1-4]。本文将对金簇与尺寸相关的发光原理、合成方法,以及金簇作为纳米探针应用于生物成像研究进行综述。
1 金簇与尺寸相关的发光原理
金属的物理和化学性质与其尺寸大小有着密切的联系。大块金是良好的光学反射器和导体,但是通常表现出非常微弱的发光,这是由于块状金属的电子能级是连续的,从而导致没有能量间隙以及有效的非辐射衰减造成的[5]。当金的尺寸减小1~100 nm成为金纳米粒子[6](Gold nanoparticles,Au NPs,简称纳米金)时,电子的运动受到纳米粒子尺寸的限制,并且主要与表面发生相互作用。纳米金由于表面等离子体共振效应而呈现出强烈的颜色,其光学特性来自于传导电子与光相互作用后发生的集体振荡。纳米金通常具有较强的吸光性,但它们并不或仅表现出微弱的发光。如直径为5~20 nm的纳米金水溶液呈现酒红色,其特征吸收波长在520 nm左右,表现出微弱的荧光。当金纳米粒子尺寸继续降低(约2 nm),变成仅有几个原子构成的金纳米团簇[7]时,其连续能级谱带分裂成离散能级,电子的集体振荡受到阻碍,因而金簇不再引起表面离子体共振效应,但电子仍在能级间跃迁与光相互作用,显示出明亮的荧光。金簇的发光一般与电子跃迁有关:其一,在已占据的 d 轨道和费米能级之间的电子跃迁;其二,最高占用轨道(HOMO)和最低占用轨道(LUMO)之间的电子跃迁[8]。不同尺寸的金簇具有不同的能级间隙,因而需要不同能量的激发光,从而得到不相同的荧光发射光谱。近期,关于金簇的荧光性质与其尺寸和表面配体密切相关的报道显示,通过改变它们的核心尺寸可使金簇的荧光发射波长发生改变,粒径越大,发光光谱逐渐红移。Dickson等[9]通过此法将金簇的荧光发射波长从近红外区域调整到紫外区域,他们制备出组成和其对应荧光发射波长分别为Au5(385 nm), Au8(455 nm), Au13(510 nm), Au23(760 nm), 和Au31(866 nm)的纳米簇。与铜簇和银簇相比,金簇的荧光强度十分稳定,不易受环境中的还原剂和氧化剂等物质的影响。这些优越的光学性质使金簇多次应用于分析检测和生物成像方面,为多个领域的开发和实际应用提供可行方案。
2 金簇的制备方法
贵金属光致发光已被发现多年[10],但由于量子产率极低(仅有10-10),一直未引起人们的重视。近年来,研究人员开发了多种方法用来制备量子产率在10-3~10-1范围内具有荧光显著增强的水溶性金簇,从而使其具有足够的亮度用于荧光标记应用。一般情况下,通过将水溶液中金离子还原为零价金原子产生的是纳米金而非金簇,这是由于金簇易聚集造成的。此外,用于覆盖金簇表面的配体的性质也显著影响其发光性能。因此,选择合适的稳定剂能稳定金簇防止其聚集并增强其荧光至关重要。通常使用一些配体作为模板对金簇进行表面改性,这其中包括硫醇分子[11-14]、树枝状大分子[15-16]、聚合物[17]、DNA 寡核苷酸[18-19]、肽以及蛋白质[20-22]等物质。由于金簇的光学性质与其尺寸有着密切关系,覆盖在金簇表面的模板或配体不仅影响金簇的几何形状,还提供合适的条件以避免金簇聚集成大纳米粒子从而改变结构影响其荧光性能。因此,合成高量子产率的金纳米团簇,关键是选择合适的模板或配体。所选模板或配体不仅要防止金纳米簇团聚,还要考虑到它们对金簇荧光的影响。
3 金纳米簇在细胞成像中的应用
近年来,生物兼容性好、小尺寸且发光性能好的金簇作为新型荧光探针多次应用于细胞成像等方面。通过对其表面配体进行修饰后可得到不同性能的金簇,在配体上连接具有靶向识别功能的分子后,金簇具有靶向检测癌细胞且可应用于癌细胞成像。例如,叶酸偶联金簇已被广泛应用于叶酸过量表达的癌细胞成像。例如:Astilean等[23]采用叶酸功能化金簇对人类卵巢癌细胞靶向荧光成像;此外,Kong等[24]偶联维生素B12到核糖核酸酶A稳定的金簇,基于该纳米探针,对人类结肠癌Caco-2细胞靶向成像。三苯基膦(TPP)是一种离域亲脂阳离子,容易通过磷脂双分子层并在活细胞线粒体中积累。因此偶联TPP到壳聚糖稳定的金簇可用于对细胞内线粒体成像[25]。Su等[26]基于RGD序列(由精氨酸、甘氨酸和天门冬氨酸组成)对富含整合素的肿瘤细胞具有较高的亲和力,将其设计进入多肽序列,并以此为模板合成的金簇可自组装形成纳米纤维结构,该金簇复合材料发光增强了近70倍,具有21.3%的量子效率,同时RGD序列的存在可用于癌细胞靶向成像。Lin等[27]报道了硫辛酸保护的金簇,通过其表面的羧基将含氨基的链酶抗生素蛋白修饰于金簇表面,可用于标记肝癌细胞。Ghosh的团队[28]报道了以苯硼酸和巯基丙酸作为配体合成金簇,由于苯硼酸和癌细胞表面的黏蛋白特异性识别,将其应用于癌细胞选择性成像。此外,以蛋白质为模板制得的金簇可直接用于选择性标记被蛋白质特异性识别的细胞。例如,转铁蛋白功能化的金簇对过量表示转铁蛋白受体的细胞(如A549肺肿瘤细胞)具有高亲和力[29]。
利用它们良好的细胞成像特性,金簇也被应用于细胞内环境中重要生理事件的成像。例如,一种通过包裹染料分子二氧化硅颗粒与金簇组装的新型纳米复合材料[30],被用于活细胞中高活性氧(highly reactive oxygen Species,hROS,·OH, ClO-和 ONOO-) 成像。这种复合材料表现出单一波长激发和双波长发射, 565 nm波长发射的红光来自于金簇,其可被存在hROS有效地猝灭;在435 nm波长发射的蓝光来自于二氧化硅纳米粒子,其荧光发射不受hROS的影响,从而为荧光法实时反映细胞内hROS提供一个内部参考。该金簇纳米复合材料载入细胞效率高,选择性荧光猝灭,光稳定性好可用于长时间成像观察,这些特性使该金簇复合材料可用于长时间监测活细胞中hROS,显示出监测细胞内生理事件的巨大优势。
此外,将肿瘤细胞与氯金酸溶液共孵育,肿瘤细胞内的高还原性物质可实现胞内金簇的原位形成,原理如图1所示。Wang等[31]原位形成金簇一方面最终集中在细胞核周围,可提供精确的细胞成像。该现象不会发生在非癌变的细胞里(如:人类胚胎肝细胞),具有较高的选择性。这种胞内原位形成金簇无需外界注入纳米粒子即可实现肿瘤细胞特异性荧光自标记;另一方面有研究指出[41]胞内原位合成的金簇能显著抑制PI3K-AKT信号通路,从而有效抑制肿瘤的发展。这种简便有效的体内肿瘤靶向治疗技术,将有助于在未来的临床应用中有效治愈癌症。
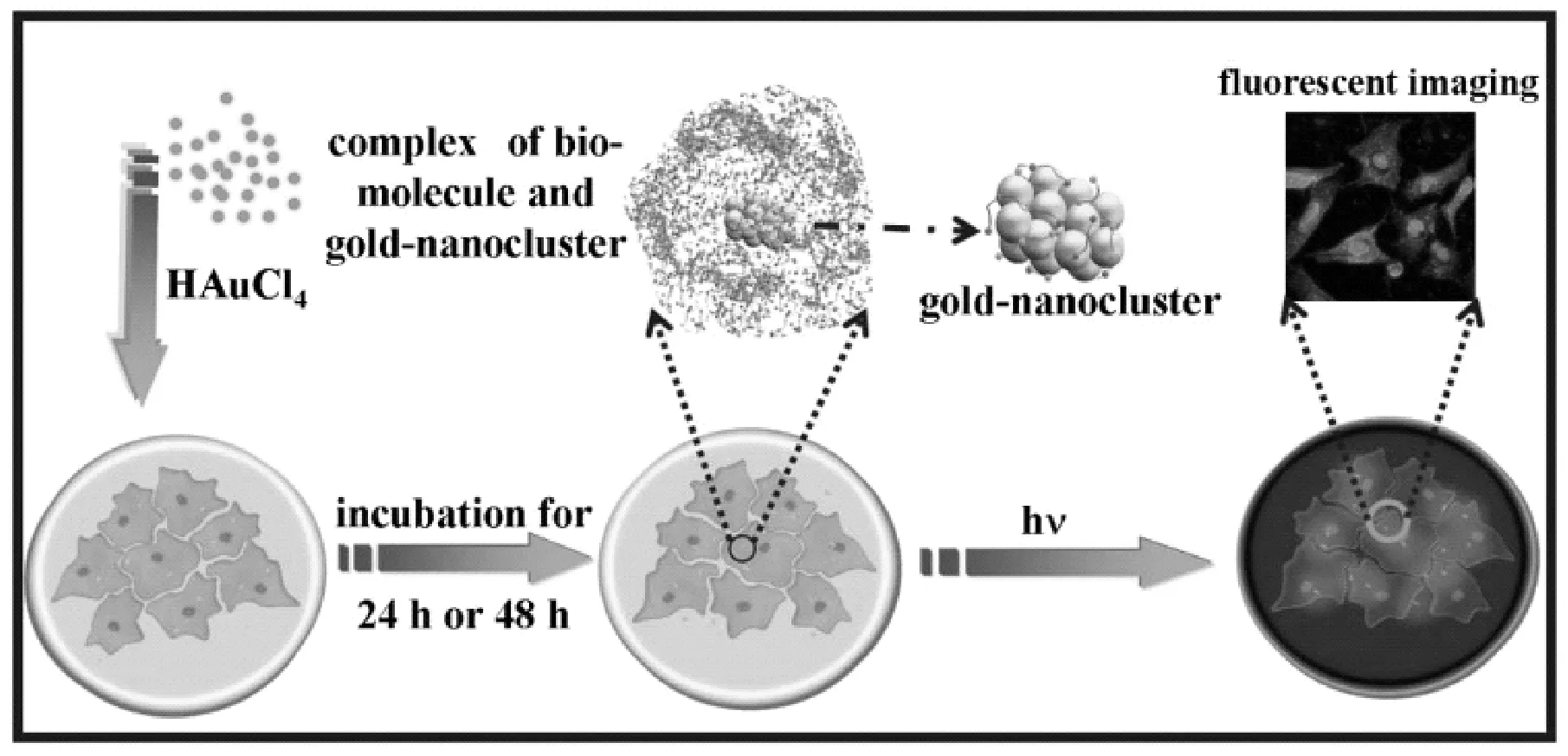
图1 细胞内原位合成金簇及其应用于细胞成像 原理示意图[31]Fig.1 Schematic illustration of in situ biosynthesis of gold nanoclusters in cells imaging[31]
4 金纳米簇在活体成像中的应用
与细胞系和体外成像研究相比,使用动物模型的体内成像面临额外的挑战。这是由于其复杂性增加,可见光通过生物组织与各种生物分子相互作用,从而导致透射光减少以及发光材料发生降解。生物组织在近红外光范围仅表现出微弱的吸收/散射和自发荧光,因而金簇的近红外发光性能使它们作为新型造影剂多次用于活体肿瘤荧光成像。在早期的研究中,Wu等[32]第一次报道了近红外发射牛血清蛋白修饰的金簇BSA-AuNCs用于体内肿瘤成像。研究表明,这些BSA-AuNCs在肿瘤区域积累到高水平,表现高度的肿瘤靶向性,这归结于肿瘤细胞和正常细胞通透性和保留性的差异。鉴于此,金簇被多次应用于活体小鼠肿瘤组织成像研究。Sancey等[33]评价超小型金簇在光学图像引导手术中的应用潜力。他们合成了以两性离子或聚乙二醇为配体包覆的金簇,对荷瘤小鼠静脉注射金簇用于测定其药代动力学特性以及研究金簇在荷瘤小鼠身体的分布情况。研究情况表明,表面缺乏特异性靶向配体的金簇,细胞载入率低;但在体内,静脉注射后能快速到达肿瘤部位,说明金簇在影像引导肿瘤手术研究中十分有潜力。
多模态成像,即两种或多种提供互补信息的成像模式的结合,具有显著的优势。因此,近年来基于金簇作为多模态成像探针应用于体内成像受到了广泛的关注[34-36]。例如:甲状腺癌作为最常见的内分泌恶性肿瘤,发病率高,缺乏双重模式精确诊断的成像方法。对于甲状腺癌的双模态荧光/计算机断层扫描(CT)成像,Chen等[34]以牛血清白蛋白(BSA)和氯胺-T为原料合成碘化BSA-AuNCs复合材料,合成原理如图2所示,并以此作为双模态探针。实验结果表明,这些碘化BSA-AuNCs不仅具有超小的体积和优异的生物相容性,而且表现出优良的荧光/CT成像特性。一方面它们的荧光发射光谱在近红外区,能够准确和选择性地显示甲状腺癌,该发光材料可分辨微小的甲状腺癌,小到2~3 mm;在注射较长时间后仍有荧光信号显示,且肿瘤和其他组织的荧光对比,肿瘤细胞处的荧光逐渐加强,其他部位的荧光逐渐减弱。另外在CT成像方面,其性能可以与临床CT造影剂相媲美。碘基制剂在吸收x射线方面是有效的,但它们的循环寿命很短,而且非特异性分布和潜在的肾脏毒性限制了它们的应用。金比碘具有更高的x射线吸收系数,单位质量的对比度约高2.7倍。因此,金簇的强x射线衰减使其成为多模态成像的良好选择,有望成为一种应用于临床医学的纳米探针。
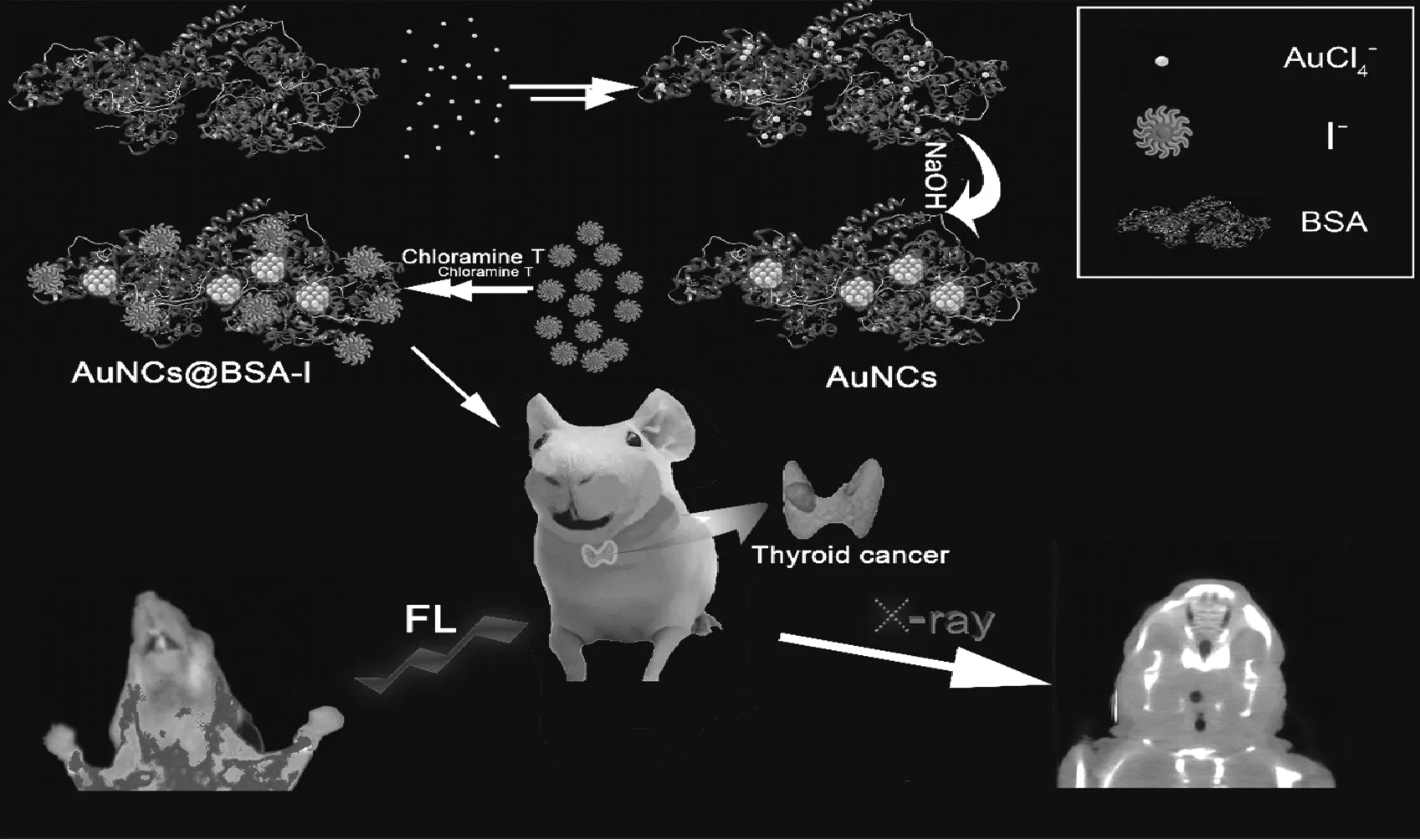
图2 以牛血清白蛋白和氯胺-T为原料合成碘化 BSA-AuNCs复合材料并以此作为双模态探针 用于活体荧光/CT成像示意图Fig.2 Schematic illustration of the preparation of AuNCs@BSA-I and biological function for in vivo synergistic dual-modality fluorescence and CT imaging
荧光、CT和MR成像方式各有优缺点,与CT成像相比,磁共振MR成像具有较低的空间分辨率,但对软组织有较高的敏感性。因此,一个探头内结合这三种方式可以帮助推进传统诊断,可准确识别疾病部位,即多模态显像剂比单模态显像剂能提供更多的肿瘤信息,因此是肿瘤诊断的理想方法。Peng等[37]以钆离子(Gd3+)介导表面富有羧基的金簇自组装成单分散球形纳米颗粒,基于该纳米材料可实现荧光/MR/CT三模态成像。由于金簇和钆离子的共存,形成的纳米材料在近红外荧光成像中荧光强度进一步增强,在CT成像中表现出高的X射线衰减,在磁共振成像中表现出合理的r1弛豫。金簇和钆离子复合材料在体内外均具有良好的生物相容性,并对A549荷瘤小鼠也具有独特的近红外荧光/CT/MR成像能力。Xu等[38]以BSA-AuNCs和氧化钆的复合粒子作为三模态显像剂。经过叶酸修饰后,金簇可以特异性识别肿瘤细胞,并允许异种移植瘤的活体光学、MR和CT成像。通过三种方式的比较可以清楚了解到体内肿瘤的构造和相关信息,这一切均表明金簇在肿瘤和其他组织生物成像有良好的应用前景,在肿瘤多模式临床诊断中具有巨大的潜力。
5 结 语
金纳米团簇作为一类新型的发光纳米材料,它们体积小、毒性低,具有良好的生物相容性和荧光特性,逐渐成熟的应用于生物成像研究。随着金纳米团簇在多领域应用的深入,相关技术研究也面临着较多的挑战。其一,与半导体量子点和许多有机染料相比,目前报道的大多数金簇量子产率低,还不能够满足实际荧光检测的需要;其二,金簇的光学性质与其尺寸和分散性密切相关,而大多数金簇粗产品常表现出的粒度不均匀性,导致其光学性质的巨大差异。在合成过程中很难做到有效精确调控金簇的组成、尺寸和分散性,进而准确调控金簇的荧光发射峰位置和发光强度。目前,金簇还未进入大规模的投资使用,但是发展简单、绿色、低成本合成光学性能优异的金簇,并以此为探针研究出更多快速、灵敏度高、特异性强的检测方法更能适应当代社会高效、快节奏的分析需求。近年来,研究者通过各种策略(包括化学共轭、静电相互作用、自组装、配体交换等作用)对金簇进行修饰,以及将金簇与其他纳米材料(包括碳纳米材料、其他金属簇、金属氧化物、金属有机框架化合物等)进行复合,控制金簇的结构、尺寸和分散性,从而提高金簇发光的量子产率。此外,通过其他材料与金簇复合可使其成为多功能光学探针,使金簇在生物医学领域具有更多发展和应用潜力。

