重症肺炎大鼠血清 肺和肠组织中表面活性蛋白-A的变化规律
李冠胜, 孙小平, 张 瑾, 邓扬嘉, 吴 倩
重症肺炎是一种严重致死性的重症感染性疾病,易进展为脓毒症、脓毒性休克、多器官衰竭(multiple organ dysfunction syndrome, MODS)而死亡[1]。其中胃肠道是发生MODS时最早受损的器官,被认为是MODS的启动器官和急危重病应激的“中心器官”[2],主要原因是肠黏膜屏障在创伤或感染后,肠腔内大量的细菌、真菌、内毒素及生物大分子等进入循环和淋巴系统引起炎症介质大量表达,累及多个脏器而引起或加重全身炎性反应[3]。在重症肺炎时,如何尽早进行肠道功能的监测,从而尽早保护肠黏膜,阻断疾病进展,目前并无准确的检测和判断指标。
研究发现表面活性蛋白-A(SP-A)是同时存在于人体肺、结肠组织中的一个细胞因子,其基因转录子起始于相同的位点[4],基因序列完全相同,具有相似的分子结构、生理功能。肺SP-A可降低肺泡表面张力、介导宿主对病原菌的清除和抵御、调节炎症反应和免疫应答等作用[5]。结肠中的SP-A主要由结肠黏膜上皮细胞分泌,具有润滑消化道、减少肠道张力而有利于肠道蠕动的作用。同时,因SP-A具有凝集素家族蛋白特征性的多聚体结构特点,可与多种免疫细胞和病原体表面受体结合参与调控免疫细胞功能及免疫炎性反应,在肺、结肠组织中SP-A可在局部防御及免疫调节方面发挥积极的作用[6]。有研究[7]显示,动态监测血液中SP-A水平,对急性肺损伤的诊断及预后具有重要作用。在重症肺炎进展中,肺组织SP-A的表达呈下降趋势,肠组织中SP-A是如何变化,在肺、肠两个器官中如何交互影响,能否通过血清SP-A判断重症肺炎病情进展,目前并未有明确结论。因此,我们通过建立重症肺炎大鼠模型,观察疾病发展过程中肺、肠组织SP-A的蛋白表达变化,明确SP-A的表达与肺、肠损伤的关系。
1 材料与方法
1.1实验动物及试剂仪器
健康SPF级雄性SD大鼠70只,鼠龄为6~8周,体质量180~200 g,由湖南斯莱克景达实验动物有限公司提供,许可证号SCXK(湘)2019-0004。分笼饲养于恒温(25 ℃) 恒湿(40%~70%)房间内。本实验已通过实验动物福利伦理委员会备案审批(审批号:20220228S0601230)。
大鼠SP-A酶联免疫吸附(ELISA)测定试剂盒购自中国江莱生物公司;兔抗大鼠SP-A、肿瘤坏死因子-α(TNF-α)抗体以及内参GAPDH抗体购自美国Abcam公司,山羊抗兔二抗购于中国碧云天生物公司,免疫荧光二抗购自美国Santa Cruz公司。酶联免疫检测仪(VarioskanLUX):ThermoFisher,美国。垂直板电泳转移装置、Trans-blot转膜装置、电泳仪:Bio-Rad,美国。多功能酶标仪:Thermo Fisher,美国。Tannon-4200凝胶成像系统:Tanon,中国。共聚焦显微镜Leica:TCS SP8,德国。
1.2病原菌制备 肺炎克雷伯杆菌标准株(ATCC700603) 由重庆市中医院检验科微生物室提供。将肺炎克雷伯杆菌标准菌株接种于羊血琼脂糖平板上,于二氧化碳恒温培养箱中37 ℃培养24 h后,收集细菌。将收集的细菌移入普通肉汤培养基中进行 37 ℃ 200 r/min 摇菌过夜培养。根据比浊法,用无菌生理盐水将其稀释成含菌量400个麦氏浊度单位的混悬液备用。
1.3动物模型建立及实验分组
将实验大鼠随机分为对照组(n=10)和重症肺炎组(n=50),重症肺炎造模成功后,将造模大鼠随机分为五组:即刻组(n=10)、12 h组(n=10)、24 h组(n=10)、36 h组(n=10)以及48 h组(n=10)。不同组别分笼饲养于恒温(25 ℃)房间内,光照和黑暗各12 h交替,自由进食标准颗粒饲料及饮水。
大鼠腹腔注射7%水合氯醛(5 mL/kg)进行麻醉,固定,颈部备皮消毒,无菌操作,切开颈部皮肤,暴露上段气管,用1 mL注射器刺破气管,造模组注入含菌量为400个麦氏浊度单位的肺炎克雷伯杆菌细菌混悬液0.35 mL,每注射0.1 mL后竖立大鼠,左右旋转大鼠固定台1 min后再继续。对照组以相同方法注入0.35 mL的无菌生理盐水。接种完后继续竖立大鼠固定台,使大鼠先后分别保持直立位和倒立位各约2 min,尽量使菌液均匀分布于双肺各个肺叶。后缝合伤口,局部用碘伏消毒。
建模成功标准:造模组大鼠气管注入细菌72 h后观察到出现反应迟钝、呆滞等意识障碍表现,同时呼吸急促(双侧胸廓急速运动)、可闻及痰鸣、毛发干枯、口唇及四爪皮肤发绀。实验室检测:血气分析示低氧血症(SaO2<90%、动脉血氧分压≤60 mm Hg);胸部X线检查出现多个肺叶弥漫性渗出影[8]。
1.4实验取材 即刻组、造模后12 h组、造模后24 h组、造模后36 h组、造模后48 h组分别于造模成功后即刻、12 h、24 h、36 h、48 h取材,对照组与模型组同时取材。均留取血清、肺泡灌洗液(BALF)以及肺、结肠组织。取材时,腹腔注射10%水合氯醛溶液麻醉大鼠(剂量为3 mL/kg) 后腹主动脉放血留取血液标本,同时处死大鼠,打开胸腔,分离出气管及肺组织,反复进行左肺肺泡灌洗3次,回收肺泡灌洗液约2 mL左右,低速离心机3000 r/min离心15 min,取上清液-20 ℃冰箱保存待用。后取右肺中叶肺组织(约2 cm)3块和肛门上5 cm左右处结肠组织(约2 cm)3块,其中一块以10%甲醛固定,用于HE染色,另一块组织使用OCT包埋剂包埋,-70 ℃保存,用于免疫荧光染色,第三块组织PBS漂洗1~2 min,-70 ℃保存,制备组织匀浆。
1.5检测方法
1.5.1 ELISA 分别检测各组大鼠血清中SP-A和TNF-α含量,检测BALF中SP-A含量,操作程序按照ELISA试剂盒步骤和要求进行。
1.5.2 Western blot 取出制备好的肺、肠组织匀浆,提取蛋白。定量并配置好后加入胶孔中进行电泳。在封闭前进行转膜。于一抗中4 ℃过夜。第二日洗膜,加二抗,最后曝光。观察各组大鼠不同组织中SP-A蛋白的变化情况。
1.5.3 免疫荧光检测 分别将各组中肺、结肠组织用OCT包埋剂包埋,切片,冰丙酮固定,血清封闭,一抗孵育,二抗染色后共聚焦显微镜观察。
1.5.4 病理检测 分别将各组中肺、结肠组织用5%甲醛溶液固定,脱水,石蜡包埋,切片,HE染色,光镜下观察病理变化情况。

2 结果
2.1建模后大鼠胸片 对照组大鼠胸片无明显异常,肺叶纹理较清晰。重症肺炎模型组可见多个肺叶斑片渗出影,边界模糊,呈“大白肺”。见图1。

注:A为对照组; B为重症肺炎模型组
2.2ELISA检测BALF和血清中的SP-A 与对照组比较,重症肺炎组各时间段BALF中的SP-A表达降低(P<0.05);重症肺炎组各时间段血清中SP-A表达升高(P<0.05)。见图2。

注:BALF为肺泡灌注液;SP-A为表面活性蛋白-A;对照为生理盐水对照组;即刻为重症肺炎造模后即刻组;12 h为重症肺炎造模后12 h组;24 h为重症肺炎造模后24 h组;36 h为重症肺炎造模后36 h组;48 h为重症肺炎造模后48 h组;与对照组比较,*P<0.05
2.3Western blot检测肺和肠组织SP-A的表达 与对照组比较,重症肺炎各时间段肺组织SP-A表达减低(P<0.05)。 与对照组比较,即刻组肠SP-A蛋白表达升高(P<0.05),12、24、36、48 h组SP-A蛋白表达均降低(P<0.05)。见图3、4。

注:SP-A为表面活性蛋白-A;GAPDH为甘油醛-3-磷酸脱氢酶;对照为生理盐水对照组;即刻为重症肺炎造模后即刻组;12 h为重症肺炎造模后12 h组;24 h为重症肺炎造模后24 h组;36 h为重症肺炎造模后36 h组;48 h为重症肺炎造模后48 h组;与对照组比较,*P<0.05
2.4血清、肺、肠组织中TNF-α表达情况 ELISA检测显示,与对照组比较,重症肺炎组各时间段血清中TNF-α水平升高(P<0.05);Western blot结果显示,与对照组比较,重症肺炎组各时间段肺和肠组织TNF-α表达均升高(P<0.05)。见图5~7。

注:SP-A为表面活性蛋白-A;GAPDH为甘油醛-3-磷酸脱氢酶;对照为生理盐水对照组;即刻为重症肺炎造模后即刻组;12 h为重症肺炎造模后12 h组;24 h为重症肺炎造模后24 h组;36 h为重症肺炎造模后36 h组;48 h为重症肺炎造模后48 h组;与对照组比较,*P<0.05

注:TNF-α为肿瘤坏死因子-α;对照为生理盐水对照组;即刻为重症肺炎造模后即刻组;12 h为重症肺炎造模后12 h组;24 h为重症肺炎造模后24 h组;36 h为重症肺炎造模后36 h组;48 h为重症肺炎造模后48 h组;与对照组比较,*P<0.05

注:TNF-α为肿瘤坏死因子-α;GAPDH为甘油醛-3-磷酸脱氢酶;对照为生理盐水对照组;即刻为重症肺炎造模后即刻组;12 h为重症肺炎造模后12 h组;24 h为重症肺炎造模后24 h组;36 h为重症肺炎造模后36 h组;48 h为重症肺炎造模后48 h组;与对照组比较,*P<0.05

注:TNF-α为肿瘤坏死因子-α;GAPDH为甘油醛-3-磷酸脱氢酶;对照为生理盐水对照组;即刻为重症肺炎造模后即刻组;12 h为重症肺炎造模后12 h组;24 h为重症肺炎造模后24 h组;36 h为重症肺炎造模后36 h组;48 h为重症肺炎造模后48 h组;与对照组比较,*P<0.05

2.5免疫荧光观察SP-A变化 与对照组比较,重症肺炎即刻和48 h组肺组织中SP-A表达减少;与对照组比较,重症肺炎即刻组肠组织SP-A表达升高,48 h组降低;与三组肺组织中SP-A的表达分别比较,各组肠组织中的SP-A的表达均较低。见图8。
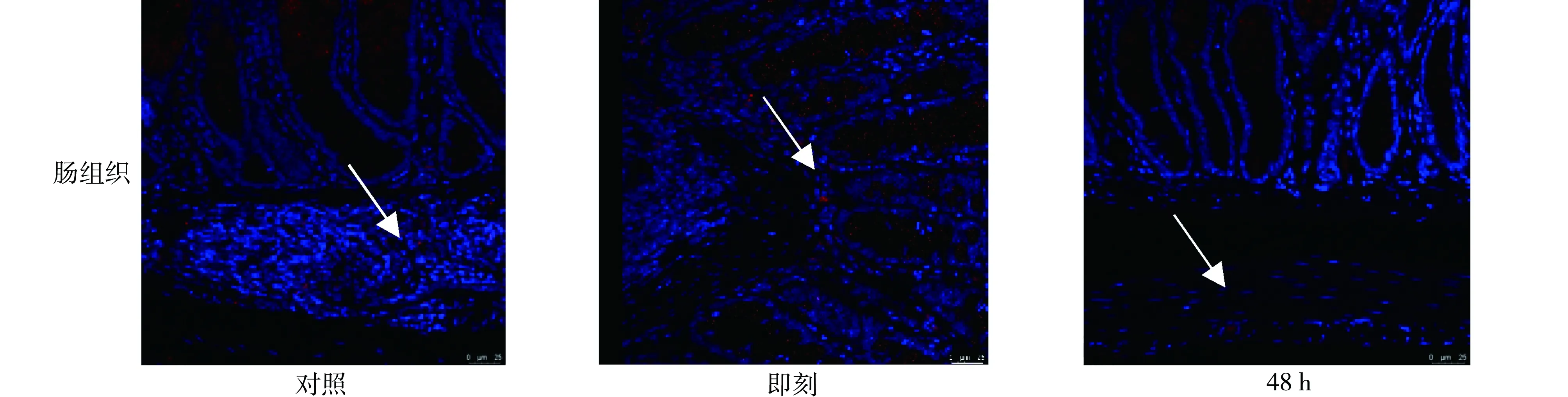
注:对照为生理盐水对照组;即刻为重症肺炎造模后即刻组;48 h为重症肺炎造模后48 h组
2.6HE染色观察肺、肠组织病理变化 与对照组比较,即刻组肺组织实变,肺泡上皮细胞肿胀,炎性细胞浸润,肺泡出血;造模12 h、24 h和 48 h组肺组织可见逐渐增多的炎性细胞浸润、渗出。与对照组比较,12 h组肠组织周围有少量渗出及出血;24 h组和48 h组细胞明显肿胀、坏死,炎性细胞逐渐增多。见图9。
3 讨论
通过构建重症肺炎大鼠模型,观察各时间段血清、BALF、肺、肠组织中SP-A的变化情况,发现肺组织与BALF中SP-A的表达规律一致,建模后呈下降趋势,24 h下降最明显,之后缓慢下降。血清SP-A在建模后升高,在24 h达高峰,之后有所下降,但均高于对照组。这与既往研究结果[9]一致。但肠组织中SP-A的表达在重症肺炎模型造模成功至24 h内有一过性升高,在24 h后与肺组织SP-A变化趋势一致,呈下降趋势。结合HE染色结果可见肠组织在重症肺炎初期的损伤较肺组织轻,但随着病情进展,肠损伤呈逐渐加重趋势。研究[10]证实,在肠道受到病原体及炎性因子刺激后,大肠内SP-A和炎症区域明显增加,高于正常组织。这是由于重症肺炎的进展中,肺组织的局部损伤向全身炎症反应进展让肠组织在炎性因子的打击下出现肠黏膜屏障受损,成为全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)的靶器官并加重SIRS。但24 h内肠组织SP-A一过性升高可能与在炎症初期大肠可代偿性分泌SP-A参加固有防御反应,SP-A可促进分泌免疫球蛋白有效阻止细菌对肠黏膜的吸附从而减轻或中止全身炎症反应有关[11]。实际上肺部感染的早期阶段亦存在SP-A的代偿性升高,在急性肺损伤大鼠模型研究中发现在急性肺损伤初期,脂多糖刺激肺组织合成、释放大量SP-A,代偿性增加[12]。而本实验从重症肺炎大鼠的胸片及HE染色可见炎性浸润已涉及多个肺叶,此时已处于感染较重阶段。但肺损伤初期并不在本次实验的观察期范围,故未发现一过性升高趋势。
TNF-α[13]是重要的促炎因子,由免疫细胞产生并导致其他炎症介质的产生和释放从而扩大炎症反应水平,促进急性期蛋白的表达,是引起 MODS[14]的主要炎性因子之一。TNF-α 在介导肠黏膜损伤的复杂反应中起关键作用[15]。本研究发现,重症肺炎组各时间段血清及肺、肠组织中TNF-α的表达均呈升高趋势,说明在重症肺炎时TNF-α参与了肺、肠组织的炎症反应。而SP-A在肺、肠组织中的表达与TNF-α呈反向变化。已有研究证实,TNF-α在肺和肠组织的免疫调节中,和SP-A参与了共同的免疫通路,SP-A 对免疫反应的不同作用主要依赖于参与调节的细胞受体不同[16]。Toll 样受体(TLR)是参与非特异性免疫的一类重要蛋白质受体,识别病原后引发机体的天然免疫反应[17]。活化后的 TLR 能促发细胞内级联反应并激活一系列转录因子, 如NF-κB,并进一步促进多种促炎性细胞因子如 TNF-α的产生[18],从而介导组织损伤和SIRS的发生。SP-A分子的CRD结构域可以通过Ca2+依赖途径和TLR受体结合[19],使TLR的活化通路被打断,促炎性细胞因子生成减少,TNF-α 降低;此外,SP-A可加强巨噬细胞对病原体的吞噬功能,抑制TLR介导的NF-κB信号通路,最终导致TNF-α显著减少[20]。这可解释随着感染进展,肺、肠组织内SP-A表达减少,SP-A与TLR受体结合减少,对TLR介导的NF-κB信号通路抑制减弱,促炎因子占主导,最终TNF-α增加。在金黄色葡萄球菌小鼠肺炎肠损伤的研究中亦发现,SP-A通过降低NF-κB信号通路的激活,减少促炎因子TNF-α的形成,从而减轻肺炎时的肠道损伤[21]。另一方面,TNF-α对SP-A的mRNA表达有明显的下调作用,这是由于炎症发生时产生的巨噬细胞可吞噬SP-A,而TNF-α是由巨噬细胞所产生,故随着炎症反应的进展,TNF-α逐渐增加,SP-A进一步降低[22]。这可解释本研究结果:肺、肠组织SP-A在建模24~48 h下降趋势减慢,在36~48 h达到稳态;而肺、肠组织中TNF-α在建模12~24 h升高,之后达到稳态,升高减缓。故肺和肠组织中TNF-α的变化趋势与SP-A相反,也间接证实了肺和肠组织拥有共同的NF-κB信号通路和调节因子;但ELISA结果提示,血清中TNF-α和SP-A变化趋势一致,提示SP-A是除TNF-α外另一个可以判断重症肺炎病情进展。
综上所述,重症肺炎大鼠模型中肺和肠组织SP-A的表达总体呈一致性下降趋势,而血清中SP-A呈升高趋势,故通过检测血清中SP-A的变化趋势就可判断肺部气血屏障的完整性,也可判断肠黏膜屏障的损伤情况。这对重症肺炎的治疗,尤其是在肠道症状发生前尽早保护肠黏膜屏障,从而减轻炎症反应,阻止向MODS的进展提供了新的思路。但由于研究尚处于动物实验阶段,且样本数量有限,未来还需要更多的临床样本加以证实。此外,SP-A和TNF-α的相互作用机制和通路是我们未来的研究方向。

