CDKN2A 基因突变与肾细胞癌药物敏感性和预后的关系
李松,李瑞杰,赵小磊
(1.河南大学淮河医院泌尿外科,河南 开封 475000;2.郑州市第二人民医院综合科,河南 郑州 450000)
肾透明细胞癌(kidney renal clear cell carcinoma)是泌尿系统肾细胞癌的一个独特亚型,根治性切除是肾细胞癌的主要治疗方法,其次是化疗和靶向治疗。然而,即使手术治疗成功,仍有30%的患者可能出现肿瘤复发或远处转移[1-3]。不同基因突变的患者可能对不同的药物治疗产生耐药性,因此对不同基因突变的患者进行个体化治疗更为重要[4]。因此,确定肾细胞癌进展和预后的潜在生物标志物和潜在相关分子机制是必要的,寻找潜在相关的靶向药物对于个体化治疗至关重要。Xu J等[5]研究证实,CDKN2A 启动子甲基化发生在支气管细胞癌变的早期。Hayashi T等[6]研究了胃癌患者的肿瘤组织,发现CDKN2A的失活通常是由5'CpG 岛的纯合缺失和高甲基化引起的,这在胃癌的发生发展中起着重要作用。Wang L等[7]发现,在77 例平滑肌肉瘤患者中,22%的患者存在CDKN2A 基因启动子高甲基化,表明CDKN2A 启动子高甲基化及其蛋白表达缺失与预后不良密切相关。然而,CDKN2A 在肾细胞癌中的作用尚不确定[8]。CDKN2A 突变状态可能影响某些肾细胞癌患者的病情进展和治疗。因此,探索CDKN2A 突变患者的一些相关信号通路将有助于进一步了解肾细胞癌进展的分子水平机制,并为患者的个体化治疗策略提供指导。为了探索肾细胞癌预后和个体化治疗反应的机制,本研究对肾细胞癌的RNA 测序数据集以分析基因突变,研究泛癌和肾细胞癌中CDKN2A 突变的药物敏感性。
1 资料与方法
1.1 数据来源 从在线探索工具TCGA 数据库下载(http://xena.ucsc.edu/)肾细胞癌基因表达谱(使用AgilentG4502A_07_3的肾细胞癌RNA 表达和突变基因)和临床信息。采用开源网络工具cBioPortal 分析Kaplan-Meier 图和CDKN2A 突变(http://www.cbioportal.org/index.do)。BioPortal 数据库(http://www.cbioportal.org)整合了各种基因数据类型,包括TCGA、UCSC、GDAC 等,从cBioPortal 数据库获得600份肾细胞癌样本,通过数据库筛选选项,提取患者相关资料,筛选条件:①“Cancer Type:KIRC”;②“Gene:CDKN2A”;③“Data Type:mRNA”。应用survival 选项分析600 份样本中CDKN2A 突变情况与生存时间(总体生存和无疾病生存)关系图,对3 种不同肾细胞癌研究中突变类型的mRNA 表达进行比较。
1.2 GDSC 数据库分析 癌症药物敏感性基因组学数据库(GDSC)(https://www.cancerrxgene.org/)是癌症临床研究中最常用的数据库之一,收集了大量关于肿瘤细胞药物敏感性的信息,进入数据库所有药物的界面,将“CDKN2A”数据集数据与化合物敏感性相关联,查看泛癌和肾细胞癌中CDKN2A 突变在药物的细胞系IC50图,并绘制和生成与相应药物敏感性的火山图和散点图。
1.3 基因集富集分析 基因集富集分析(GSEA)用于评估按表型相关性排序的基因列表中预定义基因集中的基因分布,以确定它们对表型的作用(http://software.org/gsea/下载.jsp)。应用分子特征数据库(MSigDB),基于标称P值和标准化富集分数(NES)分析路径富集。根据CDKN2A 基因表达量分为两组,通过GSEA4.1.0 分析CENPF 基因表达水平对各种生物通路基因集的影响,按照默认富集加权统计方法,选择MSigDB 数据库的基因集(c2.cp.kegg.v7.2.symbols.gmt)作为参照基因集,置换次数为1000 次,计算基因富集得分(enrichment score,ES)。
1.4 差异基因(DEGs)的鉴定与富集分析 使用R软件包在微阵列数据中选择-Log10(Pvalue)>2 且∣Log2(fold change)∣<1的DEGs。由DAVID(http://david.ncifcrf.gov)对DEGs 进行KEGG 途径和GO 富集分析,其中FDR<0.05,-LogFDR>1.302的前几个通路被认为是显著的。
1.5 统计学方法 采用Wilcoxon 试验比较突变型和野生型之间的CDKN2A mRNA 表达水平;采用Kaplan-Meier 法和Log rank 检验,通过Graphpad 计算不同CDKN2A 组之间的临床结果;edgeR 和GSEA中的FDR 分别采用Benjamini-Hochberg 程序进行多次试验调整,以控制FDR。P<0.05 被认为差异有统计学意义。
2 结果
2.1 肾细胞癌中的CDKN2A 表达及突变 600 例肾细胞癌样本中有5.00%的CDKN2A 突变病例,其余为野生型(图1A)。CDKN2A 在肾细胞癌中的突变类型包括亚基突变、错义突变、截断突变和跨越整个基因的深度缺失(图1B)。其中,3.00%为深度缺失,2.00%为错义突变、截断突变和inframe 突变(图2A)。CDKN2A 突变类型为深度缺失的mRNA 表达低于野生型(图2B);与突变型相比,野生型的CDKN2A 表达较高(图2C);CDKN2A 在肾细胞癌中的表达高于正常肾组织。

图1 肾细胞癌中CDKN2A的突变
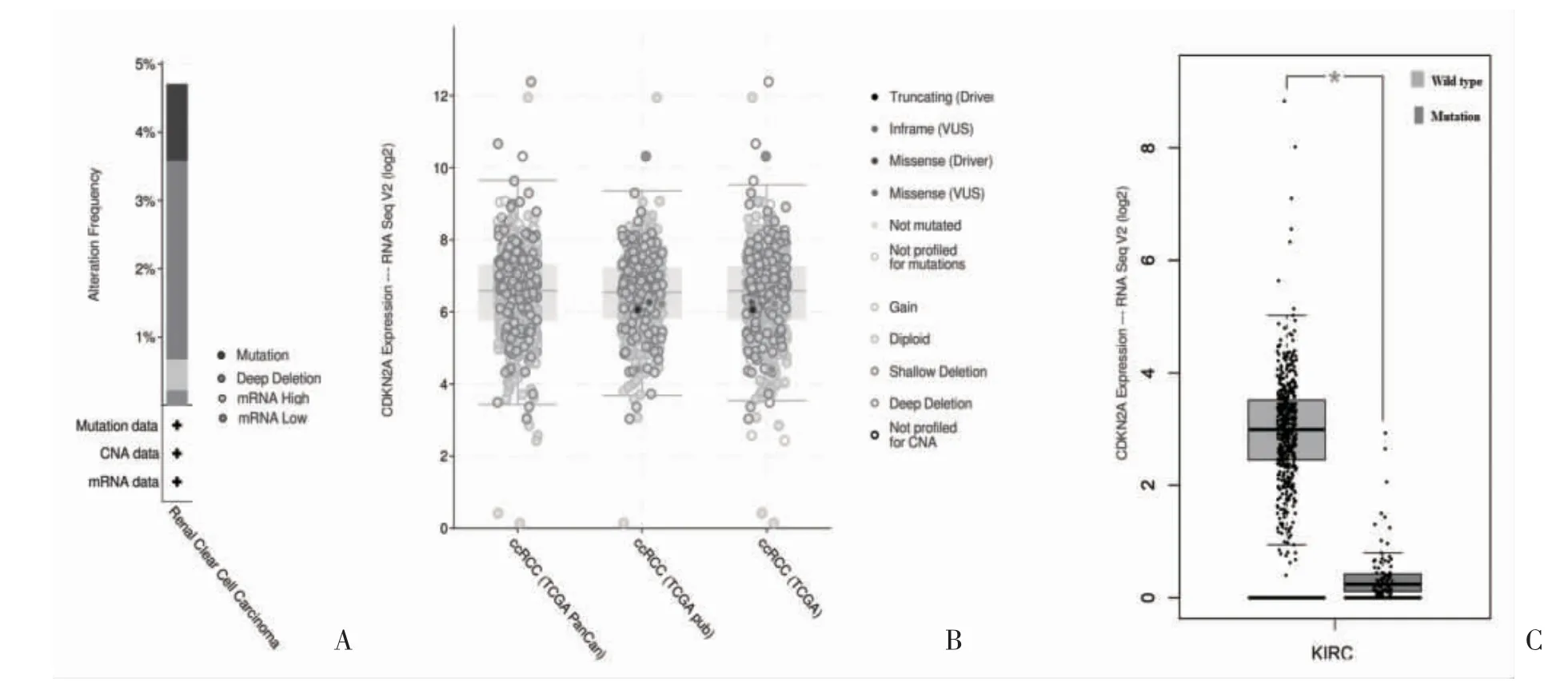
图2 肾细胞癌中CDKN2A的突变表达
2.2 CDKN2A 基因突变对肾细胞癌患者预后和药物敏感性的影响 肾细胞癌患者的临床特征见表1,生存分析显示,具有CDKN2A 突变的肾细胞癌患者总体生存率和无病生存率较差(图3),在泛癌和肾细胞癌中,CDKN2A 突变型可能比野生型增加对Tenovin-6 等药物的耐药性,并且Tenovin-6 对各种癌症和肾细胞癌中的野生型具有选择性(图4)。

图3 CDKN2A 基因突变对肾细胞癌患者预后的影响

图4 CDKN2A 基因突变对肾细胞癌患者药物敏感性的影响

表1 肾细胞癌患者的临床特征
2.3 基于GSEA的CDKN2A 突变信号通路分析GSEA 分析显示,CDKN2A 突变信号通路主要富集在Wnt-catenin 信号、泛素介导的蛋白水解、紧密连接、TGF-β 信号、磷脂酰肌醇信号、erbb 信号和粘附连接(图5)。2.4 DEGs的鉴定和富集分析 共有350 个基因被鉴定为DEGs,包括170 个下调基因和180 个上调基因。DEGs的火山图见图6A。使用DAVID 对DEGs进行富集分析,GO 分析结果表明,DEGs 主要富集于RNA 聚合酶Ⅱ启动子、转录、细胞核、细胞质、转录因子复合物和序列特异性DNA 结合的转录负调控,见图6B。KEGG 通路分析显示,DEGs 主要富集于细胞周期、癌症、慢性髓系白血病、癌症中的microRNA 和p53 信号通路,见图6C。

图5 肾细胞癌CDKN2A 突变的GSEA 富集分析

图6 DEGs的鉴定和富集分析
3 讨论
CDKN2A 基因位于染色体9p21 上,受调控的CDKN2A 蛋白包含156 个氨基酸,在细胞周期中调节细胞增殖并抑制肿瘤的产生,该基因的失活可导致细胞分离控制和恶性进展为肿瘤[9]。目前研究发现,该基因在许多肿瘤中丢失或发生突变。CDKN2A基因失活的机制包括启动子甲基化、纯合缺失和点突变,平均频率分别为33%、22%和15%;另外,研究还发现9p21 区域杂合性缺失与肿瘤发生有关[10]。
CDKN2A 在各种肿瘤的恶性转化中突变类型包括纯合缺失(HD)、杂合性缺失(LOH)、p16INK4a/p14ARF 基因启动子的突变和异常甲基化[11]。Ibrahim I等[12]研究了肺癌、卵巢癌和头颈部鳞状细胞癌的89 个细胞系中246 个位点的纯合缺失,发现CDKN2A 基因的纯合缺失最常见(26%),且与疾病预后的关系不同。本研究发现,肾细胞中约5.00%的患者携带CDKN2A 突变,包括亚基突变、错义突变、截断突变和跨越整个基因的深度缺失,其中3.00%为深度缺失,2.00%为错义突变、截断突变和近端突变。Thompson ED等[13]发现,CDKN2A的总突变率为93.3%,启动子异常甲基化占46.7%,纯合缺失占36.7%,突变占13.3%。
Ibrahim IS等[14]发现,CDKN2A 启动子甲基化与直肠癌患者的复发和预后相关,表明CDKN2A 启动子甲基化可作为预测直肠癌预后的指标。Potjer TP等[15]发现,胰腺癌患者的肿瘤组织中存在一种特殊的CDKN2A 突变,表明CDKN2A 突变可能被用作胰腺癌的标志物。本研究显示,CDKN2A 突变的肾细胞癌患者总体生存率和无病生存率较差,这表明CDKN2A 突变可能有助于肾细胞癌的进展。除此之外,降低CDKN2A 表达水平已被证明可增加肿瘤细胞对化疗或放疗的耐受性[16]。因此,CDKN2A 可以作为新的抗癌治疗策略的靶点。本研究发现,与野生型相比,CDKN2A 突变对Tenovin-6 等药物的敏感性较低,这表明Tenovin-6 突变在治疗上的预后较差,并且在各种癌症和肾细胞癌中,Tenovin-6 对野生型具有显著的选择性。随着组蛋白去乙酰化酶(HDAC)的发展,HDAC 抑制剂(HDACi)已成为抗肿瘤药物的研究热点[17]。Tenovin-6 是近年来开发的一种HDACi,是脱乙酰酶SIRT1的抑制剂,选择性地抑制Ⅲ类HDACs 中最常见的SIRT1 和SIRT2,并激活P53,具有更大的临床应用价值。Tenovin-6 可以抑制肿瘤细胞的增殖,促进细胞凋亡和周期阻滞[18]。这些研究为肾细胞癌患者个体化应用特异性抗肿瘤药物提供了额外证据,并为进一步研究提供了基础。
本研究发现,肾细胞癌患者CDKN2A 突变信号通路主要富集Wnt-catenin 信号、泛素介导的蛋白水解、紧密连接、TGF-β 信号、磷脂酰肌醇信号、erbb信号和粘附连接。已有研究证实[12],CDKN2A 基因的负调控途径是RB1 途径。CDKN2A 蛋白包含四个连续的锚蛋白重复序列,它们与CDK4 和CDK6 结合,而CDK4 和CDK6 是一种双周期依赖性蛋白激酶,作用于CDK4-6的非催化侧,可抑制CDK 和细胞周期蛋白D1 复合物的催化活性[19]。CDKN2A 突变可能通过影响多种途径促进肾细胞癌的进展,CDKN2A突变患者的肿瘤可能更容易进展和远处转移[20]。另外,本研究还发现,GO 分析中差异基因主要富集在RNA 聚合酶Ⅱ启动子、转录的负调控中。
综上所述,多个基因和通路途径可能在CDKN2A 突变中起关键作用。本研究确定了与肾细胞癌中CDKN2A 突变相关的主要途径,这可能通过制定肾细胞癌特定CDKN2A 突变亚型的治疗策略来改善肾细胞癌的预后。另外,肾细胞癌中CDKN2A突变的机制和验证仍需在临床和分子生物学实验中进一步研究。

