超快速气相电子鼻分析山茱萸炮制过程气味成分动态变化Δ
钱怡洁,魏 伟,朱广飞,皮文霞,陆兔林,毛春芹(南京中医药大学药学院,南京 210023)
山茱萸为山茱萸科植物山茱萸Cornus officinalisSieb.et Zucc.的干燥成熟果肉,具有固精缩尿、补肾益精、收敛止汗之功效,为收涩固脱之要药,常用于治疗眩晕耳鸣、腰膝酸痛、崩漏带下、大汗虚脱等症[1]。2020年版《中国药典》(一部)收载了净山萸肉(山萸肉)和酒萸肉2种饮片[1],酒萸肉较净山萸肉具有更强的滋补肝肾作用[2]。饮片是中药材经炮制后用于临床的药物,饮片的质量可直接影响临床疗效,目前山茱萸饮片的质量研究主要集中在内在成分的定量分析方面[3],而外观性状作为评价中药质量的常用手段,仍停留在主观描述层面,主要通过眼观、鼻闻、口尝等方式判断质量优劣[4],这难以控制质量且缺乏客观性。
气味是评价中药饮片质量的重要指标之一[5]。2020年版《中国药典》(一部)山茱萸炮制项下规定,酒萸肉通过“酒蒸法”或“酒炖法”所得,且应“微有酒香气”[1],目前山茱萸的气味研究主要采用气相色谱-质谱联用技术[6],但该方法在样品前处理和操作方面较为繁琐,无法模拟人鼻子对气味的识别,具有一定的局限性,且不能客观体现酒萸肉的酒香气。
超快速气相电子鼻具有灵敏度高、分析时间短、高通量、样本处理简单等优点[7],其自带的计量学模型可用于新样本和未知样本的识别与分组,可快速识别未知样本,现已在中药硫磺熏蒸质量鉴别[8]、中药产地鉴别[9]、饮片炮制[10]等领域广泛应用。基于此,本研究使用超快速气相电子鼻建立了净山萸肉及酒萸肉的气味色谱图,分析山茱萸炮制过程中的气味动态变化及气味差异标志物,旨在从气味方面为山茱萸炮制动态监控提供科学依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有Heracles Neo型超快速气相电子鼻、PAL RSI型自动进样器(法国Alpha Mos公司),FA1104N型电子天平(上海菁海仪器有限公司),DHG-9140A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司)等。
1.2 主要药品与试剂
正构烷烃混合标准品(批号A10142930,每100 g混合物中含正构烷烃0.02~52.27 g)购自美国Restek公司;黄酒(酒精度≥15.0%)购自浙江古越龙山绍兴酒股份有限公司;山茱萸药材(批号2005042,产地河南)购自扬子江药业集团,经南京中医药大学药学院陆兔林教授鉴定为山茱萸科山茱萸属植物山茱萸C.officinalisSieb.et Zucc.的干燥成熟果肉。
2 方法与结果
2.1 供试品的制备
按2020年版《中国药典》(四部)通则“酒蒸法”炮制[11]。取山茱萸药材,除去果核、果梗等杂质,得净山萸肉,平行制备3批(编号S)。取净山萸肉100 g,用黄酒闷润,密闭,分别于蒸制1、2、4、6、8、10、12、18、24 h时取出,稍晾,干燥,每个时间点平行炮制3批样品,即得27批酒萸肉供试品(编号分别为Z1、Z2、Z4、Z6、Z8、Z10、Z12、Z18、Z24),取样品粉碎,过三号筛。每100 kg净山萸肉用黄酒20 kg。
2.2 单因素考察
2.2.1 进样量 取酒萸肉(编号Z8)粉末1 g,精密称定,设置孵育温度60℃、孵育时间20 min、捕集阱捕集温度40 ℃,考察不同进样量(1 000、2 000、3 000、4 000、5 000 μL)对气味色谱峰峰面积和峰形的影响。结果显示,随着进样量的增加,色谱峰的峰面积不断增大;当进样量为4 000 μL时,色谱峰数目不再增加,峰面积趋于饱和,峰形良好,故选择进样量为4 000 μL。
2.2.2 孵育温度 取酒萸肉(编号Z8)粉末1 g,精密称定,设置进样量4 000 μL、孵育时间20 min、捕集阱捕集温度40℃,考察不同孵育温度(40、50、60℃)对气味色谱峰峰面积和峰形的影响。结果显示,当孵育温度为60℃时,色谱峰数目最多,峰面积最大,峰形良好,故选择孵育温度为60℃。
2.2.3 孵育时间 取酒萸肉(编号Z8)粉末1 g,精密称定,设置进样量4 000 μL、孵育温度60℃、捕集阱捕集温度40 ℃,考察不同孵育时间(10、20、30、40 min)对气味色谱峰峰面积和峰形的影响。结果显示,随着孵育时间的延长,色谱峰峰面积增大;当孵育时间为20 min时,色谱峰峰面积趋于饱和,峰形良好,故选择孵育时间为20 min。
2.2.4 捕集阱捕集温度 取酒萸肉(编号Z8)粉末1 g,精密称定,设置进样量4 000 μL、孵育温度60℃、孵育时间20 min,考察不同捕集阱捕集温度(30、40、50℃)对气味色谱峰峰面积和峰形的影响。结果显示,随着捕集阱捕集温度的增加,色谱峰峰面积增大;当捕集阱捕集温度为40℃时,色谱峰数目无明显变化,峰面积趋于饱和,峰形良好,故选择捕集阱捕集温度为40℃。
2.3 检测条件
本研究所用的色谱柱为低极性MXT-5(交联5%联苯/95%二甲基聚硅氧烷)、中极性MXT-1701(交联14%氰丙基苯/86%二甲基聚硅氧烷)金属毛细管柱,规格均为10 m×0.18 mm×0.4µm;样品瓶为20 mL;样品量为1 g;进样量为4 000 μL;孵育温度为60℃;孵育时间为20 min;进样速度为125 μL/s;进样持续时间为37 s;进样口温度为200℃;捕集阱捕集温度为40℃;捕集阱分流速度为10 mL/min;捕集持续时间为42 s;捕集阱最终捕集温度为240℃;初始温度为50℃,程序升温(以1℃/s升至80℃,以3℃/s升至250℃,保持21 s);采集时间为110 s;火焰离子化检测器增益为12。
2.4 方法学考察
取酒萸肉(编号Z8)粉末约1 g,共6份,精密称定,按“2.3”项下检测条件进样分析,记录峰面积,考察方法精密度和重复性;取酒萸肉(编号Z8)粉末约1 g,共7份,分别于室温下放置0、4、8、12、16、20、24 h时按“2.3”项下检测条件进样分析,记录峰面积,考察样品的稳定性。结果显示,RSD均小于5%,表明方法精密度、重复性均较好,样品在室温下放置24 h内稳定。
2.5 山茱萸炮制过程的气味定性分析
取净山萸肉及酒萸肉,按“2.3”项下检测条件连续进样3次,将色谱峰保留时间(tR)转化成Kovates保留指数(RI),通过与AroChemBase数据库比对,得到气味化合物定性分析结果(表1);采用Origin软件绘制气味色谱图(图1、图2)。由于MXT-5色谱柱的色谱峰分离度较好,故以MXT-5色谱柱为代表呈现具体的峰面积均值(表2)。结果显示,净山萸肉共识别出12个共有气味色谱峰(峰1~5、7~10、15、18、21);共有气味色谱峰峰面积占所有峰面积总和的比值从大到小依次为乙醇、糠醛、异丙醇、2-甲基丙醛、异戊醇、2-己醇、己醛、十二醛、(Z)-2-辛烯醛、5-甲基-5(H)-环戊吡嗪、乙酸乙酯(因空白瓶中也含有氯乙烷,故此峰不作为气味色谱峰)。有研究认为,乙醇气味可能来自果实存放过程中无氧呼吸释放的乙醇[12]。异戊醇[13]、糠醛[14]、己醛[15]、十二醛[15]、2-辛烯醛[15]的检出已有文献报道。酒萸肉共识别出21个共有气味色谱峰(峰1~21),其中峰6、11~14、16~17、19~20为炮制后新增气味色谱峰。

表1 气味化合物定性分析结果

图1 净山萸肉和酒萸肉的气味色谱图

图2 净山萸肉和酒萸肉在MXT-5色谱柱上的气味色谱图

表2 净山萸肉和酒萸肉在MXT-5色谱柱上的气味色谱峰峰面积均值
2.6 山茱萸炮制过程的气味动态变化分析
2.6.1 主要气味成分 山茱萸炮制过程中,峰面积较高的气味成分分别为乙醇、异丙醇、2-甲基丙醛、乙酸乙酯、2-甲基丁醛、异戊醇、2-己醇、糠醛,其峰面积总和在色谱图中占比超过80%,表明这8个气味成分可以代表山茱萸炮制过程的气味变化。上述8个气味成分中,乙醇的色谱峰峰面积占比最高(除炮制24 h的样品外),均大于50%;其次为糠醛(仅在炮制24 h的样品中超过乙醇,达33.66%);且这8个气味成分炮制后峰面积均增加,如乙醇、异戊醇、2-己醇及异丙醇的峰面积在炮制2 h时达到最大值,后呈下降趋势,但在炮制24 h时仍高于净山萸肉;乙酸乙酯、2-甲基丁醛、糠醛的峰面积随炮制时间增加而增加;2-甲基丙醛的峰面积变化无明显规律。
2.6.2 其他气味成分 除上述8个成分外的其他气味色谱峰峰面积在色谱图中的占比较低,均不高于3.00%。己醛既是山茱萸固有气味成分也是黄酒的风味物质[16],在炮制过程中其峰面积随炮制时间增加而不断增加;十二醛、(Z)-2-辛烯醛的峰面积随炮制时间增加呈下降趋势;3-甲硫基丙醛、苯甲醛、3-巯基-3-甲基-1-丁醇、5-甲基呋喃、2-壬酮、3-甲硫基丙酸乙酯、对甲基苯乙酮、甲基糠基二硫的峰面积均随炮制时间增加而不断增加,在炮制18~24 h时趋于稳定;5-甲基-5(H)-环戊吡嗪的峰面积在炮制0~2 h时增加,之后趋于稳定。
2.7 化学模式识别分析
2.7.1 主成分分析 以净山萸肉及酒萸肉的21个气味色谱峰峰面积为变量,采用Alpha Soft V14.2软件进行主成分分析。结果显示,主成分1的贡献率为99.046 0%,主成分2的贡献率为0.928 2%,累计贡献率为99.974 2%,表明前2个主成分能反映净山萸肉及酒萸肉的气味信息。结果见图3。

图3 净山萸肉和酒萸肉的主成分分析图
2.7.2 判别因子分析 以净山萸肉及酒萸肉的21个气味色谱峰峰面积为变量,采用Alpha Soft V14.2软件进行判别因子分析。结果显示,因子1和因子2的累计贡献率为83.003%,表明不同炮制时间的酒萸肉能得到有效区分,与主成分分析结果一致。结果见图4。
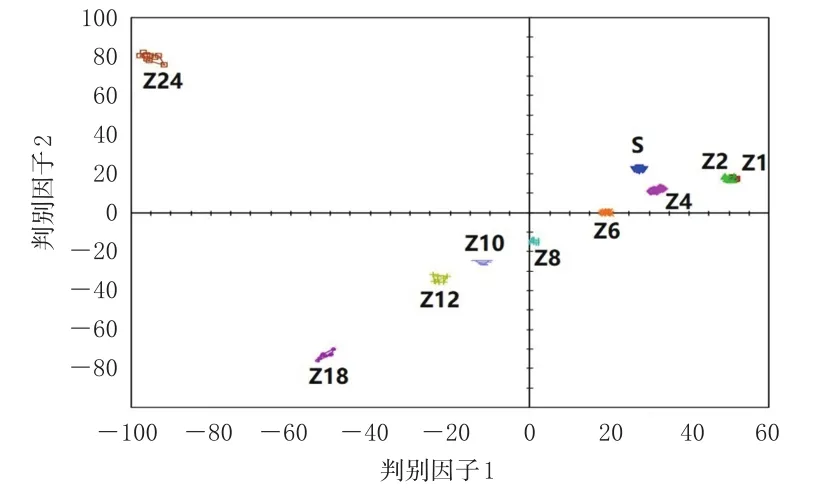
图4 净山萸肉和酒萸肉的判别因子分析图
2.7.3 偏最小二乘法-判别分析 以净山萸肉及酒萸肉的21个气味色谱峰峰面积为变量,采用SIMCA14.1软件进行偏最小二乘法-判别分析。结果显示,模型解释率(R2Y)为0.753,模型预测率(Q2)为0.686,均大于0.5,表明模型具有良好的解释率和可靠性。变量重要性投影(variable importance in projection,VIP)值大于1被认为是对分类贡献较大的变量[17]。结果显示,乙醇、糠醛、2-甲基丙醛、2-己醇、乙酸乙酯、异丙醇、2-甲基丁醛、异戊醇、甲基糠基二硫的VIP值均大于1,提示这9个气味成分是影响山茱萸饮片气味的差异标志物。将21个气味色谱峰峰面积导入SPSS 24软件进行Kruskal-Wallis检验,结果显示,各色谱峰峰面积均有显著性(P<0.01)。结合“2.6.1”项下结果,上述9个气味成分中仅甲基糠基二硫的峰面积占比较低,因此可将乙醇、异丙醇、2-甲基丙醛、乙酸乙酯、2-甲基丁醛、异戊醇、2-己醇、糠醛作为山茱萸炮制过程客观量化的监测指标。结果见图5。
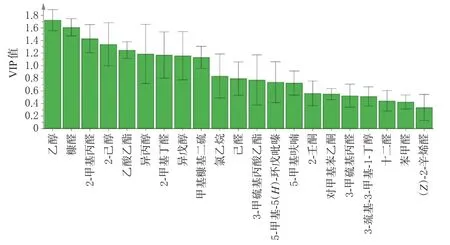
图5 21个气味色谱峰的VIP值
3 讨论
有研究发现,乙醇是黄酒香气的主要成分[18],而异戊醇、异丙醇为乙醇发酵的代谢产物[19];乙酸乙酯、2-己醇普遍存在于发酵酒中,前者具有水果、黄油、焦糖香气,后者具有花椰菜、葡萄酒香气[20-21];糠醛、2-甲基丁醛、2-甲基丙醛是美拉德反应中Strecker降解产生的风味化合物[22],广泛存在于酿造酒、烘焙食品中,前二者具有坚果香气,2-甲基丙醛具有烘焙马铃薯、水果香气[23-25]。糠醛、2-甲基丁醛是炒制过程产生香气的物质基础[26]。根据本课题组前期研究结果,得出乙醇、乙酸乙酯、异戊醇、2-己醇、糠醛为黄酒的气味特征峰;糠醛为炮制加热与辅料黄酒共有的气味特征峰;异丙醇、2-甲基丙醛、2-甲基丁醛为山茱萸的气味峰,其中2-甲基丁醛为山茱萸炮制加热产生的特征峰。
本研究结果显示,山茱萸炮制后,黄酒气味特征峰乙醇、异戊醇、2-己醇的峰面积随着炮制时间增加,呈先增加后降低趋势,在炮制2 h时达到最大值后呈下降趋势;炮制24 h时,这3个气味特征峰的峰面积仍略高于净山萸肉,这提示山茱萸的炮制时间不宜过长,时间过长可使酒萸肉的酒香气消失;此外,2-甲基丁醛和糠醛也随炮制时间增加,峰面积总体不断增加,其中糠醛为美拉德反应产生的风味物质,该成分具有内脏、神经等毒性[27],这也提示了山茱萸的炮制时间不宜过长。
主成分分析和判别因子分析结果均可以有效区分不同炮制时间的酒萸肉。结果显示,随着炮制时间增加,酒萸肉的气味发生了明显变化,这为辨别不同炮制时间酒萸肉提供了科学依据。偏最小二乘法-判别分析结果显示,乙醇等9个气味成分的VIP值均大于1,是影响酒萸肉气味的差异标志物,结合气味动态变化分析结果,提示乙醇、异丙醇、2-甲基丙醛、乙酸乙酯、2-甲基丁醛、异戊醇、2-己醇、糠醛可作为山茱萸炮制过程的监测指标。
综上所述,本研究建立了山茱萸炮制过程中气味成分的动态变化监测方法,乙醇等8个气味成分可作为山茱萸炮制过程的监测指标。

