动脉硬化对新发心力衰竭发生风险的影响
刘雪梅,李月华,吴寿岭,陈朔华
心力衰竭(心衰)是多种心血管疾病的严重表现和晚期阶段,患者再住院率高,预后较差[1]。我国心衰负担重,2000~2015 年心衰患病率从0.9%升至1.3%[2]。寻找和管理心衰危险因素、找出并实施更加有效的心衰预防措施是关键。
在心衰发病过程中,心脏会出现一系列的改变,如左心室重塑、收缩或舒张功能障碍等[3]。动脉硬化和左心室收缩、舒张功能障碍密切相关[4]。有研究报道,动脉硬化对心衰的发展具有促进作用[5-9]。关于动脉硬化对心衰的影响,目前国内尚缺乏相关研究报道。基于此,我们利用开滦研究资料开展前瞻性队列研究,选用臂踝脉搏波传导速度(baPWV)作为评价动脉硬化的指标,以开滦集团在职职工及离退休人员为观察人群,探讨动脉硬化对新发心衰及射血分数保留的心衰(HFpEF)发生风险的影响,并明确其影响是否独立于传统危险因素,为临床提供参考信息。
1 资料与方法
1.1 研究对象
本研究数据来源于正在进行的开滦前瞻性队列研究(始于2006 年)。自2010 年开始,开滦研究开始使用baPWV 来评估动脉硬化。本研究将完成第一次baPWV 检测及同期参与健康体检的检查者作为研究对象。纳入标准:(1)完成首次baPWV 检测及同期开滦研究健康体检的人群;(2)年龄≥18 周岁;(3)同意参加本研究并签署知情同意书者。排除标准:(1)有心衰病史者;(2)体检数据资料不全者;(3)患恶性肿瘤者;(4)收缩压>300 mmHg(1 mmHg=0.133 kPa)和(或)<80 mmHg,舒张压>300 mmHg 和(或)<40 mmHg,baPWV>3 500 cm/s。
2010~2015 年间完成首次baPWV 测量及健康体检的观察人群为26 378 例,排除测量baPWV 前发生心衰者167 例、体检数据缺失者2 174 例、恶性肿瘤病史者73 例及收缩压、舒张压和baPWV 处于上述极值者169 例,最终23 795 例被纳入本研究进行统计分析。参考中国专家共识标准及相关已发表文献[10-11],根据baPWV 基线测量值将研究对象分成三组:baPWV<1 400 cm/s 组(n=10 717)、baPWV 1 400~1 800 cm/s 组(n=9 354)、baPWV>1 800 cm/s组(n=3 724)。
1.2 基线资料收集
流行病学调查内容、人体测量学指标、生化指标及生活习惯等信息的采集参照本课题组已发表的文献[12-13]。平均动脉压(MAP)=舒张压+(收缩压-舒张压)/3;体重指数(BMI)=体重(kg)/身高2(m2)。
baPWV 测量方法:应用体积描记仪(欧姆龙VP21000,脉冲体积波长0.26~30.00 Hz,日本)测量脉搏波传导速度(PWV)。受检者去枕平卧,5~10 min后开始测量。将受检者基本资料(性别、年龄、身高和体重)输入仪器后,将记录心音采集装置放在其心前区,将4 个袖带束缚在其肱部及踝部,把心电极夹于两侧手腕。仪器通过袖带的感受器来测量脉搏波形和血压,自动计算,取左右两侧测量值的平均值作为最终结果。
1.3 相关定义及诊断标准
原发性高血压:收缩压≥140 mmHg 和(或)舒张压≥90 mmHg,或收缩压<140 mmHg 和(或)舒张压<90 mmHg 但使用降压药物或有高血压病史。2 型糖尿病:空腹血糖(FBG)≥7.0 mmol/L,或FBG<7.0 mmol/L 但服用降糖药或有糖尿病史。血脂异常:总胆固醇>5.2 mmol/L,或甘油三酯>1.7 mmol/L,或低密度脂蛋白胆固醇>3.1 mmol/L,或高密度脂蛋白胆固醇<1.04 mmol/L,和(或)患者服用降脂药物。体重正常:BMI<25 kg/m2;超重:BMI ≥25 kg/m2。吸烟:近一年内平均每日吸烟量≥1 支。饮酒:平均每日饮酒量(酒精含量50%以上)≥100 ml,持续年限≥1 年。积极体育锻炼:每周锻炼≥3 次,每次持续时间不小于30 min。可疑动脉硬化:baPWV 1 400~1 800 cm/s;动脉硬化:baPWV>1 800 cm/s。
1.4 心衰的判断标准
心衰的确定由经过培训的医务人员查阅上述医院及其他唐山市医保定点医院疾病诊断并记录心衰事件情况。新发心衰依据《中国心衰诊断和治疗指南2018》进行定义[14]。查阅病历明确以下情况:(1)有心衰临床症状,表现为呼吸困难、乏力及液体潴留,NYHA 心功能分级Ⅱ、Ⅲ、Ⅳ级或Killip 心功能分级Ⅱ、Ⅲ、Ⅳ级;(2)超声心动图检测患者存在左心室肥厚和(或)左心房扩大和(或)心脏舒张功能异常;(3)利钠肽升高。心衰诊断必须包含条件(1)以及条件(2)和(3)中的至少1 个。
1.5 随访
以第一次测量baPWV 的时间作为随访起点时间,以新发心衰为终点事件,截止时间为新发心衰的发生时间、死亡时间或随访截止日期(2015 年12月31 日)。经过培训的医务人员每半年查阅一次各医院的疾病诊断并记录终点事件发生情况,所有诊断均经过专业医师确认。
1.6 质量控制
对查体医师、数据录入人员及随访人员组织统一培训,对所有观察人群建立一致性调查表。同一实验室专业人员采用同一批试剂检测生化指标,采用盲法[15]。
1.7 统计学方法
采用SAS 9.3 和SPSS 17.0 统计软件进行数据分析。正态性计量资料采用均数±标准差表示,偏态分布计量资料以中位数(P25,P75)表示,分类变量采用例(百分比)表示。分类和连续变量分别采用卡方检验和方差分析,比较三组研究对象的一般临床特征。用寿命表法计算三组的新发心衰及其亚组HFpEF 的累积发病率,组间累积发病率的差异采用log-rank 检验比较。构建多变量调整Cox 比例风险回归模型进行心衰事件影响因素分析,建立3 个模型来校正混杂因素对心衰的影响:(1)模型Ⅰ为单因素Cox 比例风险模型;(2)模型Ⅱ在模型Ⅰ的基础上校正基线年龄和性别;(3)模型Ⅲ在模型Ⅱ的基础上校正吸烟、饮酒、体育锻炼、病史(高血压、糖尿病、血脂异常、心肌梗死)、BMI 及静息心率。P<0.05(双侧检验)为差异有统计学意义。
2 结果
2.1 研究对象的基线资料
所有研究对象的平均年龄为(49.21±12.58)岁,平均baPWV 为(1 499.84±335.52)cm/s。在三组间,随着baPWV 增高,收缩压、舒张压、平均动脉压、BMI、静息心率、空腹血糖、总胆固醇、甘油三酯、低密度脂蛋白胆固醇水平逐渐升高,且男性、吸烟、饮酒者及有心肌梗死、糖尿病、高血压、血脂异常病史者的比例均逐渐增加(P均<0.05),见表1。
表1 三组研究对象的基线资料比较()
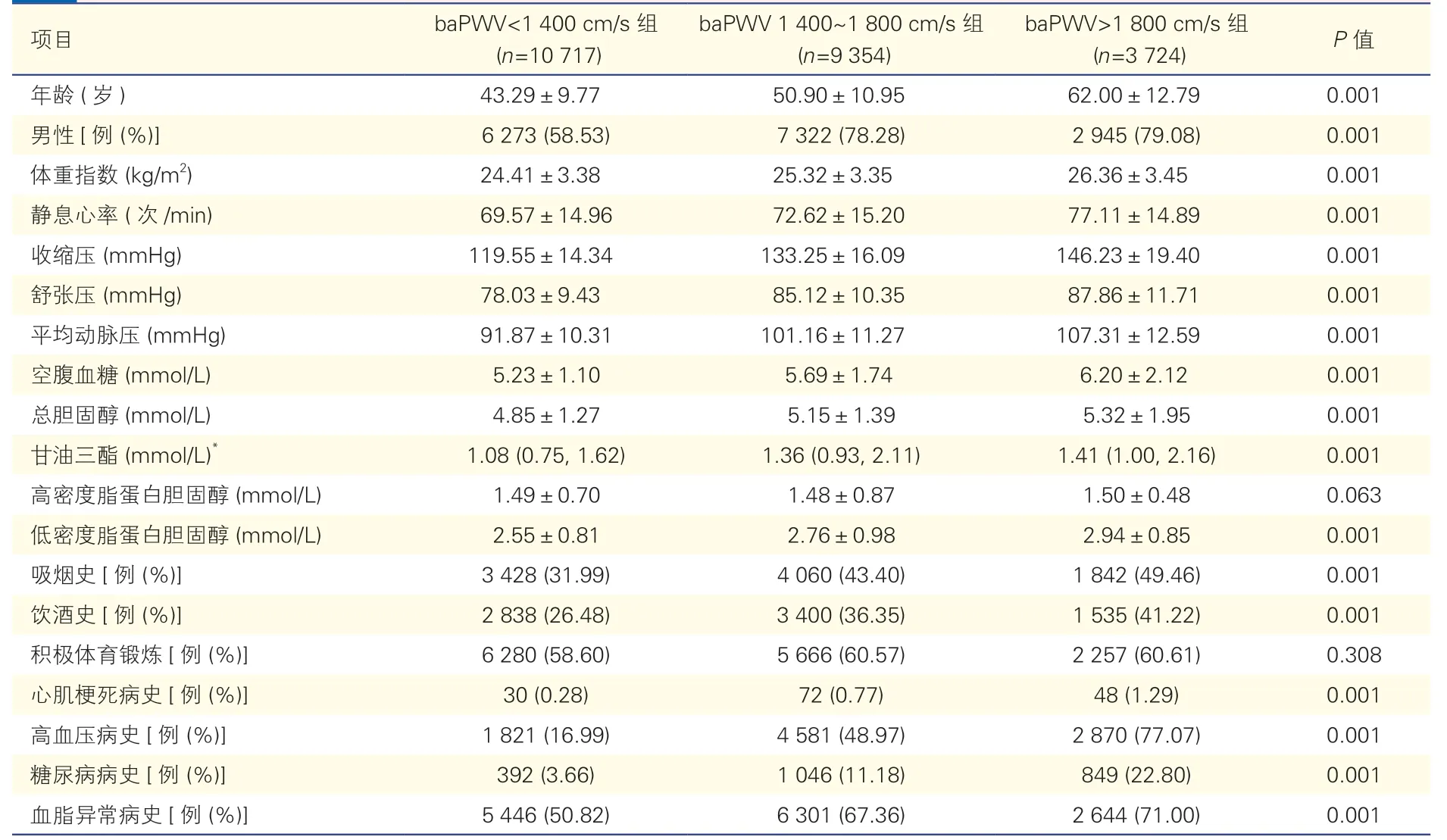
表1 三组研究对象的基线资料比较()
注:baPWV:臂踝脉搏波传导速度。*:以中位数(P25,P75)表示。1 mmHg=0.133 kPa
2.2 三组新发心衰和HFpEF 的累积发病率
平均随访(2.73±1.98)年期间,新发心衰141例(0.6%),其中HFpEF 96 例(68.1%)、射血分数降低的心衰15 例(10.6%)、未分类心衰30 例(21.3%)。baPWV<1 400 cm/s 组、baPWV 1 400~1 800 cm/s 组、baPWV>1 800 cm/s 组中新发心衰的累积发病率分别为0.15%、0.59%和1.88%,HFpEF 累积发病率分别为0.11%、0.37%及1.32%,log-rank 检验显示,组间差异均有统计学意义(P均<0.001)。
2.3 新发心衰和HFpEF 影响因素的Cox 比例风险回归分析(表2)
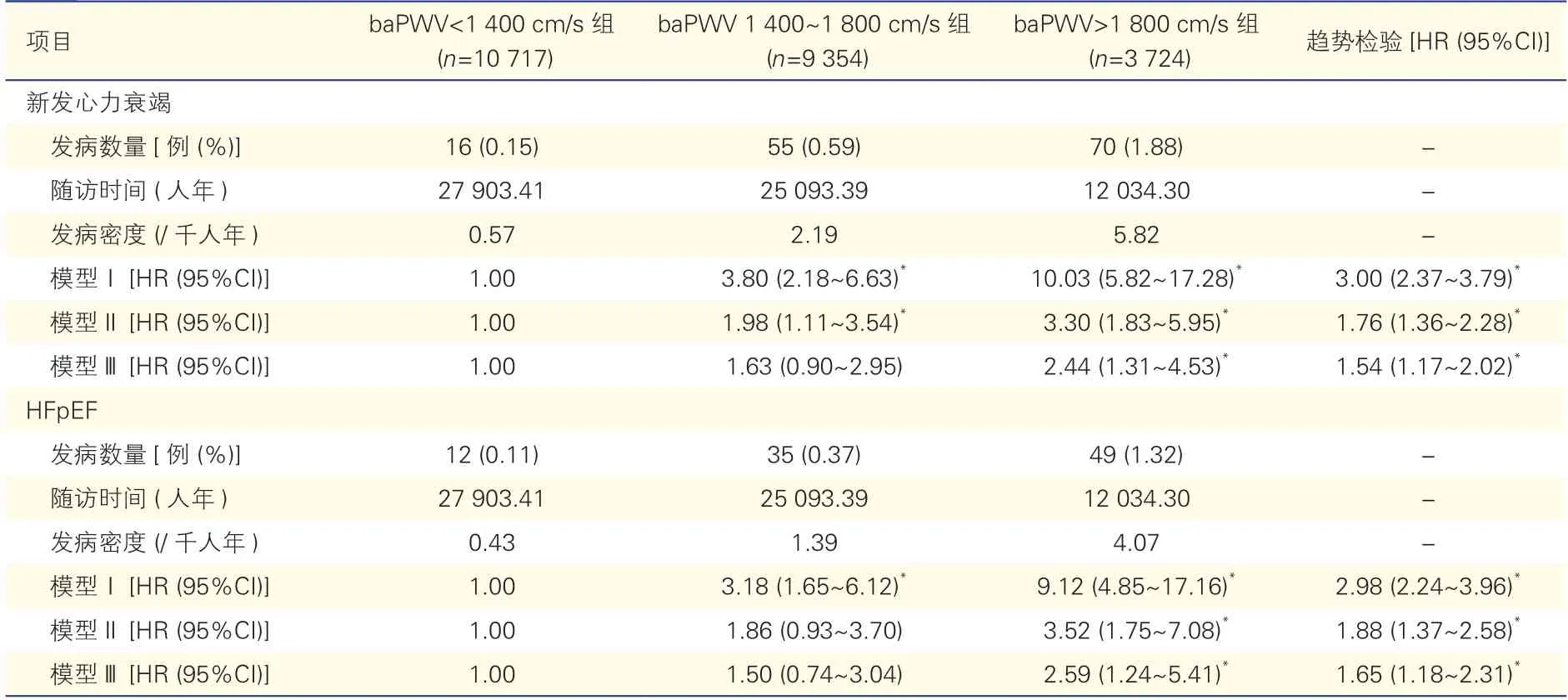
表2 新发心力衰竭和HFpEF 影响因素的Cox 比例风险回归分析
选取baPWV<1 400 cm/s 组作为参照组进行Cox 比例风险回归分析,模型Ⅱ分析结果显示,与baPWV<1 400 cm/s 组相比,baPWV 1 400~1 800 cm/s 组(HR=1.98,95%CI:1.11~3.54)和baPWV>1 800 cm/s 组(HR=3.30,95%CI:1.83~5.95)新发心衰的风险均明显增加,差异均有统计学意义(P均<0.05);baPWV 1 400~1 800 cm/s 组发生HFpEF的风险未显著增加(HR=1.86,95%CI:0.93~3.70,P>0.05),但baPWV>1 800 cm/s 组发生HFpEF的风险显著增加(HR=3.52,95%CI:1.75~7.08,P<0.05);模 型Ⅲ分析结果显示,与baPWV<1 400 cm/s 组相比,baPWV>1 800 cm/s 组新发心衰(HR=2.44,95%CI:1.31~4.53)和HFpEF 的发生风险(HR=2.59,95%CI:1.24~5.41)均显著增加,差异均有统计学意义(P均<0.05)。校正年龄、性别等混杂因素后,三组间随着baPWV 增高,新发心衰和HFpEF 的发生风险均逐渐增加,趋势检验差异均有统计学意义(P均<0.05)。
2.4 敏感性分析
排除心肌梗死患者后,共23 463 例研究对象纳入敏感性分析(重复Cox 回归分析),其中共观察到77 例心衰。敏感性分析结果与上述主要分析结果基本一致(表3)。
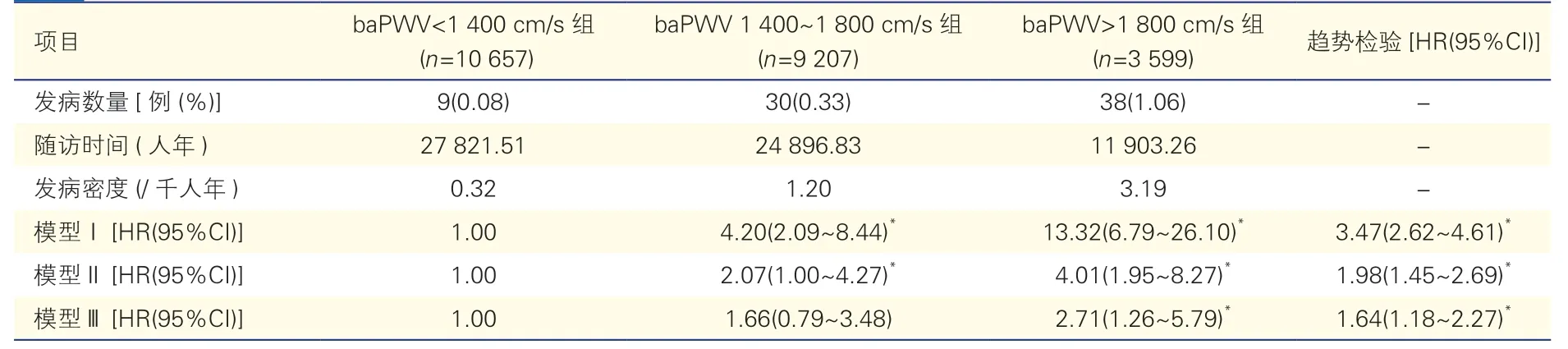
表3 排除心肌梗死患者后新发心力衰竭影响因素的Cox 比例风险回归分析
3 讨论
本研究结果显示,在开滦研究人群中,平均(2.73±1.98)年随访期间新发心衰的累计发病率为0.6%。杨若彤等[16]通过对10 个地区成年人心衰流行情况进行调查,发现心衰累计发病率为0.89%,略高于本研究结果。本研究中新发心衰的累计发病率在三个BaPWV 分组中呈逐渐上升趋势,分别为0.15%、0.59% 和1.88%。Pandey 等[17]和Tsao等[18]的研究以颈股脉搏波传导速度(cfPWV)作为评估动脉硬化的指标,发现第一三分位组的心衰发病率分别为1.7%和1.5%,至第三三分位组则分别上升到1.9%和3.8%。本研究中新发心衰的发病密度从baPWV<1 400 cm/s 组的0.57/千人年升高至baPWV>1 800 cm/s 组的5.82/千人年,HFpEF 的发病密度从baPWV<1 400 cm/s 组的0.43/千人年升高至baPWV>1 800 cm/s 组的4.07/千人年。
本研究结果显示,校正传统心衰危险因素后,baPWV>1 800 cm/s组发生心衰的风险 是baPWV<1 400 cm/s 组的2.44 倍,与Tsao 等[18]的研究结果基本一致。Tsao 等[18]还发现,心衰发生风险与动脉硬化程度呈剂量-反应关系,cfPWV 每增加1 个标准差,心衰风险增加1.29 倍。但是,在Pandey 等[17]包含390 例心衰患者的研究中,校正年龄、性别、体重指数、高血压、糖尿病、冠心病等危险因素后,cfPWV 对心衰发生风险无明显影响。Pandey 等[17]的研究结果与本研究结果不一致,可能的原因如下:(1)前者研究群体为老年人,动脉硬化程度本身就很高,而本研究以一般人群作为研究对象,平均年龄为(49.21±12.58)岁,由年龄引起的动脉硬化对心衰的影响比重较小;(2)前者心脑血管疾病患者比例较高,可能掩盖了cfPWV 对心衰发生风险的影响,造成了研究对象的生存偏倚;(3)PWV 分组方式不同,前者只是对cfPWV 进行三分位分组,而本研究采用的分组方法是依据临床经验和参考文献报道确定。不过,值得注意的是,在仅校正年龄和性别的模型中,Pandey 等[17]的研究结果和本研究结果是一致的。
此外,本研究还探讨了baPWV 对HFpEF 发生风险的影响。根据寿命表法进行分析的结果显示,校正年龄和性别后(模型Ⅱ),baPWV>1 800 cm/s 组中HFpEF 的发生风险显著增加(HR=3.52,95%CI:1.75~7.08,P<0.05),与Pandey 等[17]的研究结果一致。进一步校正高血压、糖尿病等心衰传统危险因素后的模型Ⅲ分析结果显示,baPWV 对HFpEF 发生风险的影响虽有所减弱,但baPWV>1 800 cm/s 组发生HFpEF 的风险仍显著增加(HR=2.59,95%CI:1.24~5.41),差异依然有统计学意义(P<0.05),说明与传统的HFpEF 危险因素相比,动脉硬化对HFpEF 发生风险的影响较为显著。
动脉硬化是心衰重要的危险因素,但是动脉硬化导致心衰的发病机制尚不明确。从生物学角度来看,血液由左心室进入主动脉会产生压力波,并传播到全身的其他动脉,过高的动脉僵硬度使反射波在收缩期而不是在舒张期返回,从而引起中心收缩压增加,同时心脏收缩期耗氧量增加,心脏负荷增加;另一方面,反射波的过早返回导致中心舒张压降低,冠状动脉灌注减少。动脉硬化引起反射波的改变影响了心室-动脉之间正常的耦合协同作用,导致左心室的结构和功能受到影响,心衰发生风险增加[19]。Borlaug 等[20]的研究结果表明,HFpEF 患者存在内皮功能损伤以及血管扩张障碍。动脉硬化导致心衰发病的潜在机制如下:(1)过高的动脉僵硬度致使收缩压升高,造成较大的血流冲击力,可能引起类似血管炎症反应,从而导致血管结构损伤,血管舒张功能受损,心室-动脉之间的正常协同作用会受到一定程度的影响,从而诱发心衰[21];(2)高血压、冠心病等动脉硬化的危险因素也是心衰的危险因素,这些危险因素共同作用导致心衰的发生。
本研究结果具有重要的临床意义。本研究发现,baPWV 较高时心衰发生风险也较高,动脉硬化可能是前心衰阶段发展至前临床心衰阶段的中间风险表型。因此,临床上在关注传统心衰危险因素的同时,也应该注重改善动脉僵硬度,从而可更有效地预防心衰的发生或延缓心衰的进展。
本研究存在一些不足之处:(1)本研究随访时间相对较短,后期将延长随访时间进一步分析;(2)本研究人群主要来源于中国北方开滦集团,并未考虑南北方生活习惯的差异;(3)射血分数降低的心衰发生例数较少,本文未对此类事件进行研究。
利益冲突:所有作者均声明不存在利益冲突

