基于正硅酸乙酯的农药缓释微胶囊制备优化及表征
徐 冉,刘海容,崔婧媛
(1. 同济大学环境科学与工程学院,上海 200092;2. 上海污染控制与生态安全研究院,上海 200092)
近年来,我国农业发展逐渐从传统农业向现代农业转型,一方面提升农业科技水平,加大农业产业化经营力度,一方面兼顾农业生态和农业环境保护机制,推进实现农业可持续发展[1]。化肥和农药在农业发展的路途中一直发挥着不可或缺的作用,但同时也对粮食安全和农业生态造成了巨大的影响。随着新技术的出现和材料科学的进步,学者和企业研发出了环境安全、生态友好的农药控释制剂,以达到精准释放、减少农药滥用现象的目的。微胶囊即是近年逐步兴起的一种控释技术,通过利用壳核结构将目标物质封装,以屏蔽外界环境因素变化影响的技术,能够实现对芯材的有效保护,控制芯材的缓慢释放,现已广泛应用于食品[2]、医药[3]、个护[4]和纺织[5-6]领域。
二氧化硅是广泛应用于玻璃、光导纤维、耐火材料、涂料、陶瓷等生产制造领域的重要无机固体材料,具有稳定、耐高温、耐酸(除HF外)的特性,是兼具稳定性和低成本的良好无机壁材。二氧化硅在化学稳定性和热稳定性的优越表现,使得其在封装领域有着良好的应用前景。Butstraen 等[7]以正硅酸乙酯(TEOS)为硅前驱体,通过溶胶-凝胶法制备二氧化硅包覆的蓖麻油的微胶囊,并评价了微胶囊产品的热稳定性,发现其热失重率减少27%。
天然除虫菊酯作为一种来自于天然植物的神经毒剂,相较于化学农药而言,具有高效、广谱[8]、低毒、低抗[9]和环境友好[10-11]的突出优点,其发展受限于光热易分解所导致的实际应用成本高。本研究旨在使用溶胶凝胶法,以TEOS为硅前驱体,制备天然除虫菊酯的二氧化硅微胶囊,解决其光热易分解的特性,增强天然除虫菊酯在农药施用领域的适用性,从而推广其作为农田农药和卫生农药的使用。
1 材料与方法
1.1 实验材料与仪器
实验材料:天然除虫菊酯原液,红河森菊生物有限责任公司;正硅酸四乙酯、曲拉通X-100、冰醋酸、氢氧化钠均为分析纯,国药集团化学试剂有限公司。
实验仪器:FA2004 型电子分析天平,上海精科天平厂;85-2 型恒温磁力搅拌器,上海司乐仪器厂;DZF-6020型真空干燥箱,上海精宏试验设备有限公司;SY-300 超声细胞破碎仪,上海宁商超声仪器有限公司;SCIENTZ-12N 型冷冻干燥箱,宁波新芝生物科技有限公司;PHS-3C型精密pH计,上海雷磁有限公司;XL-30E扫描电子显微镜,荷兰Philips公司;Q600SDT 综合热分析仪,美国TA 公司;BRUER VECTOR22傅里叶变换红外光谱仪,瑞士Bruker公司;Agilent 1200 HPLC-DAD高效液相色谱仪,安捷伦科技有限公司;Mastersizer 3000 型马尔文激光粒度分析仪,英国马尔文仪器有限公司等。
1.2 微胶囊的制备与优化
1.2.1 微胶囊的制备
根据徐冉等[12]的方法制备以二氧化硅为壁材的天然除虫菊酯微胶囊,称取一定质量乳化剂曲拉通X-100 于纯水中,在设定温度下水浴搅拌溶解,转速700 r·min-1。向分散均匀的溶液中加入一定量天然除虫菊酯原药后,转速不变,恒温搅拌1 h,形成稳定的水包油(O/W)乳液。配置1 mol·L-1的NaOH 溶液,调节乳液pH 值。称取一定质量的TEOS,用注射器逐滴滴入上述调节pH值后的乳液中,继续反应24 h。反应结束关闭搅拌,保持温度不变陈化3~5 h,得到微胶囊悬浮液。将所得微胶囊乳液静置、分液、过滤后冷冻干燥,即得所需乳白色微胶囊粉末。反应机理如图1所示。
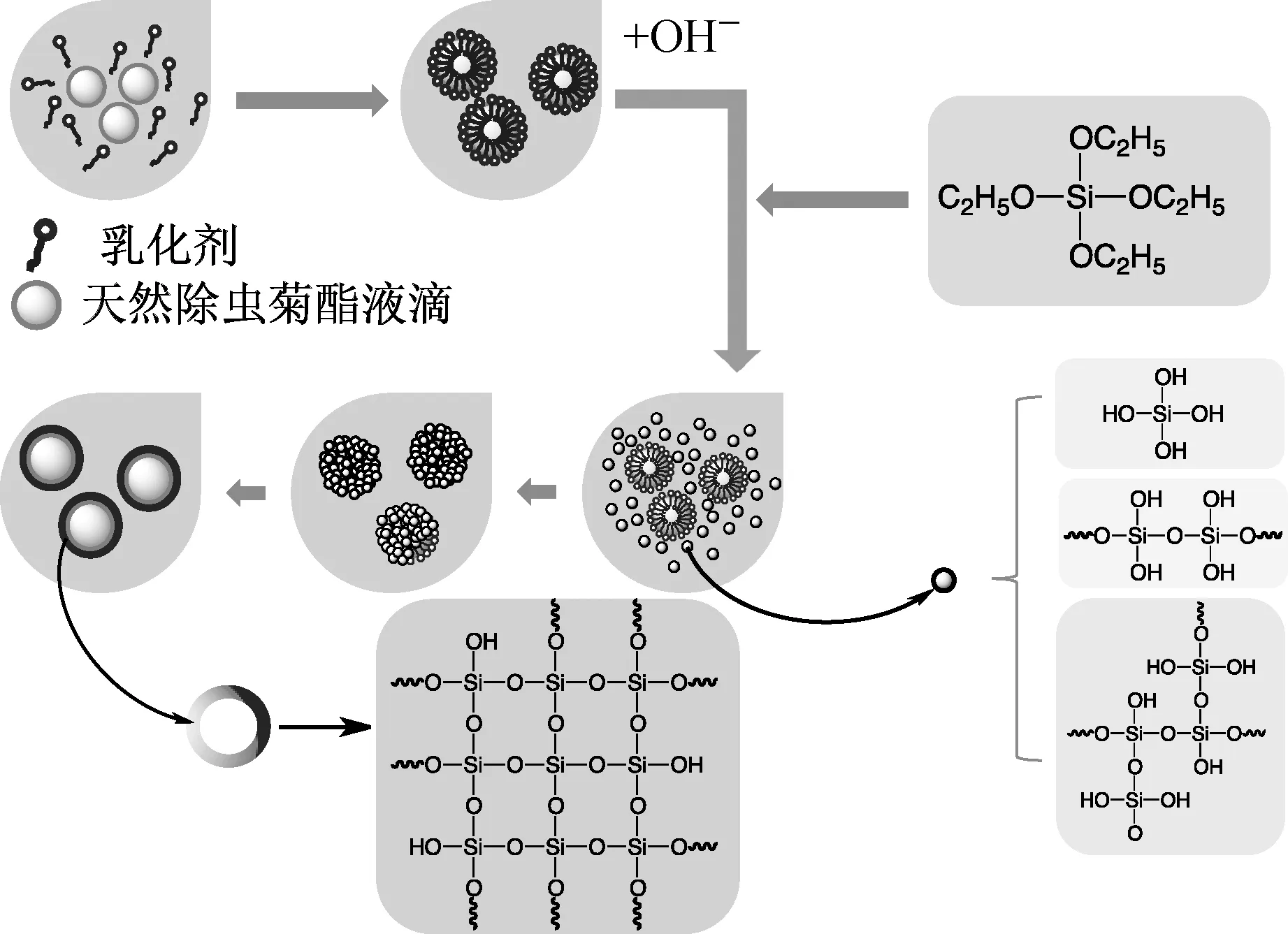
图1 二氧化硅微胶囊反应机理Fig.1 Mechanism of synthesis of microcapsules with silicon dioxide
1.2.2 微胶囊的制备条件优化
采用响应曲面法对溶胶-凝胶法制备除虫菊酯微胶囊的制备条件进行优化。选择pH、TEOS投加量(固定芯材投加量为0.50 g)、反应温度3 个因素,每个因素选3 个水平,以微胶囊中除虫菊酯的载药率为响应值,影响因素及水平列于表1 中。使用软件Design-Expert V8.0.5.0 进行Box-Behnken 实验设计和结果分析,共需进行17次实验得到响应曲面拟合方程并得到最优制备条件。方差分析(ANOVA)表生成线性项、平方项和二次交互作用项的影响和回归系数。用p值(概率)检验各个系数的显著性,p<0.05表示模拟方程项显著。回归系数做统计计算生成回归模型和等值线图。
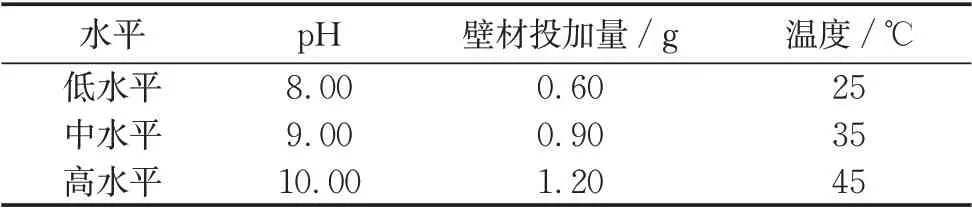
表1 响应面各影响因子及水平设置Tab.1 Settings of response surface impact factors and level
1.3 微胶囊的性能表征
1.3.1 天然除虫菊酯成分及载药率测定
天然除虫菊酯成分测定:采用液相色谱法对微胶囊中天然除虫菊酯的总含量及游离含量进行测定分析。液相色谱的条件经筛选如下:使用DiKMA C18 液相色谱柱(150×4.6 mm,5 μm),进样量为20 μl,流速为1.000 ml·min-1,流动相A 为超纯水,B为乙腈,柱温40℃,检测波长230 nm。采用梯度洗脱法,58%B 相平衡5 min 后,至35 min 提升B 相比例至75%,1 min后提升B为100%,保持10 min。最后调回B 相至初始比例58%,平衡10 min。根据天然除虫菊酯特征峰的保留时间进行定性,根据特征峰的峰面积进行定量分析。
微胶囊载药率测定:称取50 mg 微胶囊粉末加入具塞离心管内,加入一定量乙腈1 000 r·min-1离心3 次洗去表面除虫菊酯,加入定量乙腈,使用超声破碎仪处理15 min 后,1 500 r·min-1离心处理10 min,将上清液转移至25 ml容量瓶定容,用0.22 μm有机滤膜过滤待测。载药率Lc[13]的计算公式为
Lc=wp∕wm×100% (1)
式中:wp为微胶囊中除虫菊酯原药的质量;wm为对应微胶囊样品粉末的质量。
1.3.2 表面形貌表征
利用扫描电子显微镜在一定扫描电压下观察样品的表面形貌。利用激光粒度仪得到微胶囊粉末的平均粒径D以及粒径分散系数δ。利用傅里叶变换红外光谱仪,用KBr 压片法对微胶囊进行官能团的测定。
1.3.3 热稳定性分析
取5~10 mg 干燥微胶囊粉末,利用Q600 SDT型综合热分析仪分析微胶囊在50~600 ℃温度范围内的热稳定性。
1.3.4 缓释性能分析
参照王娣等[14]、阎鑫等[15]使用恒温热失重法对缓释性能进行表征。分别测定微胶囊粉末在100、125、150、175、200 ℃烘箱中加热5h 的有效成分含量,计算累计挥发率,平行3 次,并以天然除虫菊酯原药作为对比;200 ℃烘箱中样品共加热8 h,每隔1 h 取样称重,计算有效成分累计挥发率,平行3次,并以天然除虫菊酯原药作为对比。
1.3.5 储存稳定性分析
测定原药和微胶囊粉末避光储存于4 ℃冰箱内一段时间后的载药率及表面形貌的变化。
1.3.6 毒性分析
委托中国科学院上海植物生理生态研究所测试微胶囊对4 龄淡色库蚊和白纹伊蚊幼虫的毒力;委托上海南方农药研究中心测试微胶囊对3龄初期蚕豆蚜虫和黏虫幼虫的毒性。
2 结果与讨论
2.1 天然除虫菊酯成分测定
利用液相色谱法对天然除虫菊酯进行定性、定量分析,其色谱图如图2所示。
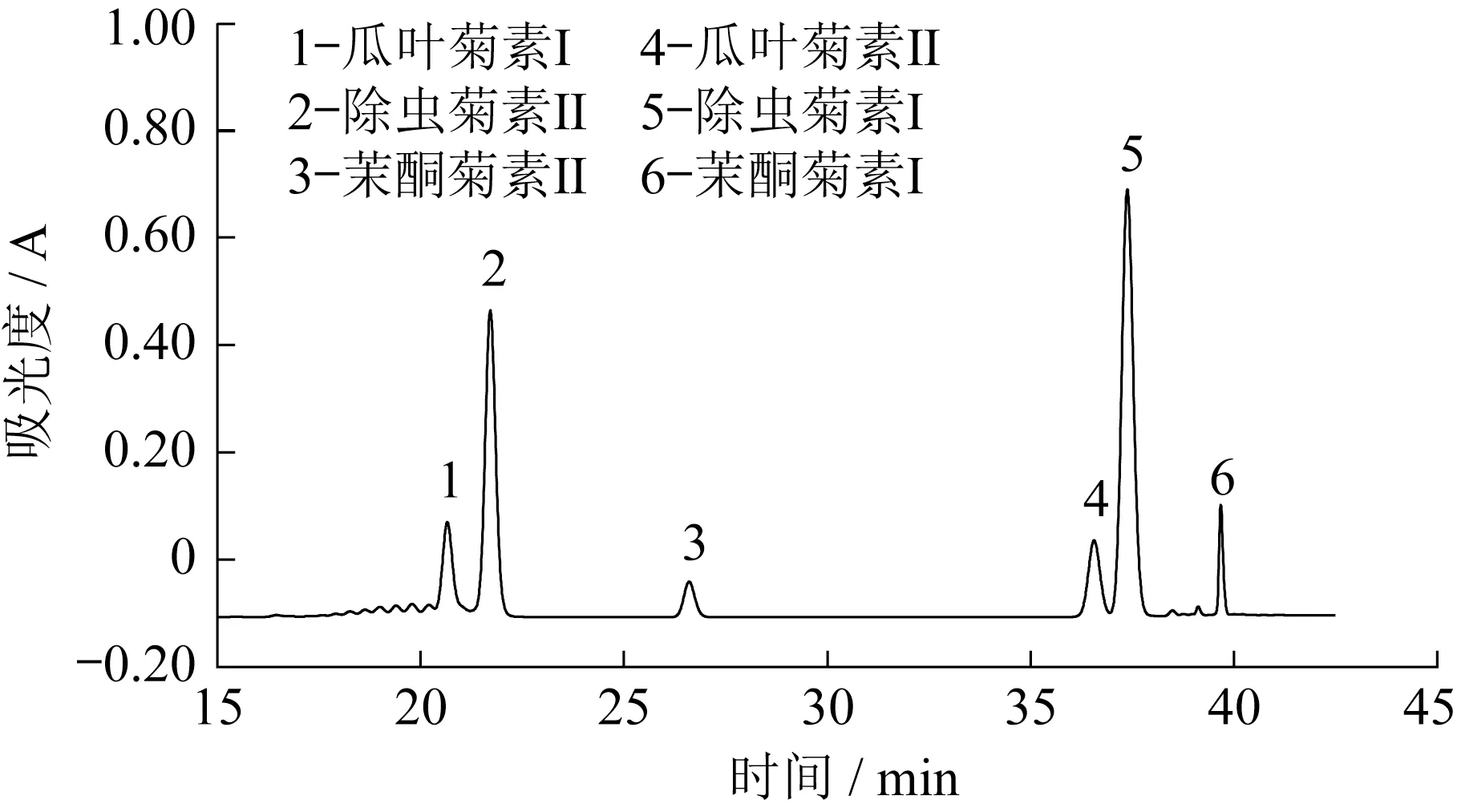
图2 天然除虫菊酯液相色谱Fig.2 Liquid chromatogram of natural pyrethrins
2.2 微胶囊制备条件优化
利用响应曲面法探究pH(因子A)、TEOS 投加量(因子B)、反应温度(因子C)3个重要因子对微胶囊制备的相互影响,以载药率作为评价指标,并使用BBD 实验设计方案来寻求最佳制备工艺条件,实验设计方案及结果见表2所示。
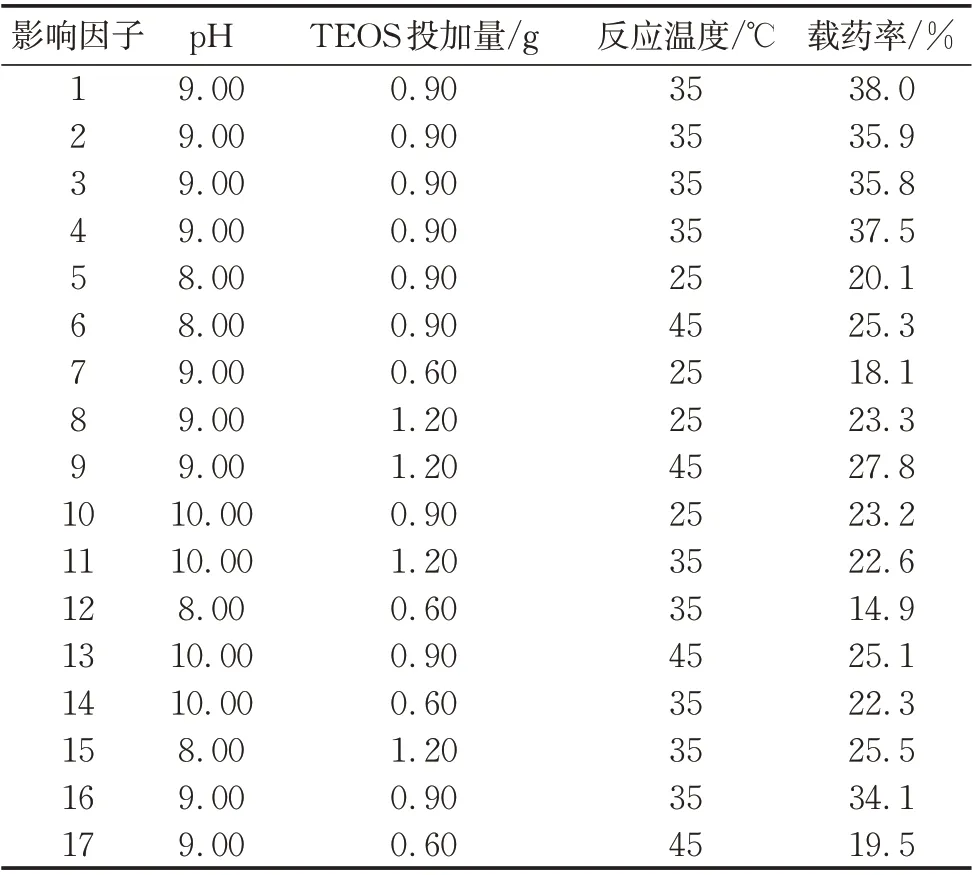
表2 响应曲面实验结果Tab.2 Design and results of response surface methodology
对实验数据结果进行二次响应回归分析,分别拟合并建立二阶响应曲面模型。模型拟合输出结果表示,二阶模型对于本实验表现为对载药率影响显著(p<0.05,F=60.25>20),模型拟合度较高,R2=0.966 4>0.80,拟合所得二次方程如式(2)所示:
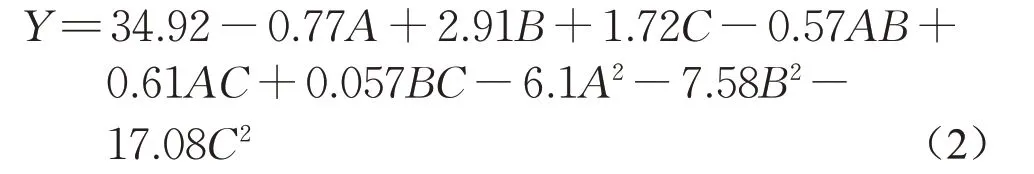
可知,3 个因素影响水平的大小依次为:TEOS投加量、pH 值、反应温度。对式(2)进行处理,得到如下相应三维曲面和等值线图,如图3所示。
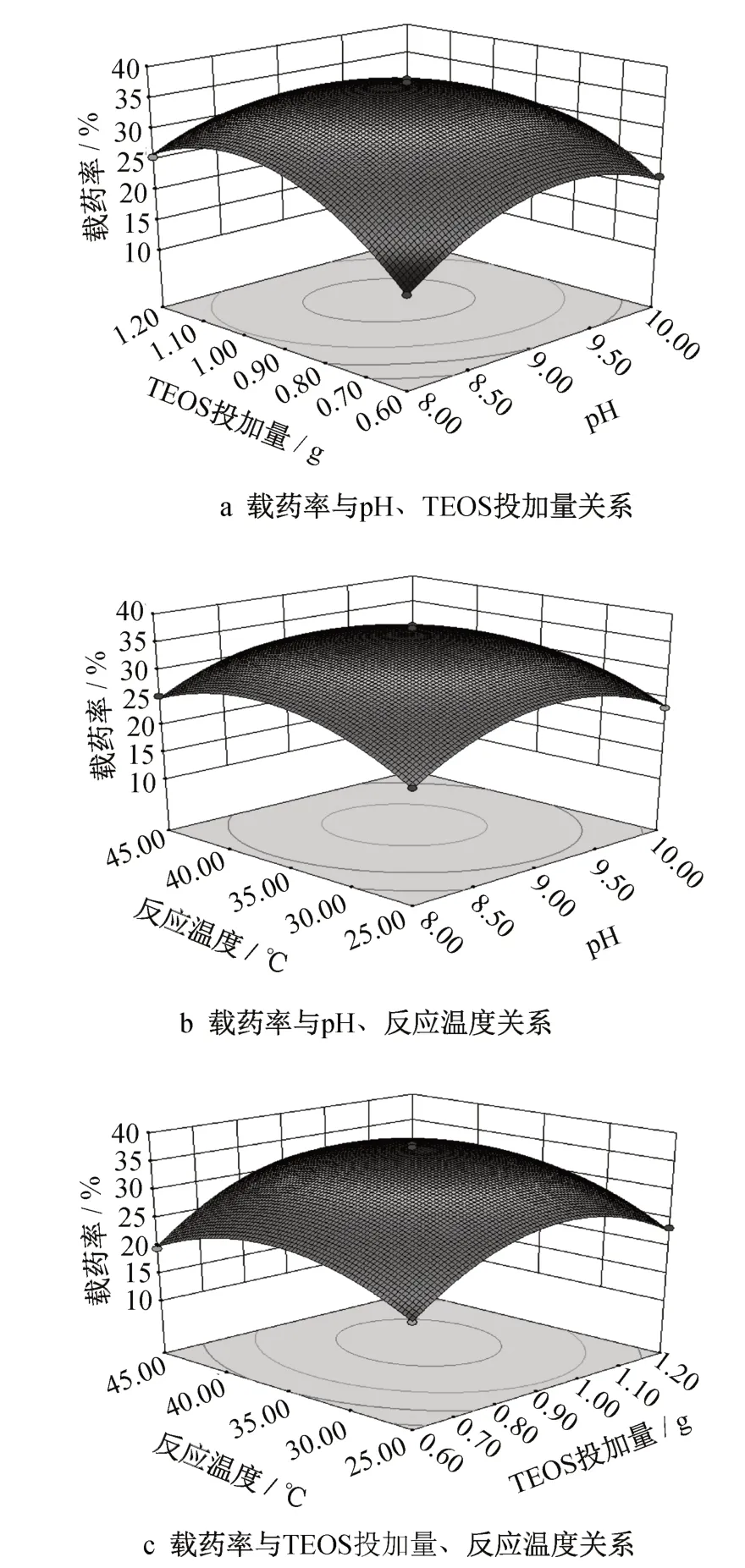
图3 载药率三维响应曲面和等值线Fig.3 Three-dimensional response surface and contour map of drug loading efficiency
最终确定制备微胶囊最佳的工艺条件为pH 为9.02,TEOS 投加量为0.96g,反应温度为36.5 ℃。TEOS投加量对微胶囊载药率的影响最为显著(p<0.05)。响应值即微胶囊载药率随着TEOS 投加量的增加而增大,达到峰值后,随着TEOS投加量的继续增大,响应值开始减小。芯材量不变的情况下,随着TEOS 的投加量增加,被完整包覆的芯材乳液滴增多,微胶囊载药率增大,当TEOS 过量时,聚沉在乳液滴表面的壁材增多,过剩的壁材自聚生成硅自聚体颗粒,导致测得载药率下降;在碱性条件下,响应值随pH值的升高而增大,当pH值过大,响应值有所减小,可能是由于溶液中OH-的增多,缩聚反应加快,三维网格结构的硅凝胶不断沉积在芯材乳液滴表面,硅凝胶相对于芯材过剩,导致芯材所占微胶囊产物的质量百分比减少,载药率减小;在低温条件下(25~45℃),响应值受温度变化的影响不明显,趋势为随温度的升高先增大后减小,这可能由于温度升高到一定值之后,水解反应加剧,与缩聚反应竞争增强[16],导致成囊率下降,载药率减小。
2.3 微胶囊表面形貌分析
图4 为二氧化硅微胶囊的扫描电子显微镜图。微胶囊呈球形,表面光滑。分散性较好,有少部分团聚现象,表面或其周围有杂质颗粒,这是由于氢键作用力较弱,缩聚速率较快,多硅酸自聚形成硅自聚体小颗粒。图3c可以通过破碎的微胶囊观察到清晰的“壳-核”结构,其壳壁厚度在0.8~1.0 μm 左右。张焕芝[17]在溶胶-凝胶法制备微胶囊的过程中发现,随硅基聚合物的逐步沉积,形成的二氧化硅微胶囊壁不断加厚,与本实验结果相似。

图4 微胶囊扫描电子显微镜图Fig.4 SEM of microcapsule
图5 为微胶囊的粒径分布图,激光粒度仪测定结果显示D10=2.5 μm,D50=29.0 μm,D90=57.1 μm,其粒径分散系数δ=1.88>1.2,呈多分散状态。微胶囊的平均粒径为29 μm。
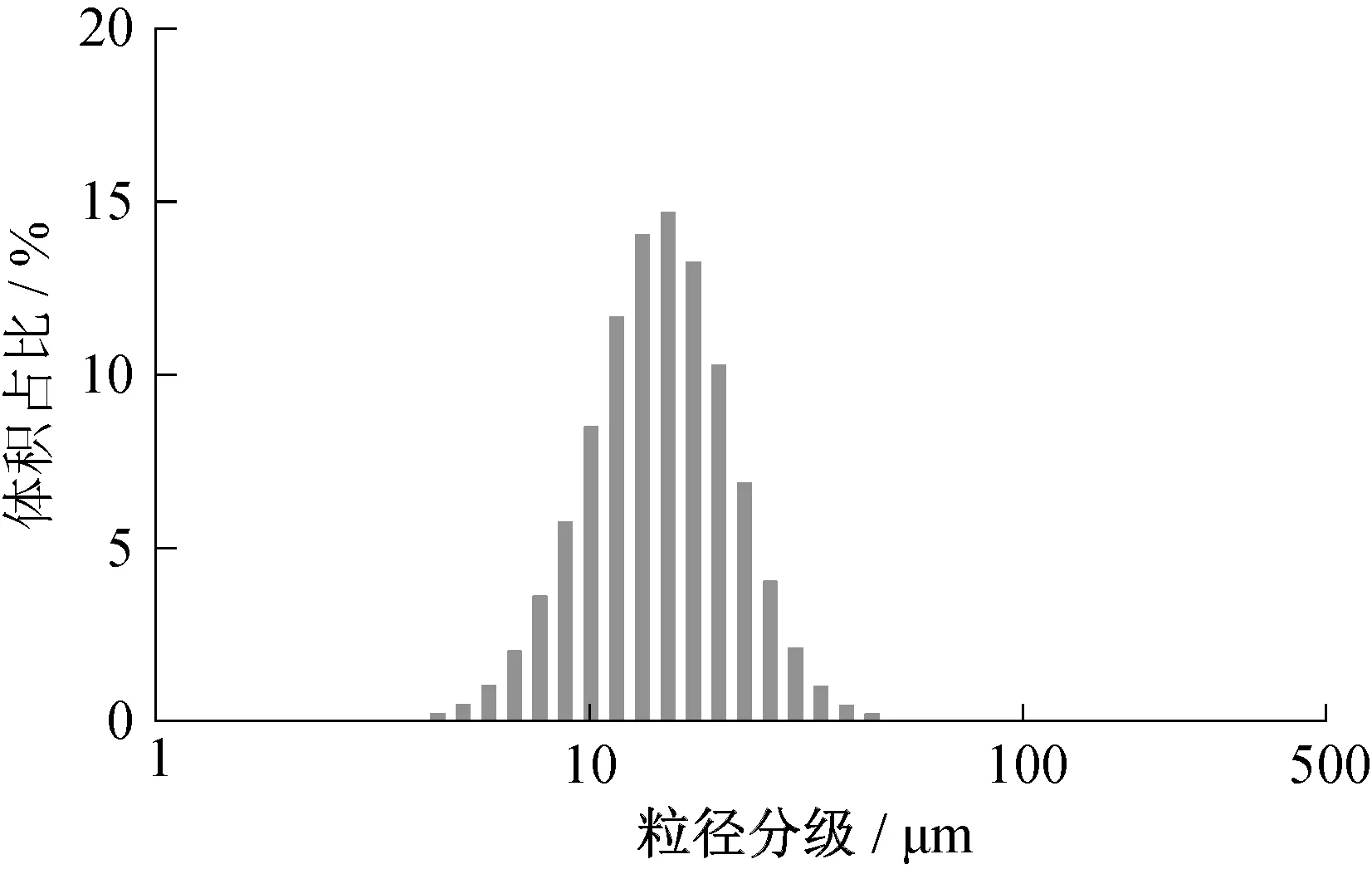
图5 微胶囊粒径分布Fig.5 Particle aerodynamic diameter spectra of microcapsule
2.4 傅里叶红外光谱分析
图6 为微胶囊的红外色谱分析图,其中曲线1、2、3分别代表了天然除虫菊酯、空白二氧化硅微胶囊和包封天然除虫菊酯的微胶囊。对比图线2、3,在1 111.2 cm-1和462.5 cm-1处出现了Si-O-Si 的对称和不对称振动吸收峰,964.1 cm-1处出现了Si-OH 的弯曲振动特征峰,在3 413.4 cm-1处的弱吸收谱带为Si-OH的伸缩振动特征峰。根据余锡宾等[16]的研究,正硅酸四乙酯作为硅前驱体的硅凝胶中均含有Si-OH 基团。Si-OH 和Si-O-Si 特征峰的存在证明本实验在低温条件下完成了溶胶-凝胶过程,实现了以TEOS为硅前驱体的水解、缩合和聚合反应,得到了二氧化硅壁材。对比曲线1、曲线3,在1 714.8 cm-1处的强烈吸收峰是酯类C=O伸缩振动的特征峰,来自天然除虫菊酯的酯基官能团;在1 650.8 cm-1处的较弱吸收峰为酮基的C=O伸缩振动特征峰,来自天然除虫菊酯醇部分的环戊烯酮;在1 151.3 cm-1处的较强吸收峰为烷烃类C-C伸缩振动特征峰,来自天然除虫菊酯酸部分的环丙烷。图2则无以上天然除虫菊酯特征峰,证明微胶囊产品将除虫菊酯成功包埋。
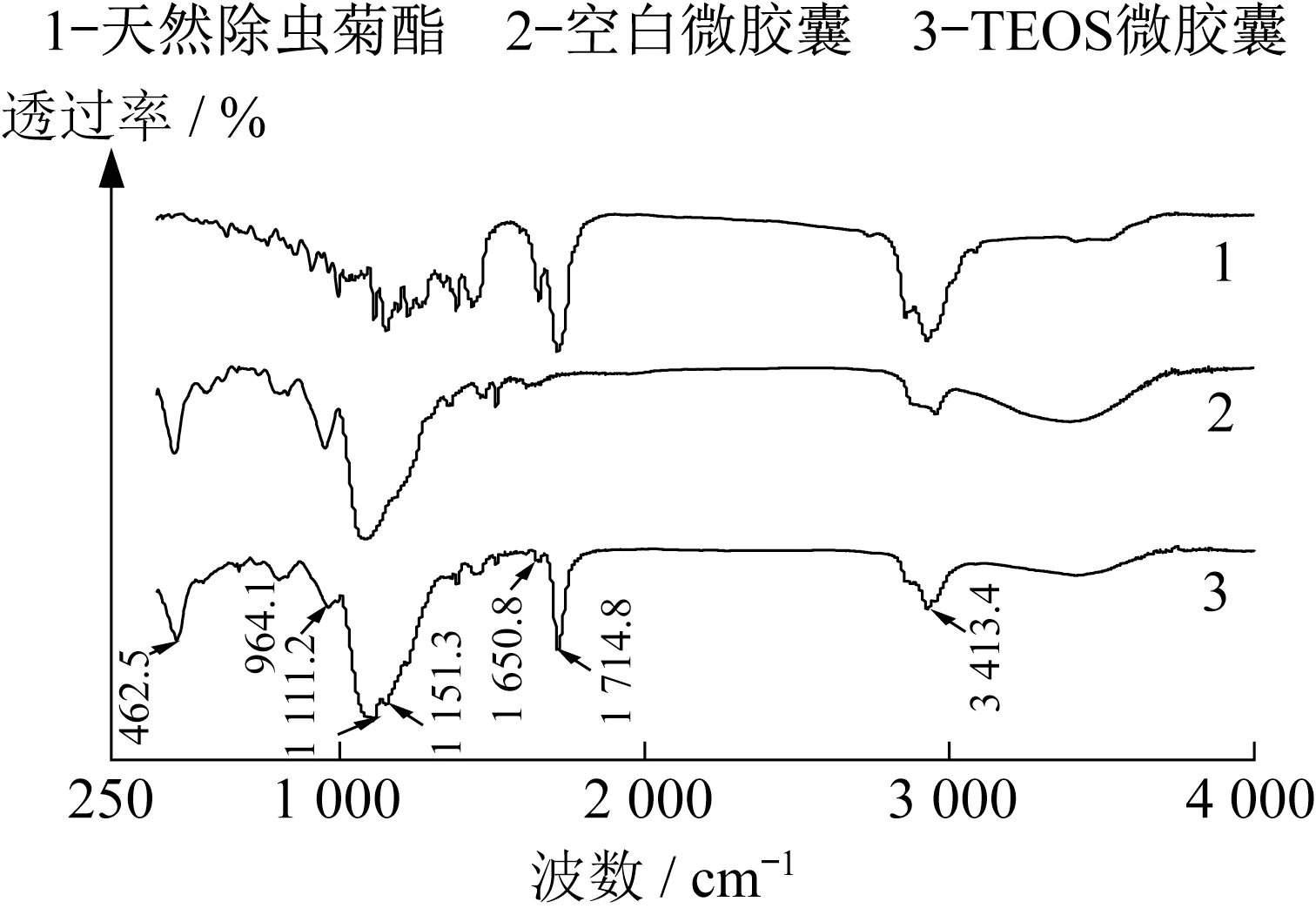
图6 微胶囊红外谱Fig.6 FTIR of microcapsule
2.5 热稳定性分析
图7为封装了天然除虫菊酯的二氧化硅微胶囊的热重分析曲线,其中图7a是微胶囊随温度变化的质量变化曲线,即TG 曲线;7b 是DTG 曲线,为TG曲线对温度的微分。曲线1、2 和3 分别是空白微胶囊、除虫菊酯微胶囊和天然除虫菊酯的曲线。
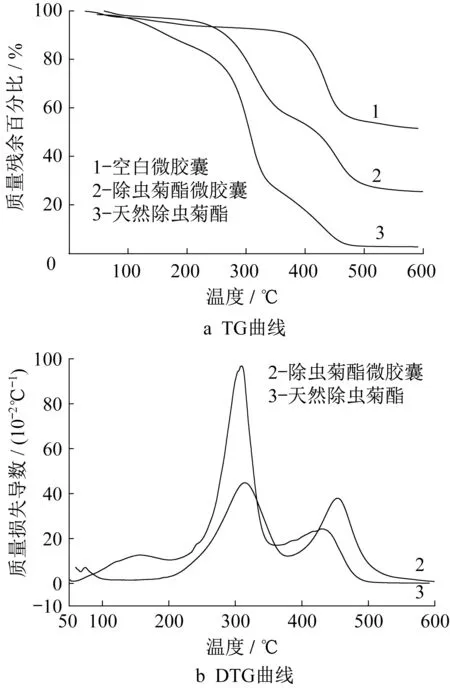
图7 微胶囊热重曲线Fig.7 Thermogravimetric analysis of microcapsule
结合两图中曲线3可知,天然除虫菊酯发生了3次明显的质量损失,损失速率最高峰分别在150 ℃、300 ℃、430 ℃左右,其中以300 ℃左右分解比例最高,损失量约为50%。第3 阶段原药的损失质量约为23%,明显小于失重第2阶段。相比之下,当温度由室温逐渐升温至200℃时,微胶囊样品仅出现了2%~4%的质量损失,推测为样品中残余的少量水分挥发所致。曲线2 的2 个主要失重阶段的损失质量约为35%和30%,相差较少。对比3条曲线分析原因,微胶囊第1 阶段的质量损失来自于囊内天然除虫菊酯活性成分的挥发并热解,而此时基于TEOS 的二氧化硅壳壁并未热解,第2 阶段30%的质量损失则来自于硅酸缩聚的结构水失重和天然除虫菊酯原药的第3阶段质量损失。对比图7b中2条曲线可知,曲线2的最大失重速率小于曲线3;400 ℃后,曲线2 的质量损失速率大于曲线3,分析是由于硅酸缩聚的结构水失重和天然除虫菊酯原药的第3阶段质量损失共同作用;曲线1相对于曲线3出现质量损失的温度有所后移。证明所制备的微胶囊的热稳定性有所提升,能对囊内的天然除虫菊酯活性成分起到一定的保护作用。
2.6 缓释性能分析
图8为天然除虫菊酯和微胶囊在不同温度下的芯材质量挥发率曲线。在所设温度梯度下,原药同微胶囊都存在芯材的质量挥发损失,相比之下,微胶囊芯材损失明显低于原药。从图8b 可知,在200℃的条件下放置8 h,微胶囊芯材的质量挥发率对比原药减少了约38.8%。由此可知微胶囊对芯材在100至200℃的条件下可以起到较好的保护作用,具有良好的缓释性能。
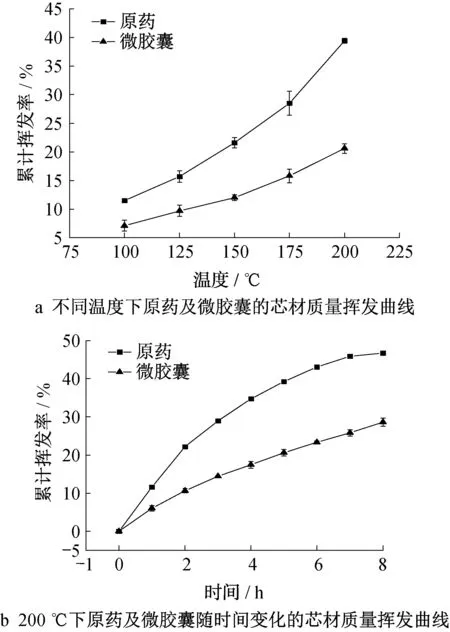
图8 微胶囊的芯材质量挥发曲线Fig.8 Mass volatilization curve of drug in microcapsule
2.7 储存稳定性分析
图9a、9b分别为微胶囊于4℃冰箱冷藏并避光储存的第0、5个月的扫描电子显微镜图。对比图9a的光滑表面,图9b 中微胶囊略微粗糙,这可能与微胶囊壳壁中Si-OH的存在有关,在环境湿度的影响下,Si-OH 与空气中的H2O 或相邻Si-OH 形成氢键,导致微胶囊表面粗糙[17]。

图9 微胶囊储存不同时间的SEM对比Fig.9 SEM of microcapsule at different storage times
在不同存储时间下,微胶囊原药剩余率的变化情况如图10 所示。微胶囊在4 ℃下避光储存4 个月,载药率为35.6%,下降了6.2%;储存8个月,载药率变为19.6 %,下降了48.5 %。储存前4 个月内,载药率损失速度较慢,后续则逐渐加快。推测原因为在储存过程中,附着于微胶囊表面的天然除虫菊酯先挥发,随着储存时间的延长,外部天然除虫菊酯完全挥发到环境中,使微胶囊内外渗透压变大,内部芯材释放速率加大。所制备的二氧化硅微胶囊在4个月内能起到较好的保护作用。
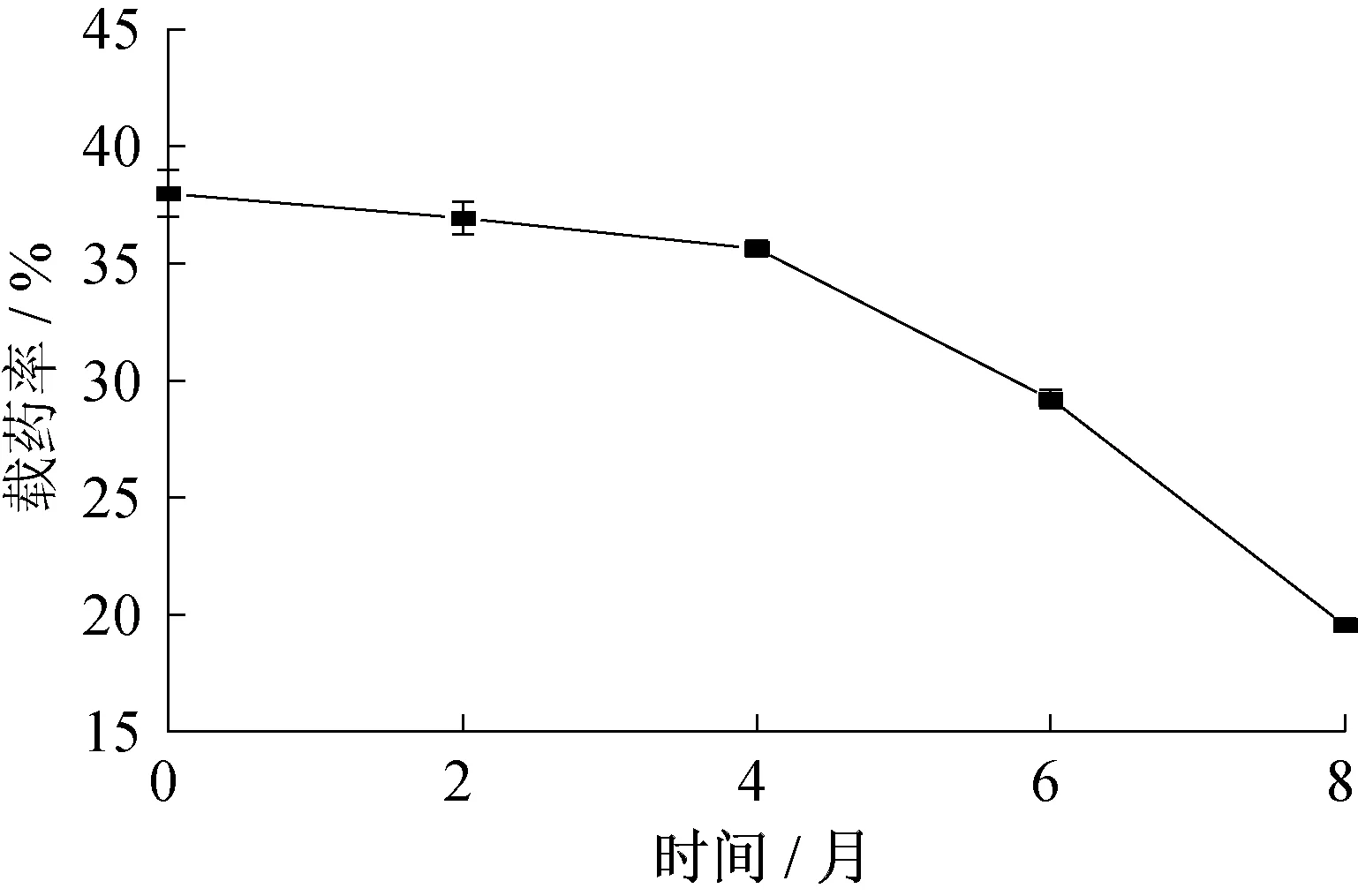
图10 微胶囊储存不同时间原药剩余率变化Fig.10 Variation of residual rate of original drug in microcapsule at different storage times
2.8 毒性分析
表3是微胶囊对淡色库蚊和白纹伊蚊幼虫及对蚕豆蚜虫和黏虫的毒性测定结果。参考评价标准[18]:半数致死浓度大于100 g·ml-1为无活性,50 ~100 g·ml-1为有活性,小于50 g·ml-1为高活性。对比可知所制备的微胶囊对2种蚊虫的幼虫均具有高生物活性,但略低于天然除虫菊酯原药。这是因为此2种蚊虫对天然除虫菊酯原药较为敏感,接触后在短时间内即可达较高的死亡率,当天然除虫菊酯原药被微胶囊化后,药效具有缓释性,致使24 h内的急性毒性低于原药。微胶囊对于蚕豆蚜虫和黏虫的杀虫效果,推测是因微胶囊增强了芯材的持效,明显加强了其持续性毒杀能力,较大地提高了对2 种害虫的 杀虫效果。
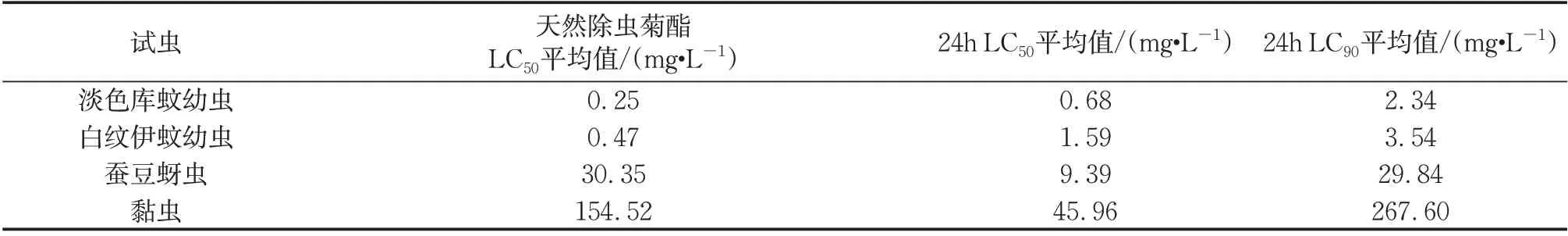
表3 4种常见昆虫毒力测定结果Tab.3 Toxicity of four common insecticides
3 结论
采用溶胶-凝胶法制备了以TEOS 为硅前驱体的天然除虫菊酯二氧化硅微胶囊,将响应曲面法应用于制备条件的优化,结合扫描电子显微镜与红外色谱等验证了最优制备条件下微胶囊的成功包埋,微胶囊平均粒径为13.5 μm,载药率最大值可达38.0 %。所得微胶囊在100~200 ℃下热稳定性良好,具有良好的缓释效果,200℃下微胶囊芯材挥发率明显优于原药。微胶囊在4 ℃避光条件下储存也能有效减少芯材挥发。天然除虫菊酯的微胶囊制剂针对蚕豆蚜虫和黏虫的24h毒力有明显提升,对于2种常见的蚊虫幼虫也能保持高生物活性,具有实际应用价值。TEOS 的微胶囊成本低且环境无害,但其缺点是在溶胶-凝胶过程中,水解和缩聚的反应是可逆的,影响因素较多,反应速率比较难控制,仍需进一步探讨。
作者贡献声明:
徐 冉:项目规划与管理、实验规划、论文审阅及修订。
刘海容:数据分析、实验结果可视化、初稿撰写。
崔婧媛:方法设计、实验探究、数据整理。

