贮藏温度对采后蜜橘果皮转色过程中质体结构及相关基因表达的影响
葛笑笑, 邓淑芳, 曾凯芳, 邓丽莉
(西南大学 食品科学学院/食品贮藏与物流研究中心, 重庆 400715)
色泽是柑橘果实重要的感官指标之一。受成熟期积温等因素影响,早熟柑橘的转色往往发生在采收后,该转色过程主要受到贮藏温度、光照、植物激素等因素的影响,其中,贮藏温度是最重要的环境因素之一[1-2]。研究表明:适宜的贮藏温度促进果实转色,而过高或过低的温度则会抑制果实转色[3-5]。
柑橘油胞的发育与果皮色泽有关。柑橘油胞是合成和储存柑橘精油的重要细胞器,柑橘精油主要由烯萜类挥发性物质构成,而一些烯萜类物质是由类胡萝卜素降解产生的[6]。研究发现,葡萄柚果皮油胞与薄壁组织的差异基因主要富集在类异戊二烯代谢途径[7],而类胡萝卜素代谢的前体物质正是类异戊二烯代谢途径的产物。除油胞外,柑橘果实的色泽变化也与质体发育密切相关。质体是绿色植物中特有的细胞器,根据功能可分为:原生质体、叶绿体、有色体、油粒体等[8]。其中,叶绿体是典型的光合质体,用于光合作用和光保护[9]。有色体是类胡萝卜素合成和积累的场所,根据内部结构可分为晶状、球状、纤维状等[10-11]。叶绿体向有色体的分化是柑橘果实成熟最具标志性的现象之一[12-13]。此外,一些与质体发育有关或定位于叶绿体的蛋白质被证明与色泽变化有关,如4-羟基-3-甲基丁-2-烯基二磷酸还原酶(HDS)、质体脂质相关蛋白(PAP)、质体小热激蛋白(psHSPs)等[8]。因此,油胞和质体是柑橘果实着色的结构基础,研究不同温度下果实超微结构变化对阐明柑橘果实采后着色的机理具有重要意义;而目前关于贮藏温度如何调控蜜橘果皮转色过程中质体发育及相关基因表达的研究较少。
本研究以重庆早熟蜜橘(绿熟)为实验材料,研究5、25、32 ℃短期贮藏过程中蜜橘果皮色泽和超微结构的变化,并根据转录组数据,对质体相关基因的表达水平进行分析,探讨不同贮藏温度对采后蜜橘果皮转色过程中质体结构及其相关基因表达量的影响,以期为进一步理解贮藏温度调控柑橘果实果皮着色的机理提供一些理论参考。
1 材料与方法
1.1 材料与试剂
蜜橘果实为采摘于重庆市北碚区的早熟蜜橘(绿熟)。绿熟蜜橘果实(盛花后170 d)于2021年9月采收后立即运回实验室,挑选大小均一、色泽一致、无机械伤、无病虫害的健康果实作为实验材料。
次氯酸钠(体积分数2%),成都市科龙化工试剂厂;聚乙烯套果袋(170 mm×140 mm,厚度为0.02 mm),四川绿果林制袋有限公司;电镜固定液,北京索莱宝科技有限公司;0.1 mol/L磷酸盐缓冲液、乙醇,重庆跃翔化工有限公司;叔丁醇,重庆市钛新化工有限公司。以上化学试剂均为分析纯。
OmniPlant RNA Kit(DNase I)试剂盒,江苏康为世纪生物科技股份有限公司;Takara- RR047A反转录试剂盒,成都微克生物技术有限公司。
1.2 仪器与设备
MIR553型恒温培养箱,日本Sanyo公司;DW- HL528型超低温保存箱,中科美菱低温科技股份有限公司;Chroma CR- 400型色差仪,日本Minolta公司;GSL- 1100X- SPC- 16M型磁控溅射镀膜仪,沈阳科晶自动化设备有限公司;Phenom Pro10102型扫描电子显微镜,荷兰Phenom公司;JEM 1200EX型透射电子显微镜,日本电子株式会社(Jeol);2100型生物分析仪,美国Agilent公司;CFX384型荧光定量PCR仪、Mini- Sub cell GT型电泳仪,美国Bio- Rad公司;4100型凝胶成像分析系统,上海天能科技有限公司。
1.3 实验方法
1.3.1果实处理方法
果实用次氯酸钠溶液浸泡1 min进行表面杀菌后用清水洗净,在室温下自然晾干,将实验果实分为3组,每组100个,用聚乙烯套果袋单独包装并密封。将果实分别贮藏于5、25、32 ℃的恒温培养箱中。处理的果实分为观察组和取样组,取样组分别于第0天、第3天、第6天、第9天取果实赤道部位果皮1~2 cm宽处,快速切成小块后放入液氮中冷冻,再置于超低温保存箱中用于后续实验指标的测定,每个指标的测定重复3次。观察组分别于第0、3、6、9天拍照记录及测定色差。
1.3.2色差测定
使用色差仪测定果实果皮色差值。根据国际照明委员会L*、a*、b*颜色空间,测定果实果皮赤道部位的L*、a*、b*、H*和C*值。其中,L*表示光泽度,a*表示红绿值,b*表示黄蓝值,H*表示色相角(0°~90°:红- 黄,90°~180°:黄- 绿,180°~270°:绿- 蓝,270°~360°:蓝- 红),C*表示彩度。每个处理测量20个果实,每个果实取果皮赤道处对应3点,取平均值作为果皮色差值。
1.3.3扫描电镜的制片方法
样品于第0、3、6、9天进行取样,根据果皮的结构特征,将赤道部位的蜜橘果皮切成1 mm×1 mm×3 mm,迅速放入电镜固定液内,样品保存在4 ℃下以待扫描电镜检测。扫描电镜制片方法参照袁梓洢[14]的方法,制片完成后,样品于磁控溅射镀膜仪中镀金膜,采用扫描电子显微镜对样品进行观察、拍照、记录等。
1.3.4透射电镜的制片方法
透射电镜的样品与扫描电镜的样品取样一致。透射电镜制片方法参照北京中科百测技术服务有限公司的常规制片方法,采用透射电子显微镜进行样品观察、拍照、记录等。
1.3.5转录组测序
0 d和经5、25、32 ℃贮藏6 d后的蜜橘果实的转录组测序委托广州基迪奥生物科技有限公司进行,文库构建和转录组分析的过程同样参考该公司的方法。本研究所参考的基因组为Citrus_Clementina_v1.0(GCF_000493195.1)。以上下调倍数(fold change,FC)和错误发现率(false discovery rate,FDR)作为筛选差异基因的指标,|log2(FC)|>0,且FDR<0.05为判别标准。
1.3.6RNA提取和cDNA合成
使用OmniPlant RNA Kit(DNase I)试剂盒提取样品总RNA。RNA纯度在生物分析仪上进行了评估,并使用无RNase葡萄糖凝胶电泳进行检查。使用RR047A反转录试剂盒对质量合格的RNA进行反转录,最终获得的cDNA置于-20 ℃下保存。
1.3.7实时荧光定量PCR分析
实验所用引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。用荧光定量PCR仪进行qPCR检测。10 μL的PCR反应体系(所有操作均在冰上进行):0.4 μL cDNA模板(将总RNA反转录的产物cDNA稀释20倍)、5.4 μL 2×SG Fast qPCR Master Mix、 0.4 μL引物F(10 μmol/L)、 0.4 μL引物R(10 μmol/L)、3.4 μL ddH2O。PCR反应程序:按照95 ℃、5 s,60 ℃、30 s的程序进行40个循环,最后从65 ℃以0.5 ℃/s的速度提高至95 ℃。采用2-ΔΔCt计算基因的相对表达量。

图1 不同贮藏温度下蜜橘果实果皮外观颜色变化Fig.1 External color changes of mandarin fruit peel stored at different temperatures
1.4 数据处理
每个样品均设置3个生物学重复。所有数据用Excel 2016和SPSS 26.0统计分析软件进行分析处理,ANOVA和Duncan’s多重比较用于分析显著性差异,P<0.05表示差异显著。
2 结果与分析
2.1 不同贮藏温度下蜜橘果皮外观及色差变化
不同贮藏温度下蜜橘果实果皮外观变化如图1。随着贮藏时间的延长,25 ℃下贮藏蜜橘果实的果皮逐渐从绿色转为黄色,在第9天时果皮完全转黄;而贮藏在5 ℃和32 ℃的蜜橘果实仍然保持绿色。
不同贮藏温度下蜜橘果实果皮色差值(C*、H*、a*/b*)的变化如表2。25 ℃贮藏果实的C*、a*/b*值随着贮藏时间延长呈显著增加的趋势,H*值逐渐下降。贮藏9 d后,25 ℃下贮藏果实的a*/b*值比5 ℃和32 ℃分别高72.22%和62.50%。5 ℃下贮藏果实的C*、H*、a*/b*值在贮藏期间(0~9 d)没有明显变化。而在32 ℃下贮藏果实的C*、a*/b*值有轻微上升的趋势,H*值缓慢下降,第9天时,C*、H*、a*/b*值与5 ℃、25 ℃组有显著差异(P<0.05)。与25 ℃组相比,虽然5 ℃和32 ℃下贮藏均抑制果皮着色,但两者对色差值的影响存在一定差异(P<0.05)。
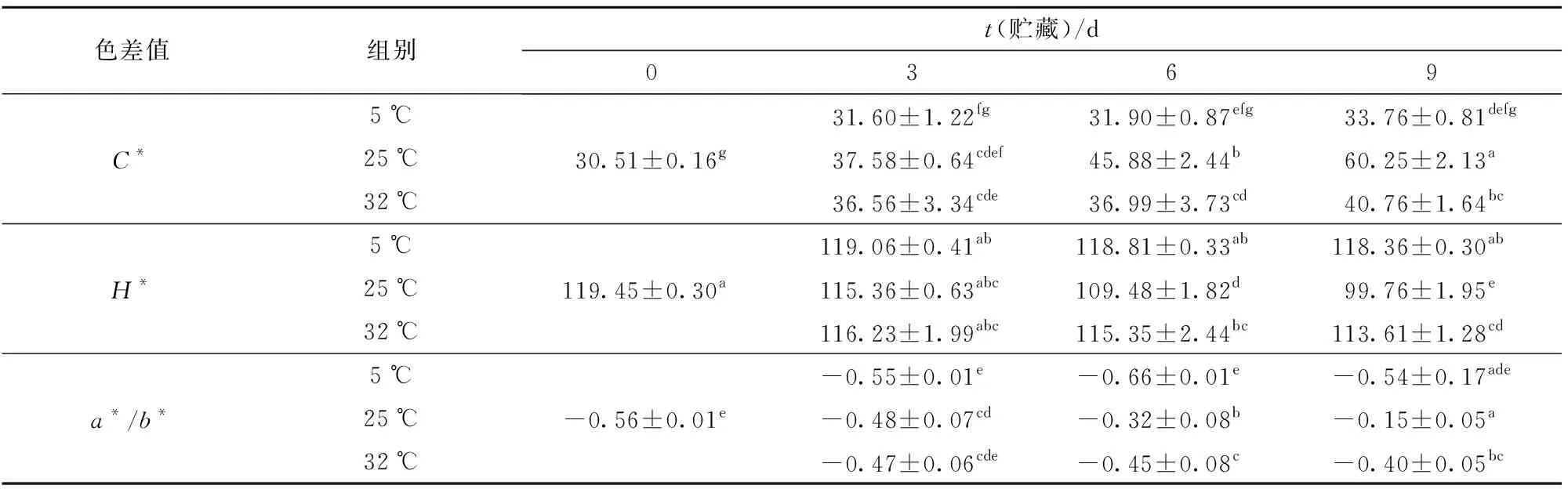
表2 不同贮藏温度对蜜橘果实果皮色差值的影响
2.2 不同贮藏温度下蜜橘果皮油胞结构的变化
不同贮藏温度下蜜橘果实果皮油胞的结构变化如图2。采收时蜜橘果实果皮油胞形态为椭圆形,由油胞和薄壁组织组成,薄壁细胞围绕着油胞形成层状结构,油胞中央出现油胞腔,大小不等,深浅不一,油胞腔的出现也说明油胞已达到成熟形态,同时也可看出蜜橘果皮较薄,油胞紧贴着表皮生长。在25 ℃贮藏时,蜜橘果实油胞腔内出现大量碎片物质,油胞腔形态逐渐消失,油胞腔内层状组织聚集,贮藏9 d时,油胞层状组织完全融合。5 ℃贮藏第6天时蜜橘果实油胞腔内部细胞逐渐裂解并融合,但层状结构依然存在;但在9 d时,油胞腔内部结构破裂,片层结构发生裂解,腔内出现一些碎片物质。32 ℃贮藏过程中果实油胞的层状结构被破坏的同时向腔室内聚集,油胞腔室周围的薄壁组织形态被破坏,在第9天时,油胞腔内结构融合后破裂,整个细胞腔呈半真空状态。

放大倍数为250倍。图2 不同贮藏温度下蜜橘果实果皮油胞的结构变化Fig.2 Structural changes of oil glands in mandarin fruit peel at different storage temperatures
2.3 不同贮藏温度下蜜橘果皮质体结构及质体发育相关基因表达水平变化
2.3.1不同贮藏温度下质体结构的变化
不同贮藏温度下蜜橘果实果皮质体的结构变化如图3。采收时,蜜橘果皮叶绿体结构完整、呈椭圆形或圆形状,排列在细胞壁周围;基粒片层清晰可见,垛叠类囊体数目较多;质体膜清晰、完整,质体内分布着少量淀粉粒和质体小球。在25 ℃下贮藏6 d后,蜜橘果皮质体排列在细胞壁周围,但形状开始变化,由原来的圆形发展为不规则椭圆形,且开始出现晶状体,质体内淀粉粒数量增多且体积增大,类囊体结构开始解体,说明伴随果皮色泽由绿转黄,叶绿体开始向有色体分化;第9天时,蜜橘果皮质体结构完整,呈椭圆形状,质体附近出现多个线粒体结构,质间空间变大,淀粉粒增多,类囊体结构解体为丝状。在5 ℃下贮藏6 d后,质体基粒片层与质体长轴平行,淀粉粒增多,质体小球无明显变化,叶绿体双层膜明显;贮藏9 d后,质体内的质体小球数量增多,观察到少许淀粉粒,类囊体呈跺叠状,叶绿体双层膜仍然存在,说明5 ℃在一定程度上延缓了叶绿体的发育。在32 ℃下贮藏6 d时,质体中质体小球数量增多且体积增大,类囊体解体为丝状,排列方向与质体长轴方向一致,质间间隙增大,质体膜部分模糊,说明叶绿体正在分化为有色体;第9天时,蜜橘果皮质体表现为叶绿体形态,质体内出现少量淀粉粒,基粒片层和基质片层清晰可见,由此说明32 ℃贮藏9 d可能导致蜜橘果皮有色体再分化为叶绿体。
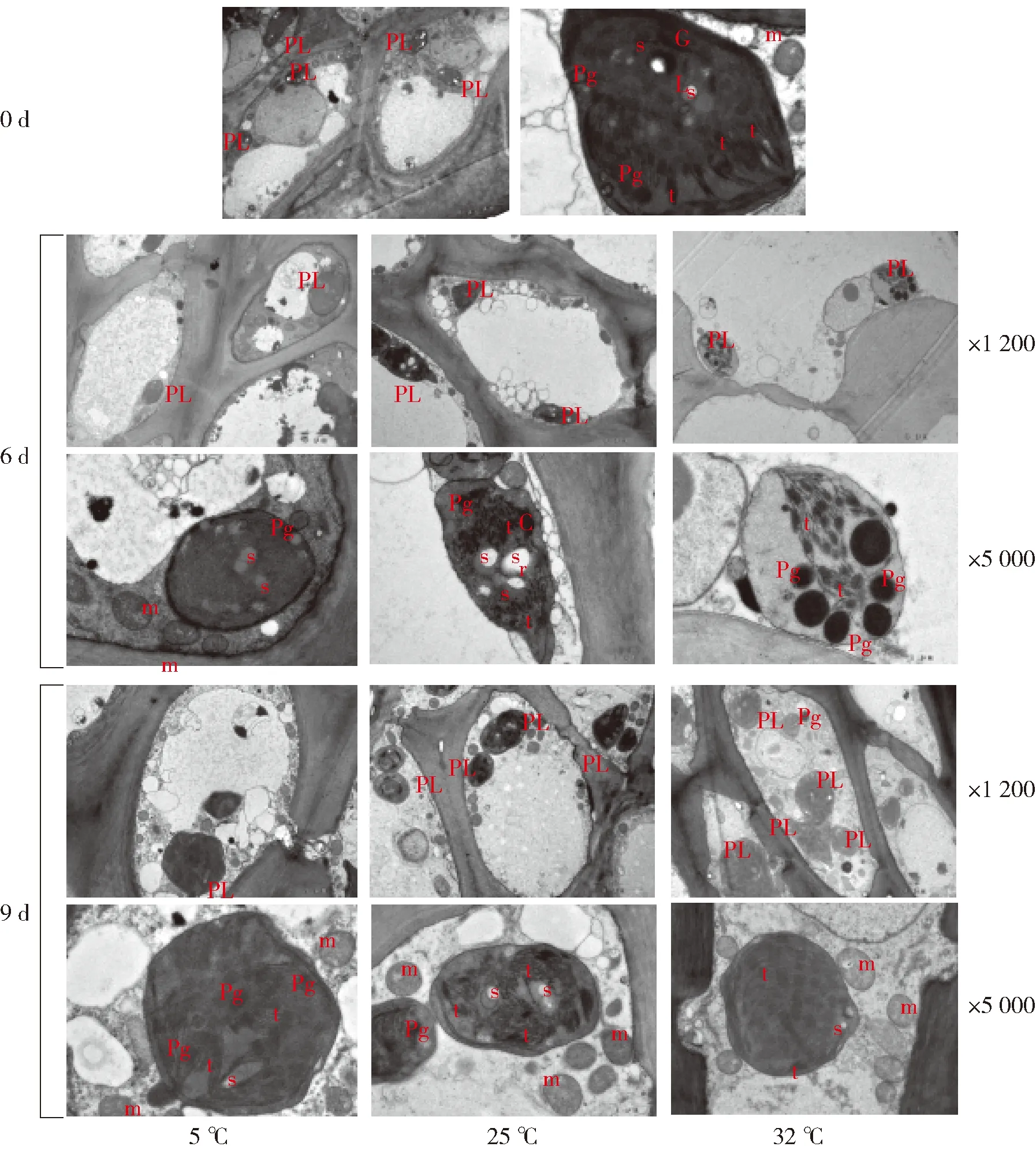
PL:质体;Pg:质体小球;t:类囊体;s:淀粉粒;m:线粒体;GL:基粒片层;Cr:晶状体。放大倍数分别为1 200倍和5 000倍。图3 不同贮藏温度下蜜橘果实果皮质体的结构变化Fig.3 Structural changes of plastid in mandarin fruit peel at different storage temperatures
2.3.2转录组学分析质体发育相关基因表达水平的变化
在5、25、32 ℃下贮藏6 d的蜜橘果实果皮差异表达基因如图4。5 ℃贮藏蜜橘果实的果皮中共有5 528个基因上调表达,5 626个基因下调表达;在25 ℃下贮藏的蜜橘果实的果皮中共有5 131个基因上调表达,5 814个基因下调表达;在32 ℃下贮藏的蜜橘果实的果皮中共有4 834个差异基因上调表达,5 169个基因下调表达。
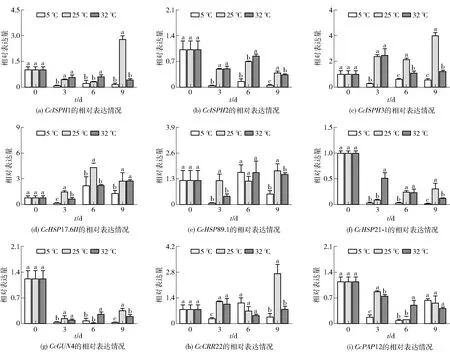
同一指标、同一贮藏时间下的不同字母表示数据具有显著性差异(P<0.05)。图5 不同贮藏温度对蜜橘果实果皮质体相关基因相对表达量的影响Fig.5 Effect of different storage temperatures on relative expression of plastid-related genes of mandarin fruit peel
质体是类胡萝卜素合成和储存的重要场所,不同贮藏温度下的蜜橘果皮质体结构变化有显著区别(图3)。质体相关基因的表达可能会对质体转化和色素产生影响。不同贮藏温度下蜜橘果实果皮质体相关差异表达基因如表3。根据已有研究报道的与质体发育有关的蛋白质,本研究筛选到38个差异表达基因,这些差异表达基因可分为4大类:HDS(筛选到3个差异表达基因)、HSPs(热休克蛋白,筛选到18个差异表达基因)、PAP(筛选到9个差异表达基因)以及PPR(五肽重复蛋白,筛选到8个差异表达基因)。
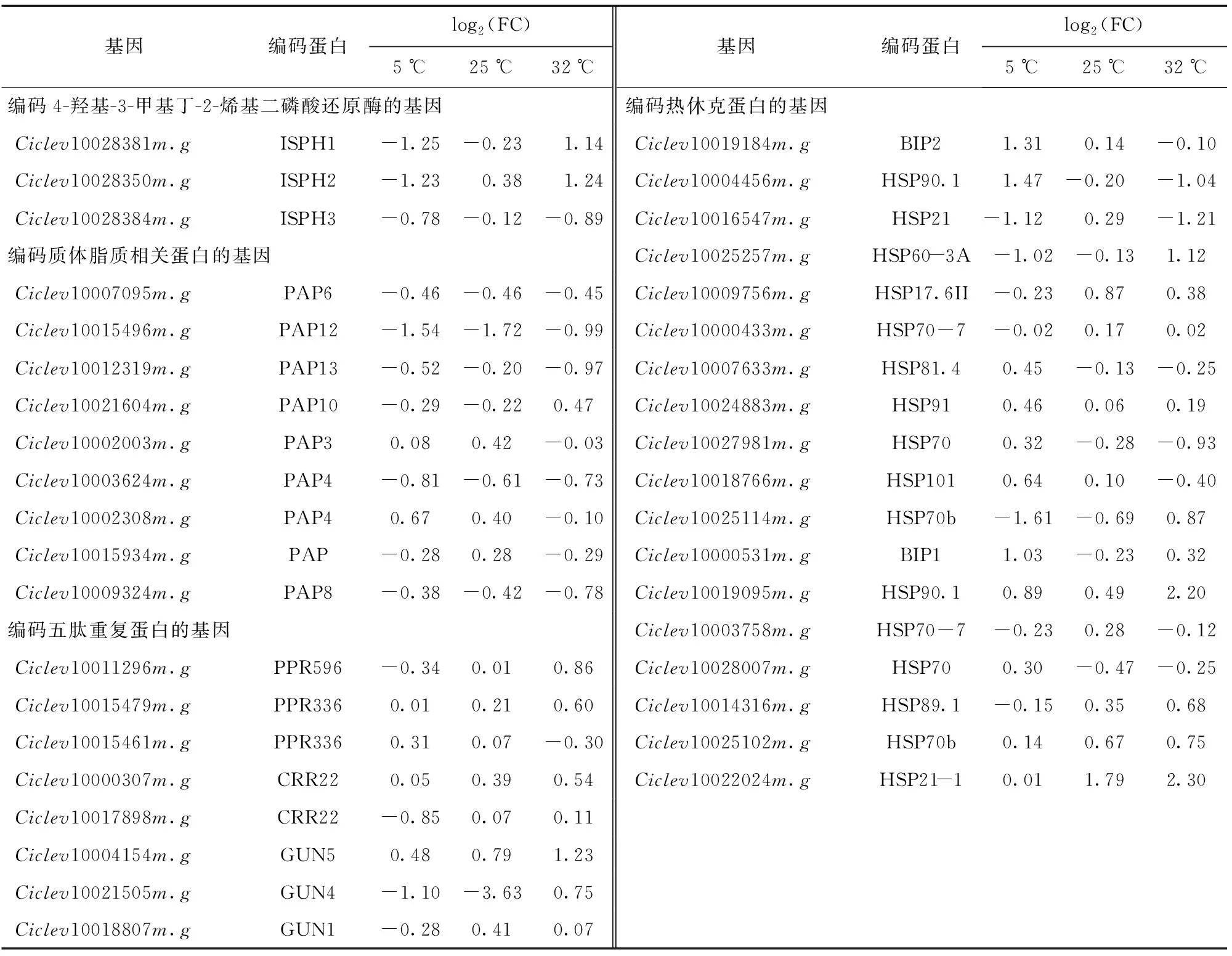
表3 蜜橘果实果皮质体相关差异表达基因
2.3.3不同贮藏温度对质体发育相关基因相对表达量的影响
不同贮藏温度对蜜橘果皮质体相关基因相对表达量的影响见图5。根据表3的结果,对9个质体发育相关基因的相对表达量进行分析。在第9天时,25 ℃贮藏的果实CcISPH1和CcISPH3都保持较高的表达水平,相对表达量是0天的276.24%和389.32%;而5 ℃贮藏的果实CcISPH1、CcISPH2和CcISPH3表达水平较低,相对表达量分别为0天的14.85%、4.90%、57.28%;32 ℃贮藏的果实CcISPH3仅在贮藏前期表现出高表达水平,与叶绿体结构变化一致。第6天时,25 ℃和32 ℃贮藏的果实CcHSP17.6II表达水平显著增加,2个贮藏组间存在显著差别;5 ℃贮藏的果实CcHSP17.6II在第3天表现下调且达到最低值,但在随后的贮藏中表达水平呈上升趋势。25 ℃贮藏的果实CcHSP89.1相对表达量在贮藏期间没有显著变化,但5 ℃和32 ℃贮藏的果实CcHSP89.1相对表达量在第3天达到最低值,而后表现出不同程度的上升趋势。3个贮藏温度下果实的CcHSP21- 1和CcGUN4基因表现出较低的表达水平,但在第9天时出现显著差别(P<0.05)。25 ℃贮藏的果实CcGUN4的相对表达量分别是5 ℃和32 ℃的12.00倍和1.71倍(P<0.05)。第9天时,25 ℃贮藏的果实CcCRR22表达水平较高;32 ℃贮藏组的CcCRR22无显著变化,说明32 ℃对该基因无明显调控作用;5 ℃贮藏的果实CcCRR22的基因表达水平在贮藏过程中有波动,但与0 d相比无显著性差异,与叶绿体结构变化结果一致。3个贮藏温度下的蜜橘果实CcPAP12表现下调,但5 ℃和25 ℃贮藏的果实在第6天达到最低值后在随后的贮藏中存在上升的趋势;而32 ℃贮藏的果实CcPAP12相对表达量随着贮藏时间的延长缓慢降低。总的来说,与采收时相比,5 ℃贮藏的蜜橘果实果皮质体相关基因均表现出低表达水平;在第6天和第9天时,25 ℃贮藏激活果实CcISPH1、CcISPH3、CcHSP17.6II和CcCRR22的表达;由于32 ℃下蜜橘果皮质体结构变化较为特别,质体相关基因表达水平波动较大,但值得注意的是,32 ℃和5 ℃对CcISPH2、CcHSP21- 1、CcGUN4表达的抑制程度存在显著性差异,说明两者对质体结构的影响存在差异。
2.4 不同贮藏温度下质体发育相关基因与色差值的相关性分析
不同贮藏温度下蜜橘果皮质体相关基因与色差值的相关性分析如图6。25 ℃贮藏组的蜜橘果皮H*值与CcISPH1、CcISPH3、CcCRR22呈极显著负相关,与CcISPH2、CcPAP12呈显著正相关;a*/b*值与CcISPH3、CcCRR22呈极显著正相关,与CcISPH1、CcHSP17.6II呈显著正相关,与CcISPH2、CcPAP12呈显著负相关,说明25 ℃下蜜橘果皮色泽变化与CcISPH1、CcISPH2、CcISPH3、CcHSP17.6II、CcCRR22表达水平关系紧密。5 ℃贮藏的蜜橘果皮H*值与CcISPH2、CcHSP21- 1、CcGUN4呈显著正相关;而a*/b*值与CcISPH2、CcHSP21- 1、CcGUN4呈显著负相关,说明5 ℃贮藏的蜜橘果皮CcISPH2、CcHSP21- 1、CcGUN4表达水平对果皮色泽变化有一定影响。32 ℃贮藏的蜜橘果皮H*值与CcISPH1、CcISPH2呈显著正相关,与CcHSP21- 1、CcGUN4、CcPAP12呈极显著正相关,与CcHSP17.6II呈显著负相关;a*/b*值与CcHSP17.6II呈显著正相关,与CcISPH1、CcISPH2、CcGUN4和CcPAP12呈显著负相关,与CcHSP21- 1呈极显著负相关,说明32 ℃下蜜橘果皮呈绿色与多基因表达有关,并与各基因呈不同的相关关系。
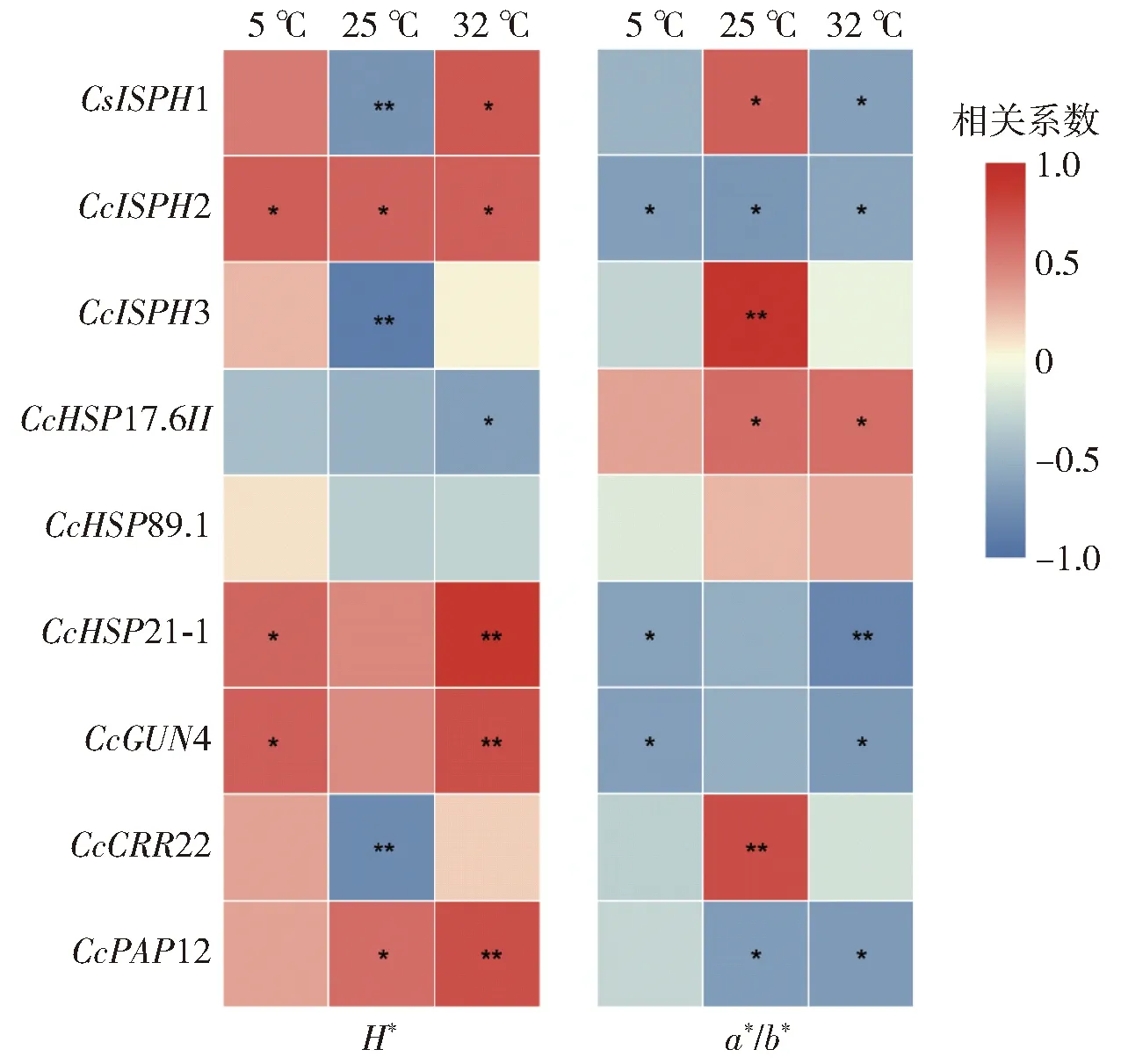
*表示相关性显著(P<0.05),**表示相关性极显著(P<0.01)。图6 不同贮藏温度下蜜橘果实果皮质体相关基因 与色差值相关性分析Fig.6 Correlation analysis of plastid-related genes and chromatism values of mandarin fruit peel at different storage temperatures
3 讨 论
在柑橘采后贮藏过程中,温度是影响果皮颜色的重要因素之一。本研究发现,重庆产早熟蜜橘果实采后在不同贮藏温度下表现出不同的着色情况,在适宜的温度(25 ℃)下蜜橘果皮C*以及a*/b*值显著升高,果皮正常着色。而5 ℃和32 ℃都抑制果皮着色,但5 ℃下贮藏蜜橘果皮H*以及a*/b*值无显著变化,32 ℃下贮藏蜜橘果皮的C*、H*以及a*/b*值有轻微变化,且与5 ℃存在显著性差异,说明两者的抑制效果是有区别的。
结合色差与亚细胞结构变化结果,与其他组相比,5 ℃贮藏果实果皮色差值无明显变化,油胞结构变化不大,保持了油胞基本形态,叶绿体结构变化缓慢,说明5 ℃贮藏延缓了果实果皮着色与果皮结构变化;25 ℃贮藏的果实色差值在贮藏期间发生显著变化,油胞形态也随着贮藏时间的延长逐渐消失,油胞层状结构遭到破坏,质体结构中出现晶状体,存在叶绿体向有色体转化的趋势。前期有研究表明,在枣果实成熟转色过程中,内源挥发性物质反式-2-乙烯醛含量显著提高[15]。柑橘中大多数挥发性物质储存在油胞中,那么25 ℃下蜜橘果皮油胞形态变化后,是否有挥发性物质释放以及挥发性物质与蜜橘果皮色泽变化的关系需要进一步研究。另外,32 ℃贮藏蜜橘果实的果皮色差值有轻微增加但果皮仍然呈绿色,果皮油胞中层状结构解体,薄壁组织形态被破坏,存在叶绿体向有色体转化的趋势,但在贮藏后期又再分化为叶绿体。
根据转录组数据,筛选到38个与质体相关的差异表达基因,分别属于HDS、HSPs、PAP和PPR家族,其中比较突出的是编码HDS、HSPs和PPR的基因。在质体中发生的2-C-甲基-D-赤藓糖醇(2-C-methyl-D-erythritol 4-phosphate,MEP)途径的代谢产物异戊烯焦磷酸(isopentenyl diphosphate,IPP)是类胡萝卜素生物合成的前体物质,HDS参与了IPP的合成,同时也与叶绿体发育有关[16]。ISPH是位于MEP途径中的关键基因,同时也是编码HDS的基因。色差值与质体相关基因的相关性结果表明,蜜橘果皮H*、a*/b*值与ISPH存在相关关系。本研究发现,25 ℃和32 ℃贮藏组果实果皮的CcISPH1和CcISPH3上调表达,同时叶绿体向有色体转化,C*和a*/b*值上升。5 ℃贮藏组蜜橘果皮的CcISPH1、CcISPH2、CcISPH3下调表达,叶绿体发育缓慢,C*、H*以及a*/b*值无显著变化,果皮保持绿色。同样,Hsieh和Goodman[17]报道在ispH突变体中,拟南芥叶绿体发育受阻,表现为白化,与本研究结果一致。
HSPs是植物在逆境下产生的一种蛋白质,不同的HSPs家族具有不同的功能,有研究表明叶绿体的分化和发育也需要HSP70和小热休克蛋白(small heat shock proteins,sHSPs)的参与[18-19]。相关性结果表明了25 ℃和32 ℃下蜜橘果皮H*、a*/b*值与HSP的表达有一定联系。CcHSP17.6II编码了17.3II类热休克蛋白,该蛋白质属于sHSP。HSP中的sHSP已被证明能在高温下做出氧化应激响应,同时李娜娜等[20]发现sHSP26在高温下对玉米叶绿体有保护作用。推测在一定范围内的高温胁迫下,sHSP能保护叶绿体,使其正常发育。CcHSP17.6II在25 ℃和32 ℃贮藏组果实中上调表达,0~6 d时,25 ℃和32 ℃贮藏组的蜜橘果皮叶绿体向有色体转化,但32 ℃贮藏组的蜜橘果皮在第9天表现为叶绿体形态,说明25 ℃对于早熟蜜橘而言不属于高温,叶绿体正常转化为有色体,而蜜橘果实贮藏在32 ℃下,打破了果实体内活性氧的动态平衡,sHSP做出氧化应激响应,增强了果实体内氧化胁迫的耐受能力,形成“叶绿体保护模式”。
PAP是一类参与质体小球和原纤维合成的蛋白家族,又被称为原纤维蛋白,其被定位于叶绿体中,目前有研究证实PAP与质体小球的形成和类胡萝卜素生物合成有关[21-23]。本研究中发现,32 ℃贮藏的蜜橘果皮CcPAP12在第6天时的表达量均显著高于5 ℃和25 ℃贮藏组,超微结构结果同样表明32 ℃下的蜜橘果皮有色体中的质体小球大量增多,与超表达OsFBN1并经高温处理的水稻叶片中的质体小球大量积累的结果一致[22]。
五肽重复(pentatricopeptide repeat,PPR)蛋白是一类RNA结合蛋白,参与了细胞器基因的转录后调控,大多数定位于叶绿体或线粒体中。有研究表明PPR蛋白可以调控质体基因和叶绿体发育[24-26]。水稻中PPR蛋白的缺失会导致叶绿体发育缺陷以及叶绿素代谢异常[27-28]。CcCRR编码了PPR蛋白At1g11290,其亚细胞定位于叶绿体,At1g11290是PPR家族成员之一,具有特殊的DYW结构域,与叶绿体及线粒体RNA转录本成熟发育有关[29]。本研究中发现伴随C*和a*/b*值显著上升,25 ℃贮藏组中CcCRR22上调表达的同时,叶绿体向有色体转化。而5 ℃和32 ℃贮藏组中的CcCRR22下调表达,推测CRR蛋白可能在不适的温度胁迫下做出一系列反应,从而影响叶绿体发育。
4 结 论
本研究以重庆产早熟蜜橘为实验材料,研究了不同贮藏温度下蜜橘果皮色泽和质体结构的变化。结果表明:25 ℃贮藏的蜜橘果实表现出显著的着色现象,同时叶绿体正常转化成有色体,CcISPH1、CcISPH3、CcCRR22表达水平与该组果实色泽变化密切相关。5 ℃和32 ℃贮藏的蜜橘果皮无明显着色现象,但5 ℃延缓了叶绿体的发育,而32 ℃诱导叶绿体分化为有色体后又再分化为叶绿体,同时质体相关基因表达存在显著差异,说明在质体结构方面,5 ℃和32 ℃抑制蜜橘果皮着色的机制有显著区别。本研究发现,不同贮藏温度下蜜橘果实果皮色泽发育与质体结构变化密切相关,同时质体发育相关基因的表达水平与色泽存在一定的相关性。然而贮藏温度如何调控质体中的色素物质以及质体分化与果实色素物质代谢的关系需要进一步研究。

