PD-1/ICOS信号转换受体通过增强CD19-CAR-T细胞增殖能力提高其对DLBCL的杀伤活性*
加尔宝·吐尔德 阿迪娜·贾库林 闻淑娟
(新疆医科大学附属肿瘤医院 1.淋巴瘤内科;2.乳腺放疗科,新疆 乌鲁木齐 830011)
弥漫大B细胞淋巴瘤(Diffuse large B-cell lymphoma,DLBCL)是一种高度侵袭性和异质性的肿瘤,是非霍奇金淋巴瘤最常见的形式[1-2]。随着新型靶向治疗的发展,大部分DLBCL患者可以治愈[3]。然而,仍有40%~50%的DLBCL患者表现为难治性或复发的特点,最终死于疾病进展[4-5]。因此,DLBCL的治疗还需要探寻更多的治疗手段。
靶向CD19的嵌合抗原受体T细胞(CAR-T细胞)已被批准用于复发难治性弥漫大B细胞淋巴瘤[6]。然而,免疫抑制微环境的存在显著削弱了CAR-T细胞在临床应用中的疗效[7-8]。前期研究[9-10]发现,PD-L1在DLBCL中显著高表达, 是此类患者不良预后因素。阻断PD-1/PD-L1信号是一种有效的增强B细胞淋巴瘤免疫应答的手段[11]。此外,研究[12-13]显示,包含ICOS胞内结构域的CAR增强了CAR-T细胞的效应功能和体内持久性。
在本研究中,为了逆转PD-1/PD-L1信号对T细胞的抑制作用,同时基于ICOS胞内结构域可以增强T细胞的效应功能和体内持久性的特点,我们将PD-1受体的胞外结构域与ICOS受体的胞内信号域融合,并将这种嵌合受体共表达在CD19-CAR-T细胞中,来探索这种新型CAR-T细胞对DLBCL的抑制活性。
1 材料与方法
1.1 细胞系、主要试剂、实验动物及血液样本 弥漫大B细胞淋巴瘤细胞DB购自武汉普诺赛生物科技有限公司。细胞培养基为RPMI-1640+10%胎牛血清,细胞培养在37℃,5% CO2条件下。过表达luciferase的DB细胞由本实验室先前构建保存。Ficol试剂购自北京索莱宝生物科技有限公司;CD3/CD28磁珠购自美国Invitrogen公司;IL-2购自美国Peprotech公司;Polybrene购自美国sigma公司;CFSE试剂购自美国Invitrogen公司;LDH细胞毒性检测试剂盒购自上海碧云天生物科技有限公司;荧光素酶底物购自上海翌圣生物科技有限公司;FITC标记的CD19蛋白购自北京Acro公司;PE标记的抗Myc抗体,PE标记的抗CD69抗体购自美国Biolegend公司;FITC标记的抗CD3抗体,PE标记的抗CD4抗体,APC标记的抗CD8抗体购自北京义翘神州有限公司;过表达CD19-CAR以及过表达PD-1/ICOS-CD19-CAR的慢病毒购自上海汉恒生物科技有限公司。15只5周龄大小的雌性NCG小鼠(体重在23 g左右)购自新疆医科大学,小鼠饲养SPF屏障环境中,所有动物实验都经过我院伦理委员会批准。志愿者招募自我院体检中心3例健康体检者,其中男2例,女1例,平均年龄45岁(年龄范围40~49岁),平均BMI为37.6 kg/m2(BMI范围为35.5~38.2 kg/m2),每位志愿者抽取20 mL的外周血,抽血程序经过我院伦理委员会批准,志愿者签署知情同意书。
1.2 慢病毒感染法构建bbz以及PD-1/ICOS-bbz 按照制造商的说明,使用Ficol试剂从外周血中分离外周血单核细胞,然后按3∶1的磁珠与细胞比例加入CD3/CD28磁珠,在室温孵育30 min,之后将磁珠细胞混合物放入专用磁力架中静置5 min,连同磁力架一起倾倒管中的液体,之后用完全培养基将试管中的磁珠细胞混合物按1×106/mL重悬,培养48 h后,按MOI值为10分别加入过表达CD19-CAR以及过表达PD-1/ICOS-CD19-CAR的慢病毒,并额外添加6 μg/mL的polybrene,在水平离心机中按800 g离心90 min,之后放入培养箱中静置培养。24 h后更换新鲜的完全培养基,并在感染72 h后使用流式检测CAR-T细胞的阳性率。
1.3 流式细胞术检测bbz以及PD-1/ICOS-bbz的阳性率 分别取3×105个未感染的T细胞(Mock),bbz以及PD-1/ICOS-bbz,PBS清洗3次后使用100 μL PBS重悬,之后加入5 μL PE标记的抗Myc抗体以及FITC标记的CD19蛋白,4℃避光孵育30 min,PBS清洗3次后,使用流式细胞仪进行检测,结果使用Flowjo V10进行处理。
1.4 流式细胞术检测长期共孵育后T细胞中CD69的表达情况 分别取2×106个bbz以及PD-1/ICOS-bbz,按照试剂盒的说明用CFSE染料进行标记,之后按照效靶比为2∶1与DB细胞共孵育,每隔7 d加入新鲜的DB细胞,共添加3次,在共孵育35 d后,取20 μL细胞悬液,PBS清洗3次后使用100 μL PBS重悬,之后加入5 μL PE标记的抗CD69抗体,4℃避光孵育30 min,PBS清洗3次后,使用流式细胞仪进行检测,结果使用Flowjo V10进行处理。
1.5 流式细胞术检测长期共孵育后T细胞的增殖情况 按照1.4的共孵育方法,每隔7 d取50 μL细胞悬液,利用T细胞标记CFSE的特性,使用流式细胞仪对CFSE+的细胞进行计数,以此来统计T细胞的增殖情况。
1.6 LDH释放法检测bbz以及PD-1/ICOS-bbz对靶细胞的细胞毒性 按照1.4的共孵育方法,在共孵育结束后,取2×106个细胞混合物,按照3∶1的磁珠与细胞比例加入CD3/CD28磁珠,在室温孵育30 min,之后将磁珠细胞混合物放入专用磁力架中静置5 min,连同磁力架一起倾倒管中的液体,得到T细胞。再按照效靶比为2∶1与DB细胞共孵育24 h,期间不添加任何细胞因子,之后按照制造商的说明使用LDH细胞毒性检测试剂盒检测对靶细胞的细胞毒性。计算公式为:细胞毒性或死亡率(%)=(处理样品吸光度-样品对照孔吸光度) / (细胞最大酶活性的吸光度-样品对照孔吸光度)×100。
1.7 体内移植瘤模型检测PD-1/ICOS-bbz的体内抗肿瘤活性 取5×106个DB-luciferase细胞,重悬于200 μL PBS中,通过尾静脉回输至NCG小鼠体内,接种7 d后,所有小鼠均成功长出肿瘤,将15只小鼠分为3组(Mock组,bbz组及PD-1/ICOS-bbz组,每组5只小鼠),通过尾静脉分别回输1×107个效应细胞,在接种肿瘤细胞后第14 d腹腔注射1 mg/kg的luciferase底物,并通过活体成像仪对体内的肿瘤细胞进行成像。之后密切监控小鼠的死亡情况。
1.8 流式细胞术检测小鼠外周血中T细胞的比例 通过眼眶采血取50 μL小鼠外周血,使用350 μL红细胞裂解液室温裂解3 min,之后加入1 mL PBS混匀,清洗3次后,加入FITC标记的抗CD3抗体,PE标记的抗CD4抗体,APC标记的抗CD8抗体,4℃避光孵育30 min,PBS清洗3次后,使用流式细胞仪进行检测,结果使用Flowjo V10进行处理。
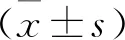
2 结果
2.1 慢病毒感染法构建bbz以及PD-1/ICOS-bbz 流式细胞术检测bbz及PD-1/ICOS-bbz的阳性率,结果显示,bbz和PD-1/ICOS-bbz中CD19-CAR的阳性率分别为31.1%和36.3%(见图1A),而只有PD-1/ICOS-bbz中表达PD-1/ICOS嵌合受体,阳性率为42.2%,见图1B。

图1 bbz和PD-1/ICOS-bbz的表征
2.2 长期共孵育后PD-1/ICOS-bbz的激活水平更高 在经过35 d的体外共孵育后,流式细胞术检测T细胞表面激活marker的表达情况,结果表明,PD-1/ICOS-bbz较bbz CD69的表达水平显著提高(P<0.001),见图2。

图2 长期共孵育后bbz和PD-1/ICOS-bbz的激活
2.3 长期共孵育后PD-1/ICOS-bbz的增殖能力和细胞毒性水平更高 细胞增殖结果显示,在长期共孵育过程中PD-1/ICOS-bbz较bbz增殖能力显著提高(P<0.01)(见图3A)。此外,共孵育结束后取T细胞与DB细胞共孵育,结果表明,PD-1/ICOS-bbz较bbz对靶细胞的细胞毒性更高(P<0.01),见图3B。

图3 bbz和PD-1/ICOS-bbz长期共孵育后的增殖和细胞毒性
2.4 PD-1/ICOS-bbz显著清除小鼠体内的淋巴瘤细胞 使用小鼠移植瘤模型评估PD-1/ICOS-bbz体内抗肿瘤活性,活体成像结果显示,在第14 d时PD-1/ICOS-bbz治疗组体内肿瘤被完全清除,而bbz组仍有存活部分肿瘤细胞(见图4A)。生存结果显示,bbz治疗组的小鼠在43 d时已全部死亡,而PD-1/ICOS-bbz治疗组的小鼠在70 d时仍全部存活(P<0.01),见图4B。

图4 bbz和PD-1/ICOS-bbz对DB细胞的体内抗肿瘤活性
2.5 PD-1/ICOS-bbz具有更强的体内增殖能力 流式结果显示,PD-1/ICOS-bbz治疗组中外周血CD3+T细胞的数目较bbz组显著增多(见图5A),且PD-1/ICOS-bbz治疗组的T细胞具有更多的CD8+T细胞的比例,表明其肿瘤杀伤能力更强,见图5B。

图5 bbz和PD-1/ICOS-bbz在体内的增殖
3 讨论
CAR-T细胞被认为是一种有效的B细胞淋巴瘤的治疗手段[14]。然而,现存的CAR-T细胞对复发/难治性DLBCL患者的疗效有限,客观缓解率只能维持在60%左右[15-16]。为了进一步提高CAR-T细胞对DLBCL疗效,降低肿瘤微环境的影响,我们构建了共表达信号转换受体的增强型CAR-T细胞。结果表明,含有PD-1/ICOS信号转换受体的CD19-CAR-T细胞能够特异性清除表达CD19的DLBCL,有效延长小鼠的生存期。此外,与二代的CD19-CAR-T细胞相比,含有PD-1/ICOS信号转换受体的CD19-CAR-T细胞具有显著的增殖优势,这种特性使PD-1/ICOS-bbz具有更强的临床应用潜力,因为到目前为止,大部分报道的经CAR-T细胞治疗失败的DLBCL患者,其外周血CAR-T细胞扩增都令人失望[17]。既往研究[18]报道,长期慢性刺激CAR-T细胞可导致其衰竭。而在本研究中,体外结果显示,在经过长期刺激后,PD-1/ICOS-bbz较bbz仍具有更好的肿瘤杀伤活性。
通过回输CAR-T细胞可以在体内产生有效的抗肿瘤作用,然而大多数肿瘤会采取多种策略来实现免疫逃逸。这种逃逸策略大致可以分为两类,一种是防止T细胞识别的策略,如目标抗原和主要组织相容性复合体表达下调[19-20];还有就是通过限制T细胞持久性和效应功能的策略,如抑制配体/受体(如CTLA-4、PD-1和LAG-3)的表达[21-22]。研究人员已经通过设计抑制配体阻断剂,证明可以增强抗肿瘤免疫反应[23]。但系统性施用这类药物往往会引起较为严重的不良反应[24]。本研究设计的PD-1/ICOS信号转换受体使得回输的CAR-T细胞在肿瘤局部解除PD-1/PD-L1的抑制作用,有效减小全身的副反应。
先前的研究表明,ICOS共刺激受体被证明可以增强CD8+T细胞介导的抗肿瘤活性[25]。此外,基于ICOS作为共刺激信号的CAR受体增强了CD8+T细胞的细胞因子释放和体内持久性[26]。本研究设计的PD-1/ICOS信号转换受体将肿瘤微环境中的PD-1信号转换为ICOS信号,证明的确可以增强CAR-T细胞的增殖活性。
CAR-T细胞应用于临床治疗时应该平衡疗效和毒性。然而,由于缺乏良好的动物模型,限制了对PD-1/ICOS-bbz毒性的评价[27]。尽管如此,我们可以在后续的研究中为PD-1/ICOS-bbz额外设计一些安全开关,使其即使发生不良反应,也可以及时采取相应手段予以控制[28]。
4 结论
本研究证实了通过逆转肿瘤来源的抑制信号来增强CAR-T细胞的抗肿瘤活性的可行性。嵌合受体(PD-1/ICOS)与肿瘤细胞上的PD-L1结合,并激活ICOS受体相关的下游信号级联,增强CAR-T细胞的增殖能力及体内的抗肿瘤活性。该研究为DLBCL的治疗提供了一种潜在的方案,有望在不远的未来进行临床研究进一步探索其治疗效果。

