硫酸铈连续滴定法测定污酸固砷氧化前液中的Fe2+和As3+
刘芳美,罗小兵,李文英,赖秋祥,廖彬玲
(紫金铜业有限公司,福建 上杭 364204)
1 引言
在铜冶炼的制酸工艺流程中,经电收尘后的熔炼炉、转炉烟气,经过两段动力波洗涤器,产生的酸为污酸,污酸送污酸污水处理站处理后达标排放。但是由于高砷、高铁杂质的存在给污酸处理工艺的选择带来一定难度。在设计工艺指标中,砷、铁的总去除率要达99%,才能使处理水达标排放。因此准确、快速地测定污酸溶液及除砷后液中的砷和铁,对整个污酸净化工艺的有效控制十分重要。由于目前行业标准中没有制定对污酸废液中Fe2+和As3+的分析测定方法,因此寻找一种快速、简便的分析方法,为生产管控提供数据支撑非常有必要。
目前测定砷的方法主要有原子荧光法[1-4],分光光度法[5,6],传感器法[7-11]等。测定铁的方法主要有分光光度法[12-14];原子吸收法[15],连续滴定法[16]和传感器法[17,18]等。虽然目前已报导的文献中有许多关于Fe2+和As3+的检测方法,但是关于污酸废液中Fe2+和As3+的检测仍然较少,且多数文献只是单一的测定其中的Fe2+或者As3+[19],鲜少有同时测定Fe2+和As3+的。Somasundaram Kaviya[20]用金纳米目视比色法测定Fe3+和As3+,但是该法检测成本高,只适用于低含量Fe3+和As3+的检测,不适用于冶炼企业中快速、高含量的检测。
本文拟采用硫酸铈滴定法连续测定污酸固砷氧化前液中的Fe2+和As3+。因为污酸固砷氧化前液中Fe2+和As3+浓度较高,采用分取试液,再移取一定量体积的纯水,加入硫酸溶解,用亚铁灵作指示剂,硫酸铈标准溶液作滴定剂快速测定污酸固砷氧化前液中的Fe2+含量,然后再加一定量的冰乙酸和混合催化剂继续滴定污酸固砷氧化前液中的As3+含量。该方法分析速度快,成本低,能及时指导生产。
2 实验部分
2.1 试剂
邻菲罗啉亚铁指示剂(0.01mol/L),硫酸(分析纯),碘化钾(分析纯),碘酸钾(分析纯),混合催化剂(将20.8mL 0.1mol/L碘化钾溶液和4.16mL 0.1mol/L碘酸钾溶液混合并定容250mL),冰乙酸(分析纯),盐酸(分析纯),硫酸铈(分析纯)。
0.1mol/L Ce(SO4)2标准溶液:
配制:称取约40g(精确至0.0001g)四水合硫酸铈,加30mL水及28mL硫酸,再加300mL水,加热溶解,再加650mL水,摇匀。
标定:称取0.25g(精确至0.00001g)已于105℃~110℃电烘箱中干燥至恒量的工作基准试剂草酸钠,溶于75mL水中,加4mL硫酸溶液(20%)及10mL盐酸,加热中65℃~70℃,用配置的硫酸铈溶液滴定至溶液呈浅黄色。加入0.10mL邻菲罗啉-亚铁指示液使溶液变为橘红色,继续滴定至溶液呈浅蓝色。同时做空白试验。
硫酸铈标准滴定溶液的浓度按下式计算:

式中:m:草酸钠质量,单位g;
V1:草酸钠消耗硫酸铈溶液体积,单位mL;
V2:空白消耗硫酸铈溶液体积,单位mL;
M:草酸钠的摩尔质量,单位g/mol,M(1/2Na2C2O4)=66.999。
2.2 实验原理
通过Ce(SO4)2的消耗量确定溶液中Fe2+和As3+含量。反应方程式如下:
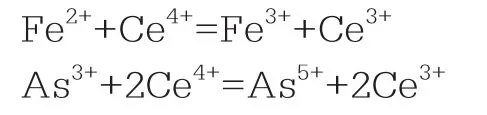
试亚铁灵作指示剂。滴定终点都为橙红色变为淡蓝色。
2.3 实验方法
2.3.1 Fe2+的滴定
移取2.00mL试样置于装有50mL蒸馏水的250mL锥形瓶中,然后缓慢加入2.95mL浓硫酸(注意不要一次性加入过多浓硫酸,以免溅起溶液)。加入2-4滴邻菲罗啉亚铁指示液,溶液为橘红色。用0.1mol/L Ce(SO4)2标准溶液滴定至浅蓝色,记录消耗量为V1。
2.3.2 As3+的滴定
加17mL冰乙酸,2-4滴混合催化剂到上述溶液中,摇匀,溶液由浅蓝色变为橘红色。继续用0.1mol/L Ce(SO4)2标准溶液滴定至浅蓝色后等2分钟,如果溶液不变色则滴定结束,如果变色则继续滴定至不变色,记录消耗量为V2。
2.3.3 分析结果的计算
试样中Fe2+的含量按以下公式计算:
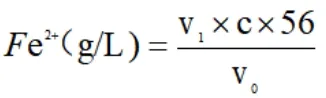
式中:C:Ce(SO4)2标准溶液浓度,mol/L,
V0:移取水样体积,mL,
V1:试样消耗Ce(SO4)2标准溶液消体积,mL,
56:铁的摩尔质量,g/moL。
试样中As3+的含量按以下公式计算:
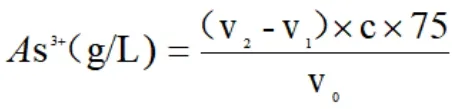
式中:C:Ce(SO4)2标准溶液浓度,mol/L,
V0:移取水样体积,mL,
(V2-V1):试样消耗Ce(SO4)2标准溶液消体积,mL,
75:砷的摩尔质量,g/moL。
3 结果与讨论
3.1 条件优化
3.1.1 硫酸用量的选择
试样经硫酸处理后用邻菲罗啉亚铁做指示剂,用0.1mol/L Ce(SO4)2标准溶液滴定。硫酸的用量会直接影响试样处理效果,从而影响Fe2+的滴定。因此,在本实验中改变硫酸的用量,按照试验方法检测Fe2+,其分析结果如下表所示。

表1 硫酸的用量的选择(n=3)
从上表数据中可以看到,当硫酸加入量少于2mL时,试样处理不完全,使得结果偏低;当硫酸加入量过多时,多余的硫酸会干扰Fe2+的检测,从而影响结果。从表中数据可知,当硫酸加入量为2mL时,检测结果最接近参考值。因此,硫酸加入量为2mL时最适宜。
3.1.2 冰乙酸用量的选择
冰乙酸的用量会直接影响As3+的检测,因此,在本实验中改变冰乙酸的用量,其他条件不变,分别加入10mL、13mL、17mL、20mL、25mL冰乙酸,按照试验方法检测As3+,其分析结果如下表所示。

表2 冰乙酸的用量的选择(n=3)
从上表中可以看出,当冰乙酸用量加入过少时,溶液颜色褪色不完全,会影响As3+的滴定;但是,当冰乙酸加入过量时,溶液酸度过高,同样会影响As3+的滴定,使得终点不易判断,滴定不完全。当冰乙酸加入量为17mL是,As3+的滴定终点灵敏,酸度合适,且检测结果与参考值最接近。
3.2 精密度试验
为了确定该试验方法是否准确可靠,在最优条件下对不同对同一试样由不同的人员在相同的条件下平行测定7次,对大量样品进行了试验,结果满意,部分分析结果和RSD如下表所示。
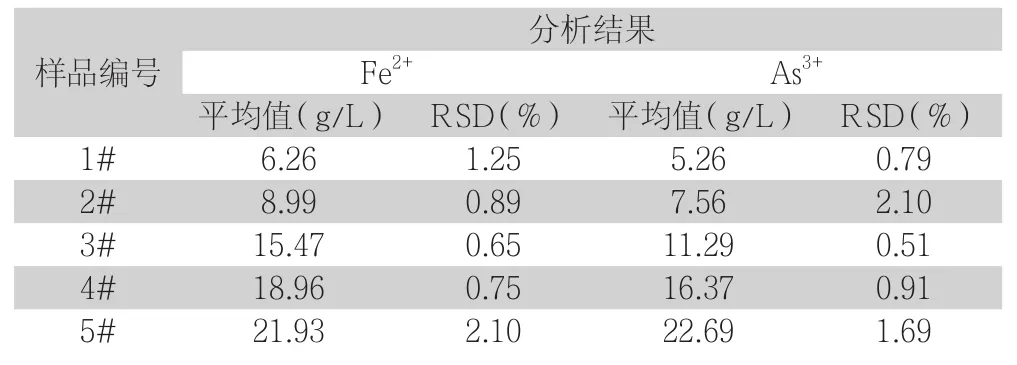
表3 不同样品精密度实验分析结果
由上表中的分析结果中可以看到,多人平行测定结果令人满意,相对标准偏差小于5%,由此可说明该实验方法稳定可靠,分析结果稳定,再现性良好,进一步验证了该试验方法在精密度上的可靠性。
3.3 对照试验
用本实验方法与仪器分析方法分析结果进行比对,其分析结果如表4、5所示。
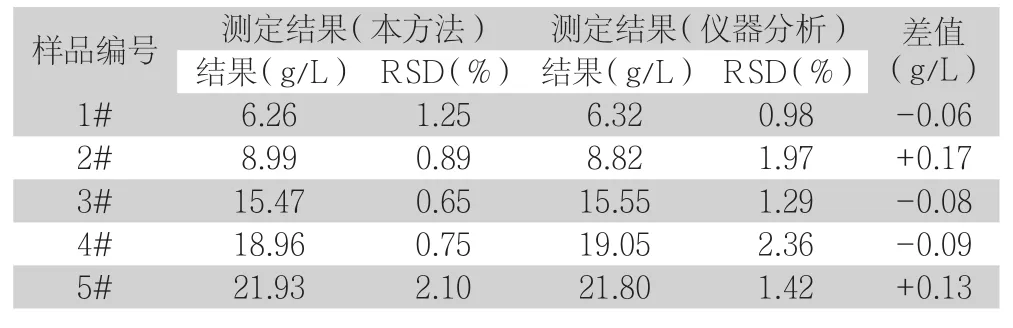
表4 不同样品Fe2+对照试验结果(n=3)
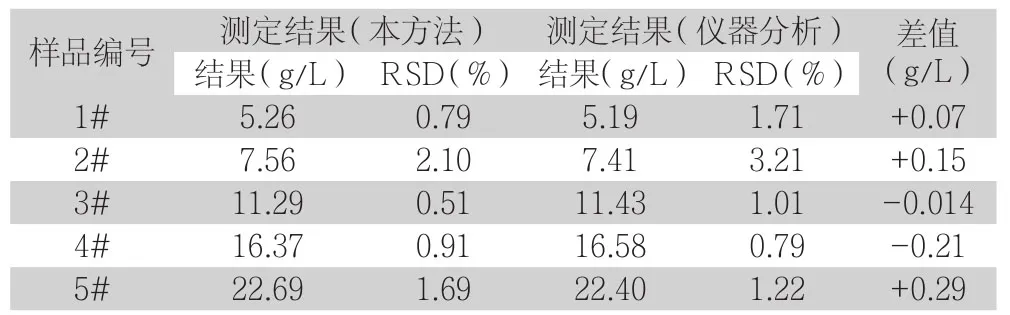
表5 不同样品As3+对照试验结果(n=3)
从上表4和5中可以看出,采用本试验的检测与仪器分析基本一致,差值小,结果满意,由此可以说明本实验方法是准确可靠的,可用于日常实际检测中。
3.4 加标回收实验
为进一步验证该方法准确度,对含量不同的1#和2#分析试样进行加标回收实验,结果如表6、7。
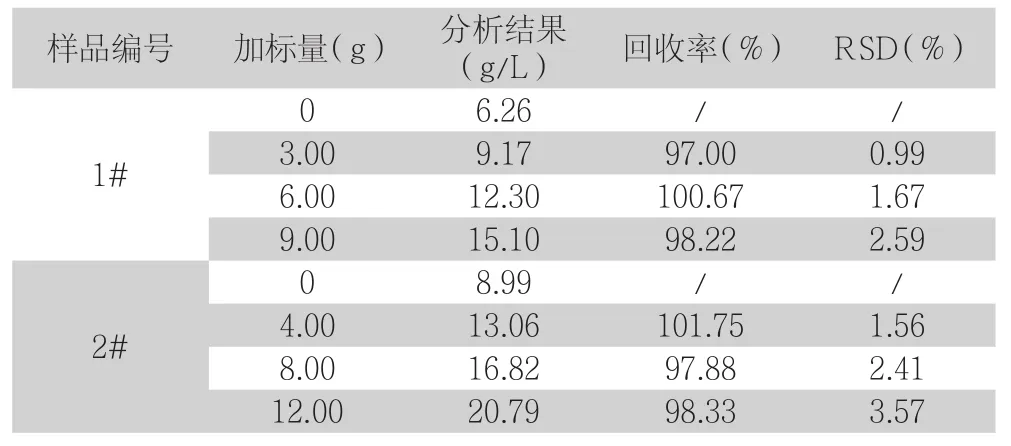
表6 Fe2+加标回收实验(n=3)
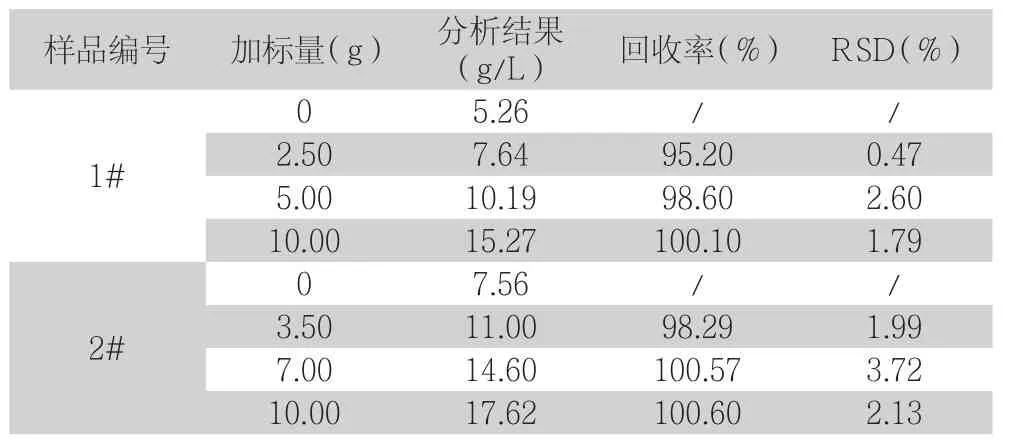
表7 As3+加标回收实验(n=3)
由表6、7数据可见,污酸固砷氧化前夜中Fe2+和As3+的回收率分别为97.00%~101.75%和97.78%~100.79%之间,RSD分别为0.99%~3.57%和0.47%~3.72%之间,由此可知该方法可用于检测污酸固砷氧化前夜中的Fe2+和As3+。
4 结论
试验表明,采用硫酸铈滴定法连续测定污酸固砷氧化前夜中的Fe2+和As3+,方法简单,精密度高准确度高,能够满足污酸固砷氧化前夜的分析检测要求。且此方法分析速度快,成本低,能及时指导生产,不足的是当废液中有H2O2等氧化剂时可能会干扰As3+的滴定,但是仍然具有一定的推广价值。

