JHDM1D-AS1/miR-144-3p对H2O2诱导的PC12损伤氧化应激和炎症的影响
张金武 沈露 肖骋 鲁建华 陈梦宇 陈莉
(咸宁市中心医院(湖北科技学院附属第一医院)神经内科,湖北 咸宁 437099)
缺血性脑疾病属于神经系统疾病,其发病率和死亡率都很高,治疗效果较差,严重影响患者的生活质量及生命安全〔1〕。氧化应激、炎症是缺血性脑损伤等疾病的重要病理生理反应,其可相互影响,进一步讨论脑缺血损伤的分子机制,寻找有效的神经保护策略是临床治疗新的策略〔2,3〕。研究表明脑缺血时脑组织lncRNA表达发生了显著改变,参与了脑缺血的病理生理学过程,可作为急性缺血性脑卒中诊断和预后生物标志物的靶点〔4,5〕。组蛋白去甲基化酶同源物1D反义1(JHDM1D-AS1)是一种长的非编码RNA(lncRNA),JHDM1D-AS1过表达通过调节miR-101-3p/双特异性磷酸酶(DUSP)1轴减轻臂丛神经损伤后脊髓中神经炎症和神经元损伤,发挥对神经的保护作用〔6〕。过氧化氢(H2O2)处理的牙周膜干细胞中JHDM1D-AS1下调,JHDM1D-AS1上调通过降低热休克蛋白家族成员(DNAJ)C10及真核细胞起始因子(eIF)2α的磷酸化,从而保护牙周膜干细胞免受H2O2诱导的凋亡〔7〕。而JHDM1D-AS1对脑损伤的影响及机制尚不清楚。研究报道miR-144-3p过表达显著降低了神经元的细胞活力,促进了细胞凋亡,并增加了氧化应激;而下调miR-144-3p可以保护神经元免受氧葡萄糖剥夺和复氧诱导的神经元损伤〔8〕。脑缺血再灌注损伤中miR-144-3p被上调,lncRNA Rian过表达通过miR-144-3p/GATA结合蛋白(GATA3)信号传导减弱了脑缺血再灌注损伤引起的细胞凋亡〔9〕。H2O2是常见的活性氧化物,可导致氧化应激反应〔10〕。本实验用H2O2诱导PC12建立脑损伤模型,研究JHDM1D-AS1是否通过调控miR-144-3p影响PC12细胞氧化应激和炎症反应。
1 材料与方法
1.1材料 PC12细胞(无锡欣润生物科技有限公司);DMEM培养基(北京凯瑞基生物科技有限公司);H2O2溶液(上海经科化学科技有限公司);荧光定量试剂盒(武汉科昊佳生物科技有限公司);凋亡检测试剂盒(日本同仁化学研究所);超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒(上海江莱生物科技有限公司);肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β酶联免疫吸附试验(ELISA)试剂盒(南京赛泓瑞生物科技有限公司);双荧光素酶报告基因检测试剂盒〔弗元(上海)生物科技有限公司〕。
1.2细胞处理与分组 PC12细胞常规培养,取对数生长期细胞,接种于96孔板,培养24 h后加入含40 μmol/L H2O2的培养液中培养,作为模型(Model)组,正常培养的细胞作为对照(Con)组;将pcDNA、pcDNA-JHDM1D-AS1、anti-miR-NC、miR-144-3p inhibitor转染至PC12细胞后用40 μmol/L的H2O2处理,记为Model+pcDNA组、Model+pcDNA-JHDM1D-AS1组、Model+anti-miR-NC组、Model+miR-144-3p inhibitor组;将pcDNA-JHDM1D-AS1分别与miR-NC、miR-144-3p mimic共转染至PC12细胞后用40 μmol/L的H2O2处理,记为Model+pcDNA-JHDM1D-AS1+miR-NC组、Model+pcDNA-JHDM1D-AS1+miR-144-3p mimic组。
1.3实时荧光定量PCR(RT-qPCR)检测JHDM1D-AS1和miR-144-3p表达水平 提取细胞总RNA,合成cDNA后按试剂盒说明进行PCR,循环条件为95℃ 3 min,95℃ 30 s,60℃ 30 s;72℃ 30 s,共40个循环;相对表达量用2-ΔΔCt法计算。JHDM1D-AS1和miR-144-3p分别以GAPDH和U6为内参,JHDM1D-AS1上游引物:5′-CCTCGCGACGCTGAGAGAATC-3′,下游:5′-ACGGCACATTCCTCCCTCGGA-3′;GAPDH上游引物:5′-ACCACAGTCCATGCCATCAC-3′,下游:5′-TCCACCCTGTTGCTGTA-3′;miR-144-3p上游引物:5′-CTCACTCACATCAACAGACATTAATT-3′,下游:5′-TATGGTTGTTCTGCTCTCTGTGTC-3′;U6上游引物:5′-GGAACGCTTCACGAATTTG-3′,下游:5′-ATTGGAACGATACAGAGAAGATT-3′;引物由上海生工生物工程公司合成。
1.4流式细胞术检测细胞凋亡 收集各组细胞,磷酸盐缓冲液(PBS)漂洗,加入10 μl的膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC),再加入5 μl的碘化丙啶(PI),混匀后避光孵育10 min;用流式细胞仪检测细胞凋亡率。
1.5试剂盒检测细胞SOD活性和MDA含量 细胞培养48 h后,收集各组细胞,严格按试剂盒说明操作。
1.6酶联免疫吸附试验(ELISA)检测TNF-α、IL-1β水平 各组细胞培养48 h后取上清,具体按照试剂盒操作进行检测。
1.7双荧光素酶报告实验检测JHDM1D-AS1和miR-144-3p的靶向关系 构建JHDM1D-AS1的野生型和突变型荧光素酶载体WT-JHDM1D-AS1和MUT-JHDM1D-AS1,将其分别与miR-NC和miR-144-3p共转染至细胞PC12中,按照说明书检测荧光素酶活性。
1.8统计学分析 采用SPSS20.0软件进行t检验、方差分析,组间两两比较采用LSD-t检验。
2 结 果
2.1JHDM1D-AS1对H2O2诱导的PC12损伤的影响 与Con组相比,Model组PC12细胞中JHDM1D-AS1表达水平明显降低,miR-144-3p表达水平明显升高,细胞凋亡率明显升高(P<0.05);与Model组和Model+pcDNA组相比,Model+pcDNA-JHDM1D-AS1组PC12细胞中JHDM1D-AS1表达水平明显升高,miR-144-3p表达水平明显降低,细胞凋亡率明显降低(P<0.05),见表1,图1。
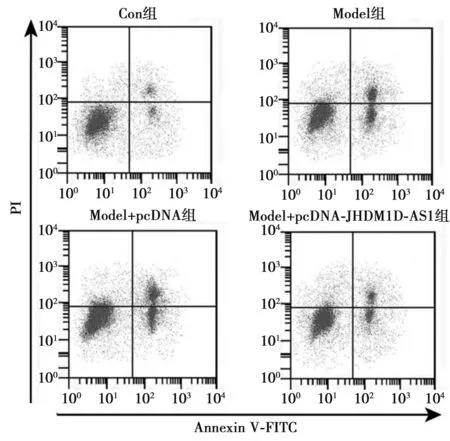
图1 JHDM1D-AS1对H2O2诱导的PC12凋亡的影响
2.2JHDM1D-AS1对H2O2诱导的PC12氧化应激的影响 与Con组相比,Model组PC12细胞中SOD活性明显降低,MDA含量明显升高(P<0.05);与Model组和Model+pcDNA组相比,Model+pcDNA-JHDM1D-AS1组PC12细胞中SOD活性明显升高,MDA含量明显降低(P<0.05),见表1。
2.3JHDM1D-AS1对H2O2诱导的PC12炎症因子的影响 与Con组相比,Model组PC12细胞中TNF-α、IL-1β含量升高(P<0.05);与Model组和Model+pcDNA组相比,Model+pcDNA-JHDM1D-AS1组PC12细胞中TNF-α、IL-1β含量降低(P<0.05),见表1。
表1 JHDM1D-AS1对H2O2诱导的PC12损伤氧化应激、炎症因子的影响
2.4JHDM1D-AS1靶向miR-144-3p JHDM1D-AS1与miR-144-3p有结合位点(图2);WT-JHDM1D-AS1与miR-144-3p共转染后细胞荧光素酶活性降低(P<0.001),MUT-JHDM1D-AS1与miR-144-3p共转染后细胞荧光素酶活性无显著变化,见表2。
表2 双荧光素酶报告实验

图2 JHDM1D-AS1靶向miR-144-3p
2.5抑制miR-144-3p对H2O2诱导的PC12损伤氧化应激和炎症因子的影响 与Model+anti-miR-NC组相比,Model+miR-144-3p inhibitor组细胞凋亡率明显降低,SOD活性明显升高,MDA含量明显降低,TNF-α、IL-1β含量明显降低(均P<0.001),见图3,表3。
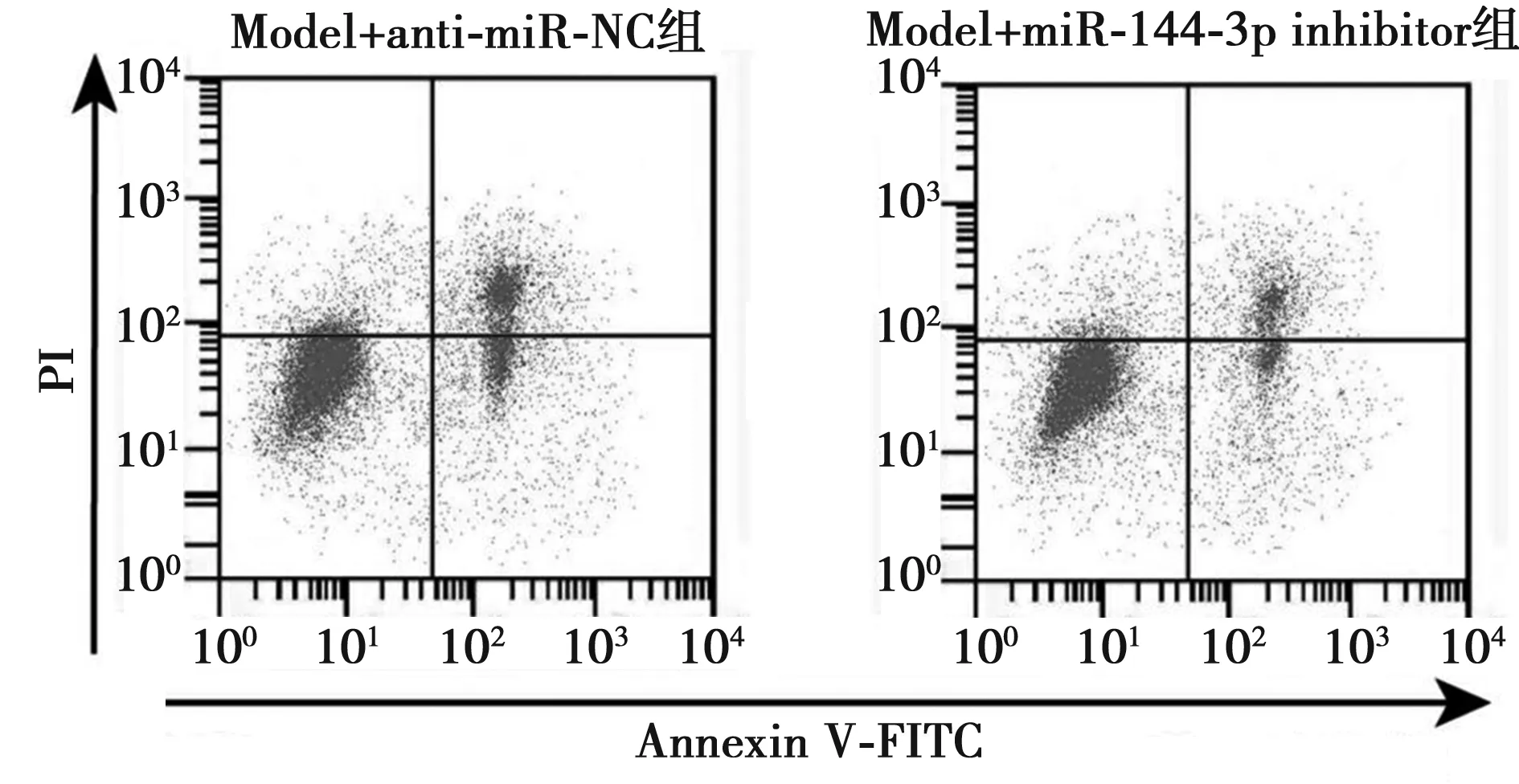
图3 抑制miR-144-3p对H2O2诱导的PC12凋亡的影响
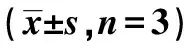
表3 抑制miR-144-3p对H2O2诱导的PC12损伤氧化应激和炎症因子的影响
2.6miR-144-3p可逆转JHDM1D-AS1对H2O2诱导的PC12损伤氧化应激和炎症因子的影响 与Model+pcDNA-JHDM1D-AS1+miR-NC组相比,Model+pcDNA-JHDM1D-AS1+miR-144-3p mimic组细胞凋亡率明显升高,SOD活性明显降低,MDA含量明显升高,TNF-α、IL-1β含量明显升高(均P<0.001),见表4,图4。
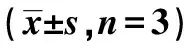
表4 miR-144-3p可逆转JHDM1D-AS1对H2O2诱导的PC12损伤氧化应激和炎症因子的影响

图4 miR-144-3p可逆转JHDM1D-AS1对H2O2诱导的PC12凋亡的影响
3 讨 论
脑缺血后的神经元损伤是个复杂的病理过程,深入分析其分子机制,通过促进或抑制相关lncRNA或miRNA的表达可能对脑损伤相关疾病的治疗有益〔11,12〕。研究报道JHDM1D-AS1可减轻神经炎症,对神经损伤具有保护作用〔6〕。在营养饥饿状态下增加的JHDM1D-AS1表达通过上调血管生成来加速胰腺癌肿瘤生长〔13〕。JHDM1D-AS1与DHX15相互作用,增强了非小细胞肺癌的生长和转移〔14〕。而JHDM1D-AS1对H2O2诱导的PC12氧化应激和炎症的影响还尚不清楚。本实验结果表明过表达JHDM1D-AS1抑制了H2O2诱导的PC12细胞凋亡、氧化应激及炎症反应。
研究报道miR-144-3p模拟物可促进促炎性细胞因子的产生,加速噬斑的形成从而导致载脂蛋白(Apo)E-/-小鼠动脉粥样硬化的病理进展加快〔15〕。抑制miR-144-3p可增强视网膜色素上皮中依赖核因子E2相关因子(Nrf)2的抗氧化信号,并防止氧化应激引起的外部视网膜变性〔16〕。血红素可通过上调miR-144-3p损害炎症消退〔17〕。以上研究表明miR-144-3p参与氧化应激及炎症反应的发生。本实验结果表明抑制miR-144-3p表达抑制了H2O2诱导的PC12细胞凋亡、氧化应激及炎症反应。且本实验发现JHDM1D-AS1靶向调控miR-144-3p,而miR-144-3p过表达逆转了JHDM1D-AS1对H2O2诱导的PC12氧化应激和炎症因子的影响。
综上,JHDM1D-AS1过表达可能通过下调miR-144-3p减轻H2O2诱导的PC12细胞凋亡、氧化应激和炎症反应。

