异泽兰黄素通过DCST1-AS1/miR-138-5p对胰腺癌细胞SW-1990的影响
程德刚 李福昌 任刚
中药是一种强有效的辅助治疗手段,可用于临床治疗胰腺癌,其作用机制有待更深入的研究[1]。异泽兰黄素是从菊科蒿属植物中分离的一种黄酮苷元,具有抗炎,抗氧化,抗肿瘤等多种药理活性[2,3],可抑制miR-21的表达,通过激活AKT通路诱导肾癌786-O细胞凋亡[4],可通过靶向Akt /GSK3β和MAPK/ERK信号级联反应来抑制食管癌TE1细胞增殖[5],可通过抑制ERK通路抑制肝癌细胞SK-HEP-1增殖以及促进其凋亡[6]。然而异泽兰黄素对胰腺癌细胞SW-1990生物学行为的影响及机制尚不清楚。研究报道miR-138-5p上调可抑制胰腺癌细胞的增殖和转移[7]。lncRNA MCM3AP-AS1通过调节miR-138-5p促进胰腺癌细胞的生长和迁移[8]。生物学软件预测发现miR-138-5p与lncRNA DCST1-AS1有结合位点,DCST1-AS1可促进胶质母细胞瘤细胞的增殖[9]。抑制DCST1-AS1可通过增加miR-874-3p表达抑制子宫颈癌细胞的增殖,迁移和侵袭[10]。因此,本实验旨在研究异泽兰黄素对胰腺癌细胞SW-1990生物学行为的影响及机制是否与DCST1-AS1和miR-138-5p有关。
1 材料与方法
1.1 实验材料 胰腺癌细胞SW-1990(美国ATCC);RPMI-1640完全培养基(武汉Procell);异泽兰黄素(HPLC≥98%,滁州仕诺达生物);CCK-8试剂盒(武汉博士德生物);吉萨姆染色液(上海钰博生物);Transwell小室、基质胶(美国康宁);Annexin V-FITC/PI凋亡检测试剂盒、蛋白提取试剂盒(上海贝博生物);荧光定量PCR试剂盒(德国Qiagen);双荧光素酶报告基因检测试剂盒(上海碧云天)。
1.2 细胞处理与分组 胰腺癌细胞SW-1990用RPMI-1640完全培养基培养,取对数生长期细胞,分别用2.5 μmol/L、10 μmol/L、40 μmol/L异泽兰黄素处理,记为异泽兰黄素2.5、10、40 μmol/L组,常规培养的细胞作为对照组;将DCST1-AS1抑制表达载体及阴性对照转染至SW-1990细胞,记为si-DCST1-AS1组、si-NC组;将DCST1-AS1过表达载体染至SW-1990细胞后用40 μmol/L异泽兰黄素处理,记为异泽兰黄素+pcDNA-DCST1-AS1组。
1.3 CCK-8检测细胞活性 各组细胞培养48 h,每孔加入10 μl CCK-8试剂,孵育2 h,酶标仪检测450 nm波长处的吸光度值(OD)。
1.4 平板克隆形成实验检测集落形成数 将各组细胞消化后以适宜浓度接种于6孔板中,约培养2周有肉眼可见克隆时停止培养,吸去培养液后用PBS将细胞洗涤2遍,甲醇固定,吉姆萨染色 30 min,干燥后在光学显微镜下计数>50个细胞的集落。
1.5 Transwell检测细胞迁移和侵袭 用无血清培养液饥饿细胞12 h,然后制备细胞悬液;将200 μl细胞悬液加入 Transwell 上室,下室加入600 μl含血清培养液,常规培养24 h,取出Transwell小室,弃去孔中培养液,用PBS洗2遍,用棉签轻轻擦掉上层未迁移细胞,甲醛固定30 min,将小室适当风干;用0.1%结晶紫染色30 min,用PBS洗3遍;风干后倍显微镜下随机选取5个视野观察,记数。侵袭实验:基质胶稀释后平铺于 Transwell 上室,凝固后同迁移操作。
1.6 流式细胞术检测细胞凋亡 收集各组细胞,用预冷的PBS漂洗2次,加入结合缓冲液重悬,加入10 μl的Annexin V-FITC,再加入5 μl的PI,混匀避光孵育10 min;上流式细胞仪检测细胞凋亡率。
1.7 Western blot法检测蛋白表达 提取细胞总蛋白,进行SDS-PAGE电泳分离蛋白,转膜、封闭,加入Cleaved-caspase3一抗(1∶500)于4℃孵育过夜,倒掉一抗,洗膜,加入HRP标记的二抗(1∶3 000),室温摇床孵育2 h,洗膜,显影,分析蛋白条带灰度值。
1.8 实时荧光定量PCR(RT-qPCR)检测DCST1-AS1和miR-138-5p的表达水平 提取各组细胞总RNA,合成cDNA,按照荧光定量PCR试剂盒说明进行PCR,相对表达量用2-△△Ct法计算。分别以GAPDH和U6为内参,DCST1-AS1上游引物序列:5’-CGGTTTTCTCCTCA
GCTTTG-3’,下游引物序列:5’-CCCATGTTTGGGGAT
AGATG-3’;GAPDH上游引物序列:5’-ATTCCATGGC
ACCGTCAAGGCTGA-3’,下游引物序列:5’-TTCTCCA
TGGTGGTGAAGACGCCA-3’;miR-138-5p上游引物序列:5’-TGCAATGGGTTTGGCGTAGAAC-3’,下游引物序列:5’-CCAGTGCCGCAGGGTAGGT-3’;U6上游引物序列:5’-CTCGCTTCGGCAGCACA-3’,下游引物序列:5’-AACGCTTCACGAATTTGCGT-3’。
1.9 双荧光素酶报告实验 将DCST1-AS1野生型和突变型荧光素酶载体分别与miR-NC或miR-138-5p共转染至SW-1990细胞,按照试剂盒说明检测SW-1990细胞的荧光素酶活性。

2 结果
2.1 异泽兰黄素对SW-1990增殖凋亡迁移侵袭的影响 与对照组比较,异泽兰黄素2.5、10、40 μmol/L组SW-1990细胞活性降低,集落形成数、迁移和侵袭细胞数减少,细胞凋亡率及Cleaved-caspase3表达水平升高,呈浓度依赖性,差异有统计学意义(P<0.05)。见图1,表1。

图1 异泽兰黄素诱导SW-1990凋亡;A 异泽兰黄素诱导SW-1990凋亡;B 异泽兰黄素促进SW-1990中Cleaved-caspase3蛋白的表达(1 对照组;2 异泽兰黄素2.5 μmol/L组;3 异泽兰黄素10 μmol/L组;4 异泽兰黄素40 μmol/L组)

表1 异泽兰黄素抑制SW-1990增殖迁移侵袭诱导凋亡
2.2 异泽兰黄素对SW-1990中DCST1-AS1、miR-138-5p表达的影响 与对照组比较,异泽兰黄素2.5、10、40 μmol/L组SW-1990细胞中DCST1-AS1表达水平降低,miR-138-5p表达水平升高,呈浓度依赖性(P<0.05)。见表2。

表2 异泽兰黄素对SW-1990中DCST1-AS1、miR-138-5p表达的检测
2.3 DCST1-AS1靶向miR-138-5p Starbase预测显示DCST1-AS1和miR-138-5p有互补序列;wt-DCST1-AS1与miR-138-5p共转染的细胞荧光素酶活性低于wt-DCST1-AS1与miR-NC共转染的细胞(P<0.05);而mut-DCST1-AS1与miR-138-5p或miR-NC共转染的细胞荧光素酶活性无差异(P>0.05)。见图2,表3。
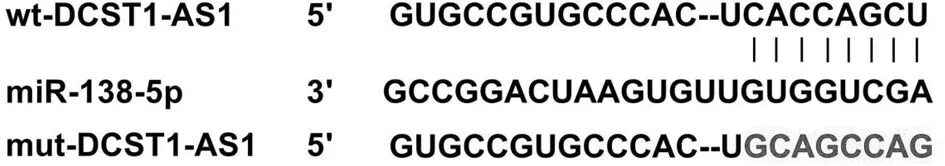
图2 DCST1-AS1和miR-138-5p的互补序列
2.4 沉默DCST1-AS1对SW-1990增殖凋亡迁移侵袭的影响 与si-NC组比较,si-DCST1-AS1组DCST1-AS1表达水平降低,miR-138-5p表达水平升高,SW-1990细胞活性降低,集落形成数、迁移和侵袭细胞数减少,细胞凋亡率及Cleaved-caspase3表达水平升高(P<0.05)。见图3,表4。

表3 双荧光素酶报告实验
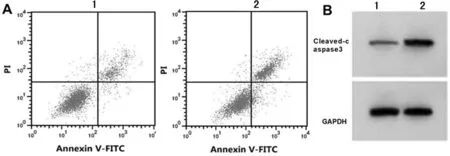
图3 沉默DCST1-AS1诱导SW-1990凋亡;A 沉默DCST1-AS1诱导SW-1990凋亡;B 沉默DCST1-AS1促进SW-1990中Cleaved-caspase3蛋白的表达(1 si-NC组;2 si-DCST1-AS1组)
2.5 过表达DCST1-AS1对异泽兰黄素处理的SW-1990增殖、凋亡、迁移侵袭的影响 与异泽兰黄素组相比,异泽兰黄素+pcDNA-DCST1-AS1组DCST1-AS1表达水平升高,miR-138-5p表达水平降低,SW-1990细胞活性升高,集落形成数、迁移和侵袭细胞数增加,细胞凋亡率及Cleaved-caspase3表达水平降低,差异均有统计学意义(P<0.05)。上述指标在对照组与异泽兰黄素组间亦均有差异(P<0.05)。见图4,表5。

表4 沉默DCST1-AS1抑制SW-1990增殖迁移侵袭诱导凋亡

图4 过表达DCST1-AS1可逆转异泽兰黄素对SW-1990凋亡的诱导作用;A 过表达DCST1-AS1可逆转异泽兰黄素对SW-1990凋亡的诱导作用;B 过表达DCST1-AS1可逆转异泽兰黄素对SW-1990中Cleaved-caspase3表达的促进作用(1 对照组;2 异泽兰黄素组;3 异泽兰黄素+pcDNA-DCST1-AS1组)

表5 过表达DCST1-AS1可逆转异泽兰黄素对SW-1990增殖、迁移、侵袭、凋亡的作用
3 讨论
黄酮类化合物具有抗氧化性,抗病毒,抗肿瘤等多种生物活性,开发抗肿瘤的含黄酮类中药对治疗各种癌症具有重要意义[11]。异泽兰黄素作为一种重要的黄酮类活性成分,研究报道异泽兰黄素通过促进HeLa和Caski宫颈癌细胞株的凋亡和细胞周期阻滞来抑制增殖[12]。异泽兰黄素可促进上皮性卵巢癌的细胞凋亡[13],可抑制神经胶质瘤的增殖,迁移和侵袭[14],可通过调节PTEN和NF-κB信号传导抑制前列腺癌细胞的增殖和迁移[15]。本实验用不同浓度的异泽兰黄素的处理胰腺癌细胞SW-1990,结果显示,SW-1990细胞的活性降低,集落形成数、迁移和侵袭细胞数减少,细胞凋亡率及Cleaved-caspase3表达水平升高,呈浓度依赖性;表明异泽兰黄素可浓度依赖性的抑制SW-1990细胞增殖、迁移和侵袭,促进细胞凋亡。
研究报道DCST1-AS1通过靶向miR-605-3p来调节胃癌细胞的增殖,迁移,侵袭和凋亡[16]。DCST1-AS1通过AKT/mTOR信号通路加速肝癌细胞的增殖,转移和自噬[17]。本实验结果显示,沉默DCST1-AS1后,SW-1990细胞活性降低,集落形成数、迁移和侵袭细胞数减少,细胞凋亡率及Cleaved-caspase3表达水平升高;表明沉默DCST1-AS1可抑制SW-1990细胞增殖、迁移和侵袭,促进细胞凋亡;提示DCST1-AS1在胰腺癌中作用与在其他癌症中相似。且本实验发现DCST1-AS1靶向调控miR-138-5p;而上调miR-138-5p水平可抑制胰腺癌细胞增殖,迁移和侵袭[18]。提示,DCST1-AS1可通过调控miR-138-5p影响胰腺癌细胞生物学行为。此外,本实验发现异泽兰黄素可降低DCST1-AS1表达水平降低,提高miR-138-5p表达水平;而过表达DCST1-AS1可逆转异泽兰黄素对SW-1990细胞的作用。
综上所述,异泽兰黄素通过调控DCST1-AS1/miR-138-5p轴抑制胰腺癌细胞SW-1990的恶性生物学行为。

