石墨烯量子点与细胞免疫相关性研究新进展*
徐亚栋 李志强
石墨烯量子点(graphene quantum dots,GQDs)是纳米碳材料家族的最新成员,由PONOMARENKO等[1]在2008年被研发成功。它是一种零维石墨烯材料,为横向尺寸小于100纳米的石墨烯薄片,包含一个或多个(2~10层)石墨烯层。其具有优异的化学、物理和生物特性,在纳米医学领域具有广泛的应用前景,如:具有很强且可协调的荧光特性,可用于荧光生物成像和生物传感;具有类芳香化合物的高负载能力,可用于小分子药物传递,甚至基因传递;以及具有光辐射下产生活性氧(reactive oxygen species,ROS)的能力,可用于光热和光动力疗法治疗癌症[2]。研究表明,石墨烯及其衍生物可影响巨噬细胞和T细胞等免疫细胞的分化发育[3],在疫苗、免疫制剂制备方面也具有潜在用途[4]。而GQDs作为石墨烯的衍生物,有更小的体积,不仅具有石墨烯的特性[5],同时具有更高的生物相容性,故可作为治疗炎性疾病的潜在药物[6]。
1石墨烯量子点的生物相容性 生物相容性的总体定义是材料不引起意外生物反应的情况下执行其预期功能的能力,但材料的生物相容性范围取决于具体的应用[7]。许多碳基纳米颗粒会因为相互聚集而产生毒性,这限制了其在生物体中的应用,但GQDs表面存在-OH和-COOH等富氧基团,这些极性成分使GQDs具有优异的水溶性[8],有利于其生物利用,而且GQDs为碳基颗粒,不用担心金属残留的毒性问题。
1.1石墨烯量子点具有低细胞毒性:碳基纳米颗粒的生物相容性在很大程度上取决于它们的表面化学性质[4]。GQDs主要通过小窝介导的内吞作用被细胞内化,体外研究表明,被-NH2,-COOH,-CHO-N-(CH3)2,聚乙二醇(PEG)等基团修饰的GQDs在浓度高达200 μg/mL时显示出低毒性,而-OH修饰的GQDs在100 μg/mL以上时表现出一定的细胞毒性[9-11]。GQDs还显示出较低的遗传毒性,以往的研究中,碳纳米管[12]和氧化石墨烯(graphene oxide,GO)[13]都被发现在低浓度下会导致DNA损伤,WU等[14]研究发现GQDs对MCF-7和MGC803细胞的DNA有轻微的损伤,但远远优于GO,GO在亚G1期便引发显著的细胞聚集,导致细胞凋亡增加。
1.2石墨烯量子点的血液相容性:血液不仅是静脉注射给药的纳米颗粒的第一接触点,也是通过其他途径给药的所有纳米颗粒到达其目标组织或器官的通道。因此评估GQDs的血液细胞相容性也非常重要。对于这方面的研究较少,KIM等[15]将人血红细胞与不同官能团修饰的GQDs(非官能化、羟基化和羧化GQDs)共同孵育发现,当浓度低于500 μg/mL时,红细胞的溶血率和流变学没有明显改变;而当浓度>750 μg/mL时,羧基化GQDs造成了溶血,并导致红细胞的变形和聚集。然而体内血液循环中,GQDs与血细胞、内皮细胞和血浆蛋白直接接触,并可能相互影响,体外单种血细胞的评估不能完全反映GQDs的血液相容性,但在小鼠模型中,短期应用还未观察到明显的血栓及心血管并发症。
1.3石墨烯量子点在生物模型中的毒性:NURUNNABI等[16]单次给小鼠静脉注射羧基GQDs,观察其生物分布和细胞毒性以及体内器官成像,发现GQDs从12 h开始被逐渐清除。并且连续给药21 d(5或10 mg·kg-1·d-1)后没有明显的器官损伤或损伤。CHONG等[11]发现对小鼠静脉和腹腔注射聚GQDs-PEG(20 mg·kg-1·d-1)14 d不会产生任何明显毒性。同样,在斑马鱼和秀丽隐杆线虫中也未观察到GQDs的明显毒性[17-18]。
1.4石墨烯量子点在体内清除和降解:给小鼠静脉和皮下注射GQDs发现,GQDs在肾脏内积聚,然后通过尿液排出[19]。口服时,GQDs通过粪便排出,不会迁移到大脑或性器官[20]。超小尺寸的GQDs(<5 nm)可以穿过肾脏滤过屏障并通过尿液排出,但是羧基GQDs虽然大小为3~6 nm,却不能穿过肾滤过屏障,而是分布在肝脏和脾脏[21]。另外,研究表明,GQDs可被人髓过氧化物酶(MPO)和嗜酸性过氧化物酶(EPO)降解[22]。这可能是小鼠静脉注射羧基GQDs没有发现明显毒性的部分机制。
总之,目前的研究显示,GQDs具有较低的毒性,这成为了它作为治疗药物的前提。
2石墨烯量子点的抗氧化性 ROS是一组由机体各种细胞产生的不稳定分子,包括过氧化氢(H2O2)、羟基自由基(OH-)、单线氧(1O2)和超氧化物(O2-)等,在机体抵抗病原体和细胞信号传导中起着重要作用,但他们如果不能及时清除并在细胞内蓄积,会破坏细胞内的蛋白质、脂质和核酸,造成氧化损伤[23]。研究表明,GQDs在生物系统中既具有ROS猝灭活性,又具有产生活性[24-25]。在光激发下,GQDs通过增加细胞内ROS水平从而降低细胞活力表现出显著的光毒性,而在无光激发的情况下GQDs可以有效地清除大量ROS,从而保护细胞免受氧化损伤[26],如图1。如:NILEWSKI等[27]报道了GQDs-PEG对细胞具有低毒性并且有显著的抗氧化作用。ROSTAMZADEH等[28]发现在大鼠心肌埂死模型中GQDs-PEG能缓解氧化应激反应,改善心肌梗死大鼠的心脏功能。

图1 在光激发下,GQDs可产生活ROS,而在无光激发的情况下GQDs可有效地清除ROS
2.1GQDs的清除活性氧的机制:石墨烯的sp2杂化的碳原子蜂窝网络是其他碳同素异形体的基本组成部分。简单来说蜂窝网格结构包裹形成零维富勒烯,卷起形成一维的碳纳米管,堆叠形成三维的石墨,切割形成零维的GQDs,如图2。活性氧可以结合到GQDs的sp2碳结构域,GQDs的π-π共轭性质和丰富的边缘缺陷位点促进了活性氧和GQDs之间的电荷转移,从而消除活性氧。此外,GQDs表面丰富的含氧官能团(-OH、-COOH等)促进了GQDs中的自由电子离域化,表现出供氢能力,来消除ROS。

图2 石墨烯及其衍生物结构示意图
2.2氧化程度和氧含量对石墨烯量子点活性氧清除能力的影响:氧化程度和氧含量会影响石墨烯基材料的加合物形成、电荷转移和供氢能力,从而影响其活性氧清除能力。一方面,引入的氧原子可以破坏GQDs原有的结构(电子转移的主要场所),降低ROS清除能力。然而,另一方面,含氧官能团,例如-OH、C=O和-COOH,可以促进ROS的吸附,并有利于ROS与石墨烯基材料之间加合物的形成和电子转移[29]。GQDs表面含有丰富的含氧基团,研究表明GQDs表面的含氧基团可以有效清除ROS,并且C-OH和C=O基团比C-O-C基团更具清除ROS的活性[30]。WANG等[31]设计了一种表面富含-OH的类酚基团功能化GQDs具有高效的ROS清除活性,并且在急性肾损伤小鼠模型中,仅使用抗氧化剂N-乙酰半胱氨酸(NAC)十六分之一剂量就可以有效保护肾脏免受氧化损伤。
2.3元素掺杂对石墨烯量子点活性氧清除能力的影响:一般来说,掺杂富电子元素(如N、P、Se、S和Cl)可以提高自由基清除能力[32-33]。WANG等[34]合成了氯掺杂的GQDs(Cl-GQDs),其ROS的清除能力是未掺杂GQDs的7倍。RUIZ等[35]发现表面具有丰富含氮基团(C-N和C=N)的GQDs具有极高的供氢能力和抗氧化活性。LI等[36]人报道了磷掺杂的GQDs的DPPH·清除活性(79.1%)是未掺杂GQD(35.5%)的2倍以上。BYEONGTAEK等[37]合成了硫醇化石墨烯量子点(SH-GQDs)能有效清除巨噬细胞内的ROS。
3石墨烯量子点的免疫调节性 ROS是免疫细胞中氧化应激和氧化还原信号转导的关键媒介[38],GQDs对ROS的调控可能对免疫应答反应产生深远影响。此外,T细胞、巨噬细胞以及树突状细胞(dendritic cell,DC)的功能受到自噬的调控[39-41]。多项研究表明GQDs可诱导细胞自噬[10,42-44],如图3。因此,GQDs可能通过清除ROS和诱导自噬两方面作用调节免疫。

图3 GQDs诱导自噬的作用机制示意图
3.1石墨烯量子点与T细胞 T细胞作为最重要的免疫细胞之一,与多种炎性疾病的发生发展有关,研究表明GQDs可影响T细胞亚群的分化发育并缓解炎症性疾病。VOLAREVIC等[6]利用GQDs治疗刀豆球蛋白A(Concanavalin A,ConA)诱导的小鼠自身免疫性肝炎,发现GQDs能抑制T细胞向Th1细胞分化和巨噬细胞活化来缓解炎症,并且大颗粒GQDs(宽度大于40 nm)和小颗粒GQDs(宽度5~30 nm)表现出相似的治疗效果。TOSIC等[45]大鼠神经炎症模型中,发现GQDs能通过调节MAPK/Akt信号通路和Th1免疫应答来缓解免疫介导的神经系统损伤。
3.2石墨烯量子点与巨噬细胞:巨噬细胞在具有高度功能异质性的先天免疫应答中起着重要作用。它是一种来源于组织中单核细胞的白细胞,能以不动细胞或自由细胞的形式吞噬和消化死亡细胞和入侵病原体的碎片,从而激活淋巴细胞和其他类型的免疫细胞,加速其对入侵病原体作出反应。巨噬细胞将在不同的微环境中极化,产生促进炎症的经典M1型巨噬细胞和抑制炎症的选择性M2型巨噬细胞。ROS有利于诱导M1型促炎巨噬细胞。自噬缺陷导致炎症M1型巨噬细胞过度激活[46],因此GQDs的ROS清除作用和自噬诱导作用可能影响巨噬细胞亚群的分化。LEE等[47]发现GQDs可改善右旋糖酐硫酸钠(dextran sulfate sodium,DSS)诱导的小鼠结肠炎,并在体内外的试验中证明了GQDs不仅能够直接抑制T细胞向Th1和Th17细胞分化,还可通过促进巨噬细胞M0向M2亚型的分化,使小鼠结肠局部调节性T细胞(Treg)的浸润增加,并间接抑制T细胞向Th1和Th17细胞分化。
3.3石墨烯量子点与DC细胞:抗原递呈细胞(antigen presenting cell,APC)和T淋巴细胞之间的相互作用是调节免疫反应的关键环节。DC是最重要的APC,能够感知微环境并迁移到淋巴结,从而激活抗原特异性T细胞[48]。除了诱导针对入侵病原体的有效免疫反应外,DC还表现出调节功能,以维持中枢和外周的免疫耐受。耐受性DC与其未成熟表型相关,表面含有少量共刺激分子,并分泌抗炎细胞因子IL-10和TGF-β,促使T细胞分化为抗炎的Treg[49]。DC和T细胞的功能都受自噬调节,并与其他信号通路发生复杂的相互作用[50]。自噬可以限制DCs的成熟及其分泌促炎细胞因子的能力[51-53]。哺乳动物雷帕霉素靶点(mammalian target of rapamycin,mTOR)是细胞自噬的关键调节因子[54],在DC分化发育中也起着关键作用。SAID等[52]发现了GQDs诱导耐受性DC细胞来调节免疫功能的机制。GQDs被DC细胞摄取后可通过mTOR依赖的自噬诱导机制抑制人单核细胞源性DC的发育和功能,使其分化为耐受性DC。从而抑制T细胞向Th1和Th17细胞分化,使其向Th2和Treg细胞的分化。此外,研究还发现GQDs不仅降低了DC中活性氧的产生,而且还减少了NF-kB的核转位,推测可能是对产生耐受性DC细胞起到了积极的作用。但在此研究中并未发现GQDs对T细胞分化的直接影响,这与LEE等[47]的研究结果有出入。
总的来说,GQDs除了能直接影响T细胞的分化发育之外,还能通过作用于巨噬细胞和树突状细胞这些具有抗原递呈作用的细胞间接影响T细胞的分化发育来发挥免疫调节功能,如图4。
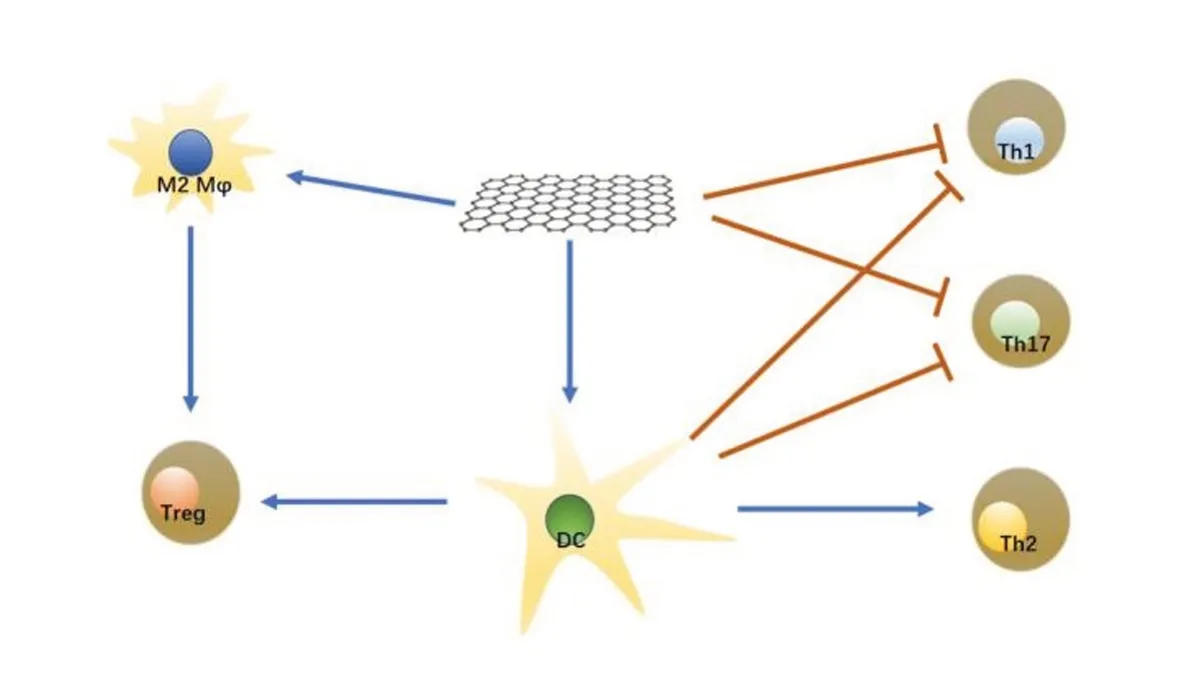
图4 GQDs调节免疫作用示意图
4总结与展望 GQDs作为一种碳基纳米材料,在药物输送、生物传感、生物成像和光化学治疗的应用中得到了广泛研究,但它的物理化学及生物学特性使它本身成为一种具有治疗活性的药物。GQDs的高水溶性、低毒性、抗氧化性以及免疫调节活性,使它具有治疗炎性疾病的潜力。由于炎性疾病的主要治疗目标是改善过度的免疫反应,注射的颗粒需要不对免疫系统产生额外的刺激,GQDs的表面结构使其带有负电荷,许多研究表明带负电荷的纳米颗粒具有低免疫原性[53]。另外,GQDs具有较大的比表面积以及特殊的理化结构(可以与各种官能团、靶向配体和生物活性分子进行结合),是药物靶向输送的理想纳米载体[2],有利于提高药物疗效和减少免疫抑制药物的全身不良反应。例如:KHODADADEI等[57]报道了负载甲氨蝶呤(Methotrexate,MTX)的氮掺杂GQDs纳米载体能够作为有效的抗癌药物传递系统,能够有效传递抗癌药物至靶细胞,并减少对正常细胞的伤害。目前GQDs的药物运输研究主要是肿瘤化疗药物运输及基因治疗,未来GQDs可负载抗体及免疫调节药物在炎性疾病的治疗方面具有巨大的潜力。除此之外,GQDs还具有多种治疗活性,抗菌活性、抗阿尔茨海默病、抗帕金森病和抗糖尿病活性也有报道。
需要注意的是GQDs是一种相对较新的材料,目前对于影响GQDs免疫调节影响因素(结构、大小、官能基团等)的研究较少,各个研究的GQDs表征数据存在差异,如QIN等[43]报道的GQDs在THP-1人单核细胞系中诱导氧化应激和促炎症反应。与前文所述诸多报道:GQDs具有清除ROS和免疫抑制作用不吻合。这可能是由于单一细胞的体外实验的特殊性或者GQDs的物理化学特征差异造成的。另一方面,短期的体外和生物模型的毒性试验还远不足以证明GQDs在哺乳动物甚至人体中的安全性,需要更广泛和长期的毒理性研究,才确保GQDs更安全更可靠地应用。
利益冲突所有作者均声明不存在利益冲突

