扎龙湿地丹顶鹤卵壳和羽毛DDTs残留量及其年际变化特征
高忠燕 罗金明 吴铁宇 张 宁 徐伟衍
(1.黑龙江省扎龙国家级自然保护区管理局,齐齐哈尔,161002;2.齐齐哈尔大学理学院,齐齐哈尔,161006)
有机氯农药滴滴涕(DDT)是20世纪农业上使用最广泛的杀虫剂之一[1],大量使用这种农药以及相关工业产品给环境带来大量的残留和严重的生态问题[2]。研究表明,有机氯农药DDT以及衍生物(简称DDTs)具有沿着食物链进行富集和显著的生物放大的特性,对生态系统中顶层捕食者的生态健康带来风险[3]。从20世纪60年代开始,欧美发达国家陆续禁止使用这种农药和相关产品。我国从1983年开始禁止使用DDT农药[4],但是含有DDT的化工产品依然允许生产和使用,因此环境中残留大量的DDTs。2009年,我国政府全面禁止各种含有DDT的化学产品使用(中国环境保护部公告2009年第23号),这对于减少环境中DDT的残留浓度具有十分重要的意义。由于DDTs是一种难以降解的有机氯化合物(其半衰期长达12~15年),因此环境中残留的DDTs还将在今后一段时期内存在且对环境中的生物生态健康带来影响[5]。
雌鸟产卵时往往会把体内富集的DDTs排到卵中,较高浓度的DDTs残留会导致卵壳的厚度显著变薄且易碎,从而降低鸟类的繁殖成功率[2,6]。鸟类也可能把体内富集有毒物质排到羽毛中,并通过羽毛的更新来降低其体内有害物质的浓度[7]。基于此,Jaspers等[8]建议使用鸟卵和羽毛组织残留的DDTs水平指示鸟类体内DDT物质的影响程度。
丹顶鹤(Grusjaponensis)是国际易危(VU)的珍稀物种[9],也是我国一级保护的大型涉禽物种[10]。目前全世界有迁徙的野生丹顶鹤2 300只左右,迁徙种群规模处于减少的趋势[9]。黑龙江省扎龙国家级自然保护区和江苏盐城湿地珍禽国家级自然保护区是迁徙丹顶鹤种群重要的繁殖地和越冬地。然而,湿地周围分布着大面积的农田,农业生产排放的有机氯农药DDT很容易进入丹顶鹤的栖息地(繁殖地和越冬地),并在环境和生物体内富集[11]。近20年来,野生丹顶鹤种群规模与20世纪90年代相比趋于减少,但是丹顶鹤种群的减少和湿地生态系统富集的DDTs是否有紧密关联尚未有定论。由于丹顶鹤是国际濒危物种,任何捕获野生丹顶鹤和盗取其卵的行为都可能对该种群的稳定产生影响。本研究以2004—2021年搜集到的10枚野生丹顶鹤弃卵、24枚丹顶鹤孵化后残留的卵壳和28支丹顶鹤脱落的羽毛(翼羽)为样本,探讨近年来野生丹顶鹤卵(壳)组织以及羽毛中残留的DDTs浓度的变化特征,并讨论迁徙丹顶鹤种群所受到的风险水平,研究结果对野生丹顶鹤物种的保护具有一定参考意义。
1 研究区概况
扎龙湿地位于中国东北松嫩平原西部(46°52′—47°32′ N,123°47′—124°37′ E),地跨齐齐哈尔市和大庆市2个行政区(图1)。乌裕尔河下游进入松嫩平原后海拔迅速降低,低平的地形使得河道消失,大面积的水流散溢,发育成典型温带芦苇沼泽湿地(扎龙湿地),整个湿地保护区面积约2 100 km2(包括核心区700 km2和缓冲区1 400 km2),大面积的原生芦苇沼泽为丹顶鹤、东方白鹳(Ciconiaboyciana)等多种珍稀鸟类提供良好的栖息和繁殖环境。每年的3月下旬,丹顶鹤自南方越冬地北迁并在扎龙湿地栖息繁殖,直到10月下旬气候变冷才迁徙至越冬地。
本地区属于中温带半湿润-半干旱季风气候,年平均降水量为410 mm,蒸发量达到1 350 mm。湿地水分主要来源于降水补给(约占55%)、上游来水补给(约占35%)和区间来水(10%)。整个湿地地势低洼,海拔110~120 m,湿地上游发育大面积的黑土,是我国重要粮食产区。半湿润-半干旱的气候及其低洼的地形特征决定了本地区容易承接来自四周农田农药与除草剂等污染物,可能影响在此生活的丹顶鹤等鸟类的生态健康。
2 材料与方法
2.1 材料
在丹顶鹤的繁殖地(扎龙湿地)设计8个采样点(图1),2004—2014年共搜集到24枚丹顶鹤孵化后残留的卵壳(2004年4枚,2009年4枚,2014年16枚),同期在上述样点采集部分丹顶鹤脱落的羽毛(翼羽,采集时间为每年4—6月),2020—2021年在上述样点搜集到10枚野生丹顶鹤弃卵(表1)。

图1 扎龙湿地位置及采样位点Fig.1 Location of Zhalong wetland and sampling sites

表1 扎龙湿地样点的生境及样本数量
为了分析扎龙湿地环境以及水生动物残留的DDTs水平的变化特征,于2021年5月,在8个采样点采集湿地底泥和常见的水生动物:贝类[中国圆田螺(Cipangopaludinachinensis)]、底栖类[龙虱(Cybisterjaponicus)]和鱼类[体长小于15 cm的鲤(Cyprinuscarpio)]。上述样品为丹顶鹤常见食物种类,也是扎龙湿地优势水生物种[12],样品采集后迅速运回实验室冷藏备用。以尹莉莉[11]2006年在扎龙湿地采集得到的底泥和水生动物组织残留的DDTs质量分数为对照。
2.2 方法
丹顶鹤卵壳的厚度采用螺旋测微器测定(SYNTEK-Q2LF型,精确度 1 μm),每个卵壳不同部位测量5次后取平均值得到某个卵壳样本的平均厚度,卵的重量使用天平测定(精确度1 g)。
所有样本的预处理和农药残留DDTs测定依照尹莉莉[11]和Bouwman等[13]的处理程序:卵壳用去离子水多次清洗去杂质后60 ℃烘干至常量备用。搜集到的羽毛用去离子水多次清洗去除羽毛表层的杂质。底泥和各种有机体样本各取2 g,依次加入10 g无水硫酸钠研磨至干松粉末,然后放入索氏提取器中,用丙酮-石油醚(2+8)提取6~8 h。整个提取过程控制在(6±2) min循环1次。完成提取后用减压氮浓缩至5 mL,接着将浓缩液移入已确定淋洗曲线的净化柱净化,放弃初始液体,用200 mL乙醚-石油醚淋洗,收集洗脱液注回净化柱反复清洗。收集全部洗脱液并使用减压氮浓缩至10 mL,采用气相色谱法测定(Clarus 580气相色谱仪,仪器检测限为0.1 ng/g)各种样本中残留的DDTs质量分数,同时进行空白试验。通过回收率验证数据的可信度,所有样本的回收率为85%~103%。
净化柱的材料处理过程:使用无水硫酸钠在马弗炉650 ℃下灼烧4 h后冷却至室温,将150~250 μm规格的弗罗里硅土在马弗炉中650 ℃下灼烧4 h,置于干燥器中冷却至室温,临用前在130 ℃烘箱中保持1 h,冷却1 h后填充净化柱(30 cm×3 cm)。
所有样品中未检测到o,p′-DDT,因此∑4DDTs代表p,p′-DDE、p,p′-DDD和p,p′-DDT之和。为了分析5个时间段(2004年、2009年、2014年、2020年和2021年)丹顶鹤的卵壳、羽毛残留DDTs质量分数以及卵壳厚度是否存在显著的变化,对卵壳和羽毛残留DDTs质量分数使用单因素方差法(one-way ANOVA)进行比较(显著检验阈值P=0.05)。底泥残留DDTs质量分数为干重,丹顶鹤卵组织以及水生动物样本质量分数为湿重。
3 结果与分析
3.1 丹顶鹤卵壳和卵组织残留DDTs质量分数
表2显示,2004年、2009年和2014年在丹顶鹤孵化后残留的卵壳部分样本中检测到残留的DDTs,主要以p,p′-DDE成分为主。2004年S7样点残留于卵壳的DDTs质量分数为30.5 ng/g,2009年S5和S7样点样本的残留量为35.6、10.1 ng/g,2014年卵壳中残留量为nd~25.6 ng/g;2020和2021年的卵壳中未检测到残留的DDTs,显著低于2004年、2009年和2014年的样本(F=10.13,P=0.005)。2020和2021年,部分丹顶鹤弃卵组织样本(S2、S4和S7)中检测到残留的DDTs,主要为p,p′-DDE,质量分数为nd~23.2 ng/g(湿重)。分析可知,残留于卵壳的DDTs质量分数近年来表现为降低的趋势,最高浓度为2009年S5样点处采集的样本(35.6 ng/g),2014年有4个样点的样本中DDTs残留低于检测限,2020年以后的卵壳中DDTs残留均低于检测限。
3.2 丹顶鹤羽毛组织残留DDTs质量分数
表2显示,丹顶鹤的羽毛中检测到一定浓度的残留DDTs,2009年S5和S7样点的羽毛样本中检测出残留DDTs达到1 520 ng/g和1 970 ng/g,2014年的S3、S5和S7样点的羽毛中检测到残留DDTs的质量分数分别为2 350、2 520、970 ng/g,2020年S1、S2以及2021年的S4、S7和S8羽毛组织中DDTs残留量为58.3~90.5 ng/g,其余样点羽毛中残留量低于检测限。通过对比不同时间丹顶鹤羽毛残留可知,其表现出随着时间推移而逐渐降低的变化特征。通过单因素方差检验发现,2020年和2021年丹顶鹤羽毛组织中DDTs质量分数显著低于2009年以及2014年(F=18.13,P=0.001)。这种变化特征和丹顶鹤的卵壳组织残留的DDTs质量分数变化特征相似。
3.3 卵(壳)和羽毛中的DDTs与湿地环境残留的关系
表3显示,部分底泥和水生动物样本中检测到残留的DDTs,主要以p,p′-DDE为主。不同水生动物种类DDTs残留量存在明显差异,总体看鱼类[(8.6±2.6)ng/g]<贝类[(14.5±6.7)ng/g]<底栖类[(67.8±14.3)ng/g]。底栖动物体内DDTs的残留量高于其他水生生物。不同时段扎龙湿地环境的DDTs残留量存在显著差异。2006年扎龙湿地底泥中残留的DDTs平均质量分数为83 ng/g[11],超过了Long等[14]提出的湖泊沉积物DDTs残留的污染标准(51.7 ng/g干重)。2021年湿地底泥中残留的DDTs平均质量分数4.6 ng/g,显著低于2006年和MacDonald的湖泊沉积物质量标准(P<0.01)。2006年,扎龙湿地的贝类样本中残留浓度[11]高于我国水产品允许浓度(500 ng/g,湿重,GB 2763—2021),而2021年贝类残留的DDTs浓度仅为14.5 ng/g,相比2006年显著降低[11],2021年所有检测的水生样品中残留的DDTs浓度也都低于我国水产品允许浓度(GB 2763—2021)。2021年采集的丹顶鹤弃卵组织残留的DDTs平均质量分数(7.5 ng/g)显著低于2006年(约50 ng/g,P<0.05)[11],也显著低于草原猎鹰(Falcomexicanus)卵组织DDTs的影响阈值(3 100 ng/g,湿重)[15]和褐鹈鹕(Pelicaunsoccidentalis)卵的影响阈值(3 000 ng/g,湿重)[16]。分析可见,扎龙湿地环境中底泥以及常见水生动物残留的DDTs表现出明显降低的变化特征,同期丹顶鹤的卵、卵壳和羽毛中残留的DDTs也表现出随着时间推移而逐渐降低的变化特征。
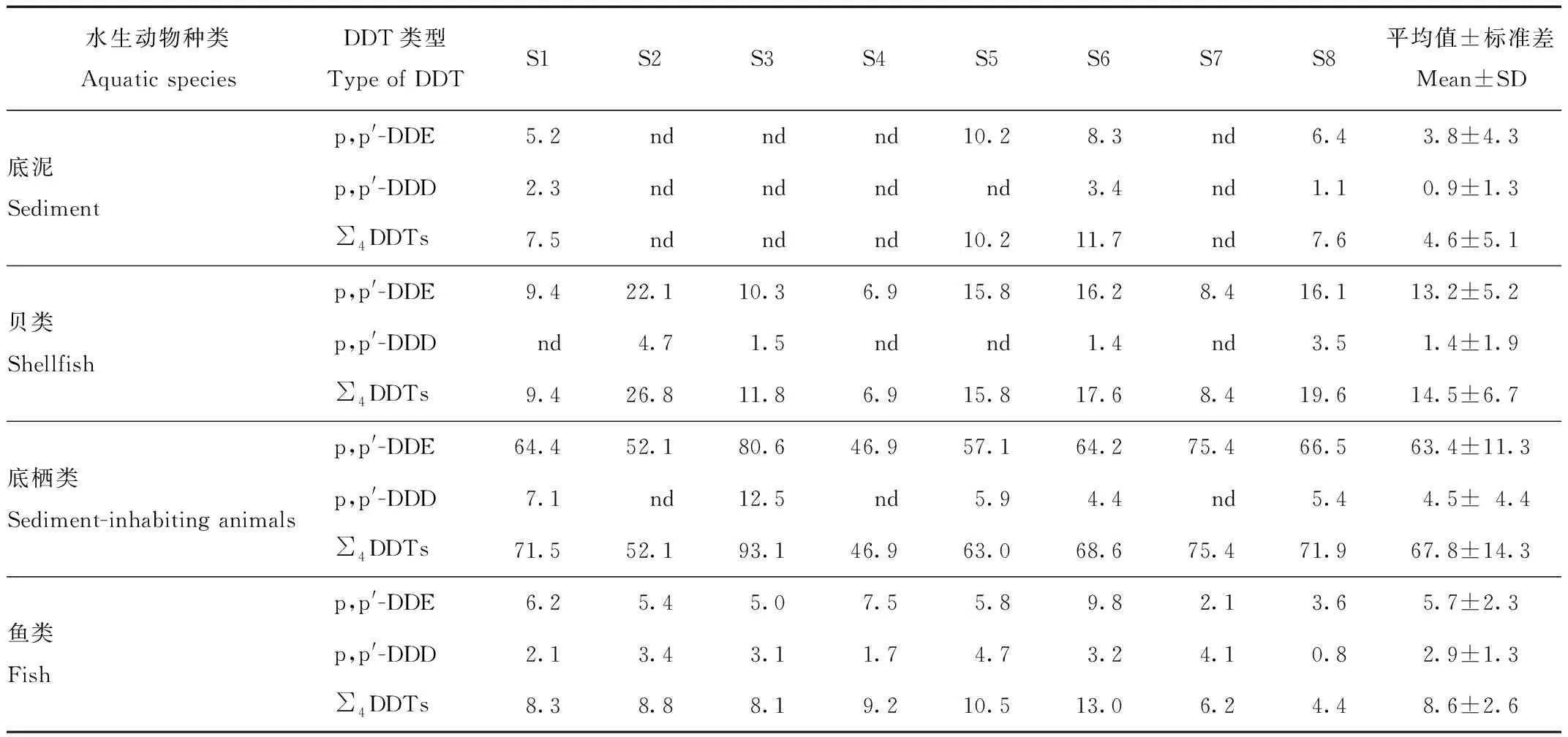
表3 2021年扎龙湿地环境底泥和水生动物样本残留的DDTs质量分数(n=3)

图2 2006年与2021年底泥、水生动物和丹顶鹤弃卵中DDTs残留量Fig.2 Change in DDTs residues in the sediment,aquatic species and eggs left by crane between 2006 and 2021 注:图中红色虚线代表水生动物允许最高范围(500 ng/g,GB 2763—2021),*代表同组数据不同时间存在显著差异(P<0.01) Note:Red dash line represents the maximal allowance in aquatic species (500 ng/g,GB 2763—2021),and “*”for significant difference between the datum in the same group (P<0.01)
3.4 丹顶鹤卵壳形态特征的变化
表4显示,丹顶鹤卵的周长为20.1~22.2 cm,年际间的差异较小(F=0.84,P=0.391)。2020和2021年采集到丹顶鹤弃卵的重量为185~229 g,重量的年际和年内差异都未达到显著性水平(F=0.08,P=0.792)。丹顶鹤卵壳的厚度表现出较大的波动特征。采集的卵壳样本最薄的(605 μm,2009年S5)与最厚的(730 μm,2014年S2)相差125 μm。另外,丹顶鹤的卵壳厚度年际变化也较大,从平均厚度最小的610 μm (2009年)到平均厚度最大的696 μm (2020年),波动范围达到86 μm。
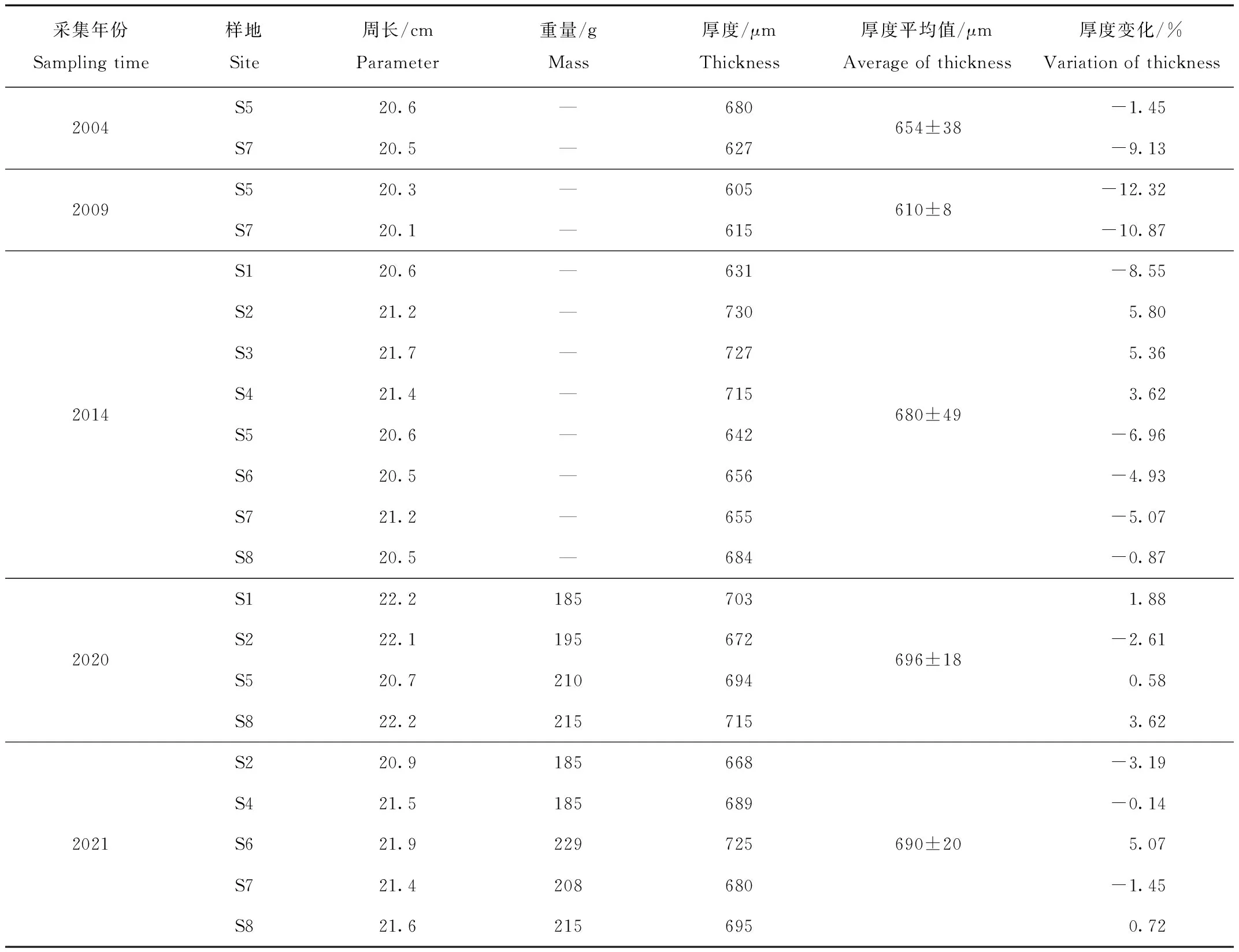
表4 丹顶鹤卵的周长和卵壳厚度的年度差异
对比可知,2004年和2009年丹顶鹤的卵壳厚度明显低于2021年的平均值(690 μm),其中2009年的卵壳厚度分别小12.32%和10.87%,2014年以后卵壳的变化幅度逐渐减小,如2014年S1样地的卵壳厚度小于2021年平均值的8.55%,S2样地的卵壳厚度则大于2021年平均值的5.80%,其余样地的卵壳厚度与2021年卵壳平均值相比变化范围小于7.0%;2020年的卵壳厚度基本接近2021年的平均厚度。显著性检验发现,2004年和2009年的卵壳厚度显著小于2020和2021年的卵壳厚度(F=6.90,P=0.018),考虑到2004年和2009年采集的样本数量较少,因此所得结论尚需进一步验证。
4 结论与讨论
本研究对近年来扎龙湿地繁殖的丹顶鹤卵壳以及羽毛中有机氯农药DDTs的残留浓度的变化进行研究,在此基础上探讨了湿地环境残留的DDTs对丹顶鹤物种带来的潜在风险。本研究发现丹顶鹤卵壳及其羽毛中残留的DDTs浓度随着时间的推移逐渐降低的变化特征,这与我国使用DDT农药的历史以及近年来对其管控的政策相关。2009年以来,各种有机氯农药以及相关工业产品被全面禁止使用,杜绝了DDTs再向环境中扩散和富集。环境中残留的DDTs随着时间流逝逐渐降解,残留浓度也会逐渐降低[8]。本研究2021年湿地环境中以及水生动物组织中检测到DDTs残留水平表现出显著降低的特征恰好证实了上述原因。
本研究发现丹顶鹤的卵组织比卵壳更容易富集有机氯农药DDTs,与这种有机污染的性质密切相关。Bouwman等[13]研究表明,DDTs是一种亲脂类污染物质,鸟的卵组织具有较高的脂类物质,比较容易富集DDTs。由于2020年以后扎龙湿地环境和水生生物中仍然检测到一定浓度的DDTs残留,可能通过觅食途径进入丹顶鹤体内并排到卵组织中,这也就解释了2020年以后丹顶鹤的卵组织中仍然检测到一定浓度的DDTs的原因。由于鸟类的卵组织富集过高的DDTs可能导致鸟类产的卵壳变薄,甚至降低鸟类的繁殖成功率[2,6]。相关学者对大型猛禽的卵组织中残留的DDTs的生态风险阈值进行了研究,草原猎鹰(Falcomexicanus)的卵组织中残留的DDTs超过3 100 ng/g(湿重)时将导致其卵壳变薄10%[15];褐鹈鹕(Pelecanusoccidentalis)的卵组织残留DDTs风险阈值为3 000 ng/g(湿重),如果达到4 000 ng/g将直接导致其繁殖失败[16]。本研究2020年以前未采集到丹顶鹤的弃卵,对于2020年以前丹顶鹤卵组织残留的DDTs水平以及可能带来的影响尚不清楚。根据2020和2021年丹顶鹤卵组织DDTs残留的水平来看,质量分数在nd~23.2 ng/g(湿重),远远低于上述引起鸟类卵壳显著变薄或者繁殖失败的临界浓度。因此,近年来扎龙湿地环境残留的DDTs对此地栖息和繁殖的丹顶鹤风险较低,不足以直接造成丹顶鹤卵壳变薄,也不太可能降低丹顶鹤的繁殖成功率。
鸟类卵壳的厚度变薄可能影响其繁殖成功率[2,6]。在我国完全禁止使用DDT农药之前(如2004年和2009年),湿地环境残留相对较高的DDTs,丹顶鹤卵壳中检测到一定浓度的DDTs残留,同期羽毛中也有较高浓度的DDTs残留,并且这期间丹顶鹤孵化后残留卵壳的厚度偏薄;在我国完全禁止使用DDTs后(2020年和2021年),丹顶鹤的卵壳中几乎未检测到DDTs,同期丹顶鹤卵壳的厚度也增加且接近平均厚度。这种变化特征在一定程度上证实环境中残留的DDTs可能对丹顶鹤的卵壳性质有一定的影响,但是前期搜集的卵壳样本数量较少,尚不能确定2009年以前扎龙湿地丹顶鹤卵壳出现了显著变薄的变化与DDTs有关,另外,有研究表明同一种鸟类取食种类不同也可能造成卵壳厚度不同[17],因此本研究提出的科学假设尚需进一步研究证实。
本研究发现丹顶鹤的羽毛中具有较高的DDTs残留,说明丹顶鹤能够在羽毛形成时期把体内富集的有害物质排泄到羽毛中,以此降低体内有害物的残留水平[8]。有学者发现大型猛禽,如欧亚鵟(Buteobuteo)、长耳鸮(Asiootus)和雀鹰(Accipiternisus)羽毛中残留的DDTs水平和其体内肌肉和肝脏组织富集的DDTs水平显著相关(P<0.05),建议用羽毛中残留的DDTs浓度指示这些大型猛禽受到的生态风险程度[8,18]。因此,通过其羽毛中残留的DDTs浓度指示鸟类体内组织的富集水平具有一定的可行性。这对于研究丹顶鹤等珍稀物种受环境污染物的生态风险的科学问题具有重要意义。然而,丹顶鹤是国际易危珍稀物种,难以直接对其体内器官组织富集的DDTs进行检测,建立体内器官组织与羽毛的DDTs的残留水平关系尚存在一定困难。另外,使用鸟类羽毛残留指示其环境质量还需要考虑到羽毛形成时期所在地的环境特征。由于丹顶鹤在每年3月底从南方迁徙而来,其脱落的羽毛往往是在越冬地形成的,检测到羽毛中的DDTs也可能来自越冬地或者中途停歇地。因此,并不能确定丹顶鹤羽毛中残留的DDTs是完全来自繁殖地(扎龙湿地)。本研究发现,2014年以前部分丹顶鹤羽毛中残留较高质量分数的DDTs(>900 ng/g),高于同期常见大型猛禽羽毛残留量,而2020年和2021年的羽毛残留量则和近年来常见大型猛禽羽毛残留量相似[8,18]。近年来丹顶鹤羽毛中残留的DDTs水平显著降低,反映了丹顶鹤栖息地(包括繁殖地和越冬地)环境中残留的这种物质的浓度已经呈显著降低的变化特征,同时也指示了丹顶鹤物种受到DDTs的生态风险显著降低,但是这并不意味着可以忽视环境中残留的DDTs的影响。根据最近的研究,如果牛背鹭(Bubulcusibis)长期富集较低浓度的DDTs,也可能对其繁殖成功率产生影响[19]。本研究在目前的湿地环境中、丹顶鹤的常见食物以及丹顶鹤的卵组织和羽毛中检测到一定浓度的DDTs残留,应该引起包括丹顶鹤繁殖地、越冬地和迁徙中途停歇地的相关管理者的重视。
本研究丹顶鹤羽毛中DDTs残留浓度与丹顶鹤体内富集浓度的关系缺少进一步分析,且缺少2006—2020年湿地环境以及水生动物残留浓度的数据,对环境以及食物残留与羽毛和卵壳残留浓度变化过程的关系分析论证不够充分,有待进一步研究。

