单核细胞与类风湿关节炎①
陶梦情 胡英豪 王丹丹 左 坚(皖南医学院弋矶山医院中医科,芜湖 241000)
类风湿关节炎(rheumatoid arthritis,RA)是最为常见的自身免疫性疾病,全球总发病率高达1%,患者群体规模庞大[1-2]。RA以关节滑膜炎为主要病理特征。正常条件下,滑膜腔是一个润滑的无菌空间,细胞分布稀少,主要由滑膜组织内迁的巨噬细胞构成。RA条件下,滑膜组织增生肥大,且伴随大量炎症细胞浸润;聚集的免疫细胞通过促进滑膜成纤维细胞增殖与破骨细胞激活直接参与滑膜炎发展进程[3-4]。异常高表达的自身抗原被自身反应性抗原递呈细胞(antigen presenting cell,APC)识别(主要指固有免疫成员,包括单核-巨噬细胞,树突状细胞等),启动适应性免疫应答,激活CD4+T细胞增殖与分化,加速IL-17和IFN-γ等细胞因子分泌[5];Th1和Th17细胞依赖旁分泌途径一方面刺激固有免疫系统合成促炎细胞因子,另一方面诱导B细胞向浆细胞分化,上调自身抗体合成率。随后,自身抗体-抗原免疫复合物作用于特定免疫细胞表面的Fcγ受体,进一步放大单核-巨噬细胞的促炎功能[6]。上述促炎免疫环境中,血管内皮细胞、软骨细胞、破骨细胞功能明显改变,为血管新生、软骨损伤、破骨增强等病理反应发生创造了条件。
根据经典理论模型,CD4+T细胞具有广泛的病理活性,主导RA整体疾病进程,在相关研究中备受关注,而以单核-巨噬细胞为代表的固有免疫系统被长期忽视。关节定植巨噬细胞的促炎及组织破坏功能得以较好地阐明,而单核细胞有关研究略显不足。但单核细胞在RA发生、发展中同样发挥关键作用(图1):具备良好分化潜能,是树突状细胞、巨噬细胞、破骨细胞等RA病理效应细胞的重要前体来源;具备强大外分泌功能,其典型产物包括细胞因子、趋化因子、生长因子、基质金属蛋白酶等,从而有效调控炎症与骨代谢[7-9];可作为APC激活T细胞。因此,充分阐明RA条件下单核细胞的激活因素及调控方式,有利于加深RA病理机制理解,开发创新性RA靶向治疗方案。
1 单核细胞概况
人体中单核细胞占外周白细胞的3%~8%,是体积最大的细胞。单核细胞主要来源于CD34阳性造血干细胞(hematopoietic stem cell,HSC),在胎儿肝脏和成年人骨髓中,受多种集落刺激因子刺激,以集落刺激因子-1受体(colony-stimulating factor-1 receptor,CSF1R)依赖性方式首先分化为粒细胞-单核细胞前体或单核-树突状细胞前体,这些前体细胞继续增殖并分化为原始单核细胞进入血液,主要表达CD117、CD34、CD33、HLA-DR(MHCⅡ表面受体),CD13呈 弱 表 达[10];分 化 为 幼 稚 阶 段 时,CD33、CD13、HLA-DR表达逐渐增强,同时开始表达CD64、CD11c、CD11b;进入成熟阶段后,CD14、CD15等标志物开始表达[11]。血液中的单核细胞在骨髓和组织间迁移,并在组织内转变为成熟巨噬细胞,循环周期为1~5 d(图1)。
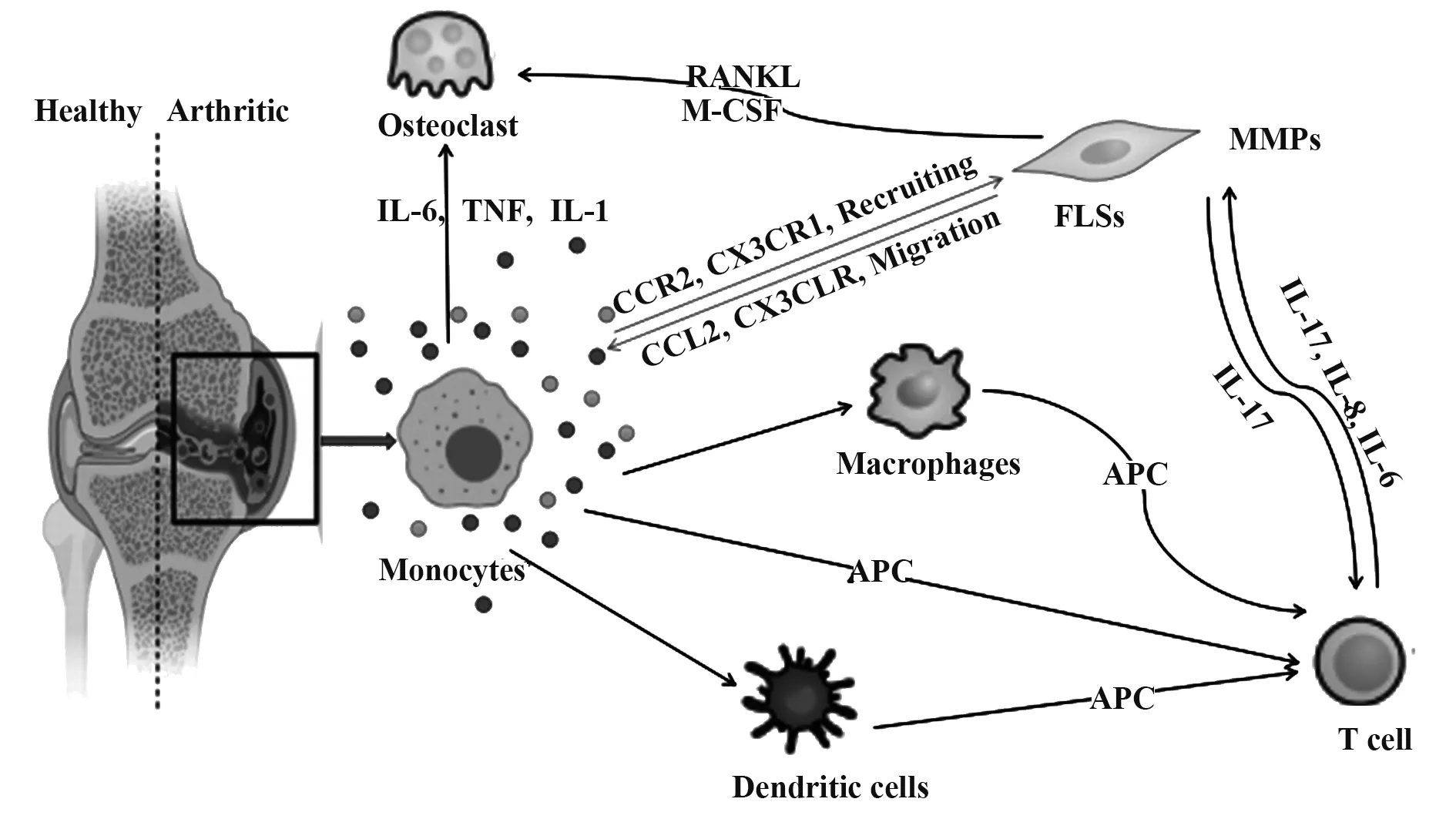
图1 单核细胞对RA的推动作用示意图Fig.1 Schematic diagram of promoting effect of monocytes on RA
单核细胞在功能表型和表观遗传学上均具有高度可塑性。静息状态下,单核细胞通过高内皮小静脉从血液进入淋巴结,或通过传入淋巴管从组织进入淋巴结。非淋巴组织中的单核细胞在正常生理条件下一般具有3个去向:①维持其自身特性并最终凋亡;②CCR7表达上调,迁移至淋巴结;③在组织巨噬细胞生态位有空位的环境下分化为巨噬细胞。炎症环境中,单核细胞向组织和淋巴结中大量浸润,在微生物病原体存在下优先分化为分泌TNF-α和iNOS的促炎树突状细胞或组织驻留巨噬细胞[12]。
以人类为例,单核细胞可根据脂多糖(lipopolysaccharide,LPS)辅助受体CD14和清道夫受体CD16(FcγRⅢ)分布状态分为3个亚类:CD14++CD16-经典型(classical monocytes,CMs)、CD14+CD16+中间型(intermediate monocytes,IMs)、CD14-CD16++非经典型(non-classical monocytes,NCMs)。CMs占健康人外周血单核细胞的90%,可迅速被招募至炎症部位,发挥吞噬作用,但无典型炎症特征,高表达CCR2[13-14];NCMs通常被称为巡逻单核细胞,在激活后可表现抗原呈递及“炎症”特征,低表达CCR2,高表达CX3CR1;IMs是兼具吞噬和炎症功能的过渡性单核细胞,表达CCR2和CX3CR1,同时高表达HLADR、CD163及CCR5等[15]。根据趋化因子受体构成差异,其他动物来源单核细胞也可类似地分为经典与非经典两种亚型。但由于表面标志物种属特异性,其流式表型判定标准有别于人类。小鼠中,经典型和非经典型单核细胞分别表征为Ly6Chi和Ly6Clow[16];大鼠中,两者分别对应CD172a+CD43-和CD172a+CD43+细胞亚群(表1)[17]。值得注意的是,不同于人类,多数研究表明鼠类CMs而非NCMs具有典型促炎功能[16-17]。但该结论仍存在争议,因为上述动物来源NCMs同样具备向M1型巨噬细胞分化的潜能。进一步表明单核细胞具有高度可塑性,其病理生理功能复杂。
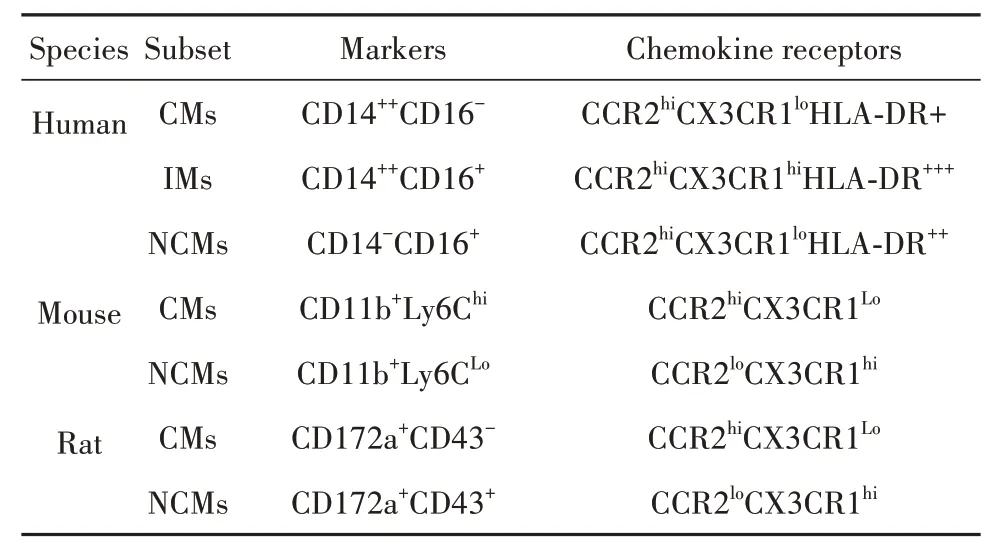
表1 单核细胞在人类及鼠类动物的分群Tab.1 Subsets of monocytes in humans and murines
2 单核细胞推动RA进展
与健康人群相比,RA患者外周血CMs比例降低,而CD16+单核细胞亚群增加(含NCMs及IMs),且该类细胞占比与疾病活动度呈正相关[18-20]。同时,单核细胞的其他相关表面标志物构成也发生较大改变。相比于健康人群,RA早期患者体内单核细胞,尤其是NCMs表面CD11c表达增加[21]。相似地,CD11b表达也得以上调,且这一现象与RA关联性受体CCR2和CX3CR1表达改变同步发生。考虑到上述趋化因子受体与单核细胞向炎症性巨噬细胞和破骨细胞定向分化密切相关,CD11b在RA患者中的异常高表达可视为RA特异性单核细胞的重要鉴定依据及疾病发展阶段的辅助诊断指标[22]。与此对应,有效的抗风湿治疗对单核细胞亚群分布具有恢复性调控作用。如经甲氨蝶呤(methotrexate,MTX)治疗后,随着C-反应蛋白水平及其他炎症指标下调,RA患者外周血IMs减少,而CMs增多[19]。
如上所述,病理条件下CD16+单核细胞具有独特的受体表达谱,对RA发展具有推动作用。究其原因,从宏观层面而言,由于STAT1通路下调,RA来源单核细胞大量分泌TNF-α[23]。TNF-α具有强大的促炎免疫活性,其过度合成是RA患者体内细胞因子网络紊乱的主要特征,与疾病进展直接相关;靶向阻断TNF-α已被证明是RA治疗的有效手段。RA患者单核细胞来源TNF-α表达不仅通过其自身下游受体途径直接诱发病理性炎症反应,同时可基于旁分泌途径促进其自身甚至其他免疫细胞分泌IL-1、IL-17等多种RA关键细胞因子,诱导T细胞异常分化[24]。
有研究进一步从亚器官角度初步阐明了上述细胞的病理功能,RA患者单核细胞周转率提高,在血液循环时间减少,具有显著关节聚集倾向[25]。这种现象与RA关节免疫环境及单核细胞受体表达谱特征有关:缺氧微环境中滑膜细胞高表达基质细胞衍生因子SDF-1,大量招募CXCR4+单核细胞,并在局部分化为巨噬细胞[26]。导致RA患者滑膜中以CD16+亚群为主的单核细胞数几乎是外周血的4倍[21]。上述聚集现象与内皮细胞黏附分子表达增加也密切相关。定植于滑膜的单核细胞继而有效改变局部免疫环境。首先,单核-巨噬细胞为B细胞长期存活提供环境,促进其产生RA诊断标志物抗环瓜氨酸抗体(anti-citrullinated protein antibodies,ACPA)[27]。ACCP阳性患者炎症/抗炎单核细胞升高,分泌更多炎症因子;而加剧的免疫紊乱又促进CD14+单核细胞分化为破骨细胞[28-29]。这一反馈机制表明单核细胞是RA关节免疫稳态破坏及骨损伤的重要推手。另一方面,IMs在滑膜中占主导地位,表达较多的HLA-DR和CD80/CD86,为CD4+T细胞激活提供第一和第二信号[24,30-31];并分泌更多的TNF-α、IL-6和IL-1β促进IL-17分化[32-33]。T细胞激活引发的炎症因子外溢又直接反馈性作用于单核细胞,并促进CD16与IgG免疫复合物生成,推动其向破骨细胞分化[34]。
3 RA单核细胞分化异常调控
3.1 经典免疫信号因素Toll样受体(Toll-like receptors,TLRs)是固有免疫细胞特征性模式识别受体,也是单核细胞主要的功能性免疫分子,通过识别宿主的细胞碎片和微生物成分激活防御性促炎免疫应答。单核细胞的TLRs相关信号异常直接驱动RA患者关节病理反应发展。作为这一结论的直接证据,RA患者外周血中CD14+单核细胞高表达多种类型的TLRs,包括TLR2、TLR5、TLR7和TLR9等;而TLR5/7 mRNA表达与RA关节炎评分DAS28直接相关[35-36]。功能方面,TLR1/2/5/9激活可促进CMs等各型单核细胞分泌IL-6和TNF-α[37];TLR5/7上调可导致CD14+细胞分化为破骨细胞[38-39]。该类受体的信号介导功能是上述病理反应的重要基础。大部分TLRs结合配体后通过MyD88依赖性方式激活下游促炎通路,主要包括核因子-κB(nuclear factor kappa-B,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,进而诱导单核细胞来源TNF-α和IL-6等促炎细胞因子分泌,促进RA进展[40]。
3.2 表观遗传因素 表观遗传因素是不容忽视的RA诱发因素。以甲基化为例,RODRÍGUEZ-UBREVA等[41]发现活动期RA患者病情与循环单核细胞DNA总体甲基化水平密切相关;而炎症性关节炎来源单核细胞DNA甲基化谱变化较正常人群更为显著[42]。MOK等[43]进一步发现单核细胞内CYP2E1启动子低甲基化是RA活动度的独立预测因素;而CCL2启动子区H3K4、H3K27、H3K36和H3K79的三甲基化亦可推动RA进展[44]。非编码RNA是DNA修饰外的另一重要表观遗传调控因素。RA患者中可见单核细 胞 内lncRNA NTT/PBOV1轴 异 常 上 调[45]。lnc-RNA NTT是单核细胞炎症的调节因子;而PBOV1在THP-1细胞中过表达可导致单核细胞G1期阻滞,分化为巨噬细胞[46]。两者协同促进了RA单核细胞向促炎细胞类型分化成熟。相比于以上领域的有限认知,miRNAs在RA中的病理意义研究较为深刻,下面进行重点探讨。
RA患者外周血和滑膜中CD14+单核细胞高表达miR-155,且与疾病活动度相关[47]。现有证据表明,miR-155可通过调节单核细胞极化、凋亡与分泌等功能在RA中发挥重要作用[47-50]。涉及的核心机制在于miR-155可选择性结合细胞因子信号传导抑制因子1(suppressor of cytokine signaling 1,SOCS1)的3'UTR区域,通过抑制其转录水平间接促进促炎细胞因子分泌[48-49]。miR-33和miR-125a-5p也被证明与RA进展有关。RA单核细胞中miR-33可能通过抑制线粒体耗氧率和诱导胞内ROS积累刺激NLRP3炎症小体信号[51]。miR-125a-5p异常高表达主要发现于幼年RA患者[52]。虽然其直接病理意义尚未阐明,但已明确这一现象与TLRs/NF-κB兴奋有关,而IL-4刺激则抑制其表达[53-54]。因此,miR-125a-5p总体有利于单核-巨噬细胞促炎表型形成。miR-129-3p和miR-518a-5p对单核细胞迁移等病理生理功能也表现出促进作用[55-56]。
另一方面,miR-146a等对RA可能存在保护作用。miR-146a是TLRs信号通路主要的负调控因子;IMs和NCMs等单核细胞可能代偿性上调miR-146a表达,抑 制TRAF6和IRAK1表 达,进而 抑制TLRs/NF-κB活化,通过负反馈机制限制炎症过度发展[57]。因此,胶原诱导关节炎(collagen-induced arthritis,CIA)小鼠中Ly6Chi单核细胞过表达miR-146a可缓解骨损伤[58]。但miR-146a-5p在银屑病关节炎患者外周血CD14+单核细胞中的表达可诱导破骨细胞活化、骨吸收[59]。表明其病理生理功能仍需进一步研究。临床样本分析发现,ACPA阳性RA患者单核细胞出现miR-let7a特异性表达降低[60-61]。miRlet7a可有效抑制IL-1、IL-6表达,导致RA患者炎症反应持续发展[61]。
3.3 能量代谢因素 能量代谢对免疫细胞分化、成熟甚至功能发挥关键作用。RA活动期患者CD14+单核细胞耗氧量及线粒体代谢水平偏高。SHIRAI等[62]发现,慢性炎症中致病性单核细胞和巨噬细胞葡萄糖过度利用,并共享代谢线路。针对性机制研究发现,RA来源单核-巨噬细胞中糖原合成激 酶-3β(glycogen synthase kinase 3β,GSK-3β)失活,线粒体电子传递链活性增强,氧化磷酸化强化,ATP及ROS生成增加[63]。糖代谢状态改变诱发或伴随显著免疫学功能变化。一方面,LPS等促炎因素刺激将磷酸化单核细胞内mTOR,继而诱发同步的葡萄糖摄取/酵解上调及以CD11b+为特征的炎症表型获得[64]。RA背景下,mTOR激活可能与氨基酸转运蛋白SLC7A5控制的亮氨酸内流有关。RA患者单核细胞中,SLC7A5表达显著升高,糖酵解代谢随之上调;阻断SLC7A5将导致mTOR信号抑制,IL-1β产率降低[65]。另一方面,葡萄糖过度利用将导致ROS蓄积,从而促进胞质中丙酮酸激酶M2(pyruvate kinase M2,PKM2)二聚化及入核转移。后者作为蛋白激酶直接激活核转录因子STAT3,促进IL-6和IL-1β等转录表达;同时通过干预HIF-1α信号诱导IL-1β生成[66]。除糖代谢外,脂代谢模式也发生了同步改变。受缺氧环境中滑膜细胞诱导,RA患者关节处单核细胞中肉碱代谢物增加,促进CCL20释放,单核细胞向破骨细胞分化的潜能及对Th17细胞的募集能力增强[67]。此外,关节炎模型小鼠单核细胞胆固醇外排基因Abca1、Apoe表达下调,对干细胞分化和髓外髓细胞生成发育与增殖具有深远影响[68]。
4 靶向单核细胞的RA治疗
4.1 细胞因子阻断 促炎细胞因子是RA发生发展的核心驱动因素。其中大量关键细胞因子如IL-1、IL-6、TNF-α的主要来源包括炎症单核细胞,而另一些细胞因子则可干预单核细胞分化和功能,从而影响后者免疫功能。因此,多种经典RA治疗药物具有单核细胞分泌干预活性。如MTX可有效抑制RA患者单核细胞中细胞因子产生及膜受体表达,首诊患者外周血单核细胞总数、CMs、IMs偏高,对MTX的治疗敏感性相对较低[69]。如青风藤碱已被证明可降低RA患者外周IMs比例,减少炎症细胞因子如粒细胞巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)、TNF-α、IL-1β、CXCL1、巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)等合成,进而缓解单核-巨噬细胞主导的局部炎症与组织破坏[70]。
上述现象对靶向制剂开发极具启发。已明确在TNF-α等刺激下,CD11b+单核细胞更易分化为破骨细胞,且促炎免疫能力增强。与这一结论对应,TNF抑制剂(tumor necrosis factor inhibitors,TNFi)可使循环中CMs亚群显著减少,并通过下调其表面CXCR4、CCR2表达抑制其免疫活性[71];单核细胞干预可进一步实现Treg分化增强及破骨细胞功能抑制[72]。此外,TNFi还可诱导幼稚单核细胞向NCMs分化成熟,避免高致病性IMs过度增加;下调NCMs中CD11b表达,增加其穿越内皮的难度,导致炎症部位单核细胞浸润减少[73];此外,作用于跨模型TNF-α可进一步强化对单核细胞炎症免疫功能的影响,并诱导其凋亡[74]。
其他单核细胞相关细胞因子的选择性阻断表现出类似治疗潜力。靶向IL-6阻断可诱导单核细胞凋亡,从而间接促进Treg分化,提高其分布比例。GM-CSF可刺激单核细胞表达HLA-DR和CD86,合成TNF-α和IL-1β,从而具备启动适应性免疫的能力;GM-CSF信号阻断原理上可逆转上述过程,同时可刺激单核细胞分泌趋化因子CXCL-11,间接抑制T细胞增殖[75]。M-CSF也可通过影响单核细胞分化干预RA进程;基于两例活动期RA患者的临床试验表明,M-CSF拮抗抗体可降低外周血IMs和NCMs分布比例,改善临床症状[76]。
4.2 表面抗原拮抗 单核细胞表面标志物CD11b在髓系细胞分化的过程中发挥重要作用。RA患者体内CD11b表达显著高于健康对照组;糖皮质激素有效治疗后其表达趋于下降[77]。这一现象初步提示CD11b可能是RA的治疗靶点。抗CD11b单克隆抗体可减少CIA小鼠体内单核细胞分布,抑制关节炎症部位对单核细胞的招募,及相关破骨细胞分化。雷帕霉素通过作用于其受体mTOR能够调控前体单核细胞内STAT5-IRF8信号通路,从而下调表面CD115表达。鉴于CD115可驱动单核细胞分化为巨噬细胞或破骨细胞,上述变化最终将有效缓解RA滑膜炎症和关节破坏[78]。
4.3 信号通路调控Janus激酶(Janus kinase,JAK)作为重要的酪氨酸激酶,衔接了诸多细胞因子受体与下游信号转导通路;同时JAK-STAT途径又参与了细胞因子合成过程,被确定为RA炎症性病变的关键信号传导途径之一。Peficitinib与Baricitinib可通过抑制滑膜成纤维样滑膜细胞JAK-STAT通路,抑制多种促炎细胞因子分泌,阻断单核细胞向炎症部位趋化及后续炎症分化过程[79-80]。FcγR通过胞内免疫受体酪氨酸活化基序激活酪氨酸激酶,启动后续磷酸偶联级联反应,激活单核-巨噬细胞免疫功能;布鲁顿酪氨酸激酶(Bruton's tyrosine kinase,BTK)通过结合FcγR介导免疫复合物免疫调控活性。此外,BTK还参与单核细胞来源破骨细胞分化过程,其选择性抑制剂HM71224可有效抑制BTK介导的单核细胞激活,并抑制破骨细胞主导的骨结构破坏,有效治疗实验性小鼠关节炎[81]。已批准和正在开发的作用于单核细胞的RA治疗药物见表2。

表2 已批准和正在开发的作用于单核细胞的RA治疗药物Tab.2 Drugs approved and under development applies to monocytes for RA treatment
5 展望
现有常规RA治疗药物虽能缓解症状,但无法遏制疾病进程,且毒副作用明显。近年兴起的生物疗法作用机制和靶点明确,短期临床效果显著,但存在安全风险。因此阐明RA发生发展过程不同阶段免疫细胞的动态变化具有重要意义。识别主导RA单核细胞病理变化的分子机制,有利于开发RA精准治疗新方案。早期诊断和适当治疗可迅速控制RA进展,显著改善肢体功能和关节结构。本课题组近期研究发现,烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyltransferase,NAMPT)介导的单核细胞炎症极化对早期RA发展具有关键推动作用。考虑到NAMPT作为炎症表型单核-巨噬细胞共有的特征性糖代谢重编程核心操控因素,及其靶向抑制对RA的显著治疗潜力,这一发现表明代谢水平调控亦可能是实现单核细胞靶向治疗的策略[82-83]。

