钙周期素结合蛋白对乳癌新辅助化疗效果的预测价值
崔茹婷 吕志栋 姚瑶 张蔚然 孔滨
[摘要] 目的 探討乳癌病人钙周期素结合蛋白(CacyBP/SIP)的表达及其与新辅助化疗效果和生存预后的关系。
方法 回顾性选取2015年1月—2016年6月于青岛大学附属医院行新辅助化疗的乳癌病人70例,采用EnVision免疫组化法检测新辅助化疗前穿刺确诊标本CacyBP/SIP的表达,结合重要的临床病理学参数,统计分析CacyBP/SIP与新辅助化疗效果和预后的关系。
结果 CacyBP/SIP在组织学分级高、有淋巴结转移、临床分期晚、人类表皮生长因子受体-2(HER-2)阳性的乳癌组织中高表达(χ=4.444~6.806,P<0.05)。二元Logistic回归分析结果显示,雌激素受体(ER)阴性(OR=0.132,95%CI=0.028~0.789,P=0.025)、HER-2阳性(OR=5.210,95%CI=1.685~27.135,P=0.004)、CacyBP/SIP低表达(OR=0.169,95%CI=0.033~0.859,P=0.039)与病人更好的新辅助化疗效果相关。Kaplan-Meier法分析显示,CacyBP/SIP低表达组病人5年无病生存率明显高于高表达组(Log-rank χ=4.598,P=0.032)。多因素COX回归分析显示,客观缓解(HR=0.151,95%CI=0.042~0.451,P=0.004)是乳癌预后的独立保护因子,而CacyBP/SIP不是乳癌新辅助化疗的独立预后因子。
结论 CacyBP/SIP异常上调与乳癌恶性进展关系密切,可作为新辅助化疗后病理完全缓解的独立预测指标。
[关键词] 乳房肿瘤;S100蛋白质类;放化疗,辅助;治疗结果;预后
[中图分类号] R737.9
[文献标志码] A
[文章编号] 2096-5532(2022)05-0714-06doi:10.11712/jms.2096-5532.2022.58.134
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.r.20220713.1055.008.html;2022-07-14 08:56:48
VALUE OF CALCYCLIN-BINDING PROTEIN IN PREDICTING THE EFFICACY OF NEOADJUVANT CHEMOTHERAPY FOR BREAST CANCER
CUI Ruting, LÜ Zhidong, YAO Yao, ZHANG Weiran, KONG Bin
(Diagnosis and Treatment Centre of Breast Diseases, The Affiliated Hospital of Qingdao University, Qingdao 266100, China)
[ABSTRACT] Objective To investigate the expression of calcyclin-binding protein (CacyBP/SIP) in breast cancer patients and its association with neoadjuvant chemotherapy efficacy and survival prognosis.
Methods A retrospective analysis was performed for 70 breast cancer patients who received neoadjuvant chemotherapy in The Affiliated Hospital of Qingdao University from January 2015 to June 2016. EnVision immunohistochemistry was used to measure the expression of CacyBP/SIP in puncture specimens before neoadjuvant chemotherapy, and the association of CacyBP/SIP with chemotherapy efficacy and prognosis was analyzed with reference to important clinicopathological parameters.
Results CacyBP/SIP was highly expressed in breast cancer tissue with a high histological grade, lymph node metastasis, late clinical stage, and positive human epidermal growth factor receptor 2 (HER-2) (χ=4.444-6.806,P<0.05). The binary logistic regression analysis showed that negative estrogen receptor (OR=0.132,95%CI=0.028-0.789,P=0.025), positive HER-2 (OR=5.210,95%CI=1.685-27.135,P=0.004), and low expression of CacyBP/SIP (OR=0.169,95%CI=0.033-0.859,P=0.039) were associated with the better efficacy of neoadjuvant chemothe-rapy. The Kaplan-Meier analysis showed that the patients with low CacyBP/SIP expression had a significantly higher 5-year di-sease-free survival rate than those with high CacyBP/SIP expression (log-rank χ=4. 598,P=0.032). The multivariate COX regression analysis showed that objective response (HR=0.151,95%CI=0.042-0.451,P=0.004) was an independent protective factor for the prognosis of breast cancer, while CacyBP/SIP was not an independent prognostic factor for neoadjuvant chemotherapy for breast cancer.
Conclusion Abnormal upregulation of CacyBP/SIP is closely associated with the malignant progression of breast cancer, and CacyBP/SIP may be used as an independent predictive factor for pathological complete response after neoadjuvant chemotherapy.
[KEY WORDS] breast neoplasms; S100 proteins; chemoradiotherapy, adjuvant; treatment outcome; prognosis
乳癌是女性癌症死亡的首要原因,近年来其发病率逐年上升,已成为威胁全世界女性身心健康的主要疾病。随着规范化及个体化诊疗模式的发展,乳癌病人的预后得到显著改善。研究已表明,对于局部晚期、人类表皮生长因子受体-2(HER-2)阳性以及三阴性乳癌,新辅助化疗可以有效提高手术可行性、降低肿瘤分期和消除微转移癌灶,并通过病理学反应提示肿瘤对化疗方案的敏感性。由于乳癌具有高度异质性,相同分子分型的病人实施同种新辅助化疗方案可以呈现不同的临床结局。寻找有效预测新辅助化疗效果的生物标志物可为制定乳癌个体化治疗方案提供参考,从而避免化疗效果较差和毒副作用带来的治疗延误。钙周期素结合蛋白(CacyBP/SIP)属于S100蛋白家族,它通过多途径调控下游信号通路活性,在肿瘤细胞增殖和凋亡、信号转导、侵袭转移以及多重耐药中发挥关键作用。研究表明,CacyBP/SIP与乳癌恶性进展和不良预后关系密切。本研究旨在评估CacyBP/SIP预测乳癌新辅助化疗效果及生存预后的临床应用价值。 现将结果报告如下。
1 资料与方法
1.1 一般资料
纳入2015年1月—2016年6月期间在青岛大学附属医院乳腺病诊疗中心行新辅助化疗的乳癌病人70例。纳入标准:①女性原发性乳癌病人;②入院前未接受任何放化疗、内分泌治疗等抗肿瘤治疗;③经新辅助化疗前穿刺及术后病理检查确诊为乳癌;④具有完整临床病理资料。排除标准:①孕妇或哺乳期病人;②严重心脑血管疾病及肝肾功能不全;③首诊Ⅳ期乳癌病人;④既往有其他恶性肿瘤病史。纳入70例病人均为女性,平均年龄(48.14±8.60)岁,其中绝经病人31例,初诊即伴淋巴结转移病人54例。參照美国癌症联合委员会(AJCC)癌症分期手册(第8版)对肿瘤进行TNM分期,Ⅱ期44例,Ⅲ期26例。采用蒽环类联合紫杉类药物的新辅助化疗方案治疗,包括TEC方案(多西他赛75 mg/m+表柔比星75 mg/m+环磷酰胺500 mg/m,第1天,21 d为1周期,共4~6周期)、EC-TH含曲妥珠单抗的靶向治疗方案(曲妥珠单抗首剂8 mg/kg,后续6 mg/kg,21 d为1周期,共6~8周期,HER-2阳性病人接受此方案治疗)、ET方案(表柔比星75 mg/m+多西他赛75 mg/m,第1天,21 d为1周期,共4~6周期)。通过定期的乳房超声、X线、MRI对病人肿瘤退缩情况进行评估,对2周期化疗效果不佳的病人及时调整方案或行手术治疗。所有病人结束新辅助化疗后4周内根据个体情况行乳房全切或保乳术。
1.2 CacyBP/SIP检测方法及结果判定
收集乳癌病人石蜡包埋组织并切片(4 μm),采用EnVision免疫组化法检测CacyBP/SIP表达,操作步骤严格按照试剂盒说明执行,以PBS代替一抗作为阴性对照。CacyBP/SIP阳性染色表现为定位于细胞膜及细胞质的棕(黄)色颗粒。免疫组化结果判定参考相关文献采用半定量积分法。由两位病理科医师双盲评估,分别对染色强度及阳性细胞占比进行评分。①染色强度评分:未染色计0分,淡黄色、棕黄色、褐色依次计1、2、3分;②阳性细胞占比评分:阳性细胞数≤25%计1分,26%~50%计2分,51%~75%计3分,≥76%计4分。两项评分乘积≤5分为CacyBP/SIP低表达,>5分为CacyBP/SIP高表达。
1.3 疗效评价
近期临床疗效评价参照实体肿瘤疗效评价标准RECIST 1.1,病灶完全消失且淋巴结转移灶短径缩小至<10 mm为完全缓解(CR),肿瘤最大径总和缩小≥30%为部分缓解(PR),肿瘤最大径增加≥20%(绝对值增加≥5 mm)或增加一个或多个新病灶为疾病进展(PD),介于PD与PR之间为疾病稳定(SD)。客观缓解率(ORR)为CR及PR病人所占比例。新辅助化疗后的病理反应评价参照Miller-Payne(MP)系统,1级:癌细胞总量未减少;2级:癌细胞减少<30%;3级:癌细胞减少介于30%~90%;4级:癌细胞总量减少>90%,仅残存散在或单个癌细胞;5级:原发灶无浸润癌细胞,可存在导管原位癌。病理完全缓解(pCR)是指原发灶及转移的区域淋巴结内均无浸润癌细胞(即MP为5级且无淋巴结浸润)。
1.4 随访情况
通过查询门诊记录或电话随访的形式,对术后病人进行资料收集和随访。收集的资料包括病人基本信息、肿瘤基线特征(临床分期、组织学分级、淋巴结状态、HER-2、Ki-67等)以及治疗信息。其中Ki-67以30%为界,判定≥30%者为Ki-67高表达,<30%者为Ki-67低表达。随访时间定义为自手术至2021年5月31日或病人发生不良事件(例如局部复发或远处转移)的时间。研究终点为无病生存期(DFS),即手术至首次出现局部复发或远处转移的时间。
1.5 统计学方法
采用SPSS 22.0软件进行统计学分析。计数资料以例数和百分数表示,组间比较采用χ检验和Fisher确切概率检验。将单因素分析中P<0.10的因素纳入多因素Logistic回归模型,分析新辅助化疗效果的独立预测指标。应用Graph Pad Prism 8.0软件绘制乳癌病人的生存曲线, Kaplan-Meier方法计算生存率,并采用Log-rank 检验对组间生存率进行比较。采用COX比例风险回归模型对乳癌新辅助化疗预后指标进行多因素分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 CacyBP/SIP表达与新辅助化疗乳癌病人基线特征的关系
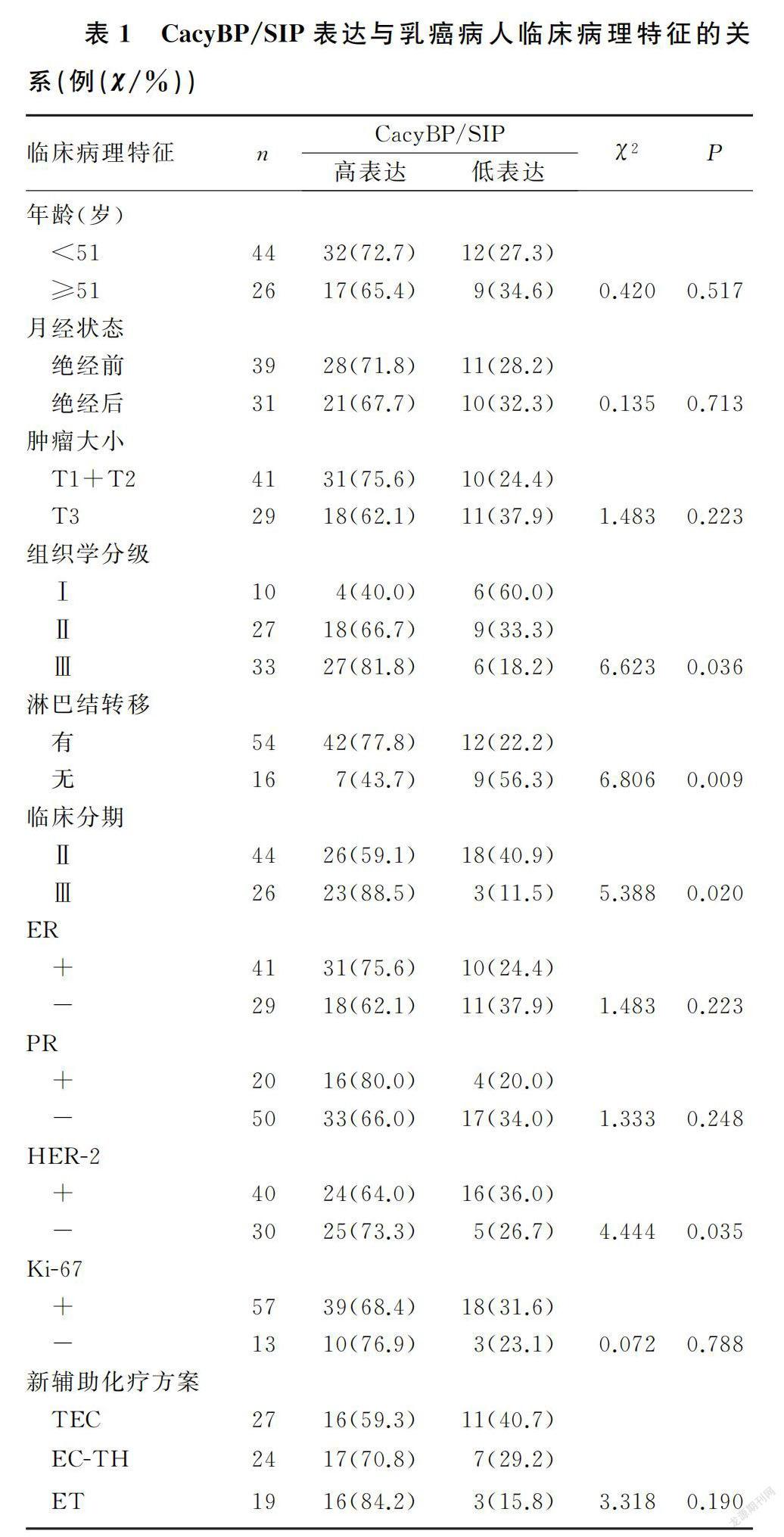
本文70例病人中,新辅助化疗前CacyBP/SIP高表达者49例(70.0%),低表达者21例(30.0%)。CacyBP/SIP在组织学分级高、有淋巴结转移、临床分期晚、HER-2阳性的乳癌组织中表达显著上调,差异有统计学意义(χ=4.444~6.806,P<0.05);而CacyBP/SIP表达与年龄、月经状态、肿瘤大小、新辅助化疗方案以及ER、孕激素受体(PR)、Ki-67状态等均无统计学关联(P>0.05)。见表1。
2.2 新辅助化疗效果
临床疗效评价:本文70例病人中,CR者15例(21.4%),PR者44例(62.9%),SD者7例(10.0%),PD者4例(5.7%),总体ORR为84.3%(59/70),疾病控制率为94.3%(66/70)。病理反应评价:MP分级1级7例(10.0%),2级25例(35.7%),3级21例(30.0%),4级5例(7.1%),5级12例(17.1%),总体pCR率为14.3%(10/70)。CacyBP/SIP高表达病人CR者4例(8.2%),PR者38例(77.6%),SD者6例(12.2%),PD者3例(6.1%),MP 5级3例(6.1%),ORR为85.7%(42/49),pCR率为4.1%(2/49)。
2.3 新辅助化疗效果的影响因素分析
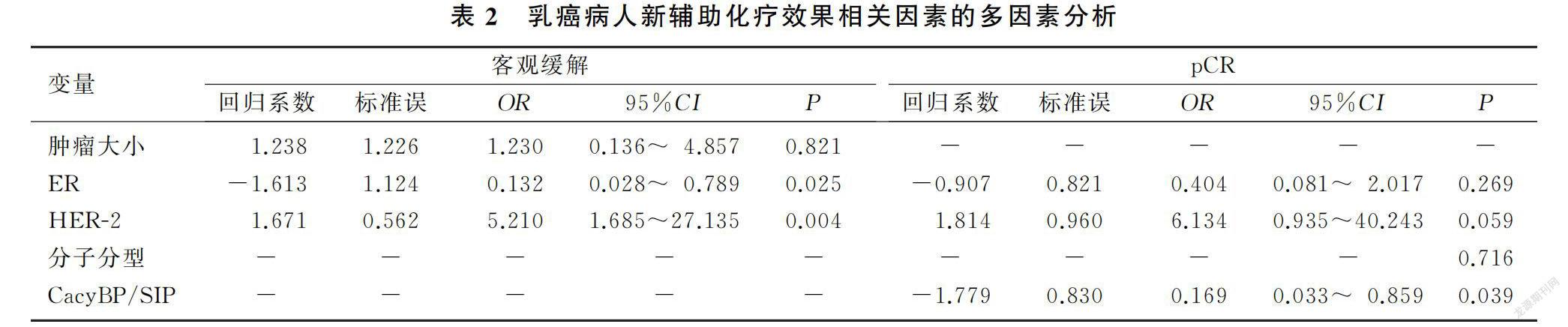
单因素分析显示,乳癌病人的ER(P=0.021)、HER-2(χ=6.312,P=0.012)与新辅助化疗后客观缓解统计学相关,ER(χ=3.925,P=0.048)、HER-2(χ=7.708,P=0.005)、分子分型(χ=8.208,P=0.027)、CacyBP/SIP(χ=8.889,P=0.003)与pCR统计学相关。将单因素分析中P<0.10的因素纳入二元Logistic回归模型进行分析,结果显示ER、HER-2是新辅助化疗后客观缓解的独立预测指标,ER阳性肿瘤获得客观缓解的概率是ER阴性者的0.132倍(OR=0.132,95%CI=0.028~0.789,P=0.025),HER-2阳性肿瘤获得客观缓解概率是阴性者的5.210倍(OR=5.210,95%CI=1.685~27.135,P=0.004);CacyBP/SIP是新辅助化疗后pCR的独立预测因子,CacyBP/SIP高表达乳癌病人新辅助化疗后获得pCR的概率是低表达病人的0.169倍(OR=0.169,95%CI=0.033~0.859,P=0.039)。见表2。
2.4 乳癌新辅助化疗预后的影响因素分析
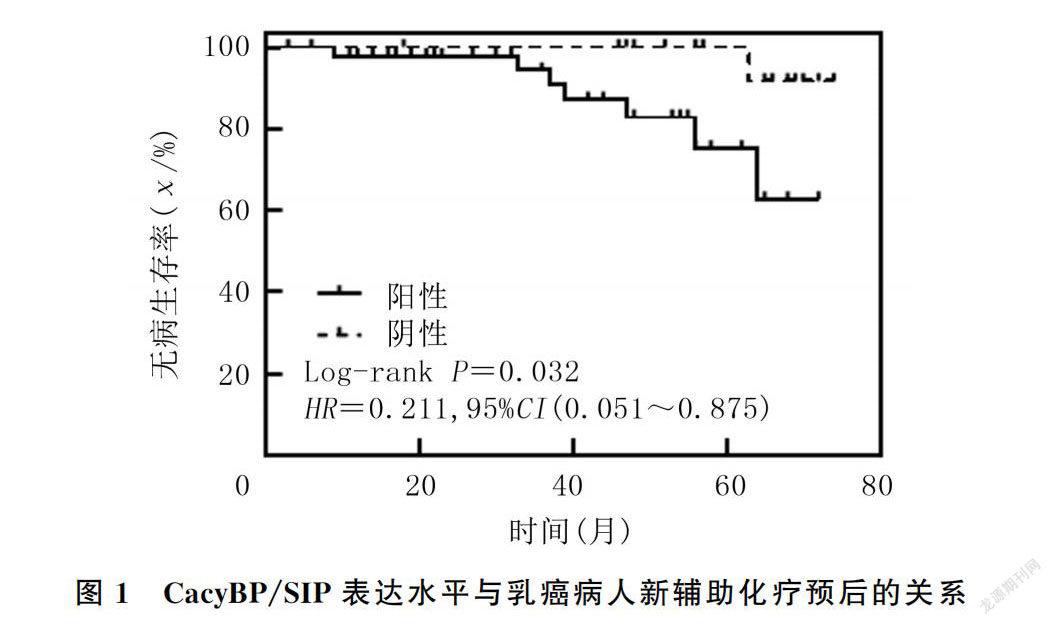
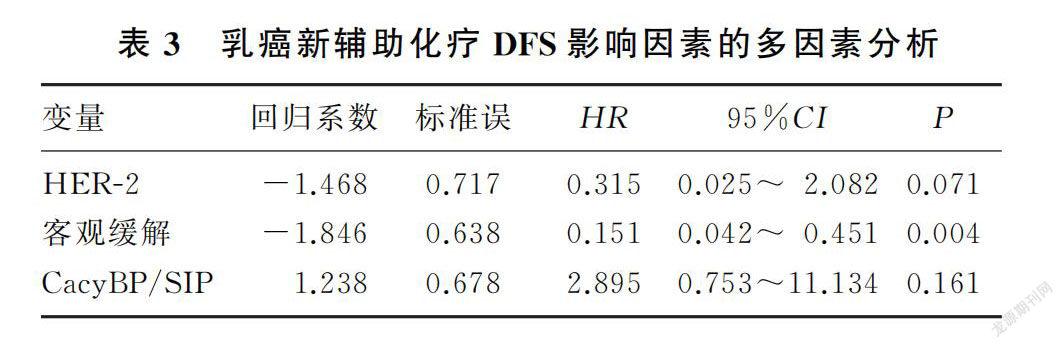
本研究截止日期为2021年5月31日,中位随访时间为53个月,70例乳癌病人中有8例出现复发转移(转移灶来源均经病理穿刺结果证实),其中6例病人胸壁复发,1例病人肺转移,1例病人肝转移,5年总体无病生存率为88.57%。绘制的乳癌新辅助化疗病人Kaplan-Meier生存曲线见图1。Log-rank检验结果显示,高表达CacyBP/SIP病人5年无病生存率显著低于低表达病人,差异具有统计学意义(83.7% vs. 95.2%;Log-rank χ=4.598,P=0.032)。单因素分析显示,影响乳癌DFS的因素包括HER-2(χ=6.467,P=0.011)、客观缓解(χ=24.197,P<0.001)以及CacyBP/SIP(χ=4.598,P=0.032)。将上述因素纳入多因素COX比例风险回归模型进行分析,结果显示,新辅助化疗后客观缓解是乳癌5年DFS的保护因素,能显著降低肿瘤局部复发和远处转移风险,具有独立预测预后价值(HR=0.151,95%CI=0.042~0.451,P=0.004),而CacyBP/SIP不是乳癌新辅助化疗的独立预后因子。见表3。
3 讨 论
近20年來,女性乳癌的发病率逐年攀升,新辅助化疗作为局部晚期和部分早期乳癌的标准治疗方案已得到广泛应用。新辅助化疗的目标已由实现肿瘤降期和提高手术可行性、保乳率,扩大范围至体内的药敏试验以明确肿瘤对化疗方案的敏感性,从而协助选择术后辅助治疗方案。研究证实,新辅助化疗后的pCR与无病生存和总生存等长期生存结局的改善相关,但数据显示仅10%~25%的病人能获得pCR。未实现pCR的病人则不可避免需要面对化疗伴随的毒副作用以及治疗延误,这需要我们谨慎考虑治疗前肿瘤组织分子生物学特征,并寻找能够预测和评估新辅助化疗敏感性的指标,以协助初诊时筛选可能获益的人群,提高新辅助化疗的有效率。对于预测反应良好的病人,可适当延长相应化疗方案的周期数,对于敏感性不佳的病人则应采用合理的替代治疗方案。本研究旨在评估CacyBP/SIP预测乳癌新辅助化疗效果及生存预后的临床价值。
CacyBP/SIP最初发现于Ehrlich腹水肿瘤细胞,通过不同结合位点与S100家族蛋白、微管蛋白等发生相互作用,参与多种生理病理过程,并通过调控细胞周期蛋白的表达以及参与信号分子泛素化降解等不同途径调控肿瘤的发生发展、侵袭转移。CacyBP/SIP在体内扮演的“促癌”或“抑癌”角色随靶器官的不同而发生转变,CacyBP/SIP高表达于乳癌、肝癌、结肠癌、神经胶质瘤等恶性肿瘤中,在胃癌、肾细胞癌中低表达。本研究对乳癌组织中CacyBP/SIP的表达进行检测,以免疫组化评分5分界定CacyBP/SIP的高表达和低表达,结合临床病理因素进行统计分析,结果显示,细胞分化差、有淋巴结转移、临床分期晚以及HER-2阳性的乳癌组织中CacyBP/SIP的表达明显上调,差异具有统计学意义。
CacyBP/SIP可能在ER、PR对乳癌的作用机制中未发挥作用,这与既往有关文献的结论基本一致。肿瘤发生发展与细胞增殖失控以及凋亡抑制密切相关,有学者应用siRNA靶向沉默乳癌细胞系中CacyBP/SIP基因表达,发现癌细胞生长增殖速度明显减慢,凋亡率增加,侵袭转移能力减弱;
对蛋白和mRNA水平的实验发现,高表达CacyBP/SIP一方面通过上调细胞周期蛋白表达促进G/S期转换进而促进肿瘤细胞增殖,另一方面通过诱导促凋亡基因和凋亡抑制基因表达失衡阻碍细胞凋亡进程。CacyBP/SIP高表达与乳癌恶性进展相关,是乳癌发生发展的重要调节因子。
本文的结果显示,70例乳癌病人新辅助化疗的ORR为84.3%,包括临床CR 15例和PD 4例,疾病控制率为94.3%。回顾文献目前尚缺乏CacyBP/SIP与乳癌化疗敏感性的体内外研究。本研究以接受紫衫类及蒽环类新辅助化疗方案的乳癌病人为研究对象,二元Logistic回归分析显示,CacyBP/SIP可作为pCR的独立预测因素,CacyBP/SIP高表达病人新辅助化疗后获得pCR的概率显著低于低表达者。细胞凋亡是多种化疗药物激活并介导杀伤肿瘤细胞的共同通路,过表达的CacyBP/SIP可能具有抑制化疗药物诱导的肿瘤细胞凋亡的作用。回顾文献,有研究者进行了CacyBP/SIP核聚集和细胞外调节蛋白激酶(ERK)信号通路激活实验,研究结果显示,过表达的CacyBP/SIP通过核积累和上调p-ERK1/2,弱化蒽环类化疗药诱导的胶质瘤细胞系U251和U87的细胞凋亡作用,进而介导细胞耐药,造成肿瘤敏感性降低和化疗有效率下降。也有学者提出,CacyBP/SIP通过上调P-糖蛋白(P-gp)和B细胞淋巴瘤-2(Bcl-2)的表达抑制蒽环类化疗药诱导的胰腺癌细胞凋亡并减少细胞内药物累积,进而增强肿瘤的侵袭性和多重耐药特性。鉴于CacyBP/SIP在其他恶性肿瘤中生物学作用的报道,我们猜测乳癌中过表达的CacyBP/SIP作为泛素-蛋白酶体降解通路的一员,通过结合特定泛素连接酶复合物调控下游靶基因异常表达,使细胞凋亡发生异常,最终导致肿瘤细胞对化疗药物的敏感性减低。CacyBP/SIP在预测新辅助化疗效果方面的临床应用,可能有助于乳癌个体化治疗决策的制定,最终结论还有待进一步的临床试验证实。
在生存方面,本研究以DFS为研究终点对70例乳癌病人的远期生存进行分析和评估。Kaplan-Meier生存分析结果显示,与CacyBP/SIP低表达乳癌病人相比较,高表达病人的DFS显著缩短,表明CacyBP/SIP是提示肿瘤侵袭性高、预后差的重要参考指标,影响病人的生存结局。进一步将单因素分析中差异有统计学意义的HER-2表达、客观缓解以及CacyBP/SIP纳入多因素COX比例风险回归模型进行分析,结果显示,不同CacyBP/SIP表达水平病人在DFS上的差异无统计学意义,仅客观缓解是乳癌5年DFS的独立预测因子。既往有文献报道,CacyBP/SIP表达是乳癌病人生存预后的预测因子。而本文的研究结果表明,CacyBP/SIP表达对生存预后的预测性不足,考虑与随访时间短和样本量小有关。
综上所述,CacyBP/SIP是提示肿瘤侵袭性高、预后差的重要参考指标,在组织学分级差、分期较晚、HER-2阳性的乳癌中表达异常上调;CacyBP/SIP表达与乳癌新辅助化疗效果相关,是pCR的独立预测因子,对临床协助筛选可能获益人群并制定合理治疗方案有潜在价值;CacyBP/SIP对乳癌生存结局的預测性不足,未来需要通过大样本的前瞻性临床研究以及更完善的分组分析来进一步评估其预后价值。
[参考文献]
[1]AHMAD A. Breast cancer statistics: recent trends[J]. Advances in Experimental Medicine and Biology, 2019,1152:1-7.
[2]FERLAY J, COLOMBET M, SOERJOMATARAM I, et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and Methods[J]. International Journal of Cancer, 2019,144(8):1941-1953.
[3]中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2021版)[J]. 中国癌症杂志, 2011,31(10):954-1040.
[4]WANG H, MAO X Y. Evaluation of the efficacy of neoadjuvant chemotherapy for breast cancer[J]. Drug Design, Deve-lopment and Therapy, 2020,14:2423-2433.
[5]IWAMOTO T, KAJIWARA Y, ZHU Y D, et al. Biomarkers of neoadjuvant/adjuvant chemotherapy for breast cancer[J]. Chinese Clinical Oncology, 2020,9(3):27.
[6]NING X X, CHEN Y, WANG X S, et al. The potential role of CacyBP/SIP in tumorigenesis[J]. Tumor Biology, 2016,37(8):10785-10791.
[7]WANG N J, MA Q Y, WANG Y N, et al. CacyBP/SIP expression is involved in the clinical progression of breast cancer[J]. World Journal of Surgery, 2010,34(11):2545-2552.
[8]GUO Z, ZHANG X F, ZHU H B, et al. TELO2 induced progression of colorectal cancer by binding with RICTOR through mTORC2[J]. Oncology Reports, 2021,45(2):523-534.
[9]EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1. 1)[J]. European Journal of Cancer (Oxford, England:1990), 2009,45(2):228-247.
[10]OGSTON K N, MILLER I D, PAYNE S, et al. A new histological grading system to assess response of breast cancers to primarychemotherapy:prognosticsignificanceandsurvival [J]. Breast (Edinburgh, Scotland), 2003,12(5):320-327.
[11]PATHAK M, DWIVEDI S N, DEO S V S, et al. Neoadjuvant chemotherapy regimens in treatment of breast cancer: a systematic review and network meta-analysis protocol[J]. Systematic Reviews, 2018,7(1):89.
[12]WANG S M, CHEN P M, SUNG Y W, et al. Effect of COL4A1 expression on the survival of neoadjuvant chemothe-rapy breast cancer patients[J]. Journal of Oncology, 2020, 2020:5209695.
[13]HEIL J, KUERER H M, PFOB A, et al. Eliminating the breast cancer surgery paradigm after neoadjuvant systemic therapy: current evidence and future challenges[J]. Annals of Oncology: Official Journal of the European Society for Medical Oncology, 2020,31(1):61-71.
[14]SYMMANS W F, WEI C M, GOULD R, et al. Long-term prognostic risk after neoadjuvant chemotherapy associated with residual cancer burden and breast cancer subtype[J]. Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology, 2017,35(10):1049-1060.
[15]WANG-LOPEZ Q, CHALABI N, ABRIAL C, et al. Can pathologic complete response (pCR) be used as a surrogate marker of survival after neoadjuvant therapy for breast cancer[J]? Critical Reviews in Oncology/Hematology, 2015,95(1):88-104.
[16]MASUDA N, LEE S J, OHTANI S, et al. Adjuvant capeci-tabine for breast cancer after preoperative chemotherapy[J]. The New England Journal of Medicine, 2017,376(22):2147-2159.
[17]MBRADEN A, V STANKOWSKI R, M ENGEL J, et al. Breast cancer biomarkers: risk assessment, diagnosis, prognosis, prediction of treatment efficacy and toxicity, and recurrence[J]. Current Pharmaceutical Design, 2014,20(30):4879-4898.
[18]HUANG S J, XU Q H. Molecular cloning of the calcyclin-binding protein gene from the swimming CrabPortunus trituberculatusand its roles in salinity stress adaptation[J]. Journal of Shellfish Research, 2015,34(3):1057-1064.
[19]LIAN Y F, HUANG Y L, ZHANG Y J, et al. CACYBP enhances cytoplasmic retention of P27 Kip1 to promote hepatocellular carcinoma progression in the absence of RNF41 mediated degradation[J]. Theranostics, 2019,9(26):8392-8408.
[20]FENG S S, ZHOU Q Z, YANG B, et al. The effect of S100A6 on nuclear translocation of CacyBP/SIP in colon can-cer cells[J]. PLoS One, 2018,13(3):e0192208.
[21]YAN S W, LI A M, LIU Y G. CacyBP/SIP inhibits the migration and invasion behaviors of glioblastoma cells through activating Siah1 mediated ubiquitination and degradation of cytoplasmic p27[J]. Cell Biology International, 2018,42(2):216-226.
[22]CHEN Y, ZHANG K, WANG X S, et al. Cell cycle-depen-dent translocation and regulatory mechanism of CacyBP/SIP in gastric cancer cells[J]. Anti-Cancer Drugs, 2018,29(1):19-28.
[23]KILA?CZYK E, GWOẐDZIṄSKI K, WILCZEK E, et al. Up-regulation of CacyBP/SIP during rat breast cancer development[J]. Breast Cancer (Tokyo, Japan), 2014,21(3):350-357.
[24]TOPOLSKA-WOṠ A M, CHAZIN W J, FILIPEK A. CacyBP/SIP—structure and variety of functions[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2016,1860(1):79-85.
[25]ZHAO M, ZHANG R Z, QI D W, et al. CacyBP/SIP promotes tumor progression by regulating apoptosis and arresting the cell cycle in osteosarcoma[J]. Experimental and Therapeutic Medicine, 2020,20(2):1397-1404.
[26]TANG Y, ZHAN W J, CAO T, et al. CacyBP/SIP inhibits Doxourbicin-induced apoptosis of glioma cells due to activation of ERK1/2[J]. IUBMB Life, 2016,68(3):211-219.
[27]TOPOLSKA-WOṠ A M, ROSIṄSKA S, FILIPEK A. MAP kinase p38 is a novel target of CacyBP/SIP phosphatase[J]. Amino Acids, 2017,49(6):1069-1076.
[28]CHEN X, ZHENG P C, XUE Z F, et al. CacyBP/SIP enhances multidrug resistance of pancreatic cancer cells by regulation of P-gp and Bcl-2[J]. Apoptosis: an International Journal on Programmed Cell Death, 2013,18(7):861-869.
[29]SHI Y Q, HU W H, YIN F, et al. Regulation of drug sensitivity of gastric cancer cells by human calcyclin-binding protein (CacyBP)[J]. Gastric Cancer, 2004,7(3):160-166.
[30]FRANIAK-PIETRYGA I, MACIEJEWSKI H, ZIEMBA B, et al. Blockage of Wnt/β-catenin signaling by nanoparticles reduces survival and proliferation of CLL cells in vitro-preliminary study[J]. Macromolecular Bioscience, 2017,17(11):1700130. doi:10.1002/mabi. 201700130.
(本文编辑 马伟平)

